Журнал эволюционной биохимии и физиологии, 2022, T. 58, № 4, стр. 257-268
ОСОБЕННОСТИ КАРОТИНОИДОВ ЧЕРНОМОРСКИХ ДВУСТВОРЧАТЫХ МОЛЛЮСКОВ
А. В. Бородина *
Институт биологии южных морей РАН
Севастополь, Россия
* E-mail: borodinaav@mail.ru
Поступила в редакцию 11.04.2022
После доработки 15.05.2022
Принята к публикации 16.05.2022
- EDN: BIPNMS
- DOI: 10.31857/S0044452922040039
Аннотация
В работе обобщены результаты исследований состава каротиноидов моллюсков-фильтраторов: Mytilus galoprovincialis, Crassostrea gigas, Anadara kagoshimensis, Cerastoderma glaucum, Chamelea gallina и Polititapes aureus, обитающих в Черном море. Представленные данные продемонстрировали изменения в составе каротиноидов у всех вышеперечисленных видов (или близких им по виду моллюсков), в зависимости от места обитания в Мировом Океане (М.О.). Наиболее очевидные отличия в составе каротиноидов отмечены между черноморскими моллюсками и их видовыми аналогами из других регионов М.О.
Обитание моллюсков C. glaucum, Ch. gallina и P. aureus в одном экотопе показало как видовую специфичность в накоплении каротиноидов, так и существенные отличия каротиноидов от их видовых аналогов из других регионов М.О. Отмеченные изменения относятся только к накоплению каротиноидов из пищи или сокращению известных по литературным данным путей метаболизма каротиноидов. У черноморских моллюсков новых метаболических реакций и путей пока не обнаружено.
Каротиноиды – тетратерпеновые природные пигменты, которые синтезируются в растениях, некоторых грибах и микроорганизмах. Во все остальные организмы каротиноиды попадают через пищу, накапливаются и подвергаются метаболической трансформации в соответствии с особенностями вида. Изучение закономерностей в накоплении каротиноидов у разных видов гидробионтов привело к появлению в прошлом столетии хемосистематики [1]. Хемосистематика каротиноидов определяет связи между химической структурой и биологическим происхождением этих соединений. Благодаря этому подходу было открыто, что наиболее разнообразными по химической структуре являются каротиноиды преимущественно морских гидробионтов, таких как микроводоросли, рыбы, животные [1]. К настоящему времени обнаружено и изучено более 850 соединений каротиноидного ряда, из них большинство природных соединений имеют морское происхождение [1–3]. Несмотря на интенсивное развитие химии каротиноидов, их метаболизм и функции в организмах животных остаются наименее изученными [3, 4]. Известно, что в организме они защищают мембраны клеток от разрушения активными формами кислорода и свободными радикалами при окислительном стрессе. В роли антиоксидантов каротиноиды повышают адаптационные возможности животных, способствуют нормализации физиологических процессов в организме [5]. Регуляторные эффекты каротиноидов обусловлены их способностью встраиваться в мембранные фосфолипидно-белковые структуры и тем изменять их текучесть. Это может сопровождаться как изменениями взаимодействий между липидами и белками, так и существенно влиять на антиоксидантную активность каротиноидов. При этом чем длиннее полиеновая цепочка каротиноида, тем выше антиоксидантная активность молекулы [6]. Известны метаболические пути преобразований многих растительных каротиноидов, характерные в целом для класса Bivalvia, изученные на примерах отдельных видов двустворок [7]. Обитая в разных морских акваториях, одни и те же виды моллюсков-фильтраторов имеют различный спектр питания, подвергаются разным гидрохимическим и экологическим воздействиям. Эти и другие факторы способствуют возникновению новых для организма адаптационных механизмов с участием каротиноидов [8, 9], что часто приводит к появлению новых соединений каротиноидного ряда [10]. В научной литературе можно встретить как полную, так и неполную информацию о составе каротиноидов одного и того же вида моллюска-фильтратора из разных регионов Мирового Океана (М.О.) [10–14]. Улучшение методов идентификации каротиноидов, начиная с 90-х годов прошлого века, способствовало росту открытий новых каротиноидов и установлению их строения [3, 15]. На крымском побережье с 2007 г. ведутся исследовательские работы по изучению каротиноидов двустворчатых моллюсков и других гидробионтов Черного моря современными методами [17, 18]. За 14 лет на крымском побережье Черного моря были исследованы каротиноиды и особенности их накопления у 6 видов двустворчатых моллюсков-фильтраторов: M. galoprovincialis, G. gigas, A. kagoshimensis, C. glaucum, Ch. galina и Polititapes aureus [17–30]. Эти исследования охватывают основные изменения, происходящие в организме каждого изученного вида моллюска-фильтратора в течение его жизненного цикла: генеративный процесс, смена спектра питания вследствие сезонных сукцессий фитопланктона, влияние циклических сезонных изменений в окружающей среде или возможных экстремальных состояний, вызванных гипоксией.
Целью этой работы было обобщение исследований по накоплению каротиноидов у черноморских двустворчатых моллюсков и их аналогов (видов, близких по роду) из других регионов М.О. по имеющимся литературным источникам.
Общие положения методов проведения пробоподготовки и определения каротиноидов в животной ткани подробно изложены как в отечественной, так и в зарубежной литературе [15, 16, 31, 32]. Особенности определения каротиноидов черноморских моллюсков методами ВЭЖХ, МС, H-NMR, CD были рассмотрены в наших более ранних работах [10, 16, 21, 23, 28]. Эти особенности животной ткани вообще и вида гидробионта в частности являются самыми главными факторами в трудоемкости и длительности работы по идентификации каротиноидов. В решении многих вопросов, связанных с идентификацией фракций, помогают международные электронные базы по физико-химическим характеристикам каротиноидов: http://www.massbank.jp/; https://massbank.eu/MassBank/; http://www.lipidbank.jp/cgi-bin/main.cgi?id=VCA; https://www.lipidmaps.org/; http://carotenoiddb.jp/. Наши исследования имели методическую поддержку со стороны зарубежных коллег [3], специализирующихся в области идентификации природных каротиноидов, что нашло отражение в ряде совместных работ [10, 20–22]. На основании опубликованных результатов была составлена таблица, обобщающая всю известную информацию по составу каротиноидов моллюсков-фильтраторов: M. galoprovincialis, G. gigas, A. kagoshimensis, C. glaucum, Ch. galina и P. aureus (табл. 1). Все 6 видов двустворчатых моллюсков относят к подклассу Autobranchia, три вида Mytilus galoprovincialis, Crassostrea gigas, Anadara kagoshimensis относятся к одному инфраклассу Pteriomorphia и разделяются на уровне разных порядков: Mytilida, Ostreida, Arcida соответственно. Другие три вида: Cerastoderma glaucum, Chamelea gallina и Polititapes aureus относятся к инфраклассу Heteroconchia и имеют разное систематическое положение относительно друг друга. Так, например, вид Cerastoderma glaucum принадлежит порядку Cardida, а оба вида Chamelea gallina и Polititapes aureus относятся к одному семейству Veneridae и разделяются по данным WORMS (World Register of Marine Species) только на уровне подсемейств Venerinae и Tapetinae соответственно. Все эти виды являются широко распространенными как в черноморском регионе, так и в различных регионах М.О. Во многих странах Средиземного моря и Тихоокеанского региона они относятся к промысловым [48, 51, 52, 54]. К особенностям обитания M. galoprovincialis, C. gigas, A. kagoshimensis относятся их искусственное выращивание и содержание в садках на морских фермах, в то время как C. glaucum, Ch. galina и P. aureus относятся к видам, обитающим на песочно-иловом субстрате [48, 49]. Они широко распространены в смешанных донных сообществах на Российском побережье Черного моря, однако там их промышленная добыча не производится [48], в отличие от многих стран, чье побережье выходит на Средиземное море, а также других стран тихоокеанского региона М.О. [48, 51, 52, 54].
Таблица 1.
Состав каротиноидов двустворчатых моллюсков M. galoprovincialis, G. gigas, A. kagoshimensis, C. glaucum, Ch. galina и P. aureus из разных регионов Мирового Океана
| Название вида | Состав каротиноидов | Регион М.О., где проводились исследования | Литературный источник (ссылка) |
| Mytilus galoprovincialis | 1, 2, 4, 5, 6, 7, 11, 12, 13, 19, 20, 23, 28, 35, 37, 39, 40, 42, 45, 46 | Черное море | [10] |
| Mytilus galoprovincialis | 24, 33, 35 | Другие регионы M.O. | [11] |
| Mytilus edulis | 3,6, 7,12, 13, 15, 16, 19, 20, 21, 22, 23, 25, 31, 35, 37, 40, 41, 42, 45, 46, 47 | Другие регионы М.О. | [13, 14] |
| 12, 17, 24, 25, 33, 35 | [11, 12] | ||
| 12, 13, 17, 24, 25, 35 | |||
| Mytilus coruscus | 8, 9, 10, 11, 13, 17, 19, 20, 23, 29, 35, 37, 38, 39, 41, 42 | Тихий Океан (Японское море) | [35, 36] |
| Anadara kagoshimensis (Anadara inaequivalvis) | 12, 13, 23, 24, 37, 39 | Черное море | [18, 24] |
| Anadara kagoshimensis (Scapharca subcrenata Scapharca sp.) | 12, 13, 23, 37, 39 | Тихий Океан (Японское море) | [43] |
| 13 | Другие регионы М.О. | [11, 12] | |
| 12, 13, 23, 37, 39 | |||
| Anadara brougthoni | 12, 13, 23, 37, 39 | Тихий Океан (Японское море) | [43, 44] |
| 13, 33, 35,17 | Другие регионы М.О. | [11, 12] | |
| Crassostrea gigas | 12, 13, 19, 23, 28, 29, 37 | Черное море | [18, 38] |
| Crassostrea gigas | 11, 12, 13, 19, 23, 28, 29, 35, 37, 40, 41, 42, 45, 46, 48, 49… | Тихий Океан (Японское море) | [39–41] |
| Cerastoderma glaucum (Cardium glaucum) | 12, 13, 18, 20, 22, 23, 24, 33, 34, 36, 45 | Черное море | [23, 29, 30] |
| Cerastoderma glaucum (Cardium glaucum) | 12, 17, 18, 22, 26, 32, 36, 44 | Североатлантический регион | [51] |
| Cardium tuberculatum | 13, 23, 45, 46 | Средиземное море | [53] |
| Polititapes aureus (Paphia aurea) | 12, 13, 14, 20, 24, 33, 34, 45, 47 | Черное море | [30] |
| Paphia amabilis (Venus amabilis) | 14, 40, 41, 42, 43, 46, 48, 49 | Тихий Океан (Японское море) | [50, 52, 7] |
| Chamelea gallina (Venus gallina) | 12, 13, 14, 19, 20, 22, 23, 24, 33, 34, 45 | Черное море | [28] |
| Chamelea gallina (Venus gallina) | 12 | Другие регионы М.О. | [11] |
| 12 | [56] | ||
| Venus chione (Callista chione) | 12, 17, 24, 27, 30, 33 | Другие регионы М.О. | [55] |
| Примечание к таблице 1 | |||
| 1 | 19'-Гексаноилоксиалленикмитилоксантин | 26 | Изофукоксантин |
| 2 | 19'-Гексаноилоксигалоцинтиаксантин | 27 | Кантаксантин |
| 3 | 19'-Гексаноилоксиизомитилоксантин | 28 | Крассостреаксантин A |
| 4 | 19'-Гексаноилоксикрассостреаксантин А | 29 | Крассостреаксантин В |
| 5 | 19'-Гексаноилоксимитилоксантин | 30 | Криптоксантин |
| 6 | 19'-Гексаноилоксифукоксантин | 31 | Крококсантин |
| 7 | 19'-Гексаноилоксифукоксантинол | 32 | Крустоксантин |
| 8 | 4-гидрокси-аллоксантин | 33 | Лютеин |
| 9 | 4-кето-аллоксантин | 34 | Мактраксантин |
| 10 | 7,8-дидегидроастаксантин | 35 | Митилоксантин |
| 11 | 8'-Апоаллоксантинол | 36 | Неоксантин |
| 12 | β,β-каротин | 37 | Пектенол A |
| 13 | Аллоксантин | 38 | Пектенол В |
| 14 | Амароциаксантин А | 39 | Пектенолон |
| 15 | Амароциаксантин В | 40 | Перидинин |
| 16 | Ангидро-амароциаксантин В | 41 | Перидининол |
| 17 | Астаксантин | 42 | Пирроксантинол |
| 18 | Виолаксантин | 43 | Пирроксантин |
| 19 | Галацинтиаксантин | 44 | Сифоноксантин |
| 20 | Гетероксантин | 45 | Фукоксантин |
| 21 | Гидрат-пирроксантинол | 46 | Фукоксантинол |
| 22 | Диадиноксантин | 47 | Эхиненон |
| 23 | Диатоксантин | 48 | Циклопирроксантин |
| 24 | Зеаксантин | 49 | Циклопирроксантинол |
| 25 | Изомитилоксантин | ||
Каротиноиды и их метаболизм у мидий из разных регионов Мирового Океана
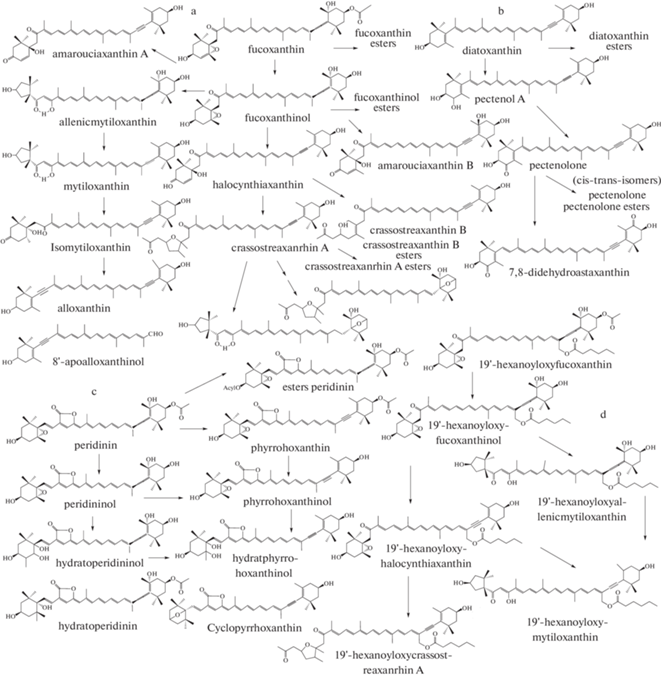
Одним из широко распространенных и культивируемых видов моллюсков на Черном море являются мидии M. galloprovincialis. На севастопольском побережье на морских фермах мидии могут накапливать до 22 различных каротиноидов [10] (табл. 1). Из этого состава каротиноидов можно выделить 4 растительных каротиноида: диатоксантин, фукоксантин, перидинин и 19'-гексаноилоксифукоксантин, от которых берут начало пути трансформации этих соединений, за исключением группы каротинов (рис. 1). При исследовании черноморской мидии M. galloprovincialis на севастопольском побережье были открыты новые каротиноиды (из группы 19'-гексаноилоксикаротиноидов), которые позволили уточнить полный цикл трансформации растительного 19'-гексаноилоксифукоксантина до 19'-гексаноилоксимитилоксантина [10]. У мидии M. galloprovincialis, обитающей на западном побережье Черного моря, в составе каротиноидов был обнаружен астаксантин, который в тканях севастопольской мидии не встречался [33]. Из-за неполной информации по составу каротиноидов M. galloprovincialis из других регионов М.О. [11, 12] проследить пути метаболизма каротиноидов и сравнить их с черноморской мидией крайне сложно. В табл. 1 показана разница в составе каротиноидов M. galloprovincialis из разных регионов М.О., а также Mytilus edulis и Mytilus coruscus [34–36].
В конце 80-х норвежскими учеными Hertzberg и соавт., Partali и соавт. были хорошо изучены пищевые цепи, по которым происходила ассимиляция каротиноидов из фитопланктона мидиями Mytilus edulis [13, 14]. У этого вида мидий было идентифицировано 20 каротиноидов. Впервые наиболее полно были описаны основные пути метаболических трансформаций каротиноидов: диатоксантин, фукоксантин, перидинин и 19'-гексаноилоксифукоксантин и характерные метаболические реакции [14]. У мидий закономерно накопление ацетиленовых каротиноидов с 3-гидрокси-7,8-дидегидро-концевой группой в молекуле и наблюдаются 3 наиболее важные метаболические реакции: гидролиз ацетата до каротенола (фуко-ксантин → фукоксантинол), превращение алленовой связи в ацетиленовую (фукоксантинол → галоцинтиаксантин), окислительное расщепление эпоксидной группы (диадиноксантин → гетеро-ксантин; пирроксантинол → гидратпирроксантинол). По мере изучения каротиноидов других гидробионтов эти три реакции в литературе отмечены как характерные для Bivalvia и оболочников [4, 14, 37].
Каротиноиды и их метаболизм у Crassostrea gigas из разных регионов Мирового Океана
Исследование черноморского интродуцента-устрицы Crassostrea gigas было ограничено только основным составам каротиноидов (83%), который был представлен 6 каротиноидами: крассостреаксантин А и В, аллоксантин, галоцинтиаксантин, диатоксантин, пектенол А [18, 38] (табл. 1). Ранее японскими учеными Fujiwara и соавт., Maoka и соавт. был подробно изучен состав каротиноидов тихоокеанской устрицы G. gigas [39–41]; он был представлен 22 каротиноидами, при этом основу составляли: галоцинтиаксантин, митилоксантин и крассостреаксантин А и В (более 50%). Состав каротиноидов устриц G. gigas, в целом, очень близок к каротиноидам, которые образуются путем метаболических преобразований растительных диатоксантина, фукоксантина и перидинина, ранее открытых у мидий [14, 18]. Однако схема метаболизма от фукоксантина до аллоксантина дополнена образованием крассотреаксантинов (А и В, а также их эфиров), открытых впервые у этого вида моллюсков [7, 37, 39]. Путь преобразования диатоксантина ограничен только пектенолом А, в отличие от мидий. Трансформация в тканях перидинина, полученного через усвоение динофлагеллят, происходит наиболее полно и доходит до образования циклопирроксантина [7, 37]. Присутствуют все три метаболические реакции, характерные для большинства морских двустворчатых моллюсков-фильтраторов и оболочников [4, 7, 37]. В черноморском интрадуценте можно предполагать некоторое укорочение путей трансформации каротиноидов за счет увеличения концентрации шести вышеуказанных. Эти шесть каротиноидов являются продуктами метаболических трансформаций 2 растительных: фукоксантина и диатоксантина. Несмотря на изменения в характерных цепочках преобразований каротиноидов, наличие 3 наиболее важных метаболических реакций у черноморского интрадуцента остается неизменным [4, 7].
Каротиноиды и их метаболизм у Anadara sp. из разных регионов Мирового Океана
Интересным, с точки зрения адаптационных возможностей, широко распространенным и культивируемым моллюском на Крымском побережье стал моллюск-вселенец A. kagoshimensis (A. inaequivalvis; Scapharca subcrenata) [25]. Особенности состава каротиноидов черноморской анадары A. kagoshimensis (A. inaequivalvis) под действием различных факторов изучались на протяжении многих лет [17–19, 24–27]. Подробный анализ состава каротиноидов анадары в естественных природных условиях на черноморском побережье показал наличие в ее тканях β-каротина, пектенола А, пектенолона (цис- и трансизомеров), аллоксантина, диатоксантина, зеаксантина и эфиров последних четырех каротиноидов (табл. 1). Все ткани моллюска содержали одинаковый набор каротиноидов, который практически не подвергался сезонным изменениям [24]. Особенностью этого моллюска является хорошо развитая нога, которая имеет наиболее высокий соматический индекс (около 40%) относительно других тканей, что отражается в самом высоком содержании каротиноидов (45.8%) в этом органе [18]. Процесс созревания гонад сопровождается снижением суммарных каротиноидов в других тканях, однако лидером по содержанию суммарных каротиноидов, по-прежнему, остается нога моллюска. Рост генеративной ткани не влияет на изменение качественного состава каротиноидов других тканей, однако в самих гонадах отмечено повышенное содержание пектенолона и аллоксантина [27]. Моллюск способен выдерживать длительные гипоксические состояния, при этом в тканях возрастает концентрация пектенолона, как в свободном состоянии, так и в эфирных фракциях [25]. Его накопление в тканях A. kagoshimensis может быть связано с наличием процесса цис-транс- изомеризации этого каротиноида. Этот процесс протекает в присутствии акцепторов или доноров электрона через стадию одноэлектронного переноса, что способствует увеличению антиоксидантной активности этого каротиноида [42].
Наиболее полные первые сведения о составе каротиноидов Scapharca subcrenata, видового аналога A. kagoshimensis из тихоокеанского региона, были опубликованы в 1981 г. [43]. Упоминания о составе каротиноидов этого вида и его близкородственных видов можно встретить в ряде публикаций прошлого века [11, 12, 44]. Состав каротиноидов тихоокеанской анадары представлен: β-каротином, аллоксантином и диатоксантином (и их эфирами), пектенолоном и пектенолом А, по некоторым данным у A. broutoni может накапливаться 7,8-дидегидроастаксантин, который является продуктом окисления пектенолона [7]. Исходя из состава каротиноидов и известных для Bivalvia путей метаболических трансформаций растительных каротиноидов, для анадар характерен метаболизм по окислительному пути от диатоксантина до 7,8-дидегидроастаксантина [7]. Эта метаболическая трансформация встречается у многих двустворчатых моллюсков с разными дополнениями или сокращениями [16]. Отличием черноморской анадары A. kagoshimensis являлось: с одной стороны, дополнение эфирами диатоксантина и пектенолона, а также изомеризацией последнего, а с другой, укорачивание пути преобразования диатоксантина лишь до изомеров пектенолона. В качественном составе черноморской A. kagoshimensis присутствует зеаксантин, вместо его изомера – лютеина, и отсутствует митилоксантин, обнаруженный у некоторых анадар других регионов М.О. [11, 12] (табл. 1). Накопление зеаксантина и аллоксантина происходит непосредственно из пищевого спектра и не подлежит дальнейшей трансформации в тканях, кроме их этерификации. Вообще, черноморская A. kagoshimensis имеет более высокое содержание эфиров каротиноидов, чем ее видовой аналог из других регионов М.О. [18, 43, 44]. Причиной депонирования каротиноидов в эфирной форме может быть не только их перевод в свободную форму при необходимости, но и роль жирных кислот, входящих в состав этих эфиров, участвующих в процессе адаптации моллюска [45]. Относительно количественной оценки состава каротиноидов, в тихоокеанской A. kagoshimensis доминирует аллоксантин, а в черноморской – пектенолон. Очевидно, все эти изменения в составе каротиноидов тихоокеанского моллюска A. kagoshimensis возникли в результате длительной адаптации к черноморским, более пресным по сравнению с М.О. водам. Необходимо отметить, что экспериментальных научных исследований, подтверждающих влияние солености на метаболизм каротиноидов, у двустворчатых моллюсков не обнаружено. Исследования фактора распреснения на адаптацию организмов и метаболизм каротиноидов во всем экотопе, в том числе на всю пищевую цепочку в среде обитания моллюсков, никто не проводил. Исходя из состава каротиноидов анадары, характерных для большинства Bivalvia 3 типов, метаболических реакций нет [4, 14]. В метаболических преобразованиях каротиноидов A. kagoshimensis присутствуют реакции гидроксилирования (диатоксантин → пектенол) и дегидрирования с образовнаием кето-группы (пектенол → пектеолон; пектенолон → 7,8-дидегидроастаксантин).
Каротиноиды и их метаболизм у Cerastoderma glaucum, Chamelea gallina и Polititapes aureus из разных регионов М.О.
Последние 4 года были исследованы 3 вида моллюсков, обитающих в одном экотопе на песочно-иловом грунте в зоне заплеска воды: C. glaucum, Ch. galina и P. aureus [23, 28–30, 46]. Эти три вида моллюсков-фильтраторов относятся к массовым видам и являются аборигенами Черного моря, подробно изучаемыми с прошлого века, особенно в глубоководной части шельфовой зоны (от 20 до 50 м) [47, 48]. Со временем эти виды стали распространяться на мелководье и их стали встречать в верховьях бухт, в зоне заплеска воды [49], где они приобретали свои адаптационные морфометрические особенности [46]. Виды, обитающие в таких экотопах, в верховьях бухт, должны приобретать некоторую устойчивость к переменам температур, солености, сгонно-нагонных явлений. Морские отливы в таких местах могут почти полностью обнажать рыхлый песчаный грунт, в котором находятся эти моллюски. Такие моллюски вызывают интерес с точки зрения их адаптационных возможностей и участия в этом их каротиноидов.
В 2018–2019 гг. были подробно изучены состав каротиноидов черноморского аборигена C. glaucum и влияние сезонных факторов на изменения этого состава [23]. Выяснено, что состав каротиноидов представлен 11 свободными и 4 этерифицированными каротиноидами (табл. 1). Основной орган накапливающий каротиноиды, – это гепатопанкреас (более 55% от суммы каротиноидов), вторым по количеству этих пигментов является нога (около 25%). В годовом цикле накопление каротиноидов имеет два максимума: весной (7.1 ± 2.1 мг 100 г –1) и ранней осенью (3.1 ± 1.1 мг 100 г –1) [23]. В качественном отношении около 40% этих соединений C. glaucum подвержено сезонным изменениям, постоянно присутствующими являлись: β-каротин, гетероксантин, мактраксантин, а также эфиры двух последних (суммарная доля 50–65%) [23]. Исходя из состава каротиноидов, у черноморского моллюска C. glaucum присутствуют следующие метаболические трансформации: фукоксантин → фукоксантинол; неоксантин → диадиноксантин → → гетероксантин; видоспецифичным каротиноидом животного происхождения является мактраксантин [50]. Точный путь метаболических преобразований предшественников мактраксантина неизвестен, однако высказано предположение о получении его моллюском через окислительное расщепление двух эпоксигрупп виолоксантина [23, 29]. Таким образом, у черноморских церастодерм присутствуют все три метаболические реакции, описанные ранее для Bivalvia. Эти результаты были сопоставлены с исследованиями видового аналога, обитающего в районе Британских островов в 70-х гг. прошлого века [51]. У C. glaucum североатлантического происхождения были обнаружены сложноэфирные фракции каротиноидов, β‑каротин, лютеин, а также комплекс ксантофиллов неустановленного строения, среди которых в гепатопанкреасе моллюска был идентифицирован гетероксантин [11, 51]. При сравнении состава каротиноидов церастодерм из этих двух регионов М.О. можно отметить ряд отличий (табл. 1). Ряд каротиноидов у североатлантической C. glaucum отсутствовали у черноморской C. glaucum. С другой стороны, состав каротиноидов черноморского аборигена C. glaucum содержал диатоксантин, аллоксантин, зеаксантин и мактраксантин, которые не были обнаружены ранее у видового аналога с Британского побережья (табл. 1). Отличительной особенностью черноморской церастодермы, как и в случае с анадарой, стоит отметить обилие эфиров каротиноидов. Несмотря на эти отличия в составе C. glaucum из разных регионов М.О., из-за недостатка исследований в этой области, утверждать наличие отличий в метаболических реакциях пока преждевременно.
Параллельно с исследованиями C. glaucum, в том же экотопе, нами проводились исследования состава каротиноидов Ch. galina. Динамика суммарных каротиноидов в течение года показала два выраженных максимума: весенний (1.5 ± 0.5 мг × × 100 г–1) и осенний (0.5 ± 0.2 мг × 100 г–1) [28]. В эти периоды был изучен состав каротиноидов до 90%, (11 свободных каротиноидов и 7 эфиров): β‑каротин, диатоксантин, галоцинтиаксантин, амароциаксантин A, гетероксантин, мактраксантин, аллоксантин, лютеин, зеаксантин, диадиноксантин, фукоксантин и эфиры 7 последних каротиноидов [28]. Отмечены следующие пути трансформации: фукоксантин → фукоксантинол → амаруциаксантин А; фукоксантин → фукоксантинол → галацинтиаксантин (рис. 1); диадиноксантин → гетероксантин, а также трансформация каротиноидов до мактраксантина. Видоспецифичным каротиноидом является амарауциаксантин А [52]. В метаболической трансформации каротиноидов у черноморской Ch. galina можно отметить все три метаболические реакции, о которых говорилось ранее [4]. Этот вид моллюска, относящийся к аборигенам Черного моря, имеет видовой аналог из Средиземного моря, между которыми имеется ряд морфометрических отличий [48, 54]. Первые сведения о составе каротиноидов Chamelea galina (Venus gallina) из других регионов М.О. встречаются в ряде работ 80-х – 90-х годов [11, 12]. В работах последних десятилетий чаще всего можно встретить анализ липидов и каротинов Ch. gallina как более коммерчески важных показателей ценности моллюсков [33, 56]. Таким образом, результаты исследований Ch. galina из других регионов М.О. ограничены каротиноидами: β-каротин, лютеин, флавоксантин и группа неопределенных ксантофиллов [11, 12, 55]. Наиболее подробный анализ состава каротиноидов можно встретить у близкородственных видов хамелии – это Paphia amabillis и Callista chione [52, 54]. Состав Callista chione представлен 6 каротиноидами: β-каротином, β-криптоксантином, лютеином, зеаксантином, астаксантином, кантаксантином [54]. Можно видеть очевидные отличия между представителями одного семейства [11]. Несмотря на малоизученность каротиноидов хамелии из других регионов М.О., можно отметить отличия в качественном составе между видовыми аналогами (табл. 1). Эти отличия могут быть связаны с наличием дополнительных путей трансформации каротиноидов у этого вида, обитающего в других регионах М.О., поэтому вопрос о метаболических реакциях остается все еще малоизученным.
Находящийся рядом в одном экотопе с Ch. gallina и C. glaucum третий вид: Polititapes aureus (Gmelin, 1791) (Paphia aurea), в годовой динамике суммарных каротиноидов имел один максимум – весной (1.68 ± 0.47 мг × 100 г–1 сырого веса), в качественном составе содержал: каротины, эхиненон, зеаксантин, лютеин, аллоксантин, фукоксантин, амаруциаксантин А, гетероксантин, мактраксантин (табл. 1). У черноморского моллюска P. aureus были обнаружены пути трансформации каротиноидов: фукоксантин → фукоксантинол → амаруциаксантин А; фукоксантин → фукоксантинол → галацинтиаксантин; диадиноксантин → гетероксантин [30]. Доминирующим в составе тканей P. aureus каротиноидом животного происхождения являлся амарауциаксантин А, характерный для всех Veneridae [52]. В метаболической трансформации каротиноидов у черноморского моллюска P. aureus присутствуют все три метаболические реакции, о которых говорилось ранее [4].
В 2008 г. был наиболее полно изучен вид Paphia amabillis, относящийся к семейству Veneridae (семейство), к Paphia (род), обитающий в Тихоокеанском регионе М.О. [52]. С одной стороны, этот вид близок по филогенетическому древу к Polititapes aureus, а с другой, он из одного семейства с Ch. gallina. У Paphia amabillis, обитающей в Тихоокеанском регионе, в составе его каротиноидов присутствуют: гидратпирроксантинол и амароциаксантин А (и их сложные 3-эфиры), эфиры фукоксантинола, перидинола [52]. Имея близкородственные отношения, но обитая в другом регионе, этот вид имеет только один общий каротиноид – амароциаксантин А [7, 52].
У C. glaucum, Ch. galina и P. aureus, как и у мидий и устриц из черноморского региона, одна из трансформаций каротиноидов происходит от растительного фукоксантина (рис. 1). Однако сам путь метаболической трансформации не полный (рис. 1, табл. 1). Эти виды, обитая в одном экотопе одной из бухт Черного моря, имея одинаковые экологические и пищевые условия, накапливали как общие каротиноиды, так и отличные (табл. 1, рис. 1). При сравнении по литературным данным состава каротиноидов этих видов с их аналогами из других регионов наблюдались отличия не только в составе каротиноидов, которые во многом зависят от пищевого спектра моллюсков, но и обнаружены изменения в самих путях метаболизма. У P. aureus отсутствовали каротиноиды, образующиеся от растительного перидинина, тогда как у Paphia amabillis этот путь трансформации наиболее широко представлен и включает в себя: перидининол, перидининол, пирроксантинол, пирроксантин, цикло-пирроксантин, циклопирроксантинол (табл. 1, рис. 1). Источником перидинина являются динофлагелляты, представители которых широко распространены в составе черноморского фитопланктона [57].
ЗАКЛЮЧЕНИЕ
Таким образом, можно утверждать, что изменения условий обитания у одного и того же вида моллюска-фильтратора приводят к реализации механизмов адаптации в организме, что может привести к изменениям в качественном составе каротиноидов, путей их трансформации, возникновению новых соединений каротиноидного ряда. Это напрямую связано с выполнением функций этих соединений в организме, что требует дальнейшего изучения и является основной целью наших исследований.
С другой стороны, обитая в одном экотопе на побережье Черного моря, в одинаковых условиях, имея один и тот же спектр питания, моллюски, относящиеся к Imparidentia (Superorder) (P. aureus, Ch. gallina и C. glaucum), накапливали только 6 видов общих каротиноидов (табл. 1), но еще меньше общих каротиноидов они имели со своими видовыми аналогами из других регионов М.О. Изучение причин этих изменений в метаболизме и накоплении каротиноидов также требует дополнительных исследований.
Список литературы
Liaeen-Jensen S (1998) Carotenoids in chemosystematics. Carotenoids – Vol. 3: Biosynthesis and Metabolism. Eds.: G Britton, S Liaaen-Jensen, H Pfander. – Basel: Birkhauser Verlag. 217–247.
Maoka T, Kawase N, Hironaka M, Nishida R (2021) Carotenoids of hemipteran insects, from the perspective of chemo-systematic and chemical ecological studies. Biochem System Ecol 95: 1–5. https://doi.org/10.1016/j.bse.2021.104241
Hashimoto Hideki, Landrum John, Miki Wataru (2009). Recent Achievements of Carotenoid Science and Technology. Arch Biochem Biophys 483 (2): 145–246. https://www.sciencedirect.com/journal/archives-of-biochemistry-and-biophysics/vol/483
Britton G, Liaaen-Jensen S, Pfander H (1998) (Eds). Vol. 3: Biosynthesis and Metabolism Basel: Birkhauser Verlag.
Чистяков ВА (2008) Неспецифические механизмы защиты от деструктивного действия активных форм кислорода. Успехи соврем биол 128 (3): 300–306. [Chistyakov VA (2008) Nonspecific defense mechanisms against the destructive action of reactive oxygen species. Advanc Modern Biol 128 (3): 300–306. (In Russ)].
Моторя ЕС, Пивненко ТН, Гажа АК, Иванушко ЛА, Воронцов ВН, Санина НМ (2009) Исследование иммуномодулирующей и мембранотропной активности каротиноидов из туники асцидии Halocynthia aurantium. Тихоокеанск мед журн 3:28–31. [Motorya ES, Pivnenko TN, Gazha AK, Ivanushko LA, Vorontsov VN, Sanina NM (2009) Study of the immunomodulatory and membranotropic activity of carotenoids from the tunic of the ascidian Halocynthia aurantium. Pacific Med J 3: 28–31. (In Russ)].
Maoka T (2011) Carotenoids in Marine Animals. Mar Drugs 9: 278–293. https://doi.org/10.3390/md9020278
Меньщикова ЕБ, Ланкин ВЗ, Зенков НК, Бондарь ИА, Круговых НФ, Труфакин ВА (2006) Окислительный стресс. Прооксиданты и антиоксиданты. М.: Фирма “Слово”. [Menshchikova EB, Lankin VZ, Zenkov NK, Bondar IA, Circular NF, Trufakin VA (2006) Okislitelnii stress. Prooksidanti I antyoksidanti. [Oxidative stress. Prooxidants and Antioxidants]. M: Firma “slovo”. (In Russ)].
Дейнека ВИ, Шапошников АА, Дейнека ЛА, Гусева ТС, Вострикова СМ, Шенцева ЕА, Закирова ЛР (2008) Каротиноиды: строение, биологические функции и перспективы применения. Научн ведомости Белгородск гос универ. Серия: Медицина. Фармация 6–2 (46): 19–25. [Deineka VI, Shaposhnikov AA, Deineka LA, Guseva TS, Vostrikova SM, Shentseva EA, Zakirova LR (2008) Carotenoids: structure, biological functions and application prospects. Scientif Bull Belgorod State Uni-ver. Series: Medicine. Pharmacy 6–2 (46): 19–25. (In Russ)]. http://dspace.bsu.edu.ru/handle/123456789/10633
Maoka T, Etoh T, Borodina AV, Soldatov AA (2011) A Series of 19’-Hexanoyloxyfucoxanthin Derivatives from the Sea Mussel, Mytilus galloprovincialis, Grown in the Black Sea, Ukraine. J Agric Food Chem 59 (24): 13059–13064. https://doi.org/10.1021/jf2035115
Goodwin TW (1984) The biochemistry of the carotenoids: animals. London; New York: Chapman and Hall.
Shahidi F, Brown JA (1998) Carotenoid pigments in seafoods and aquaculture. Crit Rev Food Sci Nutr 38 (1): 1–67. https://doi.org/10.1080/10408699891274165
Hertzberg S, Portali V, Liaaen-Jensen S. (1988) Animal Carotenoids. 32. Carotenoids of Mytilus edulis (Edible Mussel). Acta Chem Scand 42B: 495–503. http://actachemscand.org/doi/10.3891/acta.chem.scand.42b-0495
Partali V, Tangen K, Liaaen-Jensen S (1989) Carotenoids in food chain studies – III. Resorption and metabolic transformation of carotenoids in Mytilus edulis (Edible mussel). Comp Biochem Physiol Part B: Comp Biochem 92 (2): 239–246. https://doi.org/10.1016/0305-0491(89)90272-1
Britton G, Liaaen-Jensen S, Pfander H (1995) (Eds). Carotenoids. Vol 1A: Isolation and Analysis. Basel: Birkhäuser Verlag.
Karnaukhov VN, Milovidova NY, Kargopolova IN (1977) On a role of carotenoids in tolerance of sea molluscs to environment pollution. Comp Biochem Physiol. Part A: Physiology 56 (2): 189–193. https://doi.org/10.1016/0300-9629(77)90183-9
Бородина АВ, Нехорошев МВ, Солдатов АА (2008) Каротиноидный состав тканей двустворчатого моллюска Anadara inaeqivalvis – вселенца в Черное море. Экология моря 76: 34–39. [Borodina AV, Nekhoroshev MV, Soldatov AA (2008) Carotenoid composition of tissues of the bivalve mollusk Anadara inaeqivalvis - an invader to the Black Sea. Ecology Sea 76: 34–39. (In Russ)].
Бородина АВ, Солдатов АА (2014) Каротиноиды тканей массовых видов черноморских моллюсков. 87–168. В кн. Черноморские моллюски: элементы сравнительной и экологической биохимии. Шульман ГЕ, Солдатов АА (ред.) Севастополь: ЭКОСИ-Гидро-физика. [Borodina AV, Soldatov AA (2014) Carotenoids of tissues of dominant species of Black Sea shellfish. p. 87–168; In Black Sea clams: elements of comparative and ecological biochemistry. Shulman GE, Soldatov AA (Eds.). Sevastopol: EKOSI-Gidrofizika. (In Russ)].
Бородина АВ, Нехорошев МВ, Солдатов АА (2009) Особенности состава каротиноидов тканей двустворчатого моллюска Anadara inaequivalvis Brugiere. Доп. НАН Украiни. 5: 186–190. [Borodina AV, Ne-khoroshev MV, Soldatov AA (2009) Features of the composition of carotenoids in tissues of the bivalve mollusk Anadara inaequivalvis Brugiere. Dopovedi NAS Ukraine. 5: 186–190. (In Russ)].
Бородина АВ, Нехорошев МВ, Маока Т, Солдатов АА (2010) Состав каротиноидов гонад брюхоногого моллюска Rapana venosa (Valenciennes). Доп НАН Украiни 11: 136–142. [Borodina AV, Nekhoroshev MV, Maoka T, Soldatov AA (2010) Composition of carotenoids in the gonads of the gastropod mollusk Rapana venosa (Valenciennes). Dopovedi NAS Ukraine 11: 136–142. (In Russ)].
Borodina AV, Maoka T (2018) The Composition of Carotenoids in Tissues of the Ascidian Botryllus schlosseri (Pallas, 1766) from the Black Sea. Russ J Mar Biol 44 (3): 226–231. https://doi.org/10.1134/S1063074018030033
Borodina AV, Maoka T, Soldatov AA (2013) Composition and content of carotenoids in body of the Black sea gastropod Rapana venosa (Valenviennes, 1846). J Evol Biochem Physiol 49 (4): 255–263. https://doi.org/10.1134/S002209301303002X
Borodina AV, Zadorozhny PA (2020) The Annual Dynamics of Tissue Carotenoids in a Bivalve Mollusk Cerastoderma glaucum (Bruguière, 1789). J Evol Biochem Physiol 56 (1):1–10. https://doi.org/10.1134/S0022093020010019
Borodina AV, Soldatov AA (2016) The Qualitative Composition of Carotenoids and Their Seasonal Dynamics in Tissues of the Bivalve Anadara kagoshimensis (Tokunaga, 1906). Russ J Marine Biol 42 (2): 166–178. https://doi.org/10.1134/S1063074016020024
Borodina AV, Soldatov AA (2019) The Effect of Anoxia on the Content and Composition of Carotenoids in the Tissues of the Bivalve Invader Anadara kagoshimensis (Tokunaga, 1906). Russ J Biol Invas 10(4)307–314. https://doi.org/10.1134/S2075111719040027
Borodina AV (2016) Effect of food deprivation on transformation of carotenoids in the bivalve mollusc Anadara kagoshimensis (Tokunaga, 1906). J Evol Biochem Physiol 52 (4): 282–291. http://link.springer.com/article/10.1134/S0022093016040025
Borodina AV (2016) Carotenoids in the Gonads of the Bivalved Mollusk Anadara kagoshimensis(Tokunaga, 1906). J Evol Biochem Physiol 54 (4): 267–272. https://doi.org/10.1134/S0022093018040026
Borodina AV, Zadorozhny PA (2021) Seasonal Dynamics of Carotenoids in the Black Sea Bivalve Mollusk Chamelea gallina (Linnaeus, 1758). J Evol Biochem Physiol 57 (3): 503–510. https://doi.org/10.1134/S0022093021030054
Borodina AV, Zadorozhny PA (2020) Transformation of carotenoids in the marine bivalve mollusk Cerastoderma glaucum (Bruguiere, 1789) fed with green algae culture. J Evol Biochem Physiol 56 (6): 34–42. https://doi.org/10.31857/S0044452920060030
Borodina A, Zadorozhny P (2021) Ecological features of the accumulation of carotenoids in the Black Sea molluscs. IOP Conference Series: Earth and Environmental Science. Vol 937. Article 022077 (6 p.). https://doi.org/10.1088/1755-1315/937/2/022077
Карнаухов ВН (1988) Биологические функции каротиноидов. М.: Наука. [Karnaukhov VN (1988) Biological functions of carotinoids. M.: Nauka. (In Russ)].
Maoka T, Akimoto N (2008) Natural Product Chemistry in Carotenoid, Some Experimental Techniques for Structural Elucidation and Analysis of Natural Carotenoids. Carotenoid Sci (mini review) 13: 10–17. https://doi.org/10.3390/md9020278
Panayotova V, Merdzhanova A, Dobreva DA, Bratoeva K, Makedonski L (2020) Nutritional composition, bioactive compounds and health-beneficial properties of Black Sea shellfish. J IMAB 26 (3): 3293–3297. https://doi.org/10.5272/jimab.2020263.3293
Maoka T, Matsuno T (1988) Carotenoids of shellfishes. IX. Isolation and structural elucidation of three new acetylenic carotenoids from the Japanese sea mussel Mytilus coruscus. J Nippon Suisan Gakkaishi 54: 1443–1447. https://doi.org/10.2331/suisan.54.1443
Maoka T, Matsuno T (1988) Isolation and Structural Elucidation of Three New Acetylenic Carotenoids from the Japanese Sea Mussel Mytilus coruscus. J Bull Jap Soc Sci Fish 54: 1443–1447. (In Japan). https://doi.org/10.2331/suisan.54.1443
Maoka T (1997) A New Apocarotenoid from the Marine Shellfish Mytilus coruscus. J Nat Prod 60: 616–617. https://doi.org/10.1021/np970039q
Maoka T (2019) Carotenoids as natural functional pigments. J Nat Med 74:1–16https://doi.org/10.1007/s11418-019-01364-x
Бородина АВ (2009) Особенности состава каротиноидов гигантской устрицы Crassostrea gigas (Thunberg) в зависимости от плоидности и условий обитания. Экология моря 79: 31–36. [Borodina AV (2009) Features of the composition of carotenoids of the giant oyster Crassostrea gigas (Thunberg) depending on ploidy and habitat conditions. Ekologiya moray 79: 31–36. (In Russ)].
Fujiwara Y, Maoka T, Ookubo M, Matsuno T (1992) Crassostreaxanthin A and B, novel marine carotenoids from the oyster Crassostrea gigas. Tetrahedron Lett 33: 4941–4944. https://doi.org/10.1016/S0040-4039(00)61240-6
Maoka T, Hashimoto K, Akimoto N, Fujiwara Y (2001) Structures of five new carotenoids from the oyster Crassostrea gigas. J Nat Prod 64: 578–581. https://doi.org/10.1021/np000476w
Maoka T, Fujiwara Y, Hashimoto K, Akimoto N (2005) Structures of new carotenoids with a 3,4-dihydroxy-βend group from the oyster Crassostrea gigas. J Chem Pharm Bull 53 (9):1207–1209. https://doi.org/10.1248/cpb.53.1207
Polyakov NE, Leshina TV (2006) Certain aspects of the reactivity of carotenoids. Redox processes and complexation. 75 (12): 1049–1064. https://doi.org/10.1070/RC2006v075n12ABEH003640
Matsuno T, Maoka T (1981) Isolation of diatoxanthin, pectenoxanthin, pectenolone, and a new carotenoid, 3,4,3’–trihydroxy-7’,8’-didehydro-β-carotene from arkshell and related three species of bivalves. Bull Jap Soc Sci Fisher 47 (4): 495–499. (In Japan). https://doi.org/10.2331/suisan.47.495
Ha BS, Kang DS, Kim YG, Kim KS (1989) Variation in carotenoid pigment and lipids of the arkshell, (Anadara broughtonii) according to the environmental factors of the growing area. J Korean Soc Food Sci Nutrit. 18 (1): 71–92.
Фокина НН, Нефедова ЗА, Немова НН (2011) Биохимические адаптации морских двустворчатых моллюсков к аноксии (обзор). Труды Карельского научного центра РАН 3: 121–130. [Fokina NN, Nefe-dova ZA, Nemova NN (2011) Biochemical adaptations of marine bivalve molluscs to anoxia (review). Procceed Karelian Scient Center of the Russ Acad Sci 3: 121–130. (In Russ)].
Бородина АВ (2019) Накопление каротиноидов и аллометрический рост моллюска Cerastoderma glaucum (Bruguière, 1789). East Europen Scienca Jornal 50:4–8. [Borodina AV (2019) Accumulation of carotenoids and allometric growth of the mollusk Cerastoderma glaucum (Bruguière, 1789). East Eur Sci J 50: 4–8. (In Russ)].
Киселева МИ (1981) Бентос рыхлых грунтов Черного моря. Киев: Наук Думка. [Kiseleva MI (1981) Bentos rihlih gruntov Chornogo moray [Benthos of loose soils of the Black Sea. Kiev Nauk Dumka (In Russ)].
Еремеев ВН, Гаевская АВ, Шульман ГЕ, Загородняя ЮА (2011) (ред) Промысловые биоресурсы Чeрного и Азовского морей. Севастополь: ЭКОСИ–Гидрофизика. [Eremeev VN, Gaevskaya AV, Shulman GE, Za-gorodnyaya YuA (2011) (red) Commercial biological resources of the Black and Azov seas. Sevastopol: EKOSI–Gidrofizika. (In Russ)].
Макаров МВ (2020) Современное состояние малакофауны рыхлых грунтов в вершинной части бухты Казачьей (Черное море). Экологическая безопасность прибрежной и шельфовой зон моря 1: 119–130. [Makarov MV (2020) Current state of the malacofauna of loose soils in the summit of Kazachya Bay (Black Sea). Environmental safety of the coastal and shelf zones of the sea 1: 119–130. (In Russ)]. https://doi.org/10.22449/2413-5577-2020-1-119-130
Matsuno T, Sakaguchi S (1983) A novel marine carotenoid, mactraxanthin from the japanese edible surf clam. Tetrahedron Letters 24 (9): 911–912. https://doi.org/10.1016/S0040-4039(00)81562-2
Boyden CR (1970) Comparative studies on Cerastoderma edule (L.) and Cerastoderma glaucum (Poiret): PhD thesis. Department of Zoology & Comparative Physiology, Queen Mary College. London.
Maoka T, Akimoto N, Yim MJ, Hosokawa M, Miyashita K (2008) New C37 skeletal carotenoid from the clam, Paphia amabillis. J Agric Food Chem 56 (24): 12069–12072. https://doi.org/10.1021/jf802717b
Bruno Stancher, Fabio Zonta, Luciana Gabrielli Favretto. (1988) High-performance liquid chromatography of carotenoids from some marine shellfish. J Chromatography 440 (1988) 37–46. https://doi.org/10.1016/S0021-9673(00)94508-4
Pinello D, Dimech M, Megahed A, Gazzar ElH (2020) Assessment of the commercial chain of bivalves in Egypt. FAO. Fish Aquacult Circular No. 1196. Rome, FAO.
Papaioannou ChD, Sinanoglou VJ, Strati IF, Proestos Ch, Kyrana VR, Lougovois VP (2016) Impact of different preservation treatments on lipids of the smooth clam Callista chione. Int J Food Sci Technol 51: 325–332. https://doi.org/10.1111/ijfs.12972
Orban Elena, Gabriella Di Lena, Teresina Nevigato, Irene Casinia, Roberto Capronia Generoso Santaroni Giuliana Giulini (2007) Nutritional and commercial quality of the striped venus clam, Chamelea gallina, from the Adriatic sea. Food Chem 101 (3): 1063–1070. https://doi.org/10.1016/j.foodchem.2006.03.005
Токорев ЮН, Финенко ЗЗ, Шадрин НВ (ред) (2008) Микроводоросли Черного моря: проблемы биоразнообразия, сохранения, биотехнологического использования. Севастополь: ЭКОСИ-Гидрофизика. [Tokarev YuN, Finenko ZZ, Shadrin NV, Eds. (2008). Microalgae of the Black Sea: Problems of Biodiversity, Preservation and Biotechnological Use. Sevastopol: EKOSI-Gidrofizika. (In Russ)].
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии