Журнал эволюционной биохимии и физиологии, 2022, T. 58, № 4, стр. 269-283
МОРФОФУНКЦИОНАЛЬНЫЕ ОСОБЕННОСТИ ДВУХ ТИПОВ ФАГОЦИТОВ ГОЛОТУРИИ ЕUPENTACTA FRAUDATRIX (DJAKONOV ET BARANOVA, 1958)
Л. С. Долматова 1, *, Т. П. Смолина 2
1 Тихоокеанский океанологический институт им. В.И. Ильичева
Владивосток, Россия
2 Научно-исследовательский институт эпидемиологии и микробиологии им. Г.П. Сомова Роспотребнадзора
Владивосток, Россия
* E-mail: dolmatova@poi.dvo.ru
Поступила в редакцию 10.03.2022
После доработки 18.04.2022
Принята к публикации 18.04.2022
- EDN: JOHZVM
- DOI: 10.31857/S0044452922040040
Аннотация
Фагоциты дальневосточной голотурии Eupentacta fraudatrix методом градиентного центрифугирования разделяются на две фракции (Ф1 и Ф2 фагоциты), имеющие различные функциональные маркеры. Целью работы явилось выявление морфологических особенностей клеток двух фракций, их базового оксидантно-антиоксидантного статуса и фенотипа. Различными методами, включая световую и флуоресцентную микроскопию, цитометрический анализ и визуализирующую цитометрию, выявлены морфологические различия между двумя типами фагоцитов голотурии E. fraudatrix. Фагоциты различаются по своим размерным характеристикам, гранулярности, ядерно-цитоплазменному соотношению, показателям, характеризующим округлость клеток. Полученные данные свидетельствуют в пользу представлений о разном уровне дифференциации Ф1 и Ф2 фагоцитов и являются морфологическим обоснованием ранее полученных данных о разной роли этих клеток в иммунном ответе. В пользу представлений о разной функциональной роли двух типов фагоцитов свидетельствует и различный характер изменения числа этих клеток в зависимости от сезона. Наибольшие изменения числа Ф1 фагоцитов отмечены в период температурно-зависимых изменений метаболической активности голотурии, а Ф2 фагоцитов – в периоды, соответствующие тканевым перестройкам. Исследование базовых параметров функциональной активности не выявило достоверных различий в уровнях активных форм кислорода в обоих типах фагоцитов, при этом имелась тенденция к превышению уровня восстановленного глутатиона в Ф1 фагоцитах по сравнению с таковым в Ф2 клетках, что свидетельствует в пользу представлений о более высокой антиоксидантной активности в Ф1 фагоцитах. Дексаметазон оказывал на уровень связывания растительных лектинов из Canavalia ensiformis и Glycin max поверхностными рецепторами разнонаправленное действие в двух типах фагоцитов, подтверждая предположение о разном уровне их дифференцированности/активности и различной функциональной роли этих клеток.
Голотурии (Echinodermata, Holothuroidea) широко распространены в Мировом океане и вносят существенный вклад в биомассу макрозообентоса, оказывают существенное влияние на экологию своих мест обитания и являются ценным пищевым и фармакологическим сырьем [1]. Эволюционная близость этих беспозвоночных к позвоночным как вторичноротым [2] и необходимость защиты голотурий от инфекций вызвали значительный интерес к их иммунитету [3].
Большая часть иммунных клеток голотурий в норме находится в целомической жидкости, заполняющей полость тела [4]. К иммунным клеткам голотурий относят амебоциты или фагоциты (аналоги макрофагов позвоночных), осуществляющие фагоцитоз и инкапсулирование чужеродных агентов, и морулоподобные клетки, участвующие в инкапсуляции бактерий [5]. У Cucumaria japonica и близкого ей вида Eupentacta fraudatrix эти два типа клеток вместе с ювенильными (лимфоцитоподобными) клетками составляют большую часть пула (99%) всех целомоцитов – клеток целомической жидкости [6, 7]. Роль ювенильных клеток не вполне понятна, но они считаются стволовыми клетками для других типов целомоцитов [6, 8].
Фагоциты являются наиболее постоянно встречающимся типом клеток у иглокожих. Ранее фагоциты голотурий и морских ежей методом градиентного центрифугирования в растворах различной плотности были разделены на два и более типа [5]. Эти клетки, по данным Edds [9], отличались как по количественным, так и по морфологическим (различались по плотности и наличию гранул) и метаболическим (отличались по белкам цитоскелетона) признакам. Однако функциональные различия между двумя субпопуляциями долго оставались неизученными [10].
Известно, что у позвоночных макрофаги в ответ на различные сигналы среды в процессе так называемой поляризации макрофагов могут трансформироваться в два функционально различных типа: провоспалительный (М1 макрофаги, “классически” активированные), играет ключевую роль в защите от бактериальных инфекций, и антивоспалительный (М2 макрофаги, “альтернативно” активированные), вовлечен в восстановление тканей. Маркером М1 макрофагов является оксид азота (NO), а М2-макрофагов – высокая активность аргиназы. Эти два типа макрофагов также используют разные метаболические пути для производства энергии и различаются по содержанию восстановленного глутатиона (GSH), поверхностными маркерами, спектром синтезируемых цитокинов. Одним из часто используемых модуляторов поляризации макрофагов по М2 пути является дексаметазон [11].
В последнее десятилетие происходит накопление данных, свидетельствующих о наличии функциональных различий и между отдельными типами фагоцитов иглокожих. В частности, выявлено различие в их антиоксидантной активности [12, 13]. Также было показано, что два типа фагоцитов голотурии (Ф1 и Ф2) E. fraudatrix имеют разные функциональные маркеры, подобно макрофагам [12], кроме того, выявлено наличие разных поверхностных рецепторов у двух субпопуляций фагоцитов морских ежей Strongylocentrotus purpuratus [10] и двух типов фагоцитов E. fraudatrix [14].
В настоящей работе поставлена цель морфологической идентификации двух фракций фагоцитов голотурии E. fraudatrix, выявления особенностей их функциональной активности у интактных животных, а также исследование пластичности фенотипа клеток под влиянием дексаметазона.
МЕТОДЫ ИССЛЕДОВАНИЯ
Голотурии E. fraudatrix (с длиной тела 4–6 см), собирали в бухте Восток (зал. Петра Великого Японского моря) зимой, а также в бухте Алексеева (залив Петра Великого Японского моря) на базе морской экспериментальной станции “о. Попова” ТОИ ДВО РАН весной и осенью (для определения временных изменений в концентрации фагоцитов) с использованием легководолазного снаряжения. До начала экспериментов животные находились в аквариуме с проточной аэрируемой морской водой в течение двух недель.
Образцы целомической жидкости с добавлением антикоагулирующего раствора от одной, в ряде случаев, от 3–4 (при проведении функциональных исследований) или 15 (эксперименты in vitro) особей, объединяли и наслаивали на двухступенчатый градиент фиколл-верографина для выделения фагоцитов, как описано ранее [15]. Полученные после центрифугирования суспензии фагоцитов Ф1 (выделенных в интерфазе между образцом и фиколл-верографином, разведенным антикоагулирующим раствором в соотношении 1 : 4, объем/объем) и Ф2 (концентрирующихся в интерфазе между слоями фиколл-верографина, разведенного антикоагулирующим раствором в 2 и 4 раза) дважды отмывали фосфатно-солевым буфером с добавлением 36 г/л хлорида натрия (ФСБН) [5] и ресуспендировали в среде 199 с добавками (модификация метода Одинцовой [16]), как описано ранее [17].
При расчете количества клеток на одно животное в каждый временной период использовали четыре экземпляра голотурии. Концентрацию клеток определяли с использованием камеры Горяева в двух повторностях. Во всех случаях измеряли объем добавляемого к целомической жидкости антикоагулирующего раствора и суммарный объем целомической жидкости и антикоагулирующего раствора; объем целомической жидкости определяли по разнице между этими значениями. Количество клеток целомической жидкости на одну голотурию определяли как произведение концентрации клеток в целомической жидкости на объем последней.
Исследования проводили в свежевыделенных клетках, за исключением цитохимического анализа. В этом случае порцию клеток предварительно фиксировали 1%-ным глутаральдегидом в ФСБН и хранили при 4°C.
Цитометрический анализ фагоцитов проводили на проточном цитометре FACScan BD FACS Calibur (Becton Dickinson, Lincoln Park, NJ, США) по параметрам бокового (SSC) и прямого (FSC) светорассеяния, используя программу CellQuest Pro.
Диаметры клеток и ядер определяли с использованием флуоресцентного микроскопа Leica DM 4500 (Weltzlar, Германия), с предварительным окрашиванием ядер DAPI (Merсk, Германия). Определение проводили в шести экземплярах голотурии. В каждом случае исследовали не менее 20 клеток.
Кроме того, для анализа изображений и характеристики морфологических параметров использовали проточный визуализирующий цитометр (микроскоп) FlowCam 8400 (Fluid Imaging Technologies, Scarborough, США) и программное обеспечение VisualSpreadsheet 5 (version A 2020). Перед началом измерений суспензию клеток, предварительно разведенную в 4 раза, фильтровали (d = = 35 мкм). Измерения образца в объеме 100 мкл проводили при скорости потока 0.030 мл/мин. Использовали увеличение в 20 раз. Применяли заводские установки. При анализе изображений устанавливали два фильтра по параметрам ABD (Area based diameter, диаметр, основанный на площади) – различные для двух клеточных фракций, а также по симметрии (Sym, в диапазоне 0.5–1 ед.), соответствию округлости (отклонение края частицы от круга наилучшего соответствия, CF, в диапазоне 0.7–1 ед.), прозрачности (Transparency, диапазон 0–0.5 ед.), а также по циркулярности (параметр формы, вычисляемый по периметру, Cir, в диапазоне 0.6–1 ед.) – общие для двух типов фракций. Диапазон изменений морфологических параметров клеток был определен в предварительных экспериментах. В выделенных диапазонах определяли величины указанных выше параметров, а также EСD (эквивалентный циркулярный диаметр), AR (соотношение длин осей (сторон), и Cir(Hu)- (альтернативная мера округлости). Для каждого типа фракций проведено 4 независимых измерения.
Для определения влияния 100 мкМ дексаметазона (KRKA, Novo mesto, Словения) на фенотип фагоцитов клетки инкубировали 24 ч в круглодонных планшетах (1 млн клеток в лунке) при комнатной температуре. К контрольным клеткам добавляли равный объем ФСБН. Каждое воздействие производилось в двух независимых экспериментах и в двух повторностях.
Уровень активных форм кислорода (АФК) определяли с помощью флуоресцентного красителя 2'–7'-дихлородигидрофлуоресцеин диацетата (H2DCFDA) (Sigma-Aldrich, St. Louis, MO, США) в ФСБН (10 мкмоль/л), обрабатывая клетки в течение 15 мин (n = 3). Последующий цитометрический анализ живых клеток [18] проводили, используя цитометр CytoFLEX (Beckman Coulter, Inc.250 S. Kraemer Blvd. Brea, CA 92821, США) и программное обеспечение CytExpert.
Анализ содержания восстановленного глутатиона (n = 3) проводили с использованием в качестве дериватизационного реагента реактива Эллмана (5,5'-дитиобис-(2-нитробензойная кислота), ДТНБ) (Sigma-Aldrich) по модифицированному методу Fraternale и соавт. [19], как описано ранее [14]. Измерение оптической плотности растворов проводили на планшетном спектрофотометре STAT Fax 2100 (Awarness Technology Inc., США) при 402 нм. Концентрацию GSH в пробе определяли по калибровочной кривой со стандартом GSH (Sigma-Aldrich). Концентрацию белка в пробах измеряли с использованием красителя Кумасси G-250 (Sigma-Aldrich).
Экспрессию поверхностных рецепторов фагоцитов изучали методом окрашивания [20] отмытых от глутаральдегида клеток ФИТЦ-конъюгированными растительными лектинами (ICN Biomedicals, Германия) из Canavalia ensiformis (con A) и из Glycin max (SBA), связывающихся с GalNAcα1–3GalR и α-D-маннопиранозидами соответственно [21]. Связывание лектинов с поверхностными рецепторами оценивали по процентному содержанию клеток с зонами яркой зеленой флуоресценции. Ядра фагоцитов окрашивали DAPI (Merсk, Германия). Для анализа флуоресценции иcпользовали микроскоп Leica DM 4500 (Weltzlar, Германия). В каждой повторности исследовали не менее 100 клеток.
Статистическую обработку данных (среднее значение ± SEM) проводили с использованием программного обеспечения GraphPad Prism v. 6.01 (GraphPad Software, Inc., San Diego, CA, США). Для определения нормальности распределения данных использовали тест Колмогорова–Смирнова. Достоверность различий определяли с использованием t-критерия Стьюдента. Разницу между группами считали достоверной при p < 0.05.
Работа частично выполнена с использованием оборудования Дальневосточного Центра электронной микроскопии Национального научного центра морской биологии ДВО РАН.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Морфологические особенности двух типов фагоцитов. Данные цитометрического анализа, основанного на параметрах прямого и бокового светорассеяния, выявили, что целомоциты распределяются по двум областям, обозначенным R1 и R2 (рис. 1а), со значительно более высокой концентрацией клеток в R1. Разделенные в градиенте плотности фагоциты (рис. 1b) находились в области, соответствующей R1, и показали близкие, частично перекрывающиеся, параметры распределения. Вместе с тем величины прямого и бокового светорассеяния для Ф1 превышали таковые для Ф2 фагоцитов, что указывает на имеющиеся различия в диаметре и гранулярности (наличии включений) этих двух типов клеток.
Рис. 1.
Морфологическая идентификация фагоцитов голотурии E. fraudatrix. (a) Результаты цитометрического анализа клеток целомической жидкости (CF). (b) Результаты цитометрического анализа фагоцитов, полученных в результате центрифугирования в ступенчатом градиенте плотности фиколл-верографина. По оси абсцисс: интенсивность прямого светорассеяния (FSC), по оси ординат: интенсивность бокового светорассеяния (SSC). (с) Микрофотографии фагоцитов Ф1(P1) (верхняя панель) и Ф2 (P2) (нижняя панель). Левая панель – в проходящем свете, правая панель – окраска DAPI. Масштаб: 20 мкм.

Микроскопическое исследование изолированных фракций фагоцитов (рис. 1c) выявило, что оба типа клеток имеют преимущественно округлую форму. Размеры клеток (табл. 1), хотя и имеют частично перекрывающиеся диапазоны, достоверно отличаются, при этом диаметр Ф1 фагоцитов в среднем почти на 30% больше, чем у Ф2 фагоцитов (p <0.001). Оба типа фагоцитов также имели ядра одинакового диаметра, но различное ядерно-плазменное отношение, в Ф2 фагоцитах его значение больше, чем в Ф1 клетках.
Таблица 1.
Размерные показатели фагоцитов
| Тип фагоцитов | Диаметр клеток (мкм) | Диаметр ядра (мкм) | Ядерно-плазменное отношение |
|---|---|---|---|
| Ф1 | 9.27 ± 0.37 | 3.46 ± 0.20 | 0.44 ± 0.02 |
| Ф2 | 7.23 ± 0.32** | 3.31 ± 0.29 | 0.53 ± 0.04* |
Дальнейшие исследования морфологических параметров клеток были проведены с использованием метода проточной визуализирующей цитометрии FlowCam.
Выявленные ранее различия в размерности двух фракций послужили основанием для установки фильтров для получения изображений и характеристики клеток в диапазоне АBD 7–12 и 5–9 мкм для фракций Ф1 и Ф2 соответственно (рис. 2).
Рис. 2.
Изображения клеток, полученных с помощью метода FlowCam, при использовании разных фильтров для ABD (7‒12 и 5–9 мкм). Масштаб 20 мкм.

Установлено (табл. 2), что между фракциями, выделенными в соответствии с установленными фильтрами (1) и (2), представляющими фракции Ф1 и Ф2 фагоцитов соответственно, имеются различия только по параметрам размерности (АВD и EСD) и округлости (Cir и Cir(Hu)), которые в первой фракции выше, чем во второй. При этом значение параметра размерности EСD в среднем выше, чем значение АВD, и различия между фракциями по этому параметру более достоверны. Показатель Cir(Hu), который в большей мере характеризует степень округлости клеток по сравнению с таковым Cir, также в среднем выше, чем показатель Cir. Отмечена также тенденция к снижению AR в Ф2 клетках по сравнению с Ф1 фагоцитами.
Таблица 2.
Морфологические параметры двух фракций фагоцитов, полученные с использованием метода FlowCam
| Морфологические параметры | Фильтр АВD | |
|---|---|---|
| (1) 7–12 мкм | (2) 5–9 мкм | |
| АВD | 8.11 ± 0.11* | 5.4 ± 0.47 |
| EСD | 12.10 ± 0.50** | 7.02 ± 0.97 |
| Sym | 0.79 ± 0.05 | 0.77 ± 0.48 |
| AR | 0.92 ± 0.02 | 0.85 ± 0.06 |
| CF | 0.88 ± 0.01 | 0.84 ± 0.02 |
| Cir | 0.82 ± 0.01* | 0.72 ± 0.02 |
| Cir(Hu) | 0.96 ± 0.03* | 0.83 ± 0.02 |
| Transparancy | 0.31 ± 0.008 | 0.30 ± 0.03 |
Влияние сезонности на количество фагоцитов во фракциях. Проведенные в весенний и зимний периоды измерения содержания целомоцитов у голотурий не выявили временных различий (17.90 ± ± 4.38 и 17.58 ± 4.38 клеток на голотурию в марте и в декабре соответственно). Однако содержание фагоцитов в двух фракциях клеток в расчете на одну голотурию варьировало в зависимости от сезона. Так, количество фагоцитов Ф1 достоверно не менялось в период с февраля по апрель, но снижалось в период с октября по декабрь. Содержание же Ф2 фагоцитов, будучи максимальным в феврале, снижалось в последующие исследованные периоды, не отличаясь существенно в периоды с марта по октябрь, но достигая минимального значения в декабре, как и Ф1 фагоциты (рис. 3). Концентрация Ф2 фагоцитов превышала таковую Ф1 в 4–3 раза в феврале и октябре соответственно, менее значительное превышение (в 1.6 раза) было в марте, но не выявлено достоверных различий в содержании двух типов клеток в декабре и апреле. Соответственно менялся и суммарный вклад обеих фракций фагоцитов в общее количество целомоцитов: в декабре он составил 14.6%, а в марте – 38%, при неизменности общего количества целомоцитов в эти месяцы.
Рис. 3.
Содержание фагоцитов Ф1 (P1) и Ф2 (P2) в отдельные месяцы. * – различия по сравнению с Ф1 фагоцитами статистически значимы при p < 0.05; ** – различия по сравнению с апрелем статистически значимы при p < 0.05; *** – различия по сравнению с другими периодами (март–декабрь) статистически значимы при p < 0.05. Значения представлены как M ± SEM, n = 4.

Уровень АФК в фагоцитах. График для H2DCFDA-зависимой флуоресценции Ф2 фагоцитов имел тенденцию к смещению правее относительно такового для Ф1 клеток (рис. 4), а интенсивность флуоресценции в Ф2 фагоцитах имела тенденцию к превышению таковой в Ф1 фагоцитах. Тем не менее эти параметры не отличались достоверно между двумя типами фагоцитов.
Рис. 4.
Репрезентативная гистограмма уровня АФК (ROS) в фагоцитах. (a) Ф1 фагоциты. (b) Ф2 фагоциты. По оси абсцисс – интенсивность флуоресценции H2DCFDA, по оси ординат – количество проанализированных клеток. Доля (%) клеток, продуцирующих АФК (ROS), и медиана интенсивности флуоресценции представлены в рамках. Значения представлены как M ± SEM, n = 3.

Содержание восстановленного глутатиона. Не выявлено достоверных различий и в содержании GSH в двух типах фагоцитов (рис. 5), хотя отмечена тенденция к более низкой аккумуляции данного антиоксиданта в Ф2 фагоцитах по сравнению с Ф1 фагоцитами.
Рис. 5.
Концентрация GSH в свежевыделенных фагоцитах Ф1 (P1) и Ф2 (P2). Значения представлены как M ± SEM, n = 3.

Влияние дексаметазона на связывание растительных лектинов с поверхностными рецепторами фагоцитов. Через 24 ч инкубации связывание поверхностных рецепторов с con A в Ф1 и Ф2 фагоцитах достоверно не отличалось, а связывание с SBA было значительно выше в Ф2 фагоцитах по сравнению с Ф1 клетками (рис. 6a, c).
Рис. 6.
Микрофотографии фагоцитов Ф1 (P1) и Ф2 (P2), проинкубированных 24 ч и окрашенных ФИТЦ-меченым con A. (а) Контроль (ФСБН). (b) Воздействие 100 мкМ дексаметазона. Здесь и на рис. 7 левая панель – клетки в проходящем свете, средняя панель – окраска ядер клеток DAPI (синяя флуоресценция), правая панель – ФИТЦ-окрашенные клетки (зеленая флуоресценция). Масштаб: 20 мкм. (c) Доля (%) фагоцитов, связывающих соn A. 1 – Ф1 фагоциты, контроль; 2 – Ф1 фагоциты, воздействие дексаметазона; 3 – Ф2 фагоциты, контроль; 4 – Ф2 фагоциты, воздействие дексаметазона. ** – различия между контрольной и экспериментальной группами статистически значимы при p < 0.01. Значения представлены как M ± SEM, n = 2. В каждой повторности исследовали не менее 100 клеток.
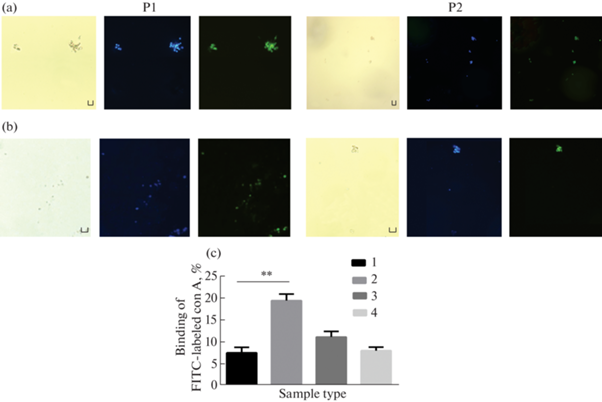
Дексаметазон в 2–4 раза стимулировал связывание con А в Ф1, но не в Ф2 фагоцитах, через 24 ч инкубации (рис. 6b, c).
Связывание поверхностных рецепторов фагоцитов с SBA было значительно выше в Ф2 фагоцитах по сравнению с Ф1 клетками (рис. 7a, c). Связывание SBA с поверхностными рецепторами при воздействии дексаметазона изменялось в обоих типах фагоцитов, причем противоположным образом: в Ф1 фагоцитах возрастало в 2 раза, а в Ф2 снижалось в 3.2 раза (рис. 7b, c).
Рис. 7.
Микрофотографии фагоцитов Ф1 (P1) и Ф2 (P2), проинкубированных 24 ч и окрашенных ФИТЦ-меченым SBA. (а) Контроль (ФСБН). (b) Воздействие 100 мкМ дексаметазона. (c) Доля (%) фагоцитов, связывающих SBA. 1 – Ф1 фагоциты, контроль; 2 – Ф1 фагоциты, воздействие дексаметазона; 3 – Ф2 фагоциты, контроль; 4 – Ф2 фагоциты, воздействие дексаметазона. * – различия между группами статистически достоверны при p < 0.05, ** – различия между группами статистически достоверны при p < 0.01. Значения представлены как M ± SEM, n = 2. В каждой повторности исследовали не менее 100 клеток.

ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Цитометрический анализ показал, что целомоциты E. fraudatrix в целом разделяются на популяции сходно с описанными для других иглокожих. Так, у морской звезды Marthasterias glacialis целомоциты представлены двумя популяциями, различающимися по морфологии и размерам клеток и относительным количеством клеток [22]. При этом наиболее многочисленной была фракция, представленная фагоцитами, которые по морфофунк-циональным признакам делились на два подтипа, по-разному участвующих в фагоцитозе. У голотурии Apostichopus japonicus были выделены две популяции целомоцитов, различающиеся по гранулярности, размерности и численности, и третья, промежуточная, между ними [23].
В настоящей работе целомоциты E. fraudatrix разделялись на две популяции, значительно различающиеся как по размерности, так и по гранулярности. Как и для A. japonicus [23], популяция наиболее гранулярных клеток была наименее многочисленной. Цитометрический анализ двух выделенных центрифугированием в градиенте плотности фиколл-верографина фракций фагоцитов показал, что обе фракции входят в популяцию менее гранулярных клеток и отличаются между собой как по размерам, так и по уровню гранулярности клеток.
Полученные микроскопическими методами данные о размере фагоцитов показали, что фагоциты E. fraudatrix разделяются в зависимости от диаметра на две группы, которые можно назвать большими (9.27 ± 0.37 мкм) и малыми (7.23 ± 0.32 мкм) фагоцитами на основе различий в размерах. Необходимо отметить, что диаметр фагоцитов иглокожих варьирует между 3 и 20 мкм [24] или, по другим данным, между 10 и 40 мкм [5], и различия выявляются как между разными классами иглокожих [8], так и между родственными видами [13]. Фагоциты были классифицированы по морфологическим признакам на субтипы, однако у авторов, описывающих фагоциты разных классов иглокожих, применяются различные подходы к классификации, что не всегда позволяет провести сравнительную идентификацию того или иного типа у разных классов [8]. Фагоциты разделяют, в частности, по диаметру клеток, на большие и маленькие [25]. Однако сами субпопуляции клеток даже внутри одного класса при делении по размеру могут накладываться друг на друга, что также затрудняет классификацию фагоцитов [8]. У голотурии Holothuria glaberrima наиболее часто встречаемым типом клеток являются лимфоцитоподобные клетки, имеющие маленький диаметр (4–6 мкм), большое ядро и маленький объем цитоплазмы [8]. У E. fraudatrix лимфоцитоподобные клетки могут иметь диаметр 2–6 мкм [26], у Holothuria polii самые немногочисленные и самые мелкие клетки имели диаметр 6–8 мкм [27]. Эти клетки обычно рассматриваются как предшественники других клеток, но обладающие фагоцитарной активностью [4, 6, 8], хотя не всегда доказана возможность их дифференцировки в другие клетки [27]. Зрелые фагоциты у голотурии H. glaberrima имеют размер 10.8 ± 2.3 мкм [8], у A. japo-nicus – 3–5 мкм, у C. japonica – 5–10 мкм [7]. У Holothuria scabra мелкие клетки (4–5 мкм) названы лимфоцитами, доля которых в три раза меньше, чем доля фагоцитов диаметром 5–10 мкм [13].
Поскольку величины диаметров клеток двух фракций фагоцитов частично перекрываются, определение диаметра не достаточно для классификации выделенных типов фагоцитов. Полученные нами данные показывают, что клетки двух фракций отличаются и по ядерно-плазменному отношению, что, по-видимому, обусловливает различную плотность этих клеток и приводит к соответствующим различиям в их распределении между ступенями градиента плотности, при котором клетки со сравнительно меньшим диаметром оказываются в более плотных слоях [28]. Сравнение с данными Завальной и соавт. [26] показывает, что клетки Ф2 фракции нельзя отнести к описанным лимфоцитоподобным клеткам E. fraudatrix, однако на основании разной степени развитости цитоплазмы можно предположить, что Ф2 фагоциты являются менее зрелыми по сравнению с Ф1 клетками и близки по размерам лимфоцитам, описанным для ряда других голотурий [8, 13, 27].
С помощью визуализирующей проточной цитометрии в каждой из двух фракций на основании диапазона их диаметров, установленных с помощью световой микроскопии, были выделены фагоциты с размерами, в небольшой степени перекрывающимися с таковыми другой фракции. Было выявлено, что Ф1 и Ф2 фагоциты, размеры которых находились в пределах 7–12 и 5–9 мкм (по ABD), соответственно, различались не только по диаметрам, но и по степени округлости, которая у Ф1 были значительно выше, чем у Ф2. Имеется также тенденция к снижению AR в Ф2 по сравнению с Ф1 фагоцитами. Это свидетельствует о большей вытянутости клеток Ф2 фракции по сравнению с Ф1 клетками [29]. Вместе с тем известно, что форма макрофагов связана с их поляризационным статусом. В частности, М2 макрофаги имеют более вытянутую форму, что связано с их более организованным цитоскелетоном [30]. На различия в свойствах цитоскелетона двух субпопуляций фагоцитов морского ежа Strongylocentrotus droebachiensis указывал ранее Edds [9]. По-видимому, выявленные различия в форме Ф1 и Ф2 фагоцитов свидетельствуют в пользу их различной роли в клеточном ответе у голотурии.
Фагоциты играют важнейшую роль в защите иглокожих, в том числе голотурий, от патогенных факторов, и их число играет существенную роль в этой защите [31, 32]. У E. fraudatrix они составляют до 40% от общего числа целомоцитов [6]. Однако голотурии, как и другие иглокожие, являясь обитателями шельфовых вод [1], подвергаются значительным колебаниям внешних воздействий, в том числе, сезонного характера, которые могут оказывать влияние на иммунитет голотурий [33]. При этом, по данным Brockton и др. [34], у морских ежей количество малых фагоцитов значительно изменяется у индивидуумов в зависимости от иммунного статуса. Однако данные о влиянии сезонности на количество фагоцитов и их отдельных фракций у голотурий практически отсутствуют.
Летний период связан со значительными вариациями в активности иммунной системы, вызванными, в первую очередь, стрессовыми температурами [33], кроме того, в этот же период происходит нерест у E. fraudatrix [35], что может снижать воспроизводимость результатов исследований интактных фагоцитов и экспериментальных воздействий, не связанных с изучением влияния факторов внешней среды.
В настоящей работе было проведено исследование количества целомоцитов и фагоцитов в зимний, весенний и осенний периоды у E. fraudatrix. Общее содержание клеток целомической жидкости не изменялось в весенний и осенний сезоны, что соответствует данным литературы о достаточной резистентности этого параметра у иглокожих к внешним воздействиям, при том, что происходили изменения в соотношении отдельных типов клеток [36]. У E. fraudatrix сезонность также оказывала значительное влияние на количество фагоцитов в исследованных фракциях и/или соотношение клеток во фракциях. Зимнее снижение количества Ф1 фагоцитов может быть связано со снижением физиологической активности голотурий, в частности, постепенным снижением двигательной активности по аналогии с A. japonicus, для которого у берегов Приморья оно отмечено в зимний период [37]. Декабрьский минимум количества фагоцитов обеих фракций, по-видимому, связан с состоянием гипобиоза у голотурий, который был показан, в частности, у A. japonicus при температуре ниже 1оС [38]. A. japonicus и E. fraudatrix обитают в сходных условиях в заливе Петра Великого, и температура воды в нем в декабре достигает значений, близких к нулю, вновь начиная подниматься лишь в феврале [39].
Относительная стабильность содержания клеток Ф1 фракции, за исключением периода покоя, свидетельствует об их участии в поддержании гомеостаза организма. При этом значительное увеличение количества Ф2 фагоцитов по сравнению с Ф1 фагоцитами в отдельные периоды (февраль, октябрь) указывает на то, что функционально они отличаются от Ф1 фагоцитов. Указанные периоды совпадают со временем восстановления тканей гонад после зимнего гипобиоза у голотурий и в посленерестовый период, описанных у трепанга [40], и свидетельствуют о возможном участии Ф2 фагоцитов в регенеративных процессах.
Соответственно в период сниженной активности голотурий (декабрь) суммарный вклад обеих фракций фагоцитов в общее количество целомоцитов значительно снижался по сравнению с таковым в период восстановительной активности в марте, когда он достигал значений, близких к описанным Eliseikina и Magarlamov [6]. Полученные данные свидетельствуют о том, что изменения в соотношении количества фагоцитов различных фракций голотурий сезонно-зависимы и, по-видимому, отражают различную роль этих клеток в организме. Значительные колебания в соотношении клеток разных фракций у иглокожих в зависимости от сезонных факторов должны приниматься во внимание при оценке данных, получаемых разными авторами.
Функциональная активность фагоцитов характеризуется прежде всего их фагоцитарной способностью, связанной с уровнем оксидантной активности в клетках [41]. Проведенное цитофлуориметрическое исследование показало, что в свежевыделенных фагоцитах Ф1 и Ф2 отмечен сходный высокий уровень продукции АФК. Полученные результаты соответствуют ранее полученным данным о высоком уровне АФК в фагоцитах голотурий по сравнению с лейкоцитами позвоночных [17] и об отсутствии различий в уровне супероксиданионрадикала между двумя фракциями свежевыделенных фагоцитов интактных животных [12].
Вместе с тем высокий уровень АФК обусловливает необходимость защиты клетки от повреждений кислородными радикалами, что обеспечивает система антиоксидантной защиты [42]. В Ф1 клетках антиоксидантная ферментная система более эффективна, чем в Ф2 фагоцитах, о чем свидетельствует значительно более высокая активность супероксиддисмутазы (СОД), обезвреживающей супероксиданионрадикал, и глутатионтрансферазы (ГТ), детоксицирующей ксенобиотики и использующей в качестве косубстрата GSH [12]. Это свидетельствует в пользу предположения о том, что антиоксидантная ферментная система может обеспечивать сохранение оксидантно-антиоксидантного баланса даже на фоне более активной продукции АФК в Ф1 клетках. При этом в настоящей работе показано, что уровень GSH, неферментного компонента антиоксидантной системы, хотя и не отличался достоверно между двумя фракциями свежевыделенных фагоцитов голотурии, однако отмечена тенденция к его снижению в Ф2 фагоцитах по сравнению с Ф1 фагоцитами. Такая же тенденция отмечена при краткосрочной инкубации фагоцитов in vitro [43]. Выявленное ранее [12] снижение активности ГТ в Ф2 фагоцитах по сравнению с таковой в Ф1 фагоцитах при близких величинах активности глутатионредуктазы, которая обеспечивает восстановление окисленного глутатиона, также свидетельствует в пользу более значительного уровня продукции GSH в Ф1 фагоцитах.
Для макрофагов показано участие GSH в поляризации по М1-пути, обеспечивающему антиинфекционную защиту, и наличие более высокого значения соотношения восстановленной и окисленной форм глутатиона в М1 макрофагах по сравнению с М2 клетками [44]. Ф1 фагоциты, по-видимому, обладают более высокой обеспеченностью GSH по сравнению с Ф2 фагоцитами, что также может быть связано с различиями в их функциях, подобно функциональным различиям между М1 и М2 макрофагами.
Считается, что М1 макрофаги обладают более высоким уровнем продукции NО [11] и АФК [45] по сравнению с М2 макрофагами. В то же время отмечается, что вопрос о продукции АФК М2 макрофагами еще мало изучен [46], и АФК необходимы для поляризации макрофагов как по М1, так и по М2 пути [47]. В последнее время появились данные о том, что продукция супероксиданиона может быть прерогативой обоих типов макрофагов в равной мере [48]. Ранее показано, что уровень NО также достоверно выше в Ф1 фагоцитах по сравнению с Ф2 фагоцитами [12]. Полученные же данные о сходном уровне АФК в двух типах фагоцитов аналогичны данным о сходстве этого параметра в двух типах макрофагов [48]. При этом можно предполагать, что продукция АФК в фагоцитах Ф1 может быть выше, чем в Ф2 фагоцитах, а отсутствие достоверной разницы в уровне АФК в этих клетках связано с более высоким уровнем активности СОД [12], обезвреживающей супероксиданионрадикал, относящийся к инициирующим АФК [49].
Изменения в оксидантно-антиоксидантном статусе тесно связаны с метаболическим репрограммированием иммунных клеток [50]. Различия между Ф1 и Ф2 фагоцитами в уровне антиоксидантной защиты, как ферментативной, так и неферментативной (продукция GSH), свидетельствуют в пользу представления о разных путях метаболизма в Ф1 и Ф2 фагоцитах интактных животных, основанном на наличии разных функциональных маркеров у Ф1 и Ф2 фагоцитов (уровень NO и активность аргиназы) [12], сходно с таковыми у М1 и М2 макрофагов [11]. В свою очередь, метаболический статус иммунных клеток влияет на их функции [51], и разница в метаболизме, по-видимому, лежит в основе различий ответов этих клеток, вплоть до противоположных, описанных при воздействии внешних стимулов (дексаметазон, термостабильный токсин Yersinia pseudotuberculosis) [12, 14].
Так, ранее было показано, что воздействие различных стрессовых факторов вызывает противоположные изменения в уровне АФК в Ф1 и Ф2 фагоцитах, что может приводить к трансформации фенотипов этих клеток. Способность к индукции изменений в функциональной активности Ф1 и Ф2 фагоцитов, сопровождающейся возрастанием продукции АФК в Ф2, но не Ф1 фагоцитах голотурии и приобретением Ф1 фагоцитами маркеров Ф2 типа, проявил, в частности, дексаметазон [12], имеющий свойство индуцировать поляризацию макрофагов по второму типу [11].
В связи с этим было предпринято также исследование возможности влияния дексаметазона на фенотип фагоцитов. Поскольку у беспозвоночных не выявлены поверхностные маркеры, схожие с таковыми у позвоночных, для фенотипирования клеток использовали один из наиболее общеупотребительных методов окраски клеток растительными лектинами, связывающимися с определенными углеводными остатками белков, меченными флуоресцентным красителем [52]. В частности, окраска лектинами показала себя полезной для выявления разных стадий дифференцировки и смерти макрофагов [28]. Так, con А преимущественно связывается с маннановыми остатками рецепторов на поверхности фагоцитов при развитии апоптоза или аутофагии [53]. По некоторым данным, связывание поверхностными рецепторами клеток SBA считается одним из наиболее надежных маркеров стадии дифференцировки макрофагов, с более высоким значением этого параметра в более зрелых тимоцитах [54] или клетках костного мозга [55]. Однако не отмечено различий в связывании SBA моноцитами и макрофагами [56]. При этом установлена положительная корреляция между связыванием SBA и апоптозом у позвоночных [57].
У H. scabra отмечается разница в связывании лектинов фагоцитами и лимфоцитами: первые связывались в большем количестве случаев с con А и PNA (лектин из Arachis hypogaea), а также некоторыми другими лектинами, по сравнению с лимфоцитами [13]. При этом свежевыделенные Ф1 и Ф2 фагоциты E. fraudatrix, как было показано ранее, не отличаются достоверно между собой по интенсивности связывания con А и PNA [14, 31]. Вместе с тем связывание SBA поверхностными рецепторами фагоцитов E. fraudatrix, по различным данным, могло быть как выше [31], так и ниже [14] в Ф1 фагоцитах по сравнению с Ф2 фагоцитами, что свидетельствует о том, что экспрессия соответствующего рецептора может зависеть от условий среды и сезонных факторов. В настоящей работе исследование связывания лектинов в зимний период, в отсутствие физиологической актвности, связанной с репродукцией, показало, что и для контрольных фагоцитов, как и в свежевыделенных фагоцитах [14], уровень con А не варьировал между фракциями. При этом уровень SBA был значительно выше в Ф2 фагоцитах по сравнению с Ф1 фагоцитами.
Дексаметазон через 24 ч инкубации индуцировал возрастание интенсивности связывания поверхностными рецепторам фагоцитов Ф1 как con А, так и SBA, а в Ф2 фагоцитах – только снижение связывания SBA. Известно, что глюкокортикоиды влияют на клетки врожденного иммунитета позвоночных сложным образом. Они защищают наивные моноциты от апоптоза, способствуя их дифференцировке в сторону М2 типа, в то же время индуцируют апоптоз в классически активированных моноцитах. Таким образом, действие дексаметазона зависит от типа клеток и степени их активации и направлено как на стимуляцию апоптоза в провоспалительных клетках, так и обеспечение дифференциации моноцитов в долгоживущий альтернативный тип, участвующий в восстановлении тканей [58]. Сходным образом, исследование эффектов дексаметазона на Ф1 и Ф2 фагоциты голотурии показало противоположную концентрационную зависимость апоптоза в этих клетках. В частности, дексаметазон в концентрации 100 мкМ стимулировал апоптоз в Ф1, но снижал в Ф2 фагоцитах [59]. По-видимому, противоположные или различные изменения в связывании поверхностных рецепторов фагоцитов с SBA и con А соответственно при воздействии дексаметазона в настоящей работе отражают изменения уровня апоптоза в клетках. Вместе с тем различный эффект дексаметазона на Ф1 и Ф2 фагоциты указывает, по аналогии с макрофагами, на различную степень дифференциации/активации этих клеток. Эти данные, наряду с приведенными выше данными о морфологических различиях двух типов фагоцитов (большие диаметр и плазменно-ядерное соотношении у Ф1 фагоцитов по сравнению с Ф2 клетками) свидетельствуют в пользу представлений о различной степени дифференцировки Ф1 и Ф2 фагоцитов. Об этом же свидетельствует соответствие размерности Ф1 и Ф2 фагоцитов, установленных в данной работе, значениям размерности для фагоцитов E. fraudatrix разной степени зрелости, представленным Завальной и соавт. [26].
В совокупности с результатами, полученными ранее о сдвигах в уровне внутриклеточных маркеров (NО и активности аргиназы) в Ф1 и Ф2 фагоцитах при действии дексаметазона в сторону преобладания Ф2 фенотипа [12], полученные данные свидетельствуют о том, что дексаметазон вызывает в Ф1 и Ф2 фагоцитах фенотипический и функциональный сдвиг, приводящий к превалированию фагоцитов второго типа, фенотипически и функционально подобных М2 макрофагам.
ЗАКЛЮЧЕНИЕ
Установленные различия в морфологии двух типов фагоцитов E. fraudatrix указывают на различную степень их зрелости. При этом фагоциты имеют различия в функциональной активности и фенотипах. Дексаметазон способен вызывать сдвиг в фенотипах обоих типов клеток, свидетельствующий о возможности сдвига в соотношении фагоцитов в пользу преобладания Ф2 клеток.
Выявленные морфофункциональные различия фагоцитов Ф1 и Ф2 лежат в основе противоположного характера изменений активности этих клеток при воздействии различных стрессовых факторов, описанных ранее, и свидетельствуют о сложном характере клеточного иммунитета у голотурий, в ряде случаев подобно таковому у позвоночных, включающему реализацию иммунного ответа по М1 или М2 пути. Дальнейшие исследования механизмов участия Ф1 и Ф2 фагоцитов в иммунном ответе как при инфекциях, так и при регенеративных процессах, позволят полнее представить эволюцию иммунитета у вторичноротых.
Список литературы
Granda V, Lovatelli A, Rome M (eds) (2008) Sea cucumbers. A global review of fisheries and trade. FAO fisheries and aquaculture technical paper No. 516. Rome: FAO.
Dong Y, Sun H, Zhou Z, Yang A, Chen Z, Guan X, Gao S, Wang B, Jiang J (2014) Expression analysis of immune related genes identified from the coelomocytes of sea cucumber (Apostichopus japonicus) in response to LPS challenge. Int J Mol Sci 15:19472–19486. https://doi.org/10.3390/ijms151119472
He L-S, Zhang P-W, Huang J-M, Zhu F-C, Danchin A, Wang Y (2018) The enigmatic genome of an obligate ancient Spiroplasma symbiont in a Hadal holothurian. Appl Environ Microbiol 84: e01965–17. https://doi.org/10.1128/AEM.01965-17
Li Q, Qi R, Wang Y, Ye S, Qiao G, Li H (2013) Comparison of cells free in coelomic and water-vascular system of sea cucumber, Apostichopus japonicus. Fish Shellfish Immunol 35:1654–1657. https://doi.org/10.1016/j.fsi.2013.07.020
Chia F-S, Xing J (1996) Echinoderm coelomocytes. Zool Stud 35: 231–254.
Eliseikina MG, Magarlamov TY (2002) Coelomocyte morphology in the holothurians Apostichopus japonicus (Aspidochirota, Stichopodidae) and Cucumaria japonica (Dendrochirota, Cucumariidae). Russ J Mar Biol 28:197–202. https://doi.org/10.1023/A:1016801521216
Dolmatova LS, Eliseikina MG, Romashina VV (2004) Antioxidant enzymatic activity of coelomocytes of the Far East sea cucumber Eupentacta fraudatrix. J Evol Biochem Physiol 40: 126–135.
Ramírez-Gómez F, Aponte-Rivera F, Méndez-Castaner L, García-Arrarás JE (2010) Changes in holothurian coelomocyte populations following immune stimulation with different molecular patterns. Fish Shellfish Immunol 29:175–185. https://doi.org/10.1016/j.fsi.2010.03.013
Edds KT (1977) Dynamic aspects of filopodial formation by reorganization of microfilaments. J Cell Biol 73:479–491.https://doi.org/10.1083/jcb.73.2.479
Liao W-Y, Fugmann SD (2017) Lectins identify distinct populations of coelomocytes in Strongylocentrotus purpuratus. PLoS ONE 12: e0187987. https://doi.org/10.1371/journal.pone.0187987
Dolmatova LS, Dolmatov IY (2020) Different macrophage type triggering as target of the action of biologically active substances from marine invertebrates. Mar. Drugs 18: 37. https://doi.org/10.3390/md18010037
Dolmatova LS., Ulanova OA, Timchenko NF (2019) Yersinia pseudotuberculosis thermostable toxin dysregulates the functional activity of two types of phagocytes in the holothurian Eupentacta fraudatrix. Biol Bull Russ Acad Sci 46: 117–127. https://doi.org/10.1134/S1062359019020043
Prompoon Y, Weerachatyanukul W, Withyachumnarnkul B, Vanichviriyakit R, Wongprasert K, Asuvapongpatana S (2015) Lectin-based profiling of coelomocytes in Holothuria scabra and expression of superoxide dismutase in purified coelomocytes. Zoolog Sci 32: 345–351. https://doi.org/10.2108/zs140285
Dolmatova LS, Ulanova OA, Timchenko NF (2021) Effect of a heat-stable toxin of Yersinia pseudotuberculosis on the functional and phenotypic traits of two types of phagocytes in the holothurian Eupentacta fraudatrix. Biol Bull Russ Acad Sci 48 (4): 395–406. https://doi.org/10.1134/S1062359021040051
Dolmatova LS, Zaika OA (2007) Apoptosis-modulating effect of prostaglandin E2 in coelomocytes of holothurian Eupentacta fraudatrix depends on the cell antioxidant enzyme status. Biol Bull Russ Acad Sci 34: 221–229. https://doi.org/10.1134/S1062359007030028
Одинцова НА (2001) Основы культивирования морских беспозвоночных. Владивосток. Дальнаука. [Odintsova NA (2001) Bases of cultivation of marine invertebrate cells. Vladivostok. Dalnauka. (In Russ)].
Dolmatova LS, Eliseykina MG, Timchenko NF, Kovaleva AL, Shitkova OA (2003) Generation of reactive oxygen species in the different fractions of the coelomocytes of holothurian Eupentacta fraudatrix in response to the thermostable toxin of Yersinia pseudotuberculosis in vitro. Chinese J Oceanol Limnol 21:293–304. https://doi.org/10.1007/BF02860423
Eruslanov E, Kusmartsev S (2010) Identification of ROS using oxidized DCFDA and flow-cytometry. Methods Mol Biol 594:57–72. https://doi.org/10.1007/978-1-60761-411-1_4
Fraternale A, Crinelli R, Casabianca A, Paoletti M, Orlandi Ch, Carloni E, Smietana M, Palamara A (2013) Molecules altering the intracellular thiol content modulate NF-kB and STAT-1/IRF-1 signalling pathways and IL-12 p40 and IL-27 p28 production in murine macrophages. PLoS ONE 8 (3): e57866. https://doi.org/10.1371/journal.pone.0057866
McKenzie ANJ, Preston TM (1992) Functional studies on Calliphora vomitoria haemocyte subpopulations defined by lectin staining and density centrifugation. Devel Compar Immunol 16:19–30. https://doi.org/10.1016/0145-305x(92)90048-h
Гнедкова ИА, Лисяный НИ, Станецкая ДН, Розуменко ВД, Главацкий АЯ, Шмелева АА, Малышева ТА, Черненко ОГ, Гнедкова МА (2015) Лектинсвязывающие и туморогенные свойства клеток глиомы С6. Онкология 17: 4–11. [Gnedkova IA, Lisyanyi NI, Stanetskaya DN, Rozumenko VD, Glavatskii AYa, Shmeleva AA, Malysheva TA, Chernenko OG, Gnedkova MA (2015) Lectinbinding and tumorigenic properties of C6 glioma cells. Onkologiya 17: 4–11. (In Russ)].
Andrade C, Oliveira B, Guatelli S, Martinez P, Simões B, Bispo C, Ferrario C, Bonasoro F, Rino J, Sugni M, Gardner R, Zilhão R, Coelho AV (2021) Characterization of coelomic fluid cell types in the star fish Marthasterias glacialis using a flow cytometry/imaging combined approach. Front Immunol 12: 641–664. https://doi.org/10.3389/fimmu
Xing K, Yang HS, Chen MY (2008) Morphological and ultrastructural characterization of the coelomocytes in Apostichopus japonicus. Aquat Biol 2: 85–92. https://doi.org/10.3354/ab00038
Endean R (1966) The coelomocytes and coelomic fluids. In: Physiology of Echinodermata. New York. Intersciences. 301–328.
Henson JH, Nesbitt D, Wright BD, Scholey JM (1992) Immunolocalization of kinesin in sea urchin coelomocytes. Association of kinesin with intracellular organelles. J Cell Sci 103: 309–320. https://doi.org/10.1242/jcs.103.2.309
Zavalnaya EG, Shamshurina EV, Eliseikina MG (2020) The immunocytochemical identification of PIWI-positive cells during the recovery of a coelomocyte population after evisceration in the holothurian Eupentacta fraudatrix (Djakonov et Baranova, 1958) (Holothuroidea: Dendrochirota). Russ J Mar Biol 46: 97–104. https://doi.org/10.31857/S0134347520020114
Canicattì C, D’Ancona G, Farina-Lipari E (1989) The coelomocytes of Holothuria polii (Echinodermata). I. Light and electron microscopy. Italian J Zool 56: 29–36. https://doi.org/10.1080/11250008909355618
DaMatta RA, Araujo-Jorge T, de Souza W (1995) Subpopulations of mouse resident peritoneal macrophages fractionated on percoll gradients show differences in cell size, lectin binding and antigen expression suggestive of different stages of maturation. Tissue and Cell 27: 505–513. https://doi.org/10.1016/S0040-8166(05)80059-X
Sediq AS, Klem R, Nejadnik MR, Meij P, Jiskoo W (2018) Label-free, flow-imaging methods for determination of cell concentration and viability. Pharm Res 35: 150. https://doi.org/10.1007/s11095-018-2422-5
Luu TU, Gott SC, Woo BWK, Rao MP, Liu WF (2015) Micro and nano-patterned topographical cues for regulating macrophage cell shape and phenotype. ACS Appl Mater Interfaces 7 (51): 28665–28672. https://doi.org/10.1021/acsami.5b10589
Oweson C, Li C, Söderhäll I, Hernroth B (2010) Effects of manganese and hypoxia on coelomocyte renewal in the echinoderm Asterias rubens (L.). Aquat Toxicol 100:84–90. https://doi.org/10.1016/j.aquatox.2010.07.012
Dolmatova LS, Dolmatov IYu (2018) Lead induces different responses of two subpopulations of phagocytes in the holothurian Eupentacta fraudatrix. J Ocean Univ China 17: 1391–1403. https://doi.org/10.1007/s11802-018-3795-0
Li C, Fang H, Xu D (2019) Effect of seasonal high temperature on the immune response in Apostichopus japonicus by transcriptome analysis. Fish Shellfish Immunol 92: 765–771. https://doi.org/10.1016/j.fsi.2019.07.012
Brockton V, Henson JH, Raftos DA, Majeske AJ, Kim Y-O, Smith LC (2008) Localization and diversity of 185/333 proteins from the purple sea urchin–unexpected protein-size range and protein expression in a new coelomocyte type. J Cell Sci 121: 339–348. https://doi.org/10.1242/jcs.012096
Долматова ЛС, Слинько ЕН, Колосова ЛФ (2018) Особенности накопления тяжелых металлов в тканях двух цветных форм голотурии Eupentacta frudatrix в летне-осенний период. Вестник ДВО РАН 1: 71–78. [Dolmatova LS, Slinko EN, Kolosova LF (2018) Accumulation of heavy metals in tissues of two color forms of the sea cucumber Eupentacta frudatrix in summer-autumn. Vestn. Dal’nevost. Otd. Ross. Akad. Nauk 1: 71–78. (In Russ)].
Marčeta T, Matozzo V, Alban S, Badocco D, Pastore P, Marin MG (2020) Do males and females respond differently to ocean acidification? An experimental study with the sea urchin Paracentrotus lividus. Environ Sci Pollut Res Int 27: 39516–39530. https://doi.org/10.1007/s11356-020-10040-7
Баранова ЗИ (1971) Иглокожие залива Посьета Японского моря. Исследования фауны морей 8 (16): 242–264. [Baranova ZI (1971) Echinoderms in Posyet Bay, Sea of Japan. Studies Marine Fauna 8 (16): 242–264. (In Russ)].
Zhang L, Pan Y, Song H (2015) Chapter 9. Environmental drivers of behavior. In: The sea cucumber Apostichopus japonicus. History, biology and aquaculture. Amsterdam: Academic Press 133–152. https://doi.org/10.1016/B978-0-12-799953-1.00009-X
Лазарюк АЮ, Кильматов ТР, Марьина ЕН, Кустова ЕВ. (2021) Особенности сезонной изменчивости гидрологического режима бухты Новик (остров Русский, залив Петра Великого, Японское море). Морской гидрофиз журн 37 (6): 680–695. [Lazaryuk AYu, Kilmatov TR, Marina EN, Kustova EV (2021) Seasonal features of the Novik Bay hydrological regime (Russky Island, Peter the Great Bay, Sea of Japan). Morsk Gidrofiz Zhurn 37: 680–695. (In Russ)]. https://doi.org/10.22449/0233-7584-2021-6-680-695
Левин ВС (1982) Дальневосточный трепанг. Владивосток. Дальневост кн изд [Levin VS (1982) Far-Eastern trepang. Vladivostok. Far-East Publishers. (In Russ)].
Menzel LP, Bigger CH (2015) Identification of unstimulated constitutive immunocytes, by enzyme histochemistry, in the coenenchyme of the octocoral Swiftia exserta. Biol Bull 229 (2): 199–208. https://doi.org/10.1086/BBLv229n2p199
Thiel M, Zourelidis C, Peter K (1996) Die Rolle der polymorphkernigen neutrophilen Leukozyten in der Pathogenese des akuten Lungenversagens (ARDS). Anaesthesist 45: 113–130.
Morris D, Guerra C, Khurasany M, Guilford F, Saviola B, Huang Y, Venketaraman V (2013) Glutathione supplementation improves macrophage functions in HIV. J Interfer Cytokine Res 33:270–279. https://doi.org/10.1089/jir.2012.0103
Peterson JD, Herzenberg LA, Vasquez K, Waltenbaugh C (1998) Glutathione levels in antigen-presenting cells modulate Th1 versus Th2 response patterns. Proc Natl Acad Sci USA 95: 3071–3076. https://doi.org/10.1073/pnas.95.6.3071
Koren-Gluzer M, Rosenblat M, Hayek T (2015) Paraoxonase 2 induces a phenotypic switch in macrophage polarization favoring an M2 anti-inflammatory state. Int J Endocrinol 2015: 915243. https://doi.org/10.1155/2015/915243
Mendoza-Coronel E, Ortega E (2017) Macrophage polarization modulates FcγR- and CD13-mediated phagocytosis and reactive oxygen species production, independently of receptor membrane. Front Immunol 8: 303. https://doi.org/10.3389/fimmu.2017.00303
Tan H-Y, Wang N, Li S, Hong M, Wang X, Feng Y (2016) The reactive oxygen species in macrophage polarization: reflecting its dual role in progression and treatment of human diseases. Oxid Med Cell Longev 2016: 2795090. https://doi.org/10.1155/2016/279509
Lewis CV, Vinh A, Diep H, Samuel CS, Drummond GR, Kemp-Harper BK (2019) Distinct redox signalling following macrophage activation influences profibrotic activity. J Immunol Res 2019: 1278301. https://doi.org/10.1155/2019/1278301
Новиков ВЕ, Левченкова ОС, Пожилова ЕВ (2014) Роль активных форм кислорода в физиологии и патологии клетки и их фармакологическая регуляция. Обзоры клин фармакол и лекарств терапии 4: 13–21. [Novikov VE, Levchenkova OS, Pozhilova EV (2014) Role of reactive oxygen species in cell pathology and physiology and their pharmacological regulation. Rev Clinic Pharmacol Drug Therapy 4: 13–21. (In Russ)]. https://doi.org/10.17816/RCF12413-21
Muri J, Kopf M (2021) Redox regulation of immunometabolism. Nat Rev Immunol 21: 363–381. https://doi.org/10.1038/s41577-020-00478-8
Fortuny L, Sebastián C (2021) Sirtuins as metabolic regulators of immune cells phenotype and function. Genes 12: 1698. https://doi.org/10.3390/genes12111698
Beri MM, Debray H, Dhainaut A, Porchet-Hennere E (1988) Distribution and nature of membrane receptors for different plant lectins in the coelomocyte subpopulations of the Annelida Nereis diversicolor. Dev Comp Immunol 12: 1–15. https://doi.org/10.1016/0145-305x(88)90020-1
Seco-Rovira V, Beltran-Frutos E, Ferrer C, Sanchez-Huertas MM, Madrid JF, Saez FJ, Pastor LM (2013) Lectin histochemistry as a tool to identify apoptotic cells in the seminiferous epithelium of Syrian hamster (Mesocricetus auratus) subjected to short photoperiod. Reprod Domest Anim 48:974–983. https://doi.org/10.1111/rda.12196
Krugluger W, Gessl A, Boltz-Nitulescu G, Förster O (1990) Lectin binding of rat bone marrow cells during colony-stimulating factor type 1-induced differentiation: soybean agglutinin as a marker of mature rat macrophages. J Leukoc Biol 48: 541–548. https://doi.org/10.1002/jlb.48.6.541
Gengozian N, Reyes L, Pu R, Homer BL, Bova FJ, Yamamoto JK (1997) Fractionation of feline bone marrow with the soybean agglutinin lectin yields populations enriched for erythroid and myeloid elements: transplantation of soybean agglutinin-negative cells into lethally irradiated recipients. Transplantation 64: 510–518. https://doi.org/10.1097/00007890-199708150-00022
Pilling D, Fan T, Huang D, Kaul B, Gomer RH (2009) Identification of markers that distinguish monocyte-derived fibrocytes from monocytes, macrophages, and fibroblasts. PLoS ONE 4 (10): e7475. https://doi.org/10.1371/journal.pone.0007475
Keppler OT, Peter ME, Hinderlich S, Moldenhauer G, Stehling P, Schmitz I, Schwartz-Albiez R, Reutter W, Pawlita M (1999) Differential sialylation of cell surface glycoconjugates in a human B lymphoma cell line regulates susceptibility for CD95 (APO-1/Fas)-mediated apoptosis and for infection by a lymphotropic virus. Glycobiology 9:557–569. https://doi.org/10.1093/glycob/9.6.557
Ehrchen JM, Roth J, Barczyk-Kahlert K (2019) More than suppression: glucocorticoid action on monocytes and macrophages. Front Immunol 10: 2028. https://doi.org/10.3389/fimmu.2019.02028
Dolmatov IYu, Dolmatova LS, Shitkova OA, Kovaleva AL (2004) Dexamethasone-induced apoptosis in phagocytes of holothurian Eupentacta fraudatrix. In: Echinoderms. Leiden. A.A. Balkema Publ 105–119.
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии


