Журнал эволюционной биохимии и физиологии, 2022, T. 58, № 4, стр. 333-346
ГЕНЫ γM-КРИСТАЛЛИНОВ В ХРУСТАЛИКЕ МОЛОДЫХ Сyprinus carpio: УРОВНИ ТРАНСКРИПЦИИ И ФИЛОГЕНЕТИЧЕСКИЙ АСПЕКТ
А. И. Капитунова 1, И. Н. Доминова 1, В. В. Жуков 1, *
1 Балтийский федеральный университет им. Иммануила Канта
Калининград, Россия
* E-mail: valerzhukov@mail.ru
Поступила в редакцию 24.02.2022
После доработки 30.05.2022
Принята к публикации 31.05.2022
- EDN: LHTXIF
- DOI: 10.31857/S0044452922040052
Аннотация
Основной целью работы была оценка уровня транскрипции генов γМ-кристаллинов в хрусталике глаза Сyprinus carpio. Для этого методом количественной ПЦР-РВ зафиксирована транскрипция и измерен ее относительный уровень у 5 генов γM-кристаллинов и кристаллин-подобных белков карпов в возрасте 4, 10 и 14 мес. Для всех возрастных групп установлена специфичность транскрипции в хрусталиках генов Gcm1, Gcm1l, Gcm2l, Crygm6. Транскрипция гена Gcm2l2 кроме хрусталика обнаружена также в мышцах, печени и мозге. Анализ значимости аминокислотной последовательности выявленных γМ‑кристаллинов для формирования преломляющих свойств хрусталика выполнен на основе рассчитанных для них величин инкремента показателя преломления. Предполагается, что высокие значения показателя преломления хрусталика определяются не столько относительным содержанием аминокислот в γМ-кристаллинах, сколько их последовательностями, обеспечивающими плотность укладки третичной пространственной структуры этих белков, а также концентрацией этих белков.
Для установления консервативных доменов и эволюционных отношений между γМ-кристаллинами рыб разных таксонов было выполнено множественное выравнивание аминокислотных последовательностей и построено филогенетическое дерево методом ближайших соседей. Высокий уровень гомологии, наличие 26 консервативных участков и филогенетическая близость сравниваемых белков у группы костистых рыб могут свидетельствовать об эволюционном закреплении их структуры и важной роли в определении специфических свойств хрусталиков у Teleostei.
Особенности зрения в водной среде находят свое отражение в строении и свойствах оптического аппарата глаза гидробионтов, которые наиболее изучены у рыб [1, 2]. Низкая преломляющая эффективность их роговицы в воде компенсируется большой преломляющей силой твердого сферического хрусталика. Коэффициент рефракции его центральной области превышает таковой у наземных позвоночных животных [3]. Высокое значение радиального градиента показателя преломления хрусталика рыб позволяет уменьшить влияние сферической аберрации на качество изображения, формируемого оптическим аппаратом глаза на сетчатке [4]. Очевидно, что указанные особенности хрусталика во многом связаны с химическим составом и способом упаковки его компонентов. Нахождение генов специфических белков хрусталика рыб и оценка уровня их транскрипционной активности должны повысить эффективность функциональных исследований этой структуры. В настоящее время считается, что количественно доминирующее положение среди белков хрусталика рыб занимают кристаллины семейства γ, среди которых преобладают γМ-кристаллины [5]. Так, в хрусталиках взрослых особей Danio rerio среди 52 идентифицированных кристаллинов доминирующее положение по своему числу (35) и количественному содержанию (47.2%) занимают именно γ-кристаллины [6]. Из этого семейства белков наиболее многочисленны γM-кристаллины, представленные 29 видами молекул. И, хотя из этого числа лишь 16 представляют точно установленные формы γM‑кристаллинов, общее содержание белков этого семейства в хрусталике D. rerio достаточно велико и составляет 30.2% от всего протеома [7]. У антарктического клыкача Dissostichus mawsoni из 22 кристаллинов хрусталика 14 относятся к семейству γ, из них 11 – γМ-кристаллины [8], которые, таким образом, составляют около 47.6% от общего числа видов кристаллинов этой структуры глаза. В хрусталике карпа Cyprinus carpio γ-кристаллины в целом составляют около 52% всех кристаллинов [9]. Однако сведения о составе этой группы белков и, в частности, о присутствии в ней γМ-кристаллинов пока отсутствуют. Это обстоятельство представляется существенным пробелом, особенно с учетом той важной роли в формировании оптических свойств хрусталиков гидробионтов, которая, как предполагается, принадлежит этим белкам [10].
Сопоставление известных последовательностей аминокислот кристаллинов указывает на то, что γM-кристаллины рыб образуют отдельную группу, которая отличается от γ-кристаллинов млекопитающих отсутствием консервативных пар триптофана в N-концевом домене и повышенным содержанием метионина [11, 12]. Последнее обстоятельство может способствовать стабильности структуры белка, а также опосредовать межмолекулярные взаимодействия, повышающие его растворимость и плотность упаковки в хрусталике [10]. Присутствие метионина также, вероятно, обеспечивает высокое значение показателя преломления γ-кристаллинов [13]. Все же остается неясным, насколько γM-кристаллины специфичны для хрусталиков рыб или же они подобно другим кристаллинам могут синтезироваться клетками разных тканей организма. Мы подошли к рассмотрению этого вопроса с позиции оценки транскрипции генов γM-кристаллинов у С. carpio. Основной целью работы стала идентификация генов γM-кристаллинов, специфически экспрессирующихся в хрусталике карпа, а также оценка относительного уровня их транскрипции с целью последующего использования в качестве маркеров структурного и функционального онтогенеза.
МЕТОДЫ ИССЛЕДОВАНИЯ
Животные
Объектом исследования являлись образцы тканей (хрусталики, мозг, печень и мышцы) самцов и самок Cyprinus carpio Парской породы в возрасте 4, 10 и 14 мес, выращенных в учебно-опытном рыболовном хозяйстве ФГБОУ ВО “КГТУ” (г. Калининград). Предоперационная анестезия рыб с последующим выделением хрусталиков, а также фрагментов мозга, мышц и печени производились на льду. Выделенные образцы хранили при –80°С. В каждой возрастной группе образцы тканей брали от 10 особей. Поскольку точное установление пола карпа возможно только после наступления половой зрелости, начиная с 2-х лет, этот фактор не учитывался.
Все процедуры, проводившиеся с участием животных, соответствовали этическим нормам, утвержденным правовыми актами Российской Федерации, принципам Базельской декларации и рекомендациям биоэтической комиссии БФУ им. И. Канта.
Дизайн праймеров
Дизайн специфических праймеров осуществлялся с помощью программного обеспечения (ПО) NCBI Primer-BLAST на основании данных о геноме Cyprinus carpio в базе NCBI. Полученные праймеры анализировались и оценивались с помощью программного обеспечения (ПО) IDT OligoAnalyzer Tool и ПО Nucleotide BLAST, с учетом следующих показателей:
1) температура отжига forward и reverse праймеров: 53–63°C;
2) содержание GC в последовательности праймеров – 50%;
3) длина праймера: 17–25 нуклеотидов;
4) размер ампликона: 100–300 пар оснований;
5) комплементарность исследуемой последовательности – только одной последовательности из кДНК исследуемого вида;
6) способность формировать шпильки (hairpins) – ΔG (энергия Гиббса) 3'-конца больше –2 ккал/моль, ΔG внутреннего участка больше –3 ккал/моль;
7) способность формировать димеры с таким же праймером (self-dimer) – ΔG 3'-конца больше –5 ккал/моль, ΔG внутреннего участка больше –6 ккал/моль;
8) способность формировать димеры с другим праймером (hetero-dimer) – ΔG 3'-конца больше –5 ккал/моль, ΔG внутреннего участка больше –6 ккал/моль.
Все пары праймеров были подобраны таким образом, чтобы области отжига на кДНК находились на стыках соседних экзонов [14].
Последовательности подобранных праймеров представлены в табл. 1.
Таблица 1.
Последовательности праймеров, использованных для анализа уровней транскрипции генов γМ-кристаллина Cyprinus carpio
| Ген | Номер NCBI | Primer sequences (5'-3') | Длина ампли- кона (п.о.) | Температура отжига, °C | Эффектив- ность (%) |
|---|---|---|---|---|---|
| 18S ribosomal RNA gene | JQ619778.1 | F – GGCGGCGTTATTCCCATGAC R - GTGGTGCCCTTCCGTCAAT |
116 | 61.0 | 74.4 |
| gamma-crystallin M1 (LOC109097131) | XM_019110801.2 | F – ACAGCTGGTACAGTGAGCTG R - TCTGTAGGAACCCCTGTATGGA |
329 | 59.7 | 79.0 |
| gamma-crystallin M1-like (LOC109087991) | XM_019102168.2 | F – ATACCTGAGCCGCGTTGGTT R - TGTAGGACCCCCTGTATGGAG |
194 | 61.0 | 84.2 |
| gamma-crystallin M2-like (LOC109112458) | XM_019125381.1 | F – CGACTGTGCCGATTTCTCCT R - GTCACAGTCATCGGTCATTTCG |
271 | 60.0 | 79.8 |
| gamma-crystallin M2-like (LOC109049519) | XM_019067197.1 | F – GTCAGCCAACAAGCAGAATCA R - TGTCCTCATAAAAGGTGACCCTC |
94 | 59.5 | 88.6 |
| gamma M6 (Crygm6) | XM_019110804.1 | F – GCCGGATGATCCCTATGTATACTG R - GAGGGATCCGATTCTTGGGG |
269 | 60.0 | 73.0 |
Оптимизация ПЦР
Для установления параметров проведения ПЦР-РВ была проведена оптимизация, которая включала в себя подбор температур отжига праймеров, а также подбор концентраций кДНК. Данная процедура необходима для увеличения эффективности и специфичности ПЦР. Выбор необходимых параметров осуществлялся посредством проведения ПЦР-РВ с градиентами температур и концентраций до получения одного единственного пика.
Оптимизацию производили посредством постановки ПЦР-РВ на градиент температур отжига с постепенным снижением температуры в пределах от 63 до 58°С. Выбор температурного диапазона определяется предсказанной температурой плавления (Tm) праймеров: температура отжига (Ta) праймера должна быть на 2–4°C ниже, чем Tm. При этом необходимо иметь в виду, что отжиг праймеров при наименьших температурах градиента может обусловливать их неспецифичное связывание с матрицей.
Среднюю эффективность амплификации генов оценивали по относительным количественным ПЦР со стандартной кривой пяти последовательных 10-кратных разведений кДНК (в диапазоне от 1 нг до 1 пг) для измерения значения Cq. Эффективность амплификации рассчитывалась по формуле: E = 10ˆ(1/наклон). Для всех генов значения эффективности амплификации варьировали от 73.0 до 89.0%.
После проведения ПЦР со всеми праймерами продукты амплификации анализировали с помощью гель-электрофореза в агарозном геле. Для чего использовали 1.5%-ный агарозный гель с добавлением бромистого этидия в качестве интеркалирующего красителя для визуализации двухцепочечных молекул ДНК и маркера длин ДНК “100+ DNA Ladder” (Евроген), а также 1х Трис-ацетатного-ЭДТА буфера (TAE; pH = 7.6) – в качестве буфера для проведения электрофореза. Напряжение источника питания PowerPac Basic (Bio-Rad) было установлено 140 В, сила тока – 400 мА, продолжительность – 30 мин. Визуализация полученных данных проводилась с помощью системы гель-документирования Gel Doc EZ (Bio-Rad). На основании полученных электрофореграмм были выбраны оптимальные значения температуры для работы каждого праймера (рис. 1).
Анализ уровней транскрипций генов
Выделение РНК исследуемых образцов проводили с помощью реагента ExtractRNA (Evrogen), следуя инструкции производителя с дополнительной обработкой ДНКазой. Для проведения обработки использовали 10х DNAse buffer и DNAse I (Thermo Fisher) с последующей инкубацией при 30оС в течение 10 мин. После этого проводили нейтрализацию реакции с помощью 0.5 М ЭДТА и инкубацию при 75оС, полученную очищенную РНК использовали для обратной транскрипции. Концентрацию выделенной тотальной РНК измеряли с помощью флуориметра Qubit 2.0 (Invitrogen) и набора реагентов Qubit RNA BR Assay Kit (Invitrogen). Полученная РНК была использована для постановки реакции обратной транскрипции с целью получения кДНК. Обратную транскрипцию проводили c помощью набора реагентов MMLV RT (Evrogen) в соответствии с протоколом, рекомендованным производителем, и использованием термоциклера для амплификации нуклеиновых кислот C1000 (Bio-Rad). Реакция проводилась с использованием 50 мM Oligo(dT)15 праймера (Евроген) и 50 мM Random(dN)10 праймера (Евроген). Концентрация РНК для каждой реакции обратной транскрипции составляла 20 нг/мкл. Дополнительно проводились 3 отрицательных контроля с заменой РНК, праймеров и MMLV RT на деионизированную воду. Полученные образцы кДНК были использованы для постановки количественной ПЦР в реальном времени, с целью определения уровней транскрипции генов кристаллинов. Также были выполнены отрицательные контроли, в которых ДНК заменялась деионизированной водой, для проверки компонентов реакции.
Для проведения сравнительного анализа уровней транскрипции из генома C. carpio [15] были выбраны 5 генов γM-кристаллинов и кристаллин-подобных белков, а также в качестве референсного – ген 18S рРНК, как один из наиболее стабильно экспрессирующихся в организме рыб [16, 17]. Последовательности использованных праймеров приведены в табл. 1. Для проведения полимеразной цепной реакции использовали ДНК-полимеразу Taq и 10x буфер Taq, 50x SYBR Green I, смесь dNTP (все Evrogen).
Амплификацию проводили на термоциклере CFX96 Thermal cycler (“Bio-Rad”, США) в 20 мкл реакционной смеси, содержащей: 1x буфера Taq, 1х SYBR Green I, 0.25 мкМ смеси dNTP, 0.3 нМ смеси праймеров, 1 ед. Taq ДНК-полимеразы. Процедуру количественной ПЦР проводили по следующему протоколу: 1) денатурация кДНК при 95°С в течение 3 мин; 2) 40 циклов денатурации при 95°С в течение 10 с с последующим отжигом праймеров при 59–61°С (в зависимости от используемых праймеров) в течение 40 с и элонгацией цепи при 72°С в течение 30 с. Исследуемые образцы амплифицировали в пятикратной повторности, принимали в расчет значения со стандартным отклонением не больше 0.2. Относительные уровни транскрипции выбранных генов определяли с помощью скорректированного метода 2–ΔΔСt [18].
Статистическая обработка данных
Статистическую обработку данных проводили с помощью программного обеспечения GraphPad Prism 8. Оценку достоверности различий между нормализованными уровнями транскрипции генов кристаллинов проводили с использованием однофакторного дисперсионного анализа ANOVA с последующим post hoc анализом с помощью критерия Тьюки, различия между сравниваемыми выборками считали статистически значимыми при p < 0.05.
Множественное выравнивание и филогенетический анализ
Для проведения филогенетического анализа и выполнения множественного выравнивания наряду с анализируемыми последовательностями C. carpio были выбраны последовательности кристаллинов (табл. 2), подтвержденные для хрусталиков взрослых особей Danio rerio (Hamilton, 1822) [7] и Dissostichus mawsoni (Norman, 1937) [8], а также кристаллины Chiloscyllium indicum (J.F. Gmelin, 1789) и Latimeria chalumnae (Smith, 1939). Выбор объектов для филогенетического анализа был обусловлен наличием сведений о белковом составе хрусталиков D. rerio и D. mawsoni. Акула C. indicum и латимерия L. chalumnae были выбраны для определения степени филогенетической близости/удаленности представителей этих наиболее древних таксономических единиц от современных костистых рыб. Поиск гомологов белков γM-кристаллинов был выполнен с использованием базы данных NCBI Protein Blast [19]. Отобранные таким образом последовательности использовались для проведения множественного выравнивания с применением алгоритма Clustal Omega в программном обеспечении UGENE [20], после чего выровненные последовательности визуализировали с помощью программного обеспечения Jalview [21]. По результатам множественного выравнивания строили филогенетическое дерево методом присоединения ближайших соседей с применением параметров по умолчанию с помощью программного обеспечения UGENE.
Таблица 2.
Перечень γМ-кристаллинов, использованных для множественного выравнивания
| Вид | NCBI номер белка | Название белка |
|---|---|---|
| Danio rerio | AAU85786 | Crystallin gamma M5 |
| Danio rerio | AAU85783 | Crystallin gamma M6 |
| Danio rerio | AAU85782 | Crystallin gamma M4 |
| Danio rerio | AAU85781 | Crystallin gamma M1 |
| Danio rerio | AAU85774 | Crystallin gamma M2b |
| Danio rerio | AAU85784 | Crystallin gamma M7 |
| Danio rerio | AAY25399 | Crystallin gamma M2a |
| Danio rerio | AAU85788 | Crystallin gamma M3 |
| Danio rerio | AAH95103.1 | Crystallin gamma Mx |
| Danio rerio | AAU85775.1 | Crystallin gamma M2c |
| Cyprinus carpio | XP_018980926.1 | Crystallin gamma M2 like |
| Cyprinus carpio | XP_018966346 | Crystallin gamma M1 |
| Cyprinus carpio | XP_018957713 | Crystallin gamma M1 like |
| Cyprinus carpio | XP_018922742.1 | M2-like isoform X2 |
| Cyprinus carpio | XP_018966349.1 | Crystallin gamma M6 |
| Chiloscyllium indicum | CAA55809 | Crystallin gamma |
| Latimeria chalumnae | XP_006013557 | Crystallin gamma M2 like |
| Latimeria chalumnae | XP_006013359.1 | Crystallin gamma M2 like isoform 2 |
| Latimeria chalumnae | XP_006013358.1 | Crystallin gamma M2 like isoform 1 |
| Dissostichus mawsoni | ABA61356 | Crystallin gamma M7 |
| Dissostichus mawsoni | ABA61355 | Crystallin gamma M5 |
| Dissostichus mawsoni | ABA61350 | Crystallin gamma M1 |
| Dissostichus mawsoni | ABA61352 | Crystallin gamma M3 |
| Dissostichus mawsoni | ABA61353 | Crystallin gamma M4 |
| Dissostichus mawsoni | ABB59450.1 | Crystallin gamma M8a |
| Dissostichus mawsoni | ABA61357.1 | Crystallin gamma M8b |
| Dissostichus mawsoni | ABA61358.1 | Crystallin gamma M8c |
| Dissostichus mawsoni | ABA61359.1 | Crystallin gamma M8d |
| Dissostichus mawsoni | ABA61351.1 | Crystallin gamma M8e |
| Dissostichus mawsoni | ABA61354.1 | Crystallin gamma M9 |
Расчет инкремента показателя преломления
Величину инкремента показателя преломления (dn/dc) кристаллинов рассчитывали как средневзвешенное значение dn/dc, определенное на основе аминокислотного состава белка. Для этого была использована модель, согласно которой показатель преломления раствора белка полностью объясняется аминокислотным составом последнего [22]. Процентное содержание каждой аминокислоты рассчитывали с помощью программного обеспечения ProtParam на сервере ExPASy [23], а затем умножали на индивидуальный показатель dn/dc для каждой аминокислоты [22] и полученные значения суммировали.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Оценка уровня транскрипции генов γ-кристаллинов
Для анализа уровней транскрипции генов γ‑кристаллинов у C. carpio в хрусталике, мозге, печени и мышцах были отобраны 5 генов: γ-кристаллин M1 (LOC109097131, Gcm1), γ-кристаллин подобный M1 (LOC109087991, Gcm1l), 2 изоформы γ-кристаллина подобного M2: LOC109112458 (Gcm2l), LOC109049519 (Gcm2l2) и γ-кристаллин M6 (Crygm6). В результате проведенного анализа было установлено, что во всех четырех типах образцов тканей транскрибируется только 2-я изоформа гена γ-кристаллина подобного M2 (Gcm2l2) (рис. 2), тогда как остальные гены являются хрусталик-специфичными.
Рис. 2.
Уровни транскрипции гена γ-кристаллина подобного M2 (Gcm2l2) в хрусталике (Lens), мозге (Brain), мышцах (Muscle) и печени (Liver) 4- (а), 10- (b) и 14- (c) месячных Cyprinas carpio, нормализованные на референсный ген и представленные в логарифмической шкале. Все результаты представлены как среднее ± стандартное отклонение. ** – p < 0.01; **** – p < 0.0001.

При этом у 4-месячных C. carpio (рис. 2a) уровни транскрипции гена Gcm2l2 в мышцах и печени более высокие, чем в мозге и хрусталике. У 10-месячных карпов (рис. 2b) транскрипция гена Gcm2l2 в мозге повышается, а в мышцах понижается. У 14‑месячных карпов (рис. 2c) наблюдается значимое повышение уровней транскрипции во всех тканях, а самый высокий рост происходит в мышцах (p < 0.01). Во всех возрастных категориях наименьший уровень транскрипции был установлен в образцах хрусталика.
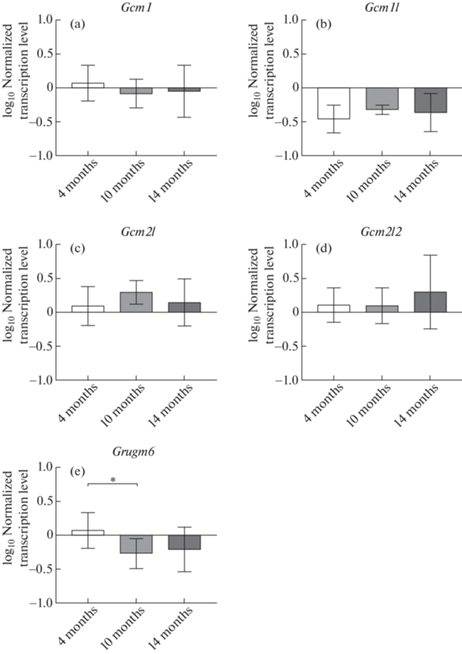
Возрастные изменения уровней транскрипции всех анализируемых генов γ-кристаллинов в хрусталиках представлены на рис. 3. Статистически значимым оказалось снижение транскрипции гена Grygm6 (p < 0.05) у 10-месячных карпов по сравнению с 4-месячными особями в процессе онтогенеза. Уровни транскрипции всех остальных генов не имеют между собой статистически значимых возрастных различий (рис. 3).
Филогенетический анализ генов кристаллинов Cyprinus carpio
Анализ аминокислотных последовательностей выбранных кристаллинов (табл. 2) показал высокий уровень сходства между ними (рис. 4).
Рис. 4.
Множественное выравнивание аминокислотных последовательностей белков γМ-кристаллинов Cyprinus carpio, Danio rerio, Dissistichus mawsoni, Chiloscyllium indicum и Latimeria chalumnae. ▼ – скрытые неконсервативные и пустые участки.

Анализ сходства между аминокислотными последовательностями γМ-кристаллинов нескольких таксономических групп показал наличие консервативных участков в структуре этих белков. Данные участки представлены:
1) 24 абсолютно консервативными позициями: 13Phe, 15Glu, 18Asn, 19Phe, 21Gly, 29Asp, 60Gly, 62Gln, 68Gly, 70Tyr, 88Ser, 111Gly, 115Glu, 120Cys, 134Ser, 137Val, 142Trp, 148Pro, 159Pro, 150Gly, 161Tyr, 178Ser, 180Arg, 181Arg, 182Ile;
2) 2 абсолютно функционально консервативными позициями: 103Ile, 140Gly;
3) 34 консервативными на более чем 70% позициями: 10Lys, 11Ile, 14Tyr, 17Arg, 25Glu, 32Asp, 33Leu, 40Cys, 44Arg, 45Val, 46Glu, 47Ser, 50Phe, 54Glu, 58Tyr, 67Arg, 69Glu, 90Arg, 99Tyr, 100Arg, 101Met, 102Arg, 105Glu, 109Phe, 118Glu, 122Asn, 125Asp, 143Leu, 145Tyr, 146Glu, 150Tyr, 156Tyr, 167Asp.
Большая часть консервативных участков представлена четырьмя аминокислотами: аргинином, тирозином, глицином и глутаминовой кислотой.
Рассчитанные показатели сходства между γМ1‑кристаллином Cyprinus carpio и всеми остальными анализируемыми белками были определены с помощью ПО Protein BLAST и представлены в табл. 3.
Таблица 3.
Степень сходства белков γМ-кристаллинов Cyprinus carpio, Danio rerio, Dissistichus mawsoni, Chiloscyllium indicum и Latimeria chalumnae относительно γМ1-кристаллина Cyprinus carpio
| γM-кристаллины | γМ1-кристаллин Cyprinus carpio |
|---|---|
| γМ1-кристаллин Cyprinus carpio | 100% |
| GCM6 Cyprinus carpio | 60.00% |
| GCM1L Cyprinus carpio | 92.70% |
| GCM5 Danio rerio | 56.18% |
| GCM6 Danio rerio | 59.43% |
| GCM1 Danio rerio | 87.08% |
| GCM2b Danio rerio | 72.00% |
| GCM7 Danio rerio | 62.71% |
| GCM3 Danio rerio | 75.28% |
| GCM5 Danio rerio | 56.18% |
| GCM2a Danio rerio | 69.54% |
| GCM4 Danio rerio | 62.92% |
| GCM1 Dissostichus mawsoni | 75.84% |
| GCM3 Dissostichus mawsoni | 69.49% |
| GCM9 Dissostichus mawsoni | 66.29% |
| GCM4 Dissostichus mawsoni | 62.01% |
| GCM7 Dissostichus mawsoni | 61.58% |
| GCM2L Latimeria chalumnae | 61.80% |
| GCM5 Dissostichus mawsoni | 55.43% |
| GC Chiloscyllium indicum | 54.55% |
| GCM6 Danio rerio | 46.02% |
| GCM2c Danio rerio | 72.00% |
| GCM2L2 Latimeria chalumnae | 59.89% |
| GCM2L1 Latimeria chalumnae | 61.02% |
| GCM8a Dissostichus mawsoni | 71.35% |
| GCM8b Dissostichus mawsoni | 72.32% |
| GCM8c Dissostichus mawsoni | 68.36% |
| GCM8d Dissostichus mawsoni | 67.80% |
| GCM8e Dissostichus mawsoni | 70.79% |
| GCM9 Dissostichus mawsoni | 66.29% |
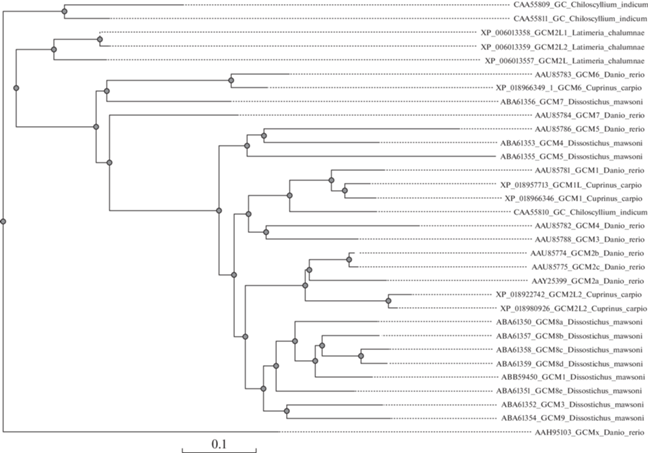
С целью демонстрации филогенетических отношений между отобранными нами кристаллинами было построено филогенетическое дерево с использованием метода ближайших соседей (рис. 5).
Инкремент показателя преломления
Анализ рассчитанных значений инкремента показателя преломления (табл. 4) показал, что среди γ-кристаллинов C. carpio наибольшим значением dn/dc обладают белки группы M. В то же время значения dn/dc γM-кристаллинов хрусталиков D. rerio превышают значение такового у α и β-кристаллинов лишь в тысячных долях.
Таблица 4.
Рассчитанные значения инкремента показателя преломления (dn/dc, мл/г) для групп кристаллинов хрусталика глаз рыб
| Кристаллины | Danio rerio | Cyprinus carpio | Dissostichus mawsoni | |
|---|---|---|---|---|
| ɑ | 0.190 ± 0.002 | – | 0.189 ± 0.001 | |
| β | 0.192 ± 0.001 | – | 0.190 ± 0.002 | |
| βγX | – | – | – | |
| γ | γM | 0.197 ± 0.003 | 0.194 ± 0.001 | 0.194 ± 0.002 |
| γN | 0.195 ± 0.001 | 0.192 ± 0.001 | – | |
| γS | 0.194 ± 0.001 | 0.193 ± 0.001 | 0.194 ± 0.001 | |
Значение инкремента показателя преломления dn/dc (мл/г) представлено как среднее ± стандартное отклонение. Для получения каждого значения использовались аминокислотные последовательности 7 белков.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Основной результат данной работы заключается в установлении генов γМ-кристаллинов, транскрипция которых характерна для хрусталика карпа, по крайней мере, на возрастном периоде от 4 до 14 мес. Из выбранных для анализа генов четыре являются специфическими для хрусталика на данном этапе онтогенеза. Это заметно меньше, чем у D. rerio, у которой в сопоставимом возрасте (около 6 мес) в хрусталике синтезируются 12 точно установленных и 6 предполагаемых форм γМ-кристаллинов [7], а также, по-видимому, чем у взрослых D. mawsoni – 11 [8].
D. rerio пока является единственным видом рыб, у которых прослежена онтогенетическая динамика синтеза кристаллинов в хрусталиках. Так, по результатам анализа методом гель-проникающей хроматографии в сочетании с ультра масс-спектрометрией обнаружено возрастание в хрусталике числа разновидностей γМ-кристаллинов на возрастном этапе от 4.5 дней до 6 мес [7]. Однако у взрослых особей дикого типа количественно определяемыми γ-кристаллинами остаются только γМ7, Мх, а также γS 2-4 и γN1-2, при том, что общее их количество составляет 32% от общей массы белков хрусталика [6].
Сопоставляя состав и относительную численность обнаруженных нами транскриптов генов γ-кристаллинов в хрусталике C. carpio с идентифицированными белками этого семейства у D. rerio, следует учитывать различную продолжительность жизни рыб. У D. rerio она составляет от 36 до 66 мес [24], в то время как отдельные особи карпа могут доживать до 47 лет [25], что сопоставимо с продолжительностью жизни D. mawsoni [26]. Не исключено, что сильное различие в продолжительности онтогенеза может находить свое отражение в динамике транскрипции генов кристаллинов хрусталика. Если учитывать только уверенно определенные группы γМ-кристаллинов, то у D. rerio в возрасте 4.5 дней экспрессируется 4 гена γM-кристаллинов, а в 3-недельном – 12. Полученные же нами результаты показывают, что на возрастном этапе развития карпа от 4 до 14 мес набор генов кристаллинов, экспрессирующихся в хрусталике карпа, остался тем же, но изменился относительный уровень их транскрипции. Однако очевидно, что для создания полной картины онтогенетических изменений транскрипции генов кристаллинов хрусталика карпа необходимо не только увеличить временной диапазон наблюдений, но и исследовать полный список генов, которые могут включаться и выключаться на различных стадиях онтогенеза. Не исключено, что при большой продолжительности жизни карпов с возрастом у них будет меняться состав ансамбля генов из числа γM-кристаллинов. Поэтому выявленное нами различие уровней транскрипции генов γ-кристаллинов карпов возрастом до 14 мес вряд ли корректно сопоставлять с динамикой синтеза соответствующих белков в хрусталике D. rerio. Главное сходство заключается лишь в отсутствие однозначной направленности изменений транскрипции генов различных γM-кристаллинов у этих рыб [7, 27].
Изменение набора транскрибируемых генов γ‑кристаллинов и уровня их транскрипции в онтогенезе могут обеспечивать формирование радиального градиента показателя преломления хрусталика рыб [28]. По-видимому, так происходит у амфибий, у которых в радиальном направлении к центру хрусталика относительная доля γ-кристаллинов возрастает, обеспечивая увеличение коэффициента рефракции [29].
Предполагается, что обилие в хрусталике рыб небольших молекул γ-кристаллинов способствует более плотной упаковке белковых молекул и формированию материала с высокими значениями коэффициента преломления, что необходимо для обеспечения зрения в водной среде. При этом формированию на сетчатке глаза рыб качественного изображения, не искаженного сферической аберрацией, способствует высокое значение радиального градиента коэффициента рефракции хрусталика. Например, у золотой рыбки Carassius auratus auratus индекс преломления вещества хрусталика имеет значения 1.55–1.57 в центральной и 1.35–1.38 в краевой части для λ = 633 нм при среднем диаметре 2.2 мм [4]. Близкие значения получены для хрусталиков и других исследованных рыб [30]. Возможно, что такие значения радиального градиента коэффициента рефракции достигаются изменением плотности упаковки белков, что обусловлено изменением набора и уровня транскрипции достаточно многочисленных генов γ-кристаллинов в морфогенезе хрусталика. Для сравнения хрусталик крыс имеет перепад градиента преломления от 1.38 до 1.5 на расстоянии 2 мм [31] , и в нем на разных стадиях онтогенеза экспрессируются все 6 генов γ‑кристаллинов млекопитающих γA-F [32]. Схожая картина наблюдается и в отношении хрусталика мышей [33]. При этом в хрусталике человека с меньшим значением градиента показателя преломления: от 1.36 до 1.41 на расстоянии 1.8 мм [34] экспрессируется только три γ-кристаллина, из которых два в эмбриогенезе [35].
Предполагалось, что высокое значение показателя преломления вещества хрусталика обусловлено свойствами γ-кристаллинов, в составе которых относительно велика доля метионина [3]. Исходя из того факта, что γМ-кристаллины являются характерной чертой рыб, можно было бы предполагать, что именно они ответственны за высокое значение показателя преломления вещества их хрусталиков. При этом сам метионин имеет не самое большое значение ни величины мольной рефракции, ни значения концентрационного инкремента показателя преломления, dn/dc [10, 13]. Более того, рассчитанные нами значения dn/dc γM-кристаллинов хрусталиков D. rerio превышают значение такого у α и β-кристаллинов лишь в тысячных долях. Вероятно, для получения высоких значений показателя преломления более значимую роль играет упаковка белков по сравнению с их аминокислотным составом. По-видимому, эволюционное закрепление γM-кристаллинов в качестве доминирующих белков хрусталиков рыб является наиболее оптимальным сочетанием последовательности аминокислот, определяющих специфику их вторичной и третичной структуры. Последнее обеспечивает плотную упаковку белков в центральной зоне хрусталика, что в конечном итоге приводит к большому значению радиального градиента. Возможно, что особые оптические свойства хрусталиков рыб объясняются не столько рефрактивными свойствами γМ-кристаллинов, но скорее количеством этих белков и плотностью упаковки их молекул, что, возможно, объясняется особенностями их третичной структуры [4, 36].
К настоящему времени уже сложилось мнение о том, что оценка показателя преломления водного раствора белка по его первичной структуре является не совсем адекватным и требует расчетов на основе вторичной и третичной структуры молекул [37]. В представляемой работе расчет носит лишь характер предварительной оценки и его результаты не являются основанием для окончательных выводов. Однако на текущий момент в литературе пока отсутствуют результаты анализа связи фолдинга кристаллинов с оптическими свойствами их растворов.
Не исключено также, что γ-кристаллины могут выполнять и другие функции, такие, как, например, устойчивость вещества хрусталика рыб к низким температурам [38]. В целом пока вопрос о вкладе свойств γМ-кристаллинов в формирование градиента показателя преломления хрусталика остается открытым. Несомненно, что его решение требует комплексного анализа¸ включающего онтогенетический мониторинг преломляющих свойств хрусталика, а также динамики синтеза его специфических белков.
Множественное выравнивание отобранных кристаллинов нескольких видов рыб показало, что среди консервативных аминокислот наибольшую долю занимают аргинин, тирозин, глицин и глутаминовая кислота. Две из них, а именно аргинин и тирозин, входят в группу семи аминокислот с наибольшим значением инкремента коэффициента преломления. Этим можно было бы объяснить эволюционное закрепление этих аминокислот в филогенезе, однако этому препятствуют низкие значения соответствующего показателя глицина и глутаминовой кислоты. Поэтому, вероятно, ответ на вопрос о причинах консервативности именно этих аминокислот лежит в другой плоскости и, вероятно, может быть прояснен после анализа фолдинга белков.
Анализ полученного филогенетического дерева показывает, что некоторые белки семейства γМ-кристаллинов (например, γМ1, γМ2, γМ8) укладываются в общие близкородственные клады у лучеперых рыб (Cyprinus carpio, Danio rerio, Dissistichus mawsoni), в отличие от древних представителей лопастеперых рыб, например, Latimeria chalumnae, γМ2-кристаллины которой располагаются на значительном удалении не только от остальных γМ2-кристаллинов, но всех других кристаллинов. Также на значительном удалении располагаются кристаллины костистых и хрящевых (Chiloscyllium indicum) рыб, что свидетельствует об эволюционном изменении молекулярной структуры этих белков.
Проведенное исследование показало наличие специфической транскрипции отдельных γМ-кристаллинов в хрусталике C. сarpio, что в общем соответствует картине, сложившейся по результатам изучения белков этой группы у D. rerio и D. mawsoni. Высокая степень сходства аминокислотной последовательности и филогенетическая близость этих белков у Teleostei, вероятно, указывают на их важность в определении специфических оптических свойств, присущих хрусталикам этой группы рыб. Однако точный механизм роли транскрипции γМ-кристаллинов и ее динамики в формировании преломляющих свойств хрусталиков рыб пока остается неясным и нуждается в дальнейших более комплексных исследованиях.
Список литературы
Land MF, Nilsson D-E (2012) Animal Eyes. Oxford. Oxford University Press.
Kröger RHH (2013) Optical plasticity in fish lenses. Prog Retin Eye Res 34: 78–88. https://doi.org/10.1016/j.preteyeres.2012.12.001
Pierscionek BK (2009) Gradient index of refraction (GRIN) profiling of the eye lens. In Ed.Michael Bass. The Optical Society of America Handbook of Optics. Volume III: Vision and Vision Optics. New York. McGraw-Hill. 19.1–19.18.
Pierscionek BK, Regini JW (2012) The gradient index lens of the eye: an opto-biological synchrony. Prog Retin Eye Res 31 (4): 332–349. https://doi.org/10.1016/j.preteyeres.2012.03.001
Lin Y-R, Mok H-K, Wu Y-H, Liang S-S, Hsiao C-C, Huang C-H, Chiou S-H (2013) Comparative proteomics analysis of degenerative eye lenses of nocturnal rice eel and catfish as compared to diurnal zebrafish. Mol Vis 19: 623–637.
Posner M, Hawke M, LaCava C, Prince CJ, Bellanco NR, Corbin RW (2008) A proteome map of the zebrafish (Danio rerio) lens reveals similarities between zebrafish and mammalian crystallin expression. Mol Vis 14: 806–814.
Greiling TM, Houck SA, Clark JI (2009) The zebrafish lens proteome during development and aging. Mol Vis 15: 2313–2325.
Kiss AJ, Cheng CH (2008) Molecular diversity and genomic organisation of the alpha, beta and gamma eye lens crystallins from the Antarctic toothfish Dissostichus mawsoni. Comp Biochem Physiol Part D Genomics and Proteomics 3 (2): 155–171. https://doi.org/10.1016/j.cbd.2008.02.002
Chiou SH, Chang WC, Pan FM, Chang T, Lo TB (1987) Physicochemical characterization of lens crystallins from the carp and biochemical comparison with other vertebrate and invertebrate crystallins. J Biochem 101 (3): 751–759. https://doi.org/10.1093/jb/101.3.751
Zhao H, Chen Y, Rezabkova L, Wu Z, Wistow G, Schuck P (2014) Solution properties of γ-crystallins: hydration of fish and mammal γ-crystallins. Protein Sci 23 (1): 88–99. https://doi.org/10.1002/pro.2394
Pan FM, Chang WC, Lin CH, Hsu AL, Chiou SH (1995) Characterization of gamma-crystallin from a catfish: structural characterization of one major isoform with high methionine by cDNA sequencing. Biochem Mol Biol Int 35 (4): 725–732. https://pubmed.ncbi.nlm.nih.gov/7627123/
Mahler B, Chen Y, Ford J, Thiel C, Wistow G, Wu Z (2013) Structure and dynamics of the fish eye lens protein, γM7-crystallin. Biochemistry 52 (20): 3579–3587. https://pubs.acs.org/doi/abs/10.1021/bi400151c
Zhao H, Brown PH, Magone MT, Schuck P (2011) The molecular refractive function of lens γ-crystallins. J Mol Biol 411 (3): 680–699. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3146585/
Глоссарий параметров ПЦР [Электронный ресурс]. Режим доступа - https://www.sigmaaldrich.com/deepweb/assets/sigmaaldrich/marketing/global/documents/200/845/oligo-architect-glossary-br3011en-mk.pdf (Дата обращения 05.05.2022) [Glossarij parametrov PCR [Jelektronnyj resurs]. Rezhim dostupa - https://www.sigmaaldrich.com/deepweb/assets/sigmaaldrich/marketing/global/documents/200/845/oligo-architect-glossary-br3011en-mk.pdf (Data obrashhenija 05.05.2022)]
Kolder ICRM, van der Plas-Duivesteijn J, Tan G, Wiegertjes GF, Forlenza M, Guler AT, Travin DY, Nakao M, Moritomo T, Irnazarow I, den Dunnen JT, Anvar SY, Jansen H., Dirks RP, Palmblad M, Lenhard, Henkel CV, Spaink HP (2016) A full-body transcriptome and proteome resource for the European common carp. BMC Genomics 17: 701. https://doi.org/10.1186/s12864-016-3038-y
Filby AL, Tyler CR (2007) Appropriate “housekeeping”genes for use in expression profiling the effects of environmental estrogens in fish. BMC Mol Biol 8: 10. https://doi.org/10.1186/1471-2199-8-10
Liu W, Yuan X, Yuan S, Dai L, Dong S, Liu J, Peng L, Wang M, Tang Y, Xiao Y (2020) Optimal reference genes for gene expression analysis in polyploid of Cyprinus carpio and Carassius auratus. BMC Genet 21: 107. https://doi.org/10.1186/s12863-020-00915-6
Yuan JS, Reed A, Chen F, Stewart CN (2006) Statistical analysis of real-time PCR data. BMC Bioinformatics 7: 85. https://doi.org/10.1186/1471-2105-7-85
NCBI // URL: https://www.ncbi.nlm.nih.gov/protein (дата обращения: 09.02.2022).
Okonechnikov K, Golosova O, Fursov M, UGENE team (2012) Unipro UGENE: a unified bioinformatics toolkit. Bioinformatics 28 (8): 1166–1167. https://doi.org/10.1093/bioinformatics/bts091
Waterhouse AM, Procter JB, Martin DMA, Clamp M, Barton GJ (2009) Jalview Version 2–a multiple sequence alignment editor and analysis workbench. Bioinformatics 25(9):1189–1191. https://doi.org/10.1093/bioinformatics/btp033
Zhao H, Brown PH, Schuck (2011) On the distribution of protein refractive index increments. Biophys J 100(9):2309–2317.
Gasteiger E, Hoogland C, Gattiker A, Duvaud S, Wilkins MR, Appel RD, Bairoch A (2005) Protein Identification and Analysis Tools on the ExPASy Server. In Ed. J.M. Walker The proteomics protocols handbook. Totowa, New Jersey. Humana Press Inc. 571–607. https://doi.org/10.1385/1-59259-890-0:571
Gerhard GS, Kauffman EJ, Wang X, Stewart R, Moore JL, Kasales CJ, Demidenko E, Cheng KC (2002) Life spans and senescent phenotypes in two strains of Zebrafish (Danio rerio). Exp Gerontol 37 (8–9): 1055–1068. https://doi.org/10.1016/S0531-5565(02)00088-8
Carey JB, Judge DS (2000) Longevity Records: Monographs on Population Aging. Vol 8: Life Spans of Mammals, Birds, Amphibians, Reptiles, and Fish. Univer Press of Southern Denmark.
Brooks CM, Andrews AH, Ashford JR, Ramanna N, Jones CD, Lundstrom CC, Cailliet GM (2011) Age estimation and lead–radium dating of Antarctic toothfish (Dissostichus mawsoni) in the Ross Sea. Polar Biol 34 (3): 329–338. https://doi.org/10.1007/s00300-010-0883-z
Wages P, Horwitz J, Ding L, Corbin RW, Posner M (2013) Changes in zebrafish (Danio rerio) lens crystallin content during development. Mol Vis 19:408–417.
Wang K, Vorontsova I, Hoshino M, Uesugi K, Yagi N, Hall JE, Schilling TF, Pierscionek BK (2020) Optical development in the zebrafish eye lens. FASEB J 34 (4): 5552–5562. https://doi.org/10.1096/fj.201902607R
Keenan J, Manning G, Elia G, Dunn MJ, Orr DF, Pierscionek BK (2012) Crystallin distribution patterns in Litoria infrafrenata and Phyllomedusa sauvagei lenses. Proteomics 12 (11): 1830–1843. https://doi.org/10.1002/pmic.201100393
Axelrod D, Lerner D, Sands PJ (1988) Refractive index within the lens of a goldfish eye determined from the paths of thin laser beams. Vis Res 28 (1): 57–65. https://doi.org/10.1016/S0042-6989(88)80006-3
Campbell MC (1984) Measurement of refractive index in an intact crystalline lens. Vis Res 24 (5): 409–415. https://doi.org/10.1016/0042-6989(84)90039-7
Van Leen RW, Breuer ML, Lubsen NH, Schoenmakers JG (1987) Developmental expression of crystallin genes: in situ hybridization reveals a differential localization of specific mRNAs. Dev Biol 123 (2): 338–345. https://doi.org/10.1016/0012-1606(87)90392-7
Ueda Y, Duncan MK, David L (2002) Lens proteomics: the accumulation of crystallin modifications in the mouse lens with age. Invest Ophthalmol Vis Sci 43 (1): 205–215.
Pierscionek B, Bahrami M, Hoshino M, Uesugi K, Regini J, Yagi N (2015) The eye lens: age-related trends and individual variations in refractive index and shape parameters. Oncotarget 6 (31): 30532–30544.
Vendra VP, Khan I, Chandani S, Muniyandi A, Balasubramanian D (2016) Gamma crystallins of the human eye lens. Biochim Biophys Acta 1860 (1 Pt B): 333–343. https://doi.org/10.1016/j.bbagen.2015.06.007
Slingsby C, Wistow GJ, Clark AR (2013) Evolution of crystallins for a role in the vertebrate eye lens. Protein Sci 22 (4): 367–380. https://doi.org/10.1002/pro.2229
Houston P, Macro N, Kang M, Chen L, Yang J, Wang L, Wu Z, Zhong D (2020) Ultrafast Dynamics of Water-Protein Coupled Motions around the Surface of Eye Crystallin. J Am Chem Soc. 142 (8): 3997–4007. https://doi.org/10.1021/jacs.9b13506
Kiss AJ, Mirarefi AY, Ramakrishnan S, Zukoski CF, Devries AL, Cheng CH (2004) Cold-stable eye lens crystallins of the Antarctic nototheniid toothfish Dissostichus mawsoni Norman. J Exp Biol 207 (Pt 26): 4633–4649. https://doi.org/10.1242/jeb.01312
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии