Журнал эволюционной биохимии и физиологии, 2022, T. 58, № 4, стр. 323-332
ФЕНОТИПИЧЕСКИ ОБУСЛОВЛЕННАЯ ДИСФУНКЦИЯ ПЕЧЕНИ КРЫС ВИСТАР ПРИ МОДЕЛИРОВАНИИ ПОСТТРАВМАТИЧЕСКОГО СТРЕССОВОГО РАССТРОЙСТВА
М. В. Кондашевская 1, *, К. А. Артемьева 1, В. В. Алексанкина 1, Д. А. Арешидзе 1, М. А. Козлова 1, Л. А. Макарцева 1
1 “Научно-исследовательский институт морфологии человека имени академика А.П. Авцына”,
ФГБНУ “Российский научный центр хирургии имени академика Б.В. Петровского”
Москва, Россия
* E-mail: marivladiko@mail.ru
Поступила в редакцию 21.04.2022
После доработки 19.05.2022
Принята к публикации 24.05.2022
- EDN: FHECKB
- DOI: 10.31857/S0044452922040088
Аннотация
Экстраординарная ситуация пандемии 2019–2022 гг. обусловила резкий скачок заболеваемости посттравматическим стрессовым расстройством (ПТСР). В настоящее время ПТСР расценивается не только как нейропсихическое расстройство, но и как коморбидное заболевание, сопровождающееся заболеваниями сердечно-сосудистой системы, нарушениями кровообращения, патологией печени и др. На сегодняшний день еще не выяснена связь поведенческих изменений с выраженностью трансформации морфофункционального состояния печени. В данной работе ПТСР моделировали на половозрелых самцах крыс Вистар, используя предаторный стресс (страх жертвы перед хищником). Тестирование в приподнятом крестообразном лабиринте позволило разделить популяцию на животных с низкотревожным (НТФ) и высокотревожным (ВТФ) фенотипами. Установлено, что морфофункциональные исследования печени, в бóльшей мере, чем биохимические результаты, позволяют сделать заключение о том, что у крыс обоих фенотипов предаторный стресс индуцирует дисфункцию печени. Это может свидетельствовать о снижении диапазона компенсаторно-приспособительных реакций у стрессированных животных. Тем не менее глубина морфофункциональных нарушений комплекса функциональных механизмов, обеспечивающих углеводно-жировой, водно-электролитный и белковый обмен в печени ВТФ крыс, свидетельствуют о донозологическом состоянии органа. В случае предъявления дополнительных нагрузок, напряжение регуляторных систем печени может привести к нарушению гомеостаза. Тогда как печень НТФ животных характеризовалась лишь небольшими диффузными изменениями. Следовательно, в настоящей работе удалось установить связь поведенческих изменений с выраженностью трансформации морфофункционального состояния печени.
Посттравматическое стрессовое расстройство (ПТСР) – это комплекс симптомов нарушения психической деятельности, возникающий в результате единоразового или повторяющегося внешнего сверхсильного травмирующего воздействия на психику человека. В современном мире, с учетом пандемии, объявленной в январе 2020 г. по поводу заболевания, названного COVID-19, вызванного коронавирусом SARS-CoV-2, проблема ПТСР приобретает особую значимость, так как поражается не только иммунная, но и нервная система, а также ментальное здоровье [1, 2]. Во всех странах мира пандемия детерминировала рост числа пациентов с диагнозом ПТСР как среди переболевших, так и не переболевших людей [1, 2].
Необходимо подчеркнуть значительное отличие воздействия стресса на гипоталамо-гипофизарно-адреналовую систему (ГГАС) при ПТСР от других разновидностей нейропсихических расстройств. Именно для ПТСР характерно достаточно быстрое изменение активности структур мозга, участвующих в стресс-реакции, в результате чего гиперинтенсивный тип реагирования нейроэндокринной системы сменяется гипофункцией. То есть большинство типов стресса приводит к гиперактивации ГГАС, развивающейся в результате десенситизации глюкокортикоидной отрицательной обратной связи и повышению уровня кортизола в крови у людей, тогда как лишь при ПТСР формируются ее сенситизация и снижение уровня этого гормона [3, 4]. Принято считать, что в основе нейроэндокринных нарушений у пациентов с ПТСР лежит дизрегуляция, которая заключается в повышенной активности симпатоадреналовой системы [5]. По мере истощения адаптационных возможностей происходит срыв регуляторных систем организма (дизадаптация) и развиваются патологические изменения [6]. Для ПТСР характерно отсроченное проявление психических и поведенческих симптомов заболевания, а также появление этих симптомов не у всех стрессированных людей. В связи с этим популяцию стрессированных людей принято разделять на устойчивых и неустойчивых к стрессу индивидов [7]. Ранее ПТСР считалось преимущественно психическим заболеванием, тогда как в настоящий момент ПТСР расценивается как коморбидное заболевание, сопровождающееся заболеваниями сердечно-сосудистой системы, нарушениями кровообращения, патологией печени и др. [8].
Множество проводимых исследований демонстрируют связь между стрессом и заболеваниями печени. Известно, что интенсивный стресс сопровождается пероксидацией липидов клеточных мембран и ведет впоследствии к тканевым повреждениям, при этом по сравнению с другими органами наиболее уязвима печень, которая играет ключевую роль в таких жизненных процессах, как детоксикация, углеводный, липидный, энергетический метаболизм и др. [9]. На сегодняшний день еще не выяснена связь поведенческих изменений с выраженностью трансформаций морфофункционального состояния печени.
На данный момент общепризнанной моделью экспериментального воспроизведения ПТСР является модель предаторного стресса – эволюционно закрепленного, избирательного страха грызунов перед хищником и его запахом, разработанная Cohen и Zohar [10] и усовершенствованная Tseilikman и соавт. [11]. Характерным для этой модели является снижение уровня кортикостерона – основного гормона стресса для лабораторных грызунов, что рассматривается в качестве важного фактора адекватности патогенезу у пациентов с диагнозом ПТСР [12, 13]. Для данной модели ПТСР разработаны методы оценки поведенческих изменений, позволяющие подразделить популяцию лабораторных грызунов на устойчивых (низкотревожных) и неустойчивых (высокотревожных) к стрессу особей [14].
Цель работы – охарактеризовать морфофункциональное состояние печени устойчивых и неустойчивых к предаторному стрессу половозрелых самцов крыс Вистар при моделировании посттравматического стрессового расстройства, установить связь поведенческих изменений с выраженностью трансформаций морфофункционального состояния печени.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование проводили на 40 половозрелых крысах-самцах Вистар (филиал “Столбовая” Научного центра биомедицинских технологий Федерального медико-биологического агентства России) с массой тела 180–200 г. Животных, прошедших карантин не менее 14 дней, содержали в стандартных условиях вивария, рассаживая в клетки по 10 особей случайным образом, при естественном освещении, температуре 20–22°С. Доступ к воде и полноценному гранулированному корму (ГОСТ 34566-2019) был свободным. Для проведения эксперимента крыс делили на 2 группы – контрольную и опытную с равным числом особей (по 20 крыс). Опытную группу крыс подвергали воздействию предаторного стресса (кошачья моча) ежедневно по 10 мин 10 сут с последующим содержанием в течение 14 сут в обычных условиях вивария. Дизайн эксперимента изображен на рис. 1.
Рис. 1.
Дизайн эксперимента.
А – предаторный стресс 10 мин 10 сут;
В – обычное содержание в виварии 14 сут;
С – тестирование крыс за сутки до окончания эксперимента в приподнятом крестообразном лабиринте.

Все экспериментальные процедуры проводили в соответствии с директивой Европейского парламента 2010/63/EU “О защите животных, используемых в экспериментальных целях” (от 22.09.2010 г.). На проведение работы было получено разрешение биоэтической комиссии ФГБНУ “Научно-исследовательский институт морфологии человека имени академика А.П. Авцына” (протокол № 20 от 12 марта 2019 г.).
Для выявления поведенческих различий реакции на стресс животных тестировали по одному в приподнятом крестообразном лабиринте (ПКЛ) в течение 600 с. Регистрировали число заходов в открытые и закрытые рукава ПКЛ, время нахождения в каждом типе рукавов, вычисляли индекс тревожности, разработанный Cohen и соавт. [15]: ИТ = 1 – [(ВОР/ВТ + ЧЗОР/ОЧЗ)/2], где ВОР – время, проведенное в открытых рукавах, ВТ – время тестирования (600 с), ЧЗОР – число заходов в открытые рукава ПКЛ, ОЧЗ – общее число заходов в рукава ПКЛ.
В конце эксперимента производили забор периферической крови натощак, под золетиловым наркозом (5 мг/100 г, Virbac Sante Animale, Франция) в пробирки с ЭДТА в качестве антикоагулянта. Для получения плазмы кровь центрифугировали при 3000 g в течение 10 мин. В плазме крови определяли уровень аспартатаминотрансферазы (АСТ) и аланинаминотрансферазы (АЛТ), а также уровень глюкозы, триглицеридов и общего холестерина, используя автоматический биохимический анализатор (CX4/Pro, BeckmanCoulter, США).
При вскрытии крыс оценивали состояние печени макроскопически, визуально оценивая: цвет, объем, консистенцию, эластичность при захвате пинцетом. Относительную массу рассчитывали как отношение абсолютной массы печени (АМП) к массе тела (МТ) и выражали в мг/кг массы тела животного $\frac{{{\text{АМТ}}}}{{{\text{МТ}}}}$ мг/кг.
Для морфометрического анализа брали образцы печени, часть которых фиксировали в 10%-ном нейтральном формалине, другую часть кусочков печени без фиксации резали на криостате, срезы окрашивали суданом III для выявления нейтральных жиров. После фиксации образцы печени обезвоживали, заключали в гистомикс, изготавливали срезы толщиной 5 мкм. Часть срезов окрашивали гематоксилином и эозином, другую часть срезов подвергали PAS-реакции для выявления гликогена. При помощи микроскопа Axioplan 2 imaging c цифровой фотокамерой и системой обработки изображений (Carl Zeiss MicroImaging GmbH, Германия) производили по 10 фотографий окрашенных срезов каждого животного. Оптическую плотность срезов, окрашенных суданом III и после PAS-реакции, определяли, используя программу ImageJ (Fiji).
Концентрацию кортикостерона в сыворотке крови определяли методом иммуноферментного анализа c использованием набора регентов (IBL, Германия).
Статистический анализ данных проводили с помощью программы Statistica 8.0. Характер распределения признаков оценивали по критерию Шапиро–Уилка. Было установлено, что эмпирическое распределение полученных нами данных отличается от нормального. Для статистической обработки использовали непараметрический метод Краскела–Уоллиса и метод парных сравнений – U-критерий Манна–Уитни. Производили расчет коэффициента ранговой корреляции Спирмена. Данные приводили в виде медианы и квартилей Me (25%; 75%). Различия считали значимыми при p < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Для оценки морфофункционального состояния печени у различных фенотипов крыс Вистар мы применяли предаторный стресс. Дизайн эксперимента изображен на рис. 1. За сутки до окончания эксперимента производили тестирование в приподнятом крестообразном лабиринте (ПКЛ) (табл. 1), на следующие сутки, на фоне пищевой депривации, крыс выводили из эксперимента передозировкой золетила.
Таблица 1.
Показатели поведения крыс Вистар при тестировании в приподнятом крестообразном лабиринте (ПКЛ) и уровень кортикостерона, позволяющие разделить популяцию стрессированных животных на низкотревожных и высокотревожных, Me (25%; 75%)
| Показатели | Группы | ||
|---|---|---|---|
| Контроль | Низкотревожные | Высокотревожные | |
| Число заходов в закрытые рукава ПКЛ | 7.3 (4.1; 10.5) | 6.8 (3.5; 10.3) | 4.3*# (2.2; 7.3) |
| Число заходов в открытые рукава ПКЛ | 4.6 (2.2; 6.5) | 3.7 (2.3; 5.6) | 1.9*# (1.1; 3.5) |
| Время в закрытых рукавах ПКЛ, с | 439.1 (398.3; 547.3) | 468.3 (419.9; 561.3) | 577.8*# (556.7; 608.5) |
| Время в открытых рукавах ПКЛ, с | 156.2 (26.7; 318.8) | 110.5 (52.4; 297.5) | 21.2*# (5.5; 38.7) |
| Индекс тревожности, усл. ед. | 0.65 (0.47; 0.76) | 0.71 (0.53; 0.0.76) | 0.88*# (0.81; 0.98) |
| Уровень кортикостерона, нмоль/л | 368.6 (304.6; 416.9) | 281.4* (207.1; 372,9) | 169.6*# (141.6; 199.3) |
Было установлено, что показатели тестирования в ПКЛ опытной группы крыс различались, а именно: у части животных (Группа 1 – 9 крыс) показатели не отличались от таковых контрольной группы крыс (табл. 1), тогда как показатели другой группы крыс (Группа 2 – 11 крыс) имели статистически значимые отличия, как от контроля, так и от Группы 1. Оказалось, что крысы Группы 1 проводили на 71.8% больше времени в открытых рукавах ПКЛ, чем крысы Группы 2 (табл. 1). Значения индекса тревожности (ИТ) крыс группы 2 составляли 0.88, что превышало ИТ контрольных крыс на 29.4% и на 17.3% – крыс группы 1 (табл. 1).
Концентрация плазменного кортикостерона (КОРТ) у крыс 1-й и 2-й групп была ниже, чем в контрольной группе (табл. 1). Тем не менее концентрация КОРТ в плазме крыс Группы 1 была на 24.8%, а у Группы 2 – на 63.7% ниже, чем у контрольных крыс (табл. 1).
В течение экспериментального периода ни у одной из крыс не наблюдалось видимых признаков болезни. В конце эксперимента (через 25 дней от начала эксперимента) масса тела крыс всех групп не имела статистически значимых различий (p ≥ 0.05). В то же время расчет отношения абсолютной массы печени (АМП мг) к массе тела (МТ кг) $\frac{{{\text{АМП}}}}{{{\text{МТ}}}}$ мг/кг показал заметно более высокие значения в группе высокотревожных крыс по сравнению с контролем и низкотревожными животными (табл. 2). Макроскопически печень высокотревожных крыс отличалась от контроля и низкотревожных животных – она была увеличена в объеме, имела рыхлую консистенцию, легко повреждалась при захвате пинцетом, имела тусклый, серовато-коричневый цвет. Все указанные признаки являются проявлениями диффузных изменений в печени высокотревожных особей. Тогда как печень низкотревожных животных не отличалась по объему, цвету и консистенции от контроля.
Таблица 2.
Биохимические показатели крови и относительная масса печени низкотревожных и высокотревожных крыс Вистар при моделировании посттравматического стрессового расстройства, Me (25%; 75%)
| Показатели | Группы | ||
|---|---|---|---|
| Контроль | Низкотревожные | Высокотревожные | |
| Относительная масса печени, мг/кг | 0.031 (0.028; 0.034) | 0.038* (0.035; 0.041) | 0.046*# (0.042; 0.048) |
| Аспартатаминотрансфераза, ммоль/л | 75.3 (66.7; 85.3) | 80.7 (66.7; 95.3) | 96.4*# (80.3; 113.2) |
| Аланинаминотрансфераза, ммоль/л | 46.8 (38.7; 53.7) | 43.3 (34.4; 51.3) | 54.6*# (49.3; 59.5) |
| Общий холестерин, моль/л | 3.5 (3.1; 3.9) | 3.9 (3.3; 4.3) | 4.7*# (2.7; 5.3) |
| Триглицериды (ТРГ), моль/л | 0.79 (0.63; 0.89) | 1.17* (0.89; 1.42) | 2.85*# (2.12; 3.83) |
| Глюкоза (Гл) ммоль/л | 5.9 (5.3; 6.1) | 5.6 (5.2; 6.1) | 4.9*# (4.7; 5.2) |
| Гл/ТРГ, усл. ед. | 7.6 (7.2; 8.9) | 5.1* (4.2; 6.2) | 1.9*# (1.4; 2.3) |
Многие заболевания печени сопровождаются нарушением целостности гепатоцитов, при этом высвобождаются в кровь такие внутриклеточные ферменты, как аланинаминотрансфераза (АЛТ) и аспартатаминотрансфераза (АСТ), поэтому их концентрация в крови возрастает. Определение концентрации АЛТ и АСТ используется в первую очередь для ранней диагностики функциональных нарушений печени [16].
Плазменная концентрация АЛТ у низкотревожных крыс не отличалась от контрольного уровня, тогда как концентрация АЛТ у высокотревожных животных была на 16.7% выше, чем в контроле (табл. 2). Плазменная концентрация АСТ низкотревожных крыс также не отличалась от контрольного уровня, тогда как концентрация АСТ высокотревожных особей была на 28.1% выше, чем в контроле (табл. 2). В то же время относительная масса печени – $\frac{{{\text{АМП}}}}{{{\text{МТ}}}}$ мг/кг оказалась повышенной как у низкотревожных крыс на 26.7%, так и у высокотревожных животных на 53.3% (табл. 2). Относительная масса печени высокотревожных крыс была на 21.1% выше, чем у низкотревожных крыс (табл. 2).
В связи с тем, что норма реакции АЛТ, АСТ и относительной массы печени характеризуется достаточно широким диапазоном, не позволяющим наверняка судить о развитии дисфункциональных изменений, было проведено гистологическое и гистохимическое исследование печени [17].
При морфологическом исследовании печени крыс контрольной и опытных групп установлено, что общий план строения у всех животных был одинаковым и соответствовал возрастной группе. При окраске срезов печени гематоксилином и эозином хорошо видно, что гепатоциты контрольной крысы (рис. 2a) имеют темный фон, характеризующий плотное заполнение клеток гликогеном. В то же время, гепатоциты низкотревожных крыс (рис. 2b) и, особенно, высокотревожных животных (рис. 2c), имеют более светлый фон, свидетельствующий о гистологических признаках снижения запасов гликогена (рис. 2).
Рис. 2.
Морфофункциональное состояние печени контрольных (a), низкотревожных (b) и высокотревожных (c) крыс Вистар при моделировании посттравматического стрессового расстройства (ПТСР)(гематоксилин и эозин, масштаб 50 мкм).
Стрелки указывают на дистрофически измененные клетки.
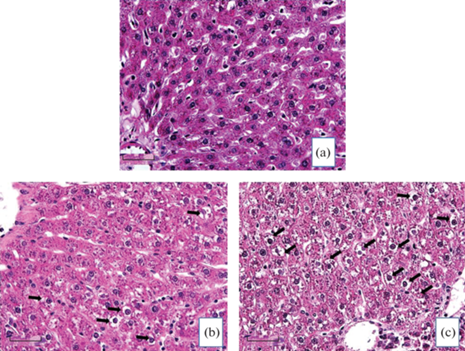
Также хорошо заметно, что в гепатоцитах низкотревожных крыс (рис. 2b) наблюдаются мелкие и средние вакуоли, а в гепатоцитах высокотревожных животных (рис. 2c) – средние и крупные вакуоли. Часть вакуолей обеих групп крыс заполнена прозрачной жидкостью, что является свидетельством развития гидропической (водяночной) дистрофии. На срезах печени высокотревожных крыс (рис. 2с) можно заметить баллонную дистрофию – заполнение отечной жидкостью почти всей цитоплазмы клетки. В последнем случае обычно наблюдаются некроз и гибель таких клеток [18]. Другая часть вакуолей гепатоцитов низкотревожных и высокотревожных крыс заполнена малопрозрачным веществом, имеющим гистологические признаки нейтральных жиров.
С целью доказательства наличия жировой дистрофии мы использовали традиционную окраску суданом III на нейтральные жиры [19]. Микроскопически в гепатоцитах низкотревожных крыс наблюдалась мелко- и среднекапельная жировая дистрофия, и лишь небольшая часть клеток содержала вакуоли, окрашенные в красный цвет суданом III, что свидетельствовало о наличии жиров. В то же время в гепатоцитах высокотревожных животных была обнаружена средне- и крупнокапельная жировая дистрофия, заметная во многих клетках. Тогда как гепатоциты контрольных крыс практически не содержали вакуолей, окрашенных в красный цвет суданом III, т.е. в норме накопление жиров в гепатоцитах происходит в очень небольших количествах и только в звездчатых клетках. Проведение измерений оптической плотности (ОП) окраски гепатоцитов суданом III на срезах печени позволило установить, что по сравнению с контролем значения ОП низкотревожных крыс были выше на 29.2% (p = 0.004), а значения ОП высокотревожных особей – на 120.3% (p = 0.004) (рис. 3). Обнаружена негативная корреляция значений ОП окраски суданом III со значениями уровня КОРТ в крови у низкотревожных крыс rs = = –0.979 (коэффициент ранговой корреляции Спирмена, p = 0.001) и у высокотревожных особей rs = –0.955 (p = 0.001).
Рис. 3.
Оптическая плотность окраски срезов печени на жиры и гликоген у низкотревожных (LAR) и высокотревожных (HAR) крыс Вистар при моделировании посттравматического стрессового расстройства.
OD – оптическая плотность, OD-lipids – ОП при визуализации нейтральных жиров суданом ΙΙΙ; OD-glycogen – ОП при визуализации гликогена реакцией Шиффа.
*p < 0.005 отличие от контроля, ^p < 0.005 различие между LAR (Группа 1) и HAR (Группа 2) фенотипами опытных крыс по U-критерию Манна–Уитни.
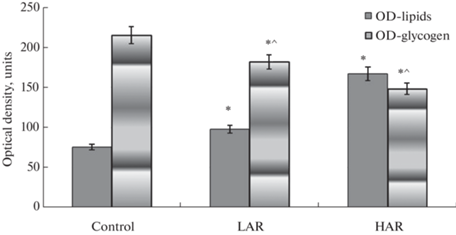
При визуализации гликогена, используя традиционную PAS-реакцию [20], было установлено, что значения ОП срезов печени снижены у низкотревожных крыс на 25.5% (p = 0.0003) и на 32.1% (p = = 0.0001) у высокотревожных животных по сравнению с контролем (рис. 3). Выявлена позитивная корреляция значений ОП гликогена со значениями уровня кортикостерона в крови у низкотревожных rs = 1 (коэффициент ранговой корреляции Спирмена, p = 0.0001) и у высокотревожных крыс rs = 1 (p = 0.0001). Следует отметить, что у всех групп крыс структура печени не нарушалась – сохранялось дольковое и пластинчатое строение, контуры клеток хорошо определялись. Это же было характерно и для высокотревожных крыс, несмотря на то, что во всех долях печени у них обнаружена массивная вакуольная дистрофия гепатоцитов.
Дистрофические изменения в печени сопровождались изменениями содержания и доминирования транспортных форм энергии в плазме крови, таких как глюкоза и липиды. При этом обнаруживалась разная реакция на предаторный стресс организма низкотревожных и высокотревожных крыс (табл. 2). Оказалось, что по сравнению с контролем уровень плазменной глюкозы снижался только у высокотревожных на 15.4% и не отличался от контроля у низкотревожных животных (табл. 2). Одновременно с этим плазменное содержание общего холестерина было повышено только у высокотревожных крыс на 32.2%, тогда как у низкотревожных особей не отличалось от контроля (табл. 2). В то же время по сравнению с контролем плазменный уровень триглицеридов оказался повышенным как у высокотревожных на 62.3%, так и у низкотревожных крыс на 32.4% (табл. 2). Отношение значений уровня глюкозы (Гл) к значениям уровня триглицеридов (ТРГ) – Гл/ТРГ снижалось у обеих стрессированных групп. По сравнению с контролем у низкотревожных крыс Гл/ТРГ было ниже на 35.1%, тогда как у высокотревожных животных – на 75.8% (табл. 2).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Для оценки состояния различных систем организма обычно используется метод функциональной нагрузки, позволяющий оценить диапазон компенсаторно-приспособительных реакций различных органов и систем. В данном исследовании при моделировании ПТСР был использован предаторный стресс (страх жертвы перед хищником) и валидная модель ПТСР [4]. Исследования, проводимые российскими и зарубежными авторами, доказывают значимость предаторного стресса для грызунов [21, 22]. В этих работах показано, что химическая коммуникация млекопитающих осуществляется с помощью обонятельных сигналов, в основном летучих компонентов различных экскретов, кодирующих информацию о постоянных характеристиках особей – информацию, необходимую для сохранения жизни вида. Такие сигнальные вещества распространяются в воздушной среде и воспринимаются обонятельным анализатором, вомероназальной системой – периферическим отделом основной обонятельной системы, снабженным автономной иннервацией, многочисленными кровеносными сосудами, и выстланный нейроэпителием [23]. Для большинства видов млекопитающих анализ запаховых раздражителей является определяющим в организации сложных форм поведения и регуляции гормонального ансамбля в организме. Воздействие запаха хищника настолько значительно для грызунов, что активизирует не только поведенческие рефлексы – бегство, тревожность и др., но и абортивную реакцию у беременных самок [23].
Тестирование крыс в приподнятом крестообразном лабиринте позволило нам разделить группу стрессированных крыс на высокотревожных и низкотревожных особей по индексу тревожности. Так же, как и в наших предыдущих экспериментах [4], крыс, имеющих значения ИТ выше 0.75, мы считали высокотревожными, а менее 0.75 – низкотревожными животными. Кроме поведенческих признаков развития ПТСР-подобного состояния, дополнительным признаком валидности модели служит снижение уровня плазменного кортикостерона [4]. Несмотря на то что снижение КОРТ наблюдалось у обоих фенотипов, у высокотревожных крыс значения КОРТ оказались самыми низкими. Последнее предполагает наибóльшие изменения в организме этой группы крыс.
Наше предположение подтвердилось уже при макроскопическом исследовании печени экспериментальных групп. Оказалось, что у высокотревожных крыс печень была увеличена в объеме, имела признаки развития воспалительной реакции (табл. 2, рис. 2). Подтверждением нарушения функционирования печени служили такие маркеры, как аланинаминотрансфераза (AЛТ) и аспартаттрансаминаза (AСТ) [24], значения которых оказались повышенными только у высокотревожных крыс. Следует заметить, что большинство биохимических маркеров дисфункции печени имеет большой диапазон нормы реакции [17], в связи с этим более надежным способом диагностики является исследование морфофункционального состояния печени. Визуализацию нейтральных жиров производили с помощью специфической окраски суданом III [19]. Использование данного метода позволило диагностировать жировую дистрофию, ярко выраженную у высокотревожного фенотипа крыс, и лишь небольшое нарушение метаболизма жиров у низкотревожных особей. При этом повышение оптической плотности срезов, окрашенных суданом III, сопровождалось снижением уровня плазменного кортикостерона (негативная корреляция). Полученный нами результат подтверждает связь между КОРТ и метаболизмом нейтральных жиров в печени, однако другими исследователями такие результаты получены при повышении уровня КОРТ или введении КОРТ выше физиологических доз [25, 26]. Следовательно, можно констатировать, что механизмы, с помощью которых КОРТ может влиять на метаболизм липидов, до настоящего времени остаются малоизученными.
Применение специфической PAS-реакции на содержание гликогена в клетках печени [20], позволило установить резкое снижение содержания этого энергетического запаса у высокотревожного фенотипа крыс и гораздо менее выраженное – у низкотревожных животных. Снижение оптической плотности срезов с окраской на гликоген сопровождалось понижением уровня плазменного КОРТ (позитивная корреляция). Судя по сведениям литературы, кроме КОРТ, содержание гликогена зависит от уровней инсулина и катехоламинов, влияющих на уровни ферментов и метаболитов глюкозы и гликогена [27, 28]. Впервые в нашем эксперименте продемонстрировано, что у высокотревожных крыс дистрофические изменения распространяются на подавляющее большинство клеток печени, в которых почти не остается гликогена, визуализируются вакуоли, заполненные отечной жидкостью и жирами. Выявленные изменения отражают серьезные нарушения метаболического баланса печени, расстройство механизмов, обеспечивающих регуляцию углеводно-жирового, водно-электролитного и белкового обмена, свидетельствующие о донозологическом состоянии органа у высокотревожного фенотипа крыс. В то же время у низкотревожных особей указанные дистрофические изменения выражены лишь в части клеток. В дальнейших экспериментах следует определить возможность самопроизвольного восстановления морфофункционального состояния печени у этого фенотипа животных, для чего следует продлить постстрессорный период.
Уместно напомнить, что печень является центром многих физиологических процессов. Важнейшей функцией печени является способность накапливать вещества, служащие источником энергии не только для местных нужд, но и для всего организма. К числу основных источников энергии относится поступающая с пищей глюкоза, которая запасается в печени в форме гликогена (гликогеногенез), а при потребности организма в энергии происходит обратный процесс – превращение гликогена в глюкозу (гликогенолиз) [29]. Несмотря на то что в физиологических условиях в печени происходит синтез, секреция и окисление липидов, накопление липидов в основном происходит не в печени, а в жировой ткани. Липиды более чем в два раза более энергоемки, чем глюкоза. Тем не менее биоэнергия, заключенная в липидах, начинает расходоваться только в экстренных случаях, тогда как энергетические ресурсы гликогена гораздо более доступны и мобилизуются за считанные секунды [30]. Показана взаимосвязь уровня глюкозы с КОРТ, однако механизмы такой связи еще предстоит выяснить [31]. В нашем исследовании, при моделировании ПТСР, дистрофические перестройки морфофункционального состояния печени сопровождались изменениями плазменной концентрации и доминирования основных транспортных форм энергии, таких как общий холестерин (ОХ), триацилглицерины (ТРГ) и глюкоза (Гл). Судя по снижению значений отношения Гл/ТРГ и повышению показателей ОХ и ТРГ, можно заключить, что предаторный стресс обусловил смену доминирования основного источника транспортной формы энергии в норме – глюкозы, на липидный. У высокотревожных крыс смена энергии была особенно ярко выражена. Причина изменения доминирования транспортной формы энергии вероятнее всего заключается в стресс-индуцированной дисфункции печени, которая является основным органом, выполняющим фундаментальную роль в регулировании углеводного, липидного и белкового обмена, а также принимает участие во многих других процессах, направленных на поддержание гомеостаза всего организма животных и человека. Преобладание мобилизации свободных жирных кислот, как источника энергии, обычно наблюдается в пожилом возрасте, а также при действии экстремальных факторов [32].
Если экстраполировать на человека состояние ПТСР с выраженной дисфункцией печени, охарактеризованное у высокотревожного фенотипа крыс в нашем эксперименте, то можно заключить, что оно является серьезным фактором риска развития атеросклероза, нарушений работы сердца и центральной нервной системы, отмечаемых в работах других исследователей [33, 34]. Кроме того, достаточно давно известно, что практически все функциональные нарушения печени и заболевания этого органа могут являться причиной различных неврологических и психоневрологических патологий, от минимальных изменений церебральной функции до когнитивной дисфункции и, даже, отека мозга [27]. Все вышеизложенное указывает на то, что последствия нарушения морфофункционального состояния печени при ПТСР могут способствовать хронизации и усугублению заболеваний, выполняя роль ключевого звена сформировавшегося порочного круга: нейрогормональные нарушения↔дисфункция печени, индуцированного сильным психоэмоциональным стрессом.
Таким образом, морфофункциональные исследования печени, в бóльшей мере, чем биохимические результаты данной серии исследований, позволяют сделать заключение о том, что у всех подопытных крыс, как с высокотревожным, так и с низкотревожным фенотипом, предаторный стресс индуцирует дисфункцию печени. В свою очередь, это может свидетельствовать о снижении диапазона компенсаторно-приспособительных реакций у этих животных. Тем не менее в работе удалось установить связь поведенческих изменений с выраженностью трансформаций морфофункционального состояния печени. Глубина морфофункциональных нарушений комплекса функциональных механизмов, обеспечивающих углеводно-жировой, водно-электролитный и белковый обмен в печени крыс с высокотревожным фенотипом, свидетельствует о донозологическом состоянии органа. В случае предъявления дополнительных нагрузок могут возникнуть срыв гомеостатических систем и развитие заболеваний. Тогда как печень животных с низкотревожным фенотипом характеризовалась лишь небольшими диффузными изменениями. Полученные сведения о нарушении функции печени у стрессированных крыс могут быть полезны в клинической практике. После стрессирования следует выполнить диагностические тесты, доступные для определения степени дисфункции печени, и провести соответствующее лечение. Коррекция функциональной активности будет способствовать повышению функциональных возможностей печени и разрыву порочного круга патологического процесса.
Список литературы
Vindegaard N, Benros ME (2020) COVID-19 pandemic and mental health consequences: Systematic review of the current evidence. Brain Behav Immun 89: 531–542. https://doi.org/10.1016/j.bbi.2020.05.048
Сомова ЛМ, Коцюрбий ЕА, Дробот ЕИ, Ляпун ИН, Щелканов МЮ (2021) Клинико-морфологические проявления дисфункции иммунной системы при новой коронавирусной инфекции COVID-19. Клин эксп морфология 10 (1): 11–20. [Somova LM, Kotsyurbiy EA, Drobot EI, Lyapun IN, Shchelkanov MYu (2021) Clinical and morphological manifestations of immune system dysfunction in new coronavirus infection (COVID-19). Clin Exp Morphology 10 (1): 11–20. (In Russ)] https://doi.org/10.31088/CEM2021.10.1.11-20
Hadad NA, Schwendt M, Knackstedt LA. (2020) Hypothalamic-pituitary-adrenal axis activity in post-traumatic stress disorder and cocaine use disorder. Stress 23 (6): 638–650. https://doi.org/10.1080/10253890.2020.1803824
Tseilikman V, Komelkova M, Lapshin M, Alliluev A, Tseilikman O, Karpenko M, Pestereva N, Manukhina E, Downey HF, Kondashevskaya M, Sarapultsev A, Dremencov E (2020) High and low anxiety phenotypes in a rat model of complex post-traumatic stress disorder are associated with different alterations in regional brain monoamine neurotransmission. Psychoneuroendocrinology. 117: 104691. https://doi.org/10.1016/j.psyneuen.2020.10469
Morris MC, Hellman N, Abelson JL, Rao U (2016) Cortisol, heart rate, and blood pressure as early markers of PTSD risk: A systematic review and meta-analysis. Clin Psychol Rev 49: 79–91. https://doi.org/10.1016/j.cpr.2016.09.001
Morris MC, Compas BE, Garber J (2012) Relations among posttraumatic stress disorder, comorbid major depression, and HPA function: a systematic review and meta-analysis. Clin Psychol Rev 32 (4): 301–315. https://doi.org/10.1016/j.cpr.2012.02.002
Javidi H, Yadollahie M (2012) Post-traumatic Stress Disorder. Int J Occup Environ Med 3 (1): 2–9.
Pitman RK, Rasmusson AM, Koenen KC, Shin LM, Orr SP, Gilbertson MW, Milad MR, Liberzon I (2012) Biological studies of post-traumatic stress disorder. Nat Rev Neurosci 13 (11): 769–787.https://doi.org/10.1038/nrn3339
Forte G, Favieri F, Tambelli R, Casagrande M (2020) COVID-19 Pandemic in the Italian Population: Validation of a Post-Traumatic Stress Disorder Questionnaire and Prevalence of PTSD Symptomatology. Int J Environ Res Public Health 17 (11): 4151. https://doi.org/10.3390/ijerph17114151
Cohen H, Zohar J (2004) An animal model of posttraumatic stress disorder: The use of cut-off behavioral criteria. Ann NY Acad Sci 1032: 167–178. https://doi.org/10.1196/annals.1314.014
Tseilikman V, Dremencov E, Maslennikova E, Ishmatova A, Manukhina E, Downey HF, Klebanov I, Tseilikman O, Komelkova M, Lapshin MS, Vasilyeva MV, Bornstein SR, Perry SW, Wong ML, Licinio J, Yehuda R, Ullmann E (2019) Post-Traumatic Stress Disorder Chronification via Monoaminooxidase and Cortisol Metabolism. Horm Metab Res 51 (9): 618–622. https://doi.org/10.1055/a-0975-9268
Рыбникова ЕА, Миронова ВИ, Пивина СГ (2010) Тест для выявления нарушений саморегуляции гипофизарно-адренокортикальной системы. Журнал высшейнервной деятельности им ИП Павлова 60 (4): 500–506. [Rybnikova EA, Mironova VI, Pivina SG (2010) Test for the detection of disorders of self-regulation of the pituitary-adrenocortical system. Journal of Higher Nervous Activity IP Pavlova 60 (4): 500–506. (In Russ.)].
Boero G, Pisu MG, Biggio F, Muredda L, Carta G, Banni S, Paci E, Follesa P, Concas A, Porcu P, Serra M (2018) Impaired glucocorticoid-mediated HPA axis negative feedback induced by juvenile social isolation in male rats. Neuropharmacology 133 (1): 242–253. https://doi.org/10.1016/j.neuropharm.2018.01.045
Кондашевская МВ, Комелькова МВ, Цейликман ВЭ, Цейликман ОБ, Артемьева КА, Алексанкина ВВ, Болтовская МН, Сарапульцев АП, Черешнева МВ, Черешнев ВА (2021) Новые нейробиологические критерии профиля устойчивости при моделировании посттравматического стрессового расстройства. Доклады Российской академии наук 501 (6): 28–33. [Kondashevskaya MV, Komelkova MV, Tseylikman VE, Tseylikman OB, Artemyeva KA, Aleksankina VV, Boltovskaya MN, Sarapultsev AP, Chereshneva MV, Chereshnev VA (2021) New neurobiological criteria for the resilience profile in modeling post-traumatic stress disorder. Reports of the Russian Academy of Sciences 501 (6): 28–33. (In Russ)]. https://doi.org/10.31857/S2686738921060056
Cohen H, Matar MA, Buskila D, Kaplan Z, Zohar J (2008) Early post-stressor intervention with high-dose corticosterone attenuates posttraumatic stress response in an animal model of posttraumatic stress disorder. Biol Psychiatry 64: 708–717.https://doi.org/10.1016/j.biopsych.2008.05.025
von Känel R, Abbas CC, Begré S, Gander ML, Saner H, Schmid JP (2010) Association between posttraumatic stress disorder following myocardial infarction and liver enzyme levels: a prospective study. Dig Dis Sci 55 (9): 2614–2623.https://doi.org/10.1007/s10620-009-1082-z
He Q, Su G, Liu K, Zhang F, Jiang Y, Gao J, Liu L, Jiang Z, Jin M, Xie H (2017) Sex-specific reference intervals of hematologic and biochemical analytes in Sprague-Dawley rats using the nonparametric rank percentile method. PLoS One 12 (12): e0189837. https://doi.org/10.1371/journal.pone.0189837
Березов ЮЕ, Полсачев ВИ, Ковалев АИ (1980) Изменения биохимических показателей функции печени при раке желудка и пищевода. Вопр Онкол 26(12):15–18. [Berezov IuE, Polsachev VI, Kovalev AI (1980) Changes in the biochemical indices of liver function in stomach and esophageal cancer. Vopr Onkol 26 (12): 15–18. (In Russ)].
Ju J, Huang Q, Sun J, Jin Y, Ma W, Song X, Sun H, Wang W (2018) Correlation between PPAR-α methylation level in peripheral blood and inflammatory factors of NAFLD patients with DM. Exp Ther Med 15 (2): 1474–1478. https://doi.org/10.3892/etm.2017.5530
Ravikumar SS, Menaka TR, Vasupradha G, Dhivya K, Dinakaran J, Saranya V (2019) Cytological intracellular glycogen evaluation using PAS and PAS-D stains to correlate plasma glucose in diabetics. Indian J Dent Res 30 (5): 703–707. https://doi.org/10.4103/ijdr.IJDR_815_18
Voznessenskaya VV, Malanina TV (2013) Effect of chemical signals from a predator (Felis catus) on the reproduction of Mus musculus. Dokl Biol Sci 453: 362–364. https://doi.org/10.1134/S0012496613060057
Apfelbach R, Parsons MH, Soini HA, Novotny MV. (2015) Are single odorous components of a predator sufficient to elicit defensive behaviors in prey species? Front Neurosci 9: 263. https://doi.org/10.3389/fnins.2015.00263
Voznessenskaya VV, Kyuchnikova MA, Wysocki CJ (2010) Roles of the main olfactory and vomeronasal systems in detection of androstenone in inbred straines of mice. Current Zool 56 (6): 813–818.
He XR, Lin QC, Chen Q (2017) Effects of Prescription Yiqi Huatan Quyu on oxidative stress level and pathological changes in chronic intermittent hypoxia rat liver. Zhonghua Yi Xue Za Zhi 97(6):457–461. https://doi.org/10.3760/cma.j.issn.0376-2491.2017.06.012
Wu T, Jiang J, Yang L, Li H, Zhang W, Chen Y, Zhao B, Kong B, Lu P, Zhao Z, Zhu J, Fu Z (2017) Timing of glucocorticoid administration determines severity of lipid metabolism and behavioral effects in rats. Chronobiol Int 34 (1): 78–92. https://doi.org/10.1080/07420528.2016.1238831
Butler MW, Armour EM, Minnick JA, Rossi ML, Schock SF, Berger SE, Hines JK (2019) Effects of stress-induced increases of corticosterone on circulating triglyceride levels, biliverdin concentration, and heme oxygenase expression. Comp Biochem Physiol A Mol Integr Physiol 240: 110608. https://doi.org/10.1016/j.cbpa.2019.110608
Morakinyo AO, Samuel TA, Awobajo FO, Adekunbi DA, Olatunji IO, Binibor FU, Oni AF (2019) Adverse effects of noise stress on glucose homeostasis and insulin resistance in Sprague-Dawley rats. Heliyon 5 (12): e03004. https://doi.org/10.1016/j.heliyon.2019.e03004
Dasgupta R, Saha I, Ray PP, Maity A, Pradhan D, Sarkar HP, Maiti BR (2020) Arecoline plays dual role on adrenal function and glucose-glycogen homeostasis under thermal stress in mice. Arch Physiol Biochem 126 (3): 214–224.https://doi.org/10.1080/13813455.2018.1508238
Han HS, Kang G, Kim JS, Choi BH, Koo SH (2016) Regulation of glucose metabolism from a liver-centric perspective. Exp Mol Med 48 (3): e218. https://doi.org/10.1038/emm.2015.122
Rui L (2014) Energy metabolism in the liver. Compr Physiol 4 (1): 177–197. https://doi.org/10.1002/cphy.c130024
Conoscenti MA, Williams NM, Turcotte LP, Minor TR, Fanselow MS (2019) Post-Stress Fructose and Glucose Ingestion Exhibit Dissociable Behavioral and Physiological Effects. Nutrients 11 (2): 361. https://doi.org/10.3390/nu11020361
Won BY, Park SG, Lee SH, Kim MJ, Chun H, Hong D, Kim YS (2020) Characteristics of metabolic factors related to arterial stiffness in young and old adults. Clin Exp Hypertens 42 (3): 225–232. https://doi.org/10.1080/10641963.2019.1619754
von Känel R, Abbas CC, Begré S, Gander ML, Saner H, Schmid JP (2010) Association between posttraumatic stress disorder following myocardial infarction and liver enzyme levels: a prospective study. Dig Dis Sci 55 (9): 2614–2623. https://doi.org/10.1007/s10620-009-1082-z
Mesarwi OA, Loomba R, Malhotra A (2019) Obstructive Sleep Apnea, Hypoxia, and Nonalcoholic Fatty Liver Disease. Am J Respir Crit Care Med 199 (7): 830–841. https://doi.org/10.1164/rccm.201806-1109TR
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии


