Журнал эволюционной биохимии и физиологии, 2022, T. 58, № 4, стр. 311-322
фМРТ ИССЛЕДОВАНИЯ ОППОНЕНТНЫХ ВЗАИМОДЕЙСТВИЙ МЕЖДУ ОБЛАСТЯМИ ГОЛОВНОГО МОЗГА ОБЕЗЬЯН MACACA MULATTA
А. К. Хараузов 1, *, Л. Е. Иванова 1, П. П. Васильев 1, Д. Н. Подвигина 1
1 Институт физиологии им. И.П. Павлова РАН
Санкт-Петербург, Россия
* E-mail: harauzov@infran.ru
Поступила в редакцию 31.01.2022
После доработки 06.04.2022
Принята к публикации 23.05.2022
- EDN: RTATKW
- DOI: 10.31857/S0044452922040064
Аннотация
В нейрофизиологических исследованиях метод функциональной магнитно-резонансной томографии (фМРТ) наиболее часто используется при картировании функций мозга путем локализации областей с повышенной активностью во время выполнения различных тестов. При этом традиционно уделяется меньше внимания сопутствующему снижению метаболизма в других областях мозга, несмотря на сопоставимую интенсивность этих процессов. В настоящее время причина снижения активности, его динамика и зависимость локализации от условий эксперимента остаются под вопросом. Целью данной работы являлась локализация у обезьян областей мозга, вовлеченных в оппонентные отношения при стимуляции мелькающим светом.
Исследование было проведено на трех бодрствующих обезьянах Macaca mulatta, у которых сравнивали карты распределения активности, полученные во время апериодической световой стимуляции и при нахождении в полной темноте. Вспышки света вызывали увеличение потребления кислорода в первичной зрительной коре и одновременное снижение этого показателя в поле 7 теменной коры и в зоне V5 срединной височной области. Области мозга, снизившие свою активность, обычно не реагируют на стимуляцию вспышками и не задействованы в процессе обработки сигнала в наших условиях. Полученные данные трактуются исходя из гипотезы об автоматическом поддержании баланса между активированными и деактивированными областями, целью которого является экономия энергетических ресурсов мозга. Предположительно снижение активности относительно фонового уровня в незадействованных областях помогло бы компенсировать увеличение потребления энергии в других областях мозга, ответственных за обработку сигнала.
Томографические методы являются наиболее распространенным способом неинвазивной нейровизуализации для изучения нейрофизиологических основ когнитивных функций человека и животных. Первоначально изменения метаболизма мозга исследовали с помощью ПЭТ, а теперь в основном методом фМРТ. С помощью различных когнитивных тестов, выявляя области мозга, в которых повышалось потребление глюкозы или кислорода во время выполнения задачи, исследователи описали множество так называемых крупномасштабных нейронных сетей в головном мозге человека, отвечающих за принятие решений, переключение внимания, функции памяти, речи, кодирования сенсорной информации и многие другие. Однако, наряду с повышением активности в областях мозга, участвующих в выполнении задачи, нередко наблюдали снижение активности в некоторых других областях мозга. Наиболее яркий пример таких оппонентных взаимодействий представляет так называемая дефолтная система мозга (Default Mode Network, DMN), активность которой максимальна, когда человек не выполняет никаких задач, и снижается по мере увеличения когнитивной нагрузки [1].
Обычно снижению активности уделяют меньше внимания, концентрируясь, в основном, на локализации областей мозга, увеличивающих свою активность в процессе выполнения тех или иных задач. Возможно, именно поэтому данные о распределении деактивированных областей в мозге человека и животных относительно редки (за исключением исследований дефолтной системы). Зависимость их локализации от экспериментальных условий отличается многообразием и в настоящее время не поддается систематизации. Так, согласно данным, полученным на человеке, активация зрительных областей мозга в ответ на стимуляцию шахматным паттерном сопровождается снижением активности не только в дефолтной системе, но и в областях первичной слуховой коры [2]. Звуковая стимуляция, наряду с активацией слуховой коры, приводила к снижению активности в экстрастриарной области зрительной коры [3]. Однако при стимуляции всего поля зрения человека мелькающим светом активация первичной зрительной коры сопровождалась снижением активности в экстрастиарных областях мозга и в затылочной части фузиформной извилины [4, 5]. А предъявление зрительных паттернов раздельно в левое или правое поле зрения человека приводило преимущественно к увеличению активности в зрительной коре контралатерального полушария и одновременно к снижению BOLD-сигнала в ипсилатеральном полушарии [6, 7].
В наших ранних фМРТ исследованиях на человеке [8], во время выполнения испытуемыми зрительных когнитивных тестов, мы наблюдали снижение активности в дефолтной системе и в первичной слуховой коре. Причем усложнение задачи приводило к пропорциональному увеличению общего объема активированных и деактивированных областей мозга, безотносительно их локализации. Было выдвинуто предположение, что получаемые результаты отражают общий принцип работы мозга, направленный на поддержание баланса нейронной активности с целью экономии его энергетических ресурсов, что подчеркивает важность процессов деактивации для функционирования мозга как единого целого.
Таким образом, исходя из имеющихся литературных данных, следует, что во время сенсорной стимуляции или целенаправленной деятельности снижение активности наблюдается в областях мозга, менее задействованных в выполнении задачи. Однако снижение активности происходит выборочно и далеко не во всех незадействованных функциональных системах, по неизвестным пока правилам. Поэтому, для понимания общих принципов функционирования мозга, необходимо продолжать накопление данных о распределении негативного BOLD ответа в зависимости от условий стимуляции, как у человека, так и у животных.
Однако исходя из того, что метод фМРТ лишь косвенно отражает изменение нейронной активности за счет изменения уровня потребления кислорода тканями мозга, снижение BOLD-сигнала (основного показателя фМРТ, отражающего уровень оксигенации крови) может быть объяснено как снижением нейронной активности [9], так и снижением кровотока [10]. Поэтому взаимосвязь между изменениями BOLD-сигнала и лежащими в их основе метаболическими процессами и нейронной активностью все еще обсуждается [6]. Подтвердить нейронную природу снижения BOLD-сигнала помогла бы непосредственная регистрация электрической активности в областях мозга, демонстрирующих оппонентные взаимодействия. Такую возможность дают исследования на обезьянах, как наиболее близких к человеку подопытных животных по морфофункциональным особенностям мозга, у которых были описаны оппонентные взаимодействия, подобные тем, что были обнаружены у человека [11, 12]. Однако работы, сочетающие томографические методы с инвазивной электрофизиологией, еще крайне малочисленны.
Даная работа – первый этап исследования, направленного на изучение нейрофизиологических принципов оппонентных взаимодействий в мозге человека и животных. Целью экспериментов являлась локализация у обезьян областей мозга, вовлеченных в оппонентные отношения. Большинство имеющейся литературы, посвященной данному вопросу, описывает оппонентные взаимодействия в мозге обезьян во время выполнения ими различных когнитивных тестов, предполагающих активное привлечение внимания к задаче. При сравнении карт распределения активности во время выполнения задачи с периодами покоя (бездействия) в таких тестах, в основном, фиксировали снижение потребления кислорода в областях, аналогичных дефолтной системе человека [12]. Однако какие области мозга у обезьян снижают свою активность при пассивном наблюдении самых простых зрительных стимулов – вспышек света – без привлечения внимания и без всякого задания, до сих пор неизвестно. Мы постарались восполнить этот пробел и изучили влияние апериодической стимуляции мелькающим светом на перераспределение уровня потребления кислорода тканями мозга у обезьян.
Проведение фМРТ экспериментов на животных сопряжено с рядом сложностей. Основная проблема – необходимость исключить даже минимальные движения головой во время эксперимента, иначе сигнал будет искажен. Самый простой способ обездвиживания – это наркоз, но при этом мозг работает в другом режиме, и результаты зависят от степени наркотизации, так как наркоз, либо патологическое нарушение сознания, приводит к изменению паттерна функциональных связей и у человека [13], и у обезьяны [14]. Самый распространенный способ фиксации бодрствующего животного на сегодняшний день – закрепление на черепе животного специальных удерживающих устройств. Однако этот способ требует хирургического вмешательства и травматичен для животного. Другой способ – создание шлема, препятствующего движениям головы. Так, Srihasam и соавт. [15] сконструировали шлем, который плотно прилегал к голове животного за счет вакуума, создаваемого промышленным насосом. Slater и соавт. [16] создали маску на основе индивидуальных особенностей формы черепа обезьян, но она была изготовлена из жесткого пластика, что почти наверняка причиняло неудобство подопытным животным. Мы пошли по пути создания индивидуальных масок на голову обезьян из силиконов различной твердости. Маски, созданные на основе данных компьютерной томографии (КТ) головы, надежно и безболезненно фиксировали животное на время эксперимента. Методика фиксации и подготовка животных к проведению фМРТ экспериментов будут подробно описаны в данной статье.
МЕТОДЫ ИССЛЕДОВАНИЯ
Эксперименты были проведены на трех самцах макак-резусов (ЦКП Биоколлекция ИФ РАН), массой 8–9 кг. Двое самцов (Юнт и Лев) на момент исследования были в возрасте восьми лет, и один самец по имени Эдуард был в возрасте 15 лет. Все животные были рождены и выращены в неволе и имели опыт участия в поведенческих экспериментах. Все процедуры, выполненные в исследованиях с участием животных, соответствовали этическим стандартам, утвержденным правовыми актами РФ, принципам Базельской декларации и рекомендациям биоэтического комитета Института физиологии им. И.П. Павлова РАН (протокол № 10/02 от 10 февраля 2022 г.).
Для фиксации головы животных нами была разработана специальная маска, состоящая из двух частей (внешней и внутренней), которую изготавливали из силиконов различной плотности. Как внутренняя, так и внешняя части маски состояли из лицевой и затылочной части. Внутреннюю маску создавали индивидуально для каждого животного из мягкого силикона таким образом, чтобы она целиком повторяла особенности формы его головы. Для этого, на основе данных КТ, формировали трехмерную виртуальную модель головы каждой обезьяны. После проведения необходимых программных манипуляций с моделью (повернуть голову, закрыть рот, удалить посторонние предметы и т.п.) ее распечатывали на 3D принтере (рис. 1a). На основе распечатанной модели из мягкого силикона отливали внутреннюю маску с отверстиями для глаз, носа и рта (рис. 1b). Таким образом, достигалось плотное и относительно комфортное примыкание маски к голове животного с учетом всех индивидуальных особенностей ее формы.
Рис. 1.
Этапы подготовки к фМРТ эксперименту на бодрствующих обезьянах. (a) – распечатанная на 3D принтере модель головы обезьяны. (b) – отлитая на основе модели лицевая часть внутренней маски из мягкого силикона. (c) – лицевая часть универсальной наружной маски с отверстиями для световодов, фиксирующий тело костюм и амагнитный контейнер с ремнями. (d) – крепление световодов перед глазами животного внутри МРТ катушки. (e) – зафиксированное животное перед проведением фМРТ эксперимента.

Внешняя маска была выполнена из твердого пластика. Ее форма и размер были универсальными и рассчитаны на основе КТ пяти животных таким образом, чтобы в будущем ее можно было использовать для экспериментов на разных обезьянах, изготавливая заново только внутреннюю маску (рис. 1c). Носовая часть внешней маски сконструирована так, чтобы к ней герметично крепилась штатная накладка для подачи газового наркоза (в случае необходимости). На уровне глаз во внешней маске предусмотрены отверстия для крепления световодов. К каждому глазу подводится по одному раздельному световоду, длиной пять метров (рис. 1d). Световоды упирались в рассеивающие свет заглушки из матового оргстекла, установленные непосредственно перед глазами животного. Таким образом, достигалась диффузная засветка всего поля зрения равномерным белым светом. Вторые концы световодов были выведены за пределы помещения, где находится томограф, и закреплены в специально разработанном нами устройстве для предъявления светодиодных вспышек с заданными временными характеристиками. Маска и система крепления световодов были сконструированы таким образом, что в отсутствие стимуляции глаза обезьяны находились в полной темноте.
Во время эксперимента животное располагали в томографе лежащим на спине. Для фиксации тела был сконструирован контейнер из оргстекла с множеством ремней (рис. 1c,e). В днище ящика были предусмотрены полозья под размер отверстий в столе томографа для стабилизации всей конструкции, которая полностью состояла из амагнитных материалов, чтобы она была совместима с томографом. В том числе, все крепления были сделаны на основе пластиковых винтов. Затылочная часть внешней маски была прочно закреплена к днищу контейнера, в нее помещали затылочную часть внутренней маски, укладывали животное, надевали лицевую часть внутренней маски и затем фиксировали всю конструкцию с помощью лицевой части внешней маски, прикручивая ее винтами к затылочной части (рис. 1c). Таким образом, достигалось надежное и безболезненное обездвиживание головы обезьяны.
Перед помещением в контейнер обезьяне вводили короткодействующий наркоз (золетил, 5 мкг/кг), надевали специально сшитый костюм из прочного материала, ограничивающий движения конечностей (рис. 1c,e). После завершения фиксации тела и головы животного, дожидались, когда оно полностью отойдет от наркоза (1.5–2 ч), и приступали к проведению экспериментов.
Поскольку вынужденное обездвиживание способно вызвать стресс у животных, что может сказаться на регистрируемом сигнале, перед проведением фМРТ исследования с каждой обезьяной проводили по четыре-пять тренировок, имитирующих эксперимент. Макакам вводили короткодействующий наркоз, помещали в фиксирующий пенал, закрепляли маску и дожидались, когда животное проснется. Затем подавали через динамики звуки, имитирующие работающий МРТ сканер, и через световоды предъявляли вспышки света. Каждая тренировка длилась 2–2.5 ч, в течение этого времени, в качестве косвенного показателя уровня стресса, регистрировали частоту сердечных сокращений (ЧСС) с помощью ЭКГ-датчиков. После тренировки у животных брали кровь на анализ содержания гормона кортизола, принимающего участие в развитии стрессовых реакций.
Тренировки проводили один раз в неделю, чтобы дать животным время на реабилитацию. На рис. 2 представлены значения ЧСС и концентрации кортизола у трех обезьян в разные дни тренировок и во время проведения фМРТ эксперимента.
Рис. 2.
Частота сердечных сокращений и концентрация кортизола в крови обезьян во время тренировок по имитации условий фМРТ эксперимента и во время проведения фМРТ эксперимента. Синяя горизонтальная линия – значение ЧСС у обезьян макак-резусов в покое. Красная горизонтальная линия – верхняя граница нормы содержания кортизола у обезьян данного вида в покое (норма 500–800 нмоль/л по [18]).
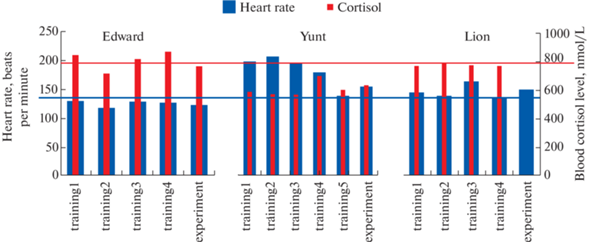
Синяя горизонтальная линия на рисунке отображает значение ЧСС у обезьян макак-резусов в покое, составляющее в среднем 135 ударов в минуту [17]. Видно, что только у Юнта этот показатель вначале превышает норму. Однако к пятой тренировке его ЧСС снижается до значений, близких к норме, что предполагает постепенное привыкание животного к стесненным условиям. У остальных двух обезьян ЧСС не изменялась по мере обучения и в среднем не превышала средних значений в покое.
Красной горизонтальной линией на рисунке отмечена верхняя граница нормы содержания кортизола у обезьян данного вида в покое (норма 500–800 нмоль/л по [18]). У всех трех животных концентрация кортизола не снижалась по мере обучения и в целом не превышала границы нормы (за исключением небольшого превышения у Эдуарда в некоторые дни тренировок).
Взятые вместе показатели ЧСС и уровня кортизола, при сопоставлении их с контрольными данными из литературы [17, 18], предполагают, что обезьяны не подвергаются сильному стрессу во время иммобилизации. Тем не менее, тренируя их заранее, мы минимизируем эффекты новизны или испуга, которые могли бы повлиять на результат фМРТ исследования.
Изменения уровня оксигенации крови (BOLD-сигнала) в ответ на стимуляцию вспышками света регистрировали в томографе Philips Achieva мощностью 1.5 Тесла. Регистрацию осуществляли со следующими параметрами: импульсная последовательность FE_EPI (16 срезов через каждые 4 мм), FS 1.5, TR 3000, TE 50. Первые 30 с обезьяна лежала в полной темноте, затем, в последующие 30 с, осуществляли стимуляцию мелькающим светом с помощью световодов, подходящих к глазам животного, после чего опять наступала темнота. Такой цикл темнота–мелькания повторяли 13 раз для повышения достоверности результатов, что составляло по времени 13 мин. Во время световой стимуляции длительность каждой вспышки составляла 10 мс, время между вспышками варьировало от 100 до 500 мс. Таким образом, достигалась переменная частота мельканий для того, чтобы не происходило навязывание ритмов. Яркость каждой вспышки составляла 250 кд/м2, этого было достаточно, чтобы вызвать ощущения мельканий даже сквозь веки, при закрытых глазах.
Препроцессинговая обработка данных включала стандартные процедуры сглаживания, удаления артефактов, преобразование данных в MNI-пространство и совмещение данных с шаблоном, основанном на результатах более 100 структурных МРТ макак [19]. Статистические карты распределения активности в мозге обезьяны оценивали с помощью стандартного метода GLM (General Linear Model), сравнивая BOLD-сигнал, накопленный за все периоды темноты (фаза покоя) и за все периоды с мелькающим светом (фаза активации). При описании индивидуальных карт активации использовали порог p < 0.001, а при описании групповых результатов использовали порог p < 0.01 без поправки на множественные сравнения. Обработку проводили в программах SPM12, DPABI_2.3, работающих в среде Matlab. Для визуализации полученных результатов использовали программный пакет Хjview.
РЕЗУЛЬТАТЫ исследования
Всего на трех обезьянах было проведено пять однотипных экспериментов, в которых регистрировали изменения потребления кислорода тканями мозга, вызываемые вспышками света. С двумя обезьянами, Юнтом и Львом, эксперимент повторили дважды для повышения достоверности данных. На рис. 3 показан пример реакции мозга на мелькания света, зарегистрированной у обезьяны Юнт. В верхней части рис. 3 красным цветом отмечены области мозга в затылочной коре, увеличившие потребление кислорода во время стимуляции. Одновременно с этим наблюдали снижение активности в теменных областях мозга (отмечено синим цветом на рис. 3). На нижней части рисунка представлено изменение во времени BOLD-сигнала, косвенно отражающего активность этих областей мозга по уровню оксигенации крови. Как видно из рисунка, во время стимуляции вспышками света наблюдается устойчивое, но разнонаправленное изменение активности – активация в затылочной коре сопровождается деактивацией в теменной коре, и наоборот – во время фазы покоя, в темноте, потребление кислорода в затылочной коре снижается, а в теменной коре повышается. Таким образом, нами были локализованы области мозга, находящиеся в оппонентных отношениях во время пассивного восприятия мелькающего диффузного света.
Рис. 3.
Пример разнонаправленного изменения активности в теменной и затылочной коре во время стимуляции вспышками света, зарегистрированного у обезьяны Юнт. (a) – распределение активности на анатомических срезах мозга. Красный цвет – увеличение потребления кислорода во время световой стимуляции; синий цвет – снижение потребления кислорода. (b) – красная и синяя линии – изменение BOLD-сигнала, отражающего активность мозга, в областях, отмеченных красным и синим цветом на верхнем рисунке. Черная линия отображает моменты включения и выключения световой стимуляции.

В целях выявления достоверных реакций на вспышки, характерных для всех трех животных, были усреднены статистические карты распределения активности, полученные в пяти экспериментах на трех макаках. Для этого индивидуальные данные, полученные на каждом животном, были совмещены с универсальным анатомическим шаблоном, основанным на данных МРТ множества макак. Для усреднения использовалась модель со случайными эффектами из пакета SPM (one-sample t-test). При усреднении результатов применили дополнительный метод шумоподавления – кластеризацию, – при котором однонаправленные изменения BOLD-сигнала в соседних вокселах объединяли в единый кластер. В наших экспериментах размер одного воксела (элемента объемного изображения мозга) составлял 2 × 2 × 2 мм. За порог кластеризации мы приняли 80 вокселей. Изменения BOLD-сигнала в меньших по объему областях мозга нами не рассматривались.
На рис. 4 представлены усредненные результаты пяти фМРТ экспериментов, полученные на трех макаках. Красным цветом отмечены области мозга, достоверно увеличивающие потребление кислорода во время световой стимуляции относительно фазы покоя, когда животные находились в полной темноте. Синим цветом отмечены области мозга, в которых потребление кислорода, наоборот, снижалось в ответ на вспышки света (двусторонний t-тест, p < 0.01).
Рис. 4.
Статистические карты распределения активности во время световой стимуляции, полученные на основе пяти фМРТ экспериментов на трех макаках (p < 0.01). Цифры под каждым срезом – расстояние в мм относительно нулевой стереотаксической координаты (см. пояснения в тексте).

Увеличение активности в ответ на вспышки наблюдали в затылочной области, симметрично в обоих полушариях. В стереотаксических координатах, где за центральную точку принимают пересечение срединно-сагиттальной плоскости и интерауральной линии (точка соприкосновения ушных держателей стереотакса), максимальную активацию наблюдали в координатах X, Y, Z: ±6, –17, +26 мм. Другими словами, максимум находился на 6 мм левее и правее нулевой координаты, симметрично в обоих полушариях, на 17 мм позади, и на 26 мм выше нулевой координаты. Согласно электронному атласу мозга макаки-резус [20], основанному на данных Paxinos и соавт. [21], увеличение BOLD-сигнала в ответ на вспышки света наблюдали в первичной зрительной коре (зона V1).
Снижение потребления кислорода во время световой стимуляции наблюдали в различных областях теменной коры, преимущественно симметрично в правом и левом полушарии. Максимальное снижение активности регистрировали в задней части теменной коры, в районе интрапариетальной борозды, в зоне 7 по Бродманну. Согласно электронному атласу мозга [20], это задняя часть латеральной интрапариетальной области (LIP) с частичным захватом дорзальной париетальной зоны с координатами X, Y, Z: ±6, –8, 32 мм. По соседству деактивацию наблюдали в задней теменной области (PPt) с частичным захватом срединной височной области (экстрастриарная зона V5) с координатами X, Y, Z: ±12, –6, 34.
Следует отметить, что активированные и деактивированные области в затылочной и теменной коре не граничили друг с другом – кратчайшее расстояние между ними, измеренное по прямой с помощью программы анализа томографических данных Инобитек, составило 10 мм. Таким образом, анализ изменений BOLD-сигнала во времени и соотнесение локализованных нами областей с данными известных атласов мозга макак-резусов позволяют утверждать, что процессы активации и деактивации в ответ на вспышки света происходят одновременно в различных морфофункциональных отделах мозга.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Для проведения фМРТ экспериментов на бодрствующих обезьянах нами была разработана оригинальная система крепления головы и тела, позволяющая проводить исследования без хирургических вмешательств. Использование индивидуальных данных о форме головы на основе КТ и сочетание силиконов различной твердости при изготовлении маски обеспечили надежную и безболезненную фиксацию головы животного. Косвенные показатели уровня стресса, такие как уровень кортизола и ЧСС, измеренные у обезьян во время имитации фМРТ эксперимента, в целом незначительно превышали нормативные показатели в покое, приближаясь к ним к концу тренировок. Это позволяет утверждать, что используемый нами метод фиксации не причиняет существенного дискомфорта обезьянам. Однако мы считаем, что предварительные тренировки необходимы, так как они позволяют животным адаптироваться к стесненным условиям, привыкнуть к шуму томографа и, таким образом, минимизировать эффекты новизны, которые могли бы повлиять на результат фМРТ исследования.
В результате экспериментов, на основе анализа изменений уровня оксигенации крови в ответ на стимуляцию всего поля зрения мелькающим светом, было зафиксировано увеличение BOLD-сигнала в первичной зрительной коре (зона V1) и одновременное его снижение в теменной коре (зона 7 по Бродманну) и в экстрастриарной коре (зона V5). Активация первичной зрительной коры была предсказуема, так как равномерное освещение всего поля зрения является простейшим стимулом, который не требует вовлечения более высоких зрительных областей мозга, осуществляющих более сложную обработку сигнала, такую как восприятие формы, движения, объединение фрагментов паттерна в единое целое и другие процессы, связанные с распознаванием изображений.
Согласно Подвигину и соавт. [22], нейроны зоны 7 теменной коры, где мы наблюдали снижение BOLD-сигнала, могут отвечать на зрительную стимуляцию, но чаще всего это происходит при активном участии животного в эксперименте, при котором необходима координация зрительных, соматосенсорных и двигательных функций. В частности, латеральная интрапариетальная область, где мы наблюдали максимальное снижение потребления кислорода во время световой стимуляции, играет ключевую роль в управлении глазодвигательным аппаратом при зрительном поиске и локализации объектов в поле зрения [23, 24]. Экстрастриарная зона V5, где мы также наблюдали снижение BOLD-сигнала, преимущественно отвечает за восприятие когерентного движения и сложных зрительных паттернов [25].
Прежде чем обсуждать причину снижения BOLD-сигнала в ответ на вспышки, необходимо прояснить его природу. На данный момент существуют две альтернативные гипотезы, объясняющие этот феномен. Согласно сосудистой гипотезе [10], количество оксигенированной крови, доступной в каждый момент времени, ограничено, поэтому она поступает пропорционально потребностям мозговой ткани. Как следствие, во время выполнения задачи кислород, который обслуживает активированные области, будет отобран из незадействованных соседних областей. Согласно нейронной гипотезе, в основе снижения BOLD-сигнала лежит снижение нейронной активности в данной области [9], при этом не исключается и сосудистый вклад в снижение BOLD-сигнала. В настоящее время, несмотря на растущее число исследований, в которых сообщается о снижении BOLD-сигнала, его происхождение и связь с метаболическими и нейронными реакциями все еще обсуждаются, а его механизмы менее понятны по сравнению с механизмами увеличения BOLD-сигнала [6, 26]. В англоязычной литературе этот феномен до сих пор называют негативным BOLD-ответом (negative BOLD-response, NBR), без привязки к его природе.
Однако со временем появляется все больше свидетельств в пользу нейронной гипотезы происхождения негативного BOLD-ответа, где наиболее убедительные данные основаны на результатах инвазивных экспериментов на обезьянах. Так, снижение нейронной активности было зарегистрировано в областях мозга макаки, в которых ранее наблюдали негативный BOLD-ответ [11]. Данное исследование проводили на животных под наркозом, а изменения нейронной активности и BOLD-сигнала регистрировали в ответ на стимуляцию центра и периферии поля зрения кольцевым шахматным паттерном. Hayden и соавт. снижение нейронной активности регистрировали у бодрствующих макак в задней цингулярной извилине, основном компоненте дефолтной системы мозга, во время решения обезьяной когнитивной задачи [27]. Авторы не проводили собственных фМРТ исследований, направленных на локализацию негативного BOLD-ответа, они основывались на литературных данных о снижении BOLD-сигнала в дефолтной сети мозга во время увеличения когнитивной нагрузки. Логическим продолжением этой работы является исследование [28], в котором с помощью электрода, помещенного в заднюю цингулярную извилину макаки (дефолтная сеть), регистрировали как нейронную активность, так и локальную концентрацию кислорода в тканях, тесно связанную с BOLD-сигналом в фМРТ. В результате, в ответ на предъявление изображений живой природы, в задней цингулярной извилине регистрировали снижение как нейронной активности, так и концентрации кислорода. Таким образом, эксперименты на животных, совместно с фМРТ исследованиями на человеке, косвенно подтверждающими нейронную природу негативного BOLD-ответа [7, 9, 29], позволяют рассматривать наблюдаемое в наших экспериментах снижение BOLD-сигнала как снижение нейронной активности в локализованных областях.
Возвращаясь к обсуждению полученных нами результатов, по нашим данным, на обезьянах еще не описан негативный BOLD-ответ на стимуляцию всего поля зрения вспышками света. Однако похожие результаты были получены в аналогичных фМРТ исследованиях на человеке [4, 5]. Наряду с активацией первичной зрительной коры, авторы наблюдали снижение активности в экстрастиарных областях мозга – латеральной затылочной области (LOC) и в затылочной части фузиформной извилины. Области, активность которых снижается в ответ на вспышки, находились рядом с областями, повышающими активность, но не пересекались.
Предъявление более сложных зрительных стимулов, таких как синусоидальные решетки, шахматные паттерны и тому подобное, тоже вызывало позитивные и негативные BOLD-ответы, локализованные, как правило, в пределах зрительной коры, по соседству друг с другом [9, 11, 30]. Так, в исследованиях на человеке стимуляция кольцевым шахматным паттерном приводила к увеличению BOLD-сигнала в первичной зрительной области, в соответствии с ретинотопическим картированием ортогонально шпорной борозде. В дорсальном направлении от этой области развивался негативный BOLD-ответ, захватывающий помимо первичной зрительной коры еще зоны V2 и V3 [9]. В эксперименте на анестезированных обезьянах стимуляция таким же паттерном приводила к появлению позитивных и негативных BOLD-ответов в пределах первичной зрительной коры. Причем эти области граничили друг с другом, а их взаимное расположение изменялось в зависимости от эксцентриситета предъявляемого стимула [11].
Общим принципом распределения активированных и деактивированных областей в упомянутых работах было увеличение активности в зонах мозга, вовлеченных в обработку стимула, и снижение активности в соседних областях, функционально менее связанных с обработкой данного типа сигналов. Однако предъявление зрительных паттернов раздельно в левое или правое поле зрения человека приводило преимущественно к увеличению активности в зрительной коре контралатерального полушария и одновременно к снижению BOLD-сигнала в ипсилатеральном полушарии [6, 7]. Это говорит о существовании оппонентных взаимодействий и между удаленными друг от друга областями мозга, в разной степени вовлеченными в обработку сигнала.
В наших экспериментах этот принцип тоже соблюдается. Во время стимуляции вспышками света основная нагрузка приходилась на первичную зрительную кору, что выражалось в позитивном BOLD-ответе. При этом области с негативным BOLD-ответом, отвечающие за локализацию объектов в пространстве и интеграцию сенсорных сигналов (зона 7), либо отвечающие за восприятие движения и сложных зрительных паттернов (зона V5), оставались менее задействованными, поскольку обезьяны пассивно созерцали предъявляемые вспышки, без всякого задания. Осуществлять целенаправленный зрительный поиск они не могли, так как световая стимуляция была диффузной, перекрывающая практически все поле зрения, и взгляду попросту не на чем было фиксироваться.
Следует отметить, что разнонаправленное изменение активности в различных областях мозга, наблюдаемое с помощью фМРТ в наших и других исследованиях, вряд ли обеспечивается за счет непосредственной (моносинаптической) связи между этими областями, особенно если они существенно разнесены в пространстве. Маловероятно и параллельное, но разнонаправленное воздействие восходящих таламокортикальных проекций на корковые представительства сенсорных систем разной модальности. Хотя в литературе встречаются данные о прямых таламокортикальных зрительных проекциях на вторичную слуховую кору и таламокортикальных слуховых проекциях на вторичную зрительную кору у некоторых видов, эти входы сравнительно редки [3, 31, 32].
Вероятнее всего, оппонентные взаимодействия происходят благодаря полисинаптическим переключениям с участием третьих структур. В качестве таких релейных структур, например, при мультимодальных взаимодействиях, рассматриваются ассоциативные области коры, интегрирующие информацию от различных органов чувств [3, 33]. Причем, эти взаимодействия пластичны и зависят от жизненного опыта. Так, в томографическом исследовании на пациентах, ослепших в раннем детстве, было показано, что тактильная стимуляция при чтении таблиц Брайля активирует зрительные области коры. Однако такая же процедура, проведенная на здоровых испытуемых, задачей которых было определить наощупь структуру таблиц, наоборот, приводила к снижению активности в зрительной коре [34].
С помощью томографических методов не представляется возможным ответить на вопрос о природе разнонаправленных изменений активности. В любом случае, поскольку активация и деактивация различных областей мозга происходит в ответ на предъявление одних и тех же стимулов и практически одновременно (в секундном временном разрешении), можно говорить об их взаимодействии, хоть и опосредованном. Изучение временных задержек между активацией и деактивацией в миллисекундном временном разрешении, совместно с анализом синхронизации текущей нейронной активности в этих областях, позволило бы пролить свет на природу оппонентных взаимодействий. Такую возможность дает сочетание томографических и электрофизиологических методов, применяемых на животных в одинаковых экспериментальных парадигмах.
Какой же смысл оппонентных взаимодействий, наблюдаемых между довольно большими областями мозга, зачастую между различными функциональными системами? Большинство исследователей рассматривают распределение позитивных и негативных BOLD-ответов как отражение процесса переключения внимания. В результате оппонентных взаимодействий, когда одни области мозга, вовлеченные в обработку сигнала, активируются, а менее задействованные соседние области снижают свою активность, повышается точность обработки информации при фокусировке внимания. Однако негативный BOLD-ответ на зрительный паттерн, выявленный у обезьян под наркозом [11], сложно объяснить переключением внимания. В наших экспериментальных условиях обезьяны тоже вряд ли усиленно следили за вспышками. Во‑первых, у них не было такого задания, во-вторых, они могли бы привыкнуть к вспышкам за время тренировок и, в-третьих, среди прочих раздражителей, таких как шум томографа и вынужденная иммобилизация, вспышки явно не доминировали в привлечении внимания обезьяны.
Мы полагаем, что разнонаправленные изменения BOLD-сигнала, наблюдаемые в наших и во многих других экспериментах, отражают общий принцип поддержания баланса нейронной активности, целью которого является экономия энергетических ресурсов мозга. Давно известно, что активность нейронов (как потенциалов действия, так и синаптической передачи) – энергоемкий процесс [35]. Поэтому снижение активности относительно фонового уровня в областях мозга, незадействованных в решении какой-либо задачи, помогло бы компенсировать увеличение потребления энергии в других областях мозга, ответственных за выполнение этой задачи.
Данную гипотезу мы выдвинули ранее на основе изучения зависимости объема активированных и деактивированных областей в мозге человека от сложности задачи [8]. Испытуемые решали зрительный пространственный тест на четырех уровнях сложности. Во время работы у них активировались затылочно-височные, теменные и лобные области, ответственные за выполнение этой задачи. Одновременно наблюдали деактивацию в структурах дефолтной системы и в областях первичной слуховой коры, не занятых в выполнении данного теста. Для каждого уровня сложности отдельно рассчитали суммарный объем активированных областей по всему мозгу, и отдельно – суммарный объем всех деактивированных областей, вне зависимости от их локализации. Зависимости объема активированных и деактивированных областей от сложности задачи полностью совпали – по мере усложнения теста количество вокселей со значимым увеличением BOLD-сигнала возрастало, и точно по такому же закону возрастало количество вокселей со значимым снижением BOLD-сигнала. Другими словами, отношение количества активированных и деактивированных вокселей всегда было постоянным, что предполагает существование в мозге человека и животных механизмов, направленных на поддержание постоянства общего уровня нейронной активности.
Косвенным подтверждением этой гипотезы является исследование с помощью высокопольного томографа (7 Тесла) реакций головного мозга человека на предъявление шахматных паттернов разного контраста [2]. По мере увеличения контраста стимула амплитуда позитивного BOLD-ответа, регистрируемого в зрительной коре, постепенно увеличивалась. Аналогичным образом увеличивалась и амплитуда негативного BOLD-ответа, регистрируемого в то же время в слуховой коре. Сходство зависимостей амплитуды позитивных и негативных BOLD-реакций, регистрируемых в различных функциональных системах, подтверждает наше предположение о том, что процессы активации и деактивации в головном мозге сбалансированы.
Поскольку увеличение активности в одних областях и снижение в других происходит практически одновременно [11], можно допустить, что поддержание баланса между различными областями мозга происходит на рефлекторном уровне, вероятно, на основе выработанных в ходе эволюции алгоритмов. Мозаику распределения негативных BOLD-ответов относительно активированных областей еще предстоит понять. Почему в одних условиях стимуляции деактивируются соседние участки, принадлежащие одной функциональной системе, а в иных условиях деактивацию наблюдают в другом полушарии, или в другой функциональной системе? Почему при возрастании когнитивной нагрузки наиболее часто деактивацию наблюдают на медиальной поверхности теменной и лобной коры, в структурах дефолтной системы? Ответы на эти вопросы, а также на вопросы, связанные с динамикой оппонентных взаимосвязей, могут дать эксперименты, сочетающие томографические и электрофизиологические методы. В этом смысле исследования на обезьянах дают неоценимое преимущество, так как у этих животных с помощью фМРТ можно выявить аналогичные человеку крупномасштабные нейронные сети [12] и регистрировать электрическую активность непосредственно этих структур мозга, что мы планируем осуществить в следующих экспериментах.
ЗАКЛЮЧЕНИЕ
Цель исследований заключалась в изучении оппонентных взаимодействий в головном мозге приматов как возможного механизма поддержания энергетического баланса мозга. В результате проведенных работ нами была разработана и внедрена в практику собственная система фиксации головы и тела обезьян, необходимая для проведения томографических исследований на бодрствующих животных. Впервые показано, что при стимуляции вспышками света, одновременно с увеличением активности в первичной зрительной коре, ответственной за обработку сигнала, происходит снижение активности в определенных областях теменной и височной коры. Эти области у макак ответственны преимущественно за локализацию объектов в поле зрения, восприятие когерентного движения и сложных зрительных паттернов, т.e. были менее задействованы при восприятии вспышек света. Поскольку процессы активации и деактивации изменялись синхронно со световой стимуляцией, мы допускаем, что они взаимосвязаны, возможно, опосредованно. Нейрофизиологические принципы таких оппонентных взаимодействий – предмет дальнейших электрофизиологических исследований на обезьянах с учетом полученных томографических данных.
Список литературы
Raichle ME, MacLeod AM, Snyder AZ, Powers WJ, Gusnard DA, Shulman GL (2001) A default mode of brain function. Proc Natl Acad Sci USA 98: 676–682.
Jorge J, Figueiredo P, Gruetter R, van der Zwaag W (2018) Mapping and characterization of positive and negative BOLD responses to visual stimulation in multiple brain regions at 7T. Human brain mapping 39 (6): 2426–2441. https://doi.org/10.1002/hbm.24012
Laurienti PJ, Burdette JH, Wallace MT, Yen YF, Field AS, Stein BE (2002) Deactivation of sensory-specific cortex by cross-modal stimuli. Journal of cognitive neuroscience 14 (3): 420–429. https://doi.org/10.1162/089892902317361930
Maggioni E, Molteni E, Zucca C, Reni G, Cerutti S, Triulzi FM, Arrigoni F, Bianchi AM (2015) Investigation of negative BOLD responses in human brain through NIRS technique. A visual stimulation study. NeuroImage 108: 410–422. https://doi.org/10.1016/j.neuroimage.2014.12.074
Maggioni E, Zucca C, Reni G, Cerutti S, Triulzi FM, Bianchi AM, Arrigoni F (2016) Investigation of the electrophysiological correlates of negative BOLD response during intermittent photic stimulation: An EEG-fMRI study. Human Brain Mapping 37 (6): 2247–2262. https://doi.org/10.1002/hbm.23170
Fracasso A, Gaglianese A, Vansteensel MJ, Aarnoutse EJ, Ramsey NF, Dumoulin SO, Petridou N (2021) FMRI and intra-cranial electrocorticography recordings in the same human subjects reveals negative BOLD signal coupled with silenced neuronal activity. BraIn Structure & Function. https://doi.org/10.1007/s00429-021-02342-4
Smith AT, Williams AL, Singh KD (2004) Negative BOLD in the visual cortex: evidence against blood stealing. Human Brain Mapping 21 (4): 213–220. https://doi.org/10.1002/hbm.20017
Kharauzov AK, Vasil’ev PP, Sokolov AV, Fokin VA, Shelepin YuE (2018) Functional magnetic resonance imaging analysis of the human brain in texture recognition tasks. J Opt Technol 85: 463–467.
Shmuel A, Yacoub E, Pfeuffer J, Van de Moortele PF, Adriany G, Hu X, Ugurbil K (2002) Sustained negative BOLD, blood flow and oxygen consumption response and its coupling to the positive response in the human brain. Neuron 36 (6): 1195–1210. https://doi.org/10.1016/s0896-6273(02)01061-9
Harel N, Lee SP, Nagaoka T, Kim DS, Kim SG (2002) Origin of negative blood oxygenation level-dependent fMRI signals. J Cerebr Blood Flow And Metabolism : Official J International Society of Cerebral Blood Flow And Metabolism 22 (8): 908–917. https://doi.org/10.1097/00004647-200208000-00002
Shmuel A, Augath M, Oeltermann A, Logothetis NK (2006) Negative functional MRI response correlates with decreases in neuronal activity in monkey visual area V1. Nature Neurosci 9 (4): 569–577. https://doi.org/10.1038/nn1675
Mantini D, Gerits A, Nelissen K, Durand JB, Joly O, Simone L, Sawamura H, Wardak C, Orban GA, Buckner RL, Vanduffel W (2011) Default mode of brain function in monkeys. J Neurosci 31 (36): 12954–12962. https://doi.org/10.1523/JNEUROSCI.2318-11.2011
Demertzi A, Tagliazucchi E, Dehaene S, Deco G, Barttfeld P, Raimondo F, Martial C, Fernández-Espejo D, Rohaut B, Voss HU, Schiff ND, Owen AM, Laureys S, Naccache L, Sitt JD (2019) Human consciousness is supported by dynamic complex patterns of brain signal coordination. Science Advances 5 (2): eaat7603. https://doi.org/10.1126/sciadv.aat7603
Barttfeld P, Uhrig L, Sitt JD, Sigman M, Jarraya B, Dehaene S (2015) Signature of consciousness in the dynamics of resting-state brain activity. Proc Natl Acad Sci U S A 112 (3): 887–892. https://doi.org/10.1073/pnas.1418031112
Srihasam K, Sullivan K, Savage T, Livingstone MS (2010) Noninvasive functional MRI in alert monkeys. NeuroImage 51 (1): 267–273. https://doi.org/10.1016/j.neuroimage.2010.01.082
Slater H, Milne AE, Wilson B, Muers RS, Balezeau F, Hunter D, Thiele A, Griffiths TD, Petkov CI (2016) Individually customisable non-invasive head immobilisation system for non-human primates with an option for voluntary engagement. J Neurosci Methods 269: 46–60. https://doi.org/10.1016/j.jneumeth.2016.05.009
Ueda Y, Slabaugh TL, Walker AL, Ontiveros ES, Sosa PM, Reader R, Roberts JA, Stern JA (2019) Heart Rate and Heart Rate Variability of Rhesus Macaques (Macaca mulatta) Affected by Left Ventricular Hypertrophy. Front Veterin Sci 6:1. https://doi.org/10.3389/fvets.2019.00001
Capitanio JP, Mendoza SP, Bentson KL (2004) Personality characteristics and basal cortisol concentrations in adult male rhesus macaques (Macaca mulatta). Psychoneuroendocrinology 29 (10): 1300–1308. https://doi.org/10.1016/j.psyneuen.2004.04.001
McLaren DG, Kosmatka KJ, Oakes TR, Kroenke CD, Kohama SG, Matochik JA, Ingram DK, Johnson SC (2009) A population-average MRI-based atlas collection of the rhesus macaque. NeuroImage 45 (1): 52–59. https://doi.org/10.1016/j.neuroimage.2008.10.058
Bakker R, Tiesinga P, Kötter R (2015) The Scalable Brain Atlas: Instant Web-Based Access to Public Brain Atlases and Related Content. Neuroinformatics 13 (3): 353–366. https://doi.org/10.1007/s12021-014-9258-x
Paxinos G, Huang XF, Toga AW (2000) The rhesus monkey brain in stereotaxic coordinates. San Diego, CA. Acad Press.
Подвигин НФ, Макаров ФН, Шелепин ЮЕ (1986) Элементы структурно-функциональной организации зрительно-глазодвигательной системы. Наука Ленинград [Podvigin NF, Makarov FN, Shelepin YE (1986) Elements of the structural and functional organization of the visual-oculomotor system. Nauka. Leningrad (In Russ)].
Christopoulos VN, Kagan I, Andersen RA (2018) Lateral intraparietal area (LIP) is largely effector-specific in free-choice decisions. Sci Rep 8: 8611. https://doi.org/10.1038/s41598-018-26366-9
Niu M, Impieri D, Rapan L, Funck T, Palomero-Gallagher N, Zilles K (2020) Receptor-driven, multimodal mapping of cortical areas in the macaque monkey intraparietal sulcus. eLife 9: e55979. https://doi.org/10.7554/eLife.55979
Vanni S, Hokkanen H, Werner F, Angelucci A (2020) Anatomy and Physiology of Macaque Visual Cortical Areas V1, V2, and V5/MT: Bases for Biologically Realistic Models. Cerebral cortex (New York, N.Y. : 1991) 30 (6): 3483–3517. https://doi.org/10.1093/cercor/bhz322
Goense J, Bohraus Y, Logothetis NK (2016) fMRI at High Spatial Resolution: Implications for BOLD-Models. Front Comput Neusci 10: 66. https://doi.org/10.3389/fncom.2016.00066
Hayden BY, Smith DV, Platt ML (2009) Electrophysiological correlates of default-mode processing in macaque posterior cingulate cortex. Proc Natl Acad Sci U S A 106 (14): 5948–5953. https://doi.org/10.1073/pnas.0812035106
Bentley WJ, Li JM, Snyder AZ, Raichle ME, Snyder LH (2016) Oxygen Level and LFP in Task-Positive and Task-Negative Areas: Bridging BOLD fMRI and Electrophysiology. Cerebral cortex (New York, N.Y. : 1991) 26 (1): 346–357. https://doi.org/10.1093/cercor/bhu260
Lin P, Hasson U, Jovicich J, Robinson S (2011) A neuronal basis for task-negative responses in the human brain. Cerebral cortex (New York, N.Y. : 1991) 21 (4): 821–830. https://doi.org/10.1093/cercor/bhq151
Bressler D, Spotswood N, Whitney D (2007) Negative BOLD fMRI response in the visual cortex carries precise stimulus-specific information. PloS ONE, 2 (5): e410. https://doi.org/10.1371/journal.pone.0000410
Barth DS, Goldberg N, Brett B, Di S (1995) The spatiotemporal organization of auditory, visual, and auditory–visual evoked potentials in rat cortex. Brain Res 678: 177–190.
Dean P (1990) Sensory cortex: Visual perceptual functions. In B. Kolb & R. Tees (Eds.), The cerebral cortex of the rat (pp. 275–307). Cambridge: MIT Press.
Calvert GA, Campbell R, Brammer MJ (2000) Evidence from functional magnetic resonance imaging of crossmodal binding in the human heteromodal cortex. Current Biol : CB 10 (11): 649–657. https://doi.org/10.1016/s0960-9822(00)00513-3
Satado N, Pascual-Leone A, Grafman J, Ibanez V, Deiber M-P, Dold G, Hallett M (1996) Activation of the primary visual cortex by Braille reading in blind subjects. Nature 380: 526–528.
Attwell D, Laughlin SB (2001) An energy budget for signaling in the grey matter of the brain. Jo, Cerebral Blood Flow Metabolism 21 (10): 1133–1145. https://doi.org/10.1097/00004647-200110000-00001
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии


