Журнал эволюционной биохимии и физиологии, 2022, T. 58, № 5, стр. 380-390
ВОЗДЕЙСТВИЕ СИСТЕМНОЙ ГИПОТЕРМИИ НА РЕАКЦИИ ПИАЛЬНЫХ АРТЕРИЙ ПРИ ОСТРОЙ МАССИВНОЙ КРОВОПОТЕРЕ У НАРКОТИЗИРОВАННЫХ КРЫС ЛИНИИ WISTAR
1 Институт физиологии им. И.П. Павлова РАН
Санкт-Петербург, Россия
* E-mail: melnikovann@infran.ru
Поступила в редакцию 14.04.2022
После доработки 20.05.2022
Принята к публикации 16.06.2022
- EDN: AAUVHT
- DOI: 10.31857/S0044452922050084
Аннотация
Изучалось влияние снижения температуры тела на реакции церебральных артерий наркотизированных (уретан, 1000 мг/кг) самцов крыс линии Wistar в условиях гемодинамической стабильности и после предварительно вызванной острой массивной кровопотери. С использованием метода прижизненной микроскопии оценивали изменения диаметра пиальных артерий (исходный диаметр 10–40 мкм) в 4‑экспериментальных группах – в отсутствие и на фоне предварительно вызванной кровопотери (35% объема циркулирующей крови) при комнатной температуре 22–23°С и при постепенно развивающейся иммерсионной гипотермии в воде с температурой 12–13°С до гипотермической остановки дыхания животных.
В группах с кровопотерей остановка дыхания у крыс при комнатной температуре происходила в среднем через 3 ч при снижении температуры тела до 32.4 ± 0.5°С; при иммерсионном охлаждении – через 2.5 ч при 15.1 ± 0.8°С. В группах животных без кровопотери остановки дыхания при комнатной температуре не происходило более, чем за 3.5 ч наблюдений, однако ректальная температура снижалась до 34.4 ± 0.2°С; при иммерсионном охлаждении остановка дыхания наблюдалась через 3 ч охлаждения крысы при 13.1 ± 0.3°С.
В процессе снижения температуры тела у крыс всех экспериментальных групп происходит вазоконстрикция. В группах с кровопотерей непосредственно после забора крови уменьшение диаметра пиальных сосудов составляло 10–15% от нормы, а при последующем охлаждении в воде – более 30% от нормы. У крыс без кровопотери при охлаждении в воде сужение пиальных артерий было значительно меньше.
Проведенная экспериментальная работа показала, что системная гипотермия усугубляет микроциркуляторную дисфункцию, вызванную острой массивной кровопотерей, и можно говорить об аддитивном влиянии гипотермии и геморрагии на вазоконстрикторные реакции пиальных артерий у крыс.
Массивная кровопотеря ведет к прогрессирующему ухудшению состояния организма от регионарной гипоперфузии до тяжелой гипоксии с необратимыми повреждениями тканей и смертельным исходом. В большинстве случаев чрезмерное кровотечение сопряжено со снижением температуры тела [1, 2], причем роль гипотермии неоднозначна. Хотя самопроизвольное снижение температуры тела при травмах коррелирует с увеличением процента летальности, однако в ряде экспериментальных исследований [3, 4] было показано, что применение гипотермии является действенной стратегией сохранения тканей и улучшения выживаемости организма. В настоящее время все еще актуальным является вопрос о положительном или отрицательном влиянии снижения температуры тела на состояние церебральной микроциркуляции при массивной кровопотере.
Бесспорно, что индуцированная терапевтическая гипотермия и самопроизвольная (аксидентальная) гипотермия в условиях геморрагии – два очень разных физиологических состояния. Индуцированное гипотермическое воздействие на организм активно используется в клинической практике при операциях на сердце, для лечения пациентов с гипоксическими, ишемическими повреждениями после черепно-мозговых травм, инсультов, при неонатальной энцефалопатии и повреждениях спинного мозга [5–7]. При плановом хирургическом вмешательстве индукция гипотермии контролируемым образом может защитить ткани от ишемического поражения, снижая метаболическую потребность и потребность тканей в кислороде и ослабляя воспалительный и иммунный ответ. Напротив, пациенты с тяжелыми травмами, осложненными гипотермией, гемодинамически нестабильны. Было показано [8, 9], что снижение температуры тела ниже 35°С у пациентов с травматическими кровотечениями (политравмой) при поступлении в клинику является фактором, предрасполагающим к более тяжелым осложнениям и повышенной смертности. Политравма характеризуется звеньями патогенеза, получившими название “триада смерти”: переохлаждение, ацидоз и коагулопатия, и представляет собой сложный порочный круг, который наблюдается у пациентов с тяжелой травмой и геморрагическим шоком [6, 10, 11].
Компенсаторные механизмы, задействованные для поддержания перфузионного давления и кровотока к жизненно важным органам при острой кровопотере, обусловливают увеличение частоты сердечных сокращений и системную вазоконстрикцию [12]. Низкие температуры окружающей среды могут повлиять на способность сердечно-сосудистой системы организма адекватно реагировать на гиповолемию, в результате толерантность к геморрагии может быть усилена или ослаблена.
В значительной части экспериментальных работ с моделированием геморрагического шока показано повышение выживаемости животных при умеренной гипотермии, вероятно, за счет снижения потребности организма в кислороде [13–15]. Было показано [4], что, хотя геморрагия вызывает серьезные нарушения микроциркуляции в сублингвальной области, в ворсинках кишечника и в коре почек овец, но последующее снижение ректальной температуры до 33–34°C улучшает микроциркуляторное кровоснабжение этих областей. Другое исследование [16] выявило, что локальная гипотермия не оказывает неблагоприятного воздействия на собак во время геморрагии (–20% объема крови) и улучшает перфузию микрососудов желудка и полости рта и их оксигенацию.
Поскольку отсутствуют данные, посвященные влиянию системной гипотермии на церебральную гемодинамику при тяжелом геморрагическом шоке, была проведена данная экспериментальная работа. Целью исследования было проанализировать влияние прогрессирующей гипотермии на микрососудистое русло коры головного мозга крыс в условиях гемодинамической стабильности и при острой массивной кровопотере.
МЕТОДЫ ИССЛЕДОВАНИЯ
Эксперименты были проведены на наркотизированных (уретан, в/б, 1000 мг/кг) крысах-самцах линии Wistar массой 300–320 г. Исследование проводили на животных из биоколлекции “Коллекция лабораторных млекопитающих разной таксономической принадлежности” Института физиологии им. И.П. Павлова РАН. Все процедуры, выполненные в данном исследовании, соответствовали этическим стандартам, утвержденным правовыми актами РФ, принципам Базельской декларации и рекомендациям Комиссии по контролю над содержанием и использованием лабораторных животных при Институте физиологии им. И.П. Павлова РАН (Протокол № 05/10 от 10.05.2021 г.).
Животные подвергались следующим операционным процедурам: для исследования пиальных микрососудов мозга делали трепанационное отверстие в теменных костях размером 7 × 5 мм, в его пределах удаляли твердую мозговую оболочку. В левую бедренную артерию вставляли катетер для прямого измерения артериального давления, а в правую бедренную артерию – для отбора крови. Во время операций у крыс поддерживалась ректальная температура (Тр) 37–38°С с помощью грелки.
При проведении эксперимента животных случайным образом распределяли на 4 группы: первая (n = 7) – контрольная, в которой животные после операции находились при комнатной температуре порядка 22.5°С; вторая (n = 10) – с предварительным забором крови при комнатной температуре порядка 22.5°С; третья (n = 6) – охлаждение животных в условиях гемодинамической стабильности в воде с температурой 12–13°С, и четвертая (n = 11) – охлаждение животных с предварительно вызванной кровопотерей (особенности забора крови изложены ниже) в воде с температурой 12–13°С. После окончания экспериментов при комнатной температуре (1-я группа) животных усыпляли передозировкой раствора уретана.
Крысы 3-й и 4-й групп подвергались постепенно развивающейся иммерсионной гипотермии до гипотермической остановки дыхания. За момент остановки дыхания принимали полное отсутствие дыхательных движений в течение 1 мин. Во время охлаждения животных фиксировали в специальном станке (зубные, ушные держатели, мягкая фиксация конечностей) в неглубокой ванне так, чтобы туловище было погружено в воду, а голова находилась над водой. У животных 2-й и 4-й групп производили отбор артериальной крови из расчета 2.1 мл на 100 г веса животного или 35% от объема циркулирующей крови (ОЦК), что приравнивается к кровопотере тяжелой степени, т.е. у крысы с весом 300 г общий забор крови составлял 6.3 мл. Время забора крови составляло ~20 мин, средняя скорость забора 0.3 мл/мин, при этом до начала микроскопирования среднее артериальное давление (САД) составляло порядка 40 мм рт.ст.
Визуализацию и мониторинг микрососудистого русла пиальной оболочки коры головного мозга осуществляли с помощью установки витальной микроскопии, в состав которой входили микроскоп ЛЮМАМ К-1 (ЛОМО, Россия) с контактным темнопольным объективом и цветная видеокамера ACUMEN AiP-B84A (ACUMEN Int. Corp., Тайвань). Полученное изображение обрабатывалось на компьютере пакетом программ Pinnacle Studio. Калибровку измерений производили при помощи стандартного объект-микрометра ОШ-1 (цена деления 10 мкм).
В ходе эксперимента изучали реакции пиальных артериальных сосудов с исходным диаметром от 10 до 40 мкм, большинство артерий имели диаметр порядка 20–25 мкм. Изменения диаметра сосудов фиксировали по мере снижения температуры в ходе эксперимента с шагом 1°С до Тр животного 32°С, а затем в 3-й и 4-й группах с экспериментальным охлаждением с последующим шагом в 2°С, т.е. 30, 28, 26, 24, 22, 20, 18 и при гипотермической остановке дыхания животного. В каждой из серий эксперимента на каждом температурном отрезке делалось по 50–90 измерений на идентичных участках сосудов.
Непрерывно регистрировали частоту сердечных сокращений по ЭКГ, среднее артериальное давление (прямое измерение через катетер от бедренной артерии) и частоту дыхания (угольный датчик). С помощью АЦП Е-154 (L-Card, Россия) аналоговые сигналы оцифровывались и записывались в памяти компьютера.
При статистической обработке данных использовался пакет программ STATISTICA 6.0, достоверность различий внутри каждой группы оценивали с помощью непараметрического критерия Вилкоксона, для выявления различий между группами использовался непараметрический критерий Манна–Уитни, уровень достоверности различий р < 0.05. Все экспериментальные данные представлены как средняя ± ошибка средней (M ± SE).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Снижение объема циркулирующей крови на 35% и поддержание САД на уровне 40 мм рт.ст. в течение 20 мин и последующее нахождение животных 2-й группы в условиях комнатной температуры 22.3 ± 0.4°С приводили к остановке дыхания через 190.6 ± 18.3 мин при ректальной температуре 32.4 ± 0.5°С (табл. 1). Скорость охлаждения крыс данной группы составила 0.026 ± 0.003°С/мин.
Таблица 1.
Ректальная температура и артериальное давление у крыс на различных этапах эксперимента, M ± SE
| Эксперимен-тальные группы | Время экспе-римента, мин | Время иммер-сии живот-ного, мин | Ректальная температура, °С | Среднее артериальное давление, мм рт.ст. | ||||
|---|---|---|---|---|---|---|---|---|
| норма | окончание забора крови | окончание эксперимента | норма | окончание забора крови | окончание эксперимента | |||
| 1 (n = 7) | 222.6 ± 8.5 | 37.4 ± 0.1 | 34.4 ± 0.2# | 97.9 ± 3.9 | 71.7 ± 5.5### | |||
| 2 (n = 10) | 190.6 ± 18.3 | 37.3± 0.1 | 36.3 ± 0.1 | 32.4 ± 0.5 | 99.5 ± 5.2 | 38.9 ± 3.9 | 13.8 ± 2.8 | |
| 3 (n = 6) | 185.2 ± 2.1 | 183.3 ± 2.0 | 36.7 ± 0.1 | 13.1 ± 0.3* | 99.7 ± 2.5 | 28.3 ± 1.8*** | ||
| 4 (n = 11) | 186.6 ± 23.5 | 160.2 ± 22.1 | 37.1 ± 0.2 | 36.7 ± 0.2 | 15.1 ± 0.8 | 95.5 ± 5.6 | 38.7 ± 1.7 | 18.2 ± 1.4 |
Крыс 1-й группы без изменения ОЦК мы наблюдали более 220 мин при той же комнатной температуре, после чего эксперимент заканчивался, при этом Тр снижалась с 37.4 ± 0.1°С до 34.4 ± ± 0.2°С. Снижение Тр до 36°С происходило за 71 ± ± 8 мин, до 35°С за 138 ± 12 мин от момента регистрации исходных показателей. Общая скорость охлаждения составила 0.014 ± 0.002°С/мин, что практически в 2 раза медленнее, чем в группе с кровопотерей.
Все животные, подвергшиеся кровопотере, погибали за 3 ч эксперимента, тогда как в группе контроля все таким же образом прооперированные животные оставались живы на протяжении всего периода (более 3.5 ч) наблюдений.
В ходе эксперимента (рис. 1) у крыс 1-й группы по мере снижения Тр до 34.4 ± 0.2°С все измеряемые физиологические показатели равномерно снижались. Так, САД снизилось на 27.2% с 97.9 ± ± 3.9 мм рт.ст. до 71.3 ± 5.5 мм рт.ст. (р < 0.05), ЧСС на 22% с 426.3 ± 9.4 уд/мин до 332.6 ± 20.8 уд/мин (р < 0.05), ЧД на 12.2% с 108.0 ± 8.9 мин–1 до 94.9 ± ± 6.8 мин–1 (р < 0.05). Состояние животных на протяжении эксперимента оставалось довольно стабильным, среднее снижение ректальной температуры за 3.5 ч нахождения прооперированных животных при комнатной температуре составляло порядка 3 градусов.
Рис. 1.
Среднее артериальное давление, частота сердечных сокращений и частота дыхательных движений у крыс при нормо- и гипотермии.
Обозначения: 1 – без охлаждения; 2 – предварительный забор крови при комнатной температуре; 3 – иммерсионная гипотермия; 4 – иммерсионная гипотермия с предварительной кровопотерей.
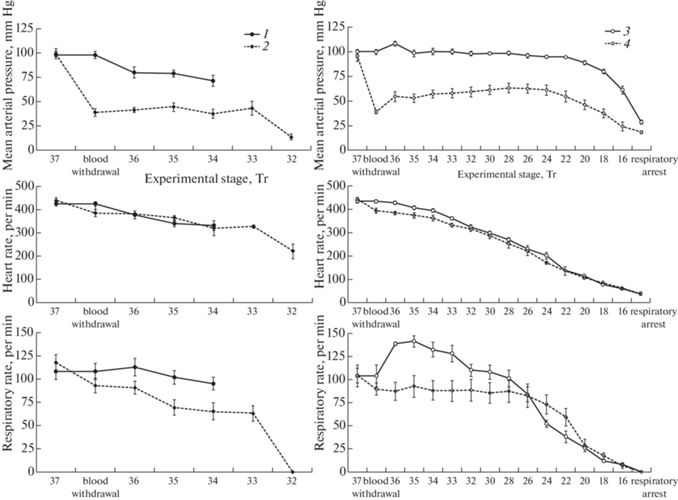
У крыс 2-й группы экспериментальная кровопотеря приводила к снижению САД до ⁓ 40 мм рт.ст., и в дальнейшем при понижении температуры до спонтанной остановки дыхания животного при Тр 32.4 ± 0.5°С САД не менялось, находясь в пределах от 37.4 ± 4.5 до 44.3 ± 4.5 мм рт.ст. (p > 0.05). Показатели как ЧСС, так и ЧД снизились после забора крови. Так, ЧСС снизилась на 12% от 439.2 ± 13.1 до 385.6 ± 15.4 уд/мин (p < 0.05), ЧД – на 21% от 117.6 ± 8.3 до 93.0 ± 7.9 мин–1 (p < 0.05). Продолжавшееся понижение температуры тела обусловливало дальнейшее уменьшение данных показателей. Остановка дыхания происходила через 190.6 ± 18.3 мин от начала эксперимента при САД 13.8 ± 2.8 мм рт.ст., ЧСС 221.2 ± 32.4 уд/мин.
Использование иммерсионной гипотермии позволило наблюдать изменения в работе сердечно-сосудистой и дыхательной систем во время быстрого охлаждения организма вплоть до гипотермической остановки дыхания. После операционного вмешательства до начала охлаждения Тр у крыс статистически не отличалась и составляла в 3-й группе 36.7 ± 0.1°С, в 4-й группе до забора крови 37.1 ± 0.2°С, после забора – 36.7 ± 0.2°С. Таким образом, охлаждение животных начиналось практически с одинаковых величин Тр. Погружение животных в воду проводило к снижению температуры тела и, в конечном итоге, к гипотермической остановке дыхания. Время охлаждения крыс 3-й группы без изменения ОЦК составляло 183 ± 2 мин, прекращение дыхательных движений регистрировалось при Тр 13.1 ± 0.3°С. В 4-й группе время охлаждения составляло 160 ± 22 мин (p > > 0.05), при этом остановка дыхания происходила при 15.1 ± 0.8°С (p < 0.05). Средняя скорость иммерсионного охлаждения животных в рассматриваемых двух группах достоверно не отличалась: в 3-й группе – 0.128 ± 0.01°С/мин, в 4-й группе с предварительным забором крови – 0.158 ± 0.017°С/мин (p > 0.05).
Охлаждение крыс во время иммерсионной гипотермии (рис. 1) сопровождалось развитием ответной реакции со стороны всех органов и систем. В начале воздействия гипотермии у крыс 3-й группы при нормоволемии наблюдалось небольшое повышение САД, при охлаждении животных ниже 34°САД оставалось довольно высоким (на уровне нормы), снижаясь лишь после 20°С. ЧД также возрастала на 35% (p < 0.001) в начале охлаждения. Затем, по достижении степени умеренной гипотермии, наблюдалось последовательное угнетение функционального состояния организма, и ЧД постепенно снижалась вплоть до остановки дыхания. При температурах в диапазоне 32–20°С ЧСС уменьшалась в 3 раза, а в момент остановки дыхания составляла 36.7 ± 1.8 уд/мин.
В результате экспериментальной кровопотери САД у крыс снижалось до 40 мм рт.ст., и этот уровень поддерживался до начала иммерсии. После начала охлаждения САД увеличивалось (до 55–63 мм рт.ст.) и находилось на таком плато, снижаясь лишь при состоянии глубокой гипотермии. На протяжении всего охлаждения у животных 4-й группы наблюдались брадикардия и постепенное замедление ЧД до гипотермической остановки дыхания.
На рис. 2 показано изменение диаметра пиальных артерий на различных этапах эксперимента. За 100% принимали диаметр пиальных артерий в начале периода наблюдений. Изменение диаметра сосудов у контрольных крыс (1-я группа) было незначительно. При Тр 36°С диаметр уменьшился на 4.2% (p > 0.05), при Тр 35°С – на 3.6% (p > 0.05) от исходного. В конце опыта при Тр 34.4°С диаметр был близок к исходному и составлял 98.9 ± 3.0% (p > 0.05). Кровопотеря 35% от ОЦК у крыс 2-й группы приводила к сужению пиальных артерий на 10.1% (p < 0.001). Однако при дальнейшем нахождении на воздухе и спонтанном охлаждении животного диаметр сосудов изменялся статистически незначимо, вероятно, за счет разнонаправленных изменений диаметра сосудов: сужение показано лишь для 50–60% от общего количества измерений в данной серии в диапазоне температур от 36 до 33°С, расширение – для 21–40%, часть сосудов диаметра не меняла. К моменту остановки дыхания при Тр 32.4°С происходит наиболее значимая вазоконстрикция до уровня 85.9 ± 2.9% (p < 0.001) относительно исходной величины.
Рис. 2.
Динамика изменений диаметров пиальных артерий крыс по отношению к исходному состоянию при соответствующих воздействиях в различных экспериментальных группах.
Обозначения: 1 – без охлаждения; 2 – предварительный забор крови при комнатной температуре; 3 – иммерсионная гипотермия; 4 – иммерсионная гипотермия с предварительной кровопотерей.
* – различия между 1-й и 2-й группой статистически значимы при p < 0.05 (U-критерий Манна–Уитни); ** – различия между 3-й и 4-й группой статистически значимы при p < 0.01; *** – различия между 3-й и 4-й группой статистически значимы при p < 0.001 (U-критерий Манна–Уитни).
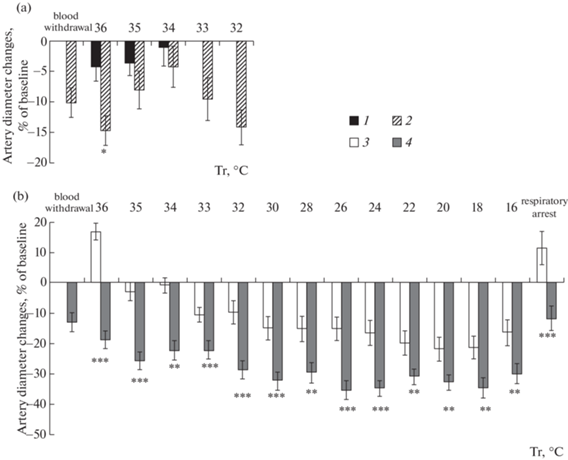
На протяжении всего периода охлаждения животных в воде мы наблюдали (рис. 2, b) статистически значимые различия (p < 0.001) в изменении диаметра пиальных сосудов у крыс с кровопотерей (4-я группа) и без нее (3-я группа). В обеих группах от начала погружения животного в воду до достижения Тр отметки в 36°С проходило порядка 4–5 мин. За это время диаметр сосудов в 3-й группе существенно увеличивался (на 16.5 ± 4.8%, p < < 0.001), тогда как в 4-й группе после забора крови наблюдалась вазоконстрикция. Диаметр артерий в 4-й группе после забора крови составил 86.9 ± 3.1% от нормы, а после начала охлаждения – 81.0 ± 2.8%.
Было обнаружено, что в 3-й группе после первоначальной вазодилатации наблюдалась последующая вазоконстрикция уже при температуре 35°С. На участке снижения температуры от 30 до 20°С диаметр сосудов достоверно не изменялся и составлял от 80 до 85% от нормы. В том же интервале температур в группе с предварительной кровопотерей диаметр артериол составлял от 71 до 65% от нормы. Остановка дыхания характеризуется расширением сосудов, практически сопоставимым с состоянием сосудов в начале охлаждения как для 3-й, так и для 4-й группы.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
При кровопотере из кровеносного русла по причине различного рода повреждений происходит утрата значительного количества крови, в результате которой развивается сложный комплекс приспособительных и патологических реакций организма. Показано, что биологический ответ на кровотечение в условиях нормотермии представляет собой сочетание сердечно-сосудистой компенсации и активации механизмов апоптоза клеток в жизненно важных органах, особенно в головном мозге [1, 7, 17]. Значительная кровопотеря снижает доставку кислорода, в то время как его поглощение остается довольно постоянным. В целом гипоксический стимул ведет к истощению запасов внутриклеточного АТФ (аденозинтрифосфата), что приводит к клеточной дисфункции и органной декомпенсации. Нарушения в системе микроциркуляции при стрессорном воздействии сопровождаются сужением сосудов за счет значительного повышения уровня катехоламинов в крови [18]. Тем не менее вопросы патогенетического влияния стресса на сердечно-сосудистую систему до конца не изучены.
В данной работе моделировалась острая массивная кровопотеря (~35% ОЦК) на мелких лабораторных животных – крысах линии Wistar, которая приводила к гипоксии, носящей как циркуляторный, так и гемический (анемический) характер. У всех групп животных были проведены анестезия и хирургическое вмешательство по поводу катетеризации бедренной артерии и трепанации черепа. Основной экспериментальной группой была 4-я группа животных с предварительным забором крови и последующим гипотермическим воздействием. Три другие группы, по сути, являлись контрольными: 1-я группа – нормотермия, 2-я – геморрагия при нормотермии, 3-я – гипотермия. В ходе исследования показано снижение температуры у всех групп животных. Закономерно значительное снижение Тр у крыс 3-й и 4-й групп вследствие гипотермического иммерсионного воздействия, но достоверное понижение температуры наблюдалось и у животных 1-й и 2-й групп. Если в 1-й контрольной группе более чем за 3 ч наблюдений Тр достигала 34.4 ± 0.2°С, то при геморрагии (2-я группа) за сопоставимое время Тр снижалась до 32.4 ± 0.5°С, и происходила остановка дыхания. Вероятно, при данном уровне кровопотери компенсаторные реакции оказались недостаточными, а вызванные ею метаболические, биохимические и энзиматические нарушения [19] привели к развитию полиорганной недостаточности и без восполнения утраченного ОЦК инфузионными растворами – к летальному исходу.
При сравнении температуры тела при остановке дыхания у групп животных с иммерсией было установлено, что воздействие геморрагии повышает температурный порог прекращения дыхания. Так, в 3-й группе остановка дыхания происходила при Тр 13.1 ± 0.3°С, а в 4-й группе – при Тр 15.1 ± 0.8°С (p < 0.05). Температурный порог прекращения дыхания у крыс – величина довольно стабильная. Остановка дыхания у половозрелых крыс наступает при Тр в диапазоне 12–19°С [20], а самопроизвольное восстановление дыхания в условиях глубокой гипотермии возможно лишь в случае извлечения животного из воды и его разогрева.
Важность коррекции температуры тела и поддержания нормотермии подчеркивается в современном протоколе лечения пациентов с политравмой [2, 21]. Однако большинство экспериментальных исследований [3, 10, 22] показали пользу терапевтической гипотермии при геморрагическом шоке. Доказано, что умеренная гипотермия при температуре 33°C ухудшает коагуляцию, но, тем не менее, продлевает выживаемость крыс после геморрагического шока и реанимации. Гипотермия снижает последствия вторичного повреждения головного мозга за счет ряда механизмов, в том числе снижения эксайтотоксичности, окислительного стресса, апоптоза, аутофагии и воспаления [9, 14, 17]. В работе Wu и соавт. [22] продемонстрировано, что после охлаждения до Тр 34°С в течение 2 ч после геморрагического шока (забор крови 3 мл/100 г животного и последующее поддержание АД 40 мм рт.ст.) и последующих реанимационных мероприятий выживаемость крыс выше по сравнению с таким же охлаждением животных в течение 12 ч. Результаты нашей работы показали, что животные охлаждались до гипотермической остановки дыхания в течение одинакового времени как при кровопотере, так и без нее. Однако уровень Тр при гипотермической остановке дыхания статистически достоверно различался, у крыс с кровопотерей апноэ происходило при более высокой Тр. Следовательно, предположение об усилении толерантности к геморрагии на фоне сильного гипотермического воздействия нашими экспериментами не подтверждается.
Во время охлаждения организма в воде мы наблюдали изменения функционирования организма по клиническим проявлениям сердечно-сосудистой и респираторной систем. В зависимости от температуры тела гомойотермного организма классифицируют следующие степени гипотермии: легкая или мягкая (32–35°С), умеренная (28–32°С), тяжелая (28–20°С) и глубокая (<20°С) [7, 23, 24]. Для легкой степени гипотермии характерны терморегуляторная дрожь, тахикардия, тахипноэ, гипертензия, увеличение сердечного выброса, периферическая вазоконстрикция; для умеренной степени гипотермии – брадикардия, замедление дыхания, возможна мерцательная аритмия; тяжелая и глубокая степени гипотермии приводят к прогрессирующей брадикардии, асистолии, возможной фибрилляции желудочков, снижению системного давления и, в конечном итоге, к остановке дыхания.
В нашей работе у крыс 3-й группы при гипотермии легкой степени наблюдалось небольшое кратковременное повышение САД, вероятно, за счет повышения уровня метаболизма и норадреналин-опосредованной периферической вазоконстрикции [23, 25]. При снижении Тр ниже 32°С, т.е. при умеренной и тяжелой степени гипотермии, САД оставалось на уровне нормы и снижалось при достижении глубокой гипотермии. ЧД также возрастала на 35% (p < 0.001) в начале охлаждения. Это типичная реакция функции внешнего дыхания на компенсаторной стадии гипотермии – гипотермии легкой степени, которая характеризуется увеличением легочной вентиляции, частоты и глубины дыхания [25]. Затем по достижении степени умеренной гипотермии наблюдалось последовательное угнетение функционального состояния организма, и ЧД постепенно снижалась вплоть до остановки дыхания.
Сообщалось, что при охлаждении крыс до Тр 31°С ЧСС снижается незначительно, но повышаются значения стандартного отклонения и коэффициента вариации [26]. У крыс 3-й группы было зафиксировано существенное понижение ЧСС уже при температуре 32°С (на 25% от исходного, p < < 0.001), что объясняется, вероятно, выбранным быстрым режимом охлаждения. При гипотермии тяжелой степени наблюдалась прогрессирующая брадикардия, а в момент остановки дыхания ЧСС составляло 36.7 ± 1.8 уд/мин. Можно отметить, что изменения функциональных показателей, которые фиксировались нами во время охлаждения животных 3-й группы, совпадают с аналогичными результатами, изложенными в литературе.
У крыс 4-й группы в результате экспериментальной кровопотери развивалась тяжелая гипотензия. Начало иммерсии приводило к существенному подъему САД (до 55–63 мм рт.ст.). Показатель давления оставался на таком уровне на протяжении дальнейшего периода охлаждения животных, и, в отличие от гипотермических крыс 3-й группы с кратковременным подъемом САД в начале охлаждения, не снижался до этапа глубокой гипотермии. В связи с этим хотелось бы отметить тот факт, что при умеренной гипотермии показатель артериального давления может не соответствовать реальному объему циркулирующей крови.
Согласно исследованиям Nishi и соавт. [10], легкая гипотермия при геморрагическом шоке подавляла ЧСС и увеличивала АД, что не противоречит полученным нами результатам. В указанной работе предполагалось, что более низкая ЧСС при гипотермии снижает потребность миокарда в кислороде, а более высокое АД может улучшать перфузию тканей, что приводит к уменьшению метаболического ацидоза. Возможно, это обеспечивает дополнительный механизм защиты мозга при гипотермии. В нашем исследовании ЧСС в 4-й группе снижалась на протяжении всего охлаждения и статистически не отличалась по сравнению с 3-й группой, а ЧД снизилась сразу после начала охлаждения, и после достижения Тр 28°С дальнейшее уменьшение ЧД было сопоставимо с показателями в 3-й группе. Таким образом, функциональное состояние животных при гипотермии как при гемодинамической стабильности, так и при острой массивной кровопотере остается одинаково тяжелым в условиях быстрого иммерсионного охлаждения при достижении стадий умеренной и глубокой гипотермии, несмотря на значительную разницу в САД. Статистически достоверные различия между показателями ЧСС и ЧД при иммерсионном охлаждении животных прослеживаются лишь на этапе легкой гипотермии.
Практически все известные нам экспериментальные работы по изучению микроциркуляции при сочетанном воздействии переохлаждения и кровопотери были выполнены при охлаждении организма не ниже 32°С. В нашем исследовании оценивалось состояние церебральной гемодинамики при системной прогрессирующей гипотермии вплоть до стадии глубокой гипотермии.
Геморрагический шок вызывает серьезные нарушения микроциркуляции. Показано, что после ухудшения гемодинамики последующее охлаждение до Тр 33–34°С приводит к восстановлению микроциркуляторного снабжения изучаемых областей у овец [4], а при локальной гипотермии собак улучшаются перфузия и оксигенация микрососудов желудка и полости рта [16]. Gong и соавт. [11] показали, что легкая гипотермия (33°С) после экспериментальной остановки сердца улучшает церебральное микроциркуляторное кровоснабжение и снижает повышенный коэффициент экстракции кислорода головным мозгом.
В наших экспериментах кровопотеря во 2-й и 4‑й группах приводила к сужению пиальных микрососудов на 10% и 13% соответственно (рис. 2). Последующее охлаждение вызывало лишь вазоконстрикторные реакции пиальных сосудов по отношению к исходному состоянию. Тем не менее можно проследить изменение величины сужения сосудов при различных степенях гипотермического воздействия. Так, при Тр 34–33°С наблюдалось снижение вазоконстрикторной реакции, и диаметр пиальных артериол несколько увеличивался по отношению к предыдущему значению.
В контрольной гипотермической группе (3-я группа) начало охлаждения характеризовалось быстрым ответом церебральной гемодинамики: мы наблюдали вазодилатацию сразу после погружения животного в холодную воду, диаметр пиальных артерий увеличивался на 16.5 ± 4.8% от исходного (p < 0.01). Это можно рассматривать как результат быстрых компенсаторных реакций, обусловленных норадреналин-опосредованным периферическим вазоспазмом и централизацией кровотока [18, 26]. Как показано выше, такая вазодилатация сопровождалась периодом кратковременного подъема САД. Дальнейшее охлаждение крыс, соотвествующее степени легкой гипотермии, характеризуется сужением пиальных артериол на 5–10% от начального диаметра. На этапах умеренной и тяжелой гипотермии диаметр сосудов оставался на уровне 75–85% от начального. Таким образом, на протяжении всего периода охлаждения у крыс без вызванной кровопотери наблюдалась прогрессирующая вазоконстрикция.
При охлаждении крыс 4-й группы первоначальная, вызванная забором крови вазоконстрикция только усугублялась. В начале охлаждения мы не наблюдали первичного расширения сосудов, аналогичного вазодилатации в контрольной группе гипотермии. Можно проследить тенденцию уменьшения диаметра по мере охлаждения крыс: при гипотермии легкой степени вазоконстрикция составила 20–25%, а при умеренной и тяжелой – 30–35%.
На рис. 3 отображена зависимость величины изменения диаметра пиальных артериол от времени эксперимента.
Рис. 3.
Изменения диаметров пиальных артерий крыс по отношению к исходному состоянию в различных группах в зависимости от времени эксперимента.
Обозначения: 2 – предварительный забор крови при комнатной температуре; 3 – иммерсионная гипотермия; 4 – иммерсионная гипотермия с предварительной кровопотерей.
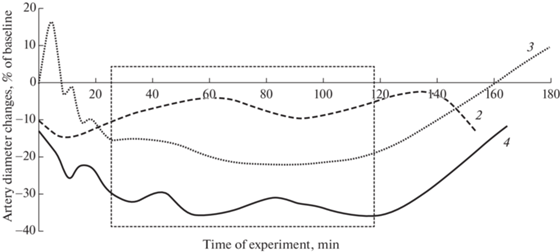
На этом рисунке наиболее интересным и информативным является интервал от 30 до 120 мин (выделен прямоугольником). Можно отметить, что изменение диаметра сосудов в 4-й группе (геморрагия + гипотермия) приблизительно равно сумме изменений диаметров артериол 2-й (геморрагия) и 3-й (гипотермия) групп. Вероятно, во время гипотермии животных с массивной кровопотерей происходит наложение причин вазоконстрикции при продолжающейся гипотермии и при кровопотере, и можно говорить об аддитивном действии гипотермии и гиповолемии.
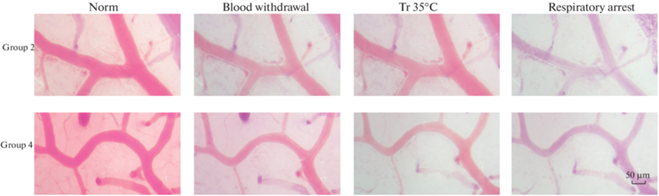
Микрофотография (рис. 4) демонстрирует состояние пиальных микрососудов крыс во 2-й (предварительный забор крови и последующее нахождение животного при комнатной температуре) и 4-й (предварительный забор крови и последующее иммерсионное охлаждение животного) группах эксперимента. В обеих группах выражена вазоконстрикция после забора крови. При спонтанном охлаждении до Тр 35°С диаметр сосудов незначительно увеличивается, однако при остановке дыхания вновь наблюдается вазоконстрикция. При иммерсии в воде вазоконстрикция усугубляется.
Рис. 4.
Реакции пиальных артериальных сосудов на кровопотерю и охлаждение.
Микрофотография пиальных сосудов крыс, подвергшихся предварительно вызванной кровопотере, на разных этапах эксперимента: до воздействия (norm), после забора крови (blood withdrawal), при Тр 35°С и при остановке дыхания животных (respiratory arrest). Верхние фотографии демонстрируют изменения у крыс 2-й группы, находящихся в условиях комнатной температуры, нижние – у крыс 4-й группы, при последующем иммерсионном охлаждении животных.
Проведенное исследование показало, что в условиях массивной кровопотери (до 35% ОЦК) при комнатной температуре 22–23°С у гомойтермного организма (крыс линии Wistar) в среднем за 3 ч происходит снижение температуры тела до Тр 32–33°С и прекращение дыхательных движений, при иммерсионном охлаждении в воде с температурой 12–13°С остановка дыхания происходит через 2.5 ч при Тр 15–16°С.
Были выявлены значительные изменения жизненно важных показателей организма, таких как ЧСС, САД и ЧД, во время иммерсионного охлаждения вплоть до полной гипотермической остановки дыхания. Предварительно вызванная геморрагия у крыс приводила к повышению температурного порога остановки дыхания. Тем не менее функциональное состояние животного при кровопотере в условиях быстрого иммерсионного охлаждения при достижении стадий умеренной и глубокой гипотермии незначительно отличалось от нормоволемического состояния организма.
В процессе снижения температуры тела у крыс всех экспериментальных групп происходит вазоконстрикция. В группах с кровопотерей непосредственно после забора крови уменьшение диаметра пиальных сосудов составляло 10–15% от нормы, а при последующем охлаждении в воде – более 30% от нормы. Вероятно, дополнительное быстрое иммерсионное охлаждение крыс, в том числе на этапе глубокой гипотермии, не препятствует нарушениям микроциркуляции, вызванным тяжелой кровопотерей.
Таким образом, полученные данные указывают, что системная гипотермия усугубляет микроциркуляторную дисфункцию, вызванную острой массивной кровопотерей, и можно говорить об аддитивном влиянии гипотермии и геморрагии на вазоконстрикторные реакции пиальных артерий у крыс.
Список литературы
Kheirbek T, Kochanek A, Alam H (2009) Hypothermia in bleeding trauma: a friend or a foe? Scandinavian J Trauma, Resuscitat Emergen Med 17: 65. https://doi.org/10.1186/1757-7241-17-65
van Veelen M, Maeder B (2021) Hypothermia in Trauma. Int J Environ Res Public Health 18 (16): 8719. https://doi.org/10.3390/ijerph18168719
Burggraf M, Lendemans S, Waack I, Teloh J, Effenberger-Neidnicht K, Jäger M, Rohrig R (2019) Slow as compared to rapid rewarming after mild hypothermia improves survival in experimental shock. J Surg Res 236: 300–310. https://doi.org/10.1016/j.jss.2018.11.057
Eguillor J, Ferrara G, Edul V, Buscetti M, Canales H, Lattanzio B, Gatti L, Gutierrez F, Dubin A (2021) Effect of systemic hypothermia on microcirculation in conditions of hemodynamic stability and in hemorrhagic shock. Shock 55 (5): 686–692https://doi.org/10.1097/SHK.0000000000001616
Jiang S, Zhao Y, Zhao X (2013) Potential role of therapeutic hypothermia in the salvage of traumatic hemorrhagic shock. Critical Care 17: 318. https://doi.org/10.1186/cc12559
Шевелев ОА, Петрова МВ, Саидов ШХ, Ходорович НА, Прадхан П (2019) Механизмы нейропротекции при церебральной гипотермии (обзор). Общ реаниматол 15 (6): 94–114. [Shevelev OA, Petrova MV, Saidov SK, Khodorovich NA, Pradkhan P (2019) Neuroprotection mechanisms in cerebral Hypothermia (review). General Reanimatol 15 (6): 94–114. (In Russ)]. https://doi.org/10.15360/1813-9779-2019-6-94-114
Gogol R, Hudziak D, Bis J, Mendrala K, Morkisz Ł, Podsiadło P, Kosiński S, Piątek J, Darocha T (2021) The role of deep hypothermia in cardiac. Int J Environ Res Public Health 18: 7061–7075https://doi.org/10.3390/ijerph18137061
Царев АВ (2017) Непреднамеренная гипотермия и объем кровопотери у пациентов с политравмой. Вестн пробл биол мед 141 (4 ч. 3): 239–242. [Tsarev AB (2017) Intraoperative hypothermia and volume of blood loss of patients with politrauma. Bull Probl Biol Med 141 (4Pt3): 239–242. (In Russ)]. https://doi.org/10.29254/2077-4214-2017-4-3-141-239-242
Rosli D, Schnuriger B, Cadinas D, Haltmeier T (2020) The impact of accidental hypothermia on mortality in trauma patients overall and patients with traumatic brain injury specifically: a systematic review and meta-analysis. World J Surg 44 (12): 4106–4117https://doi.org/10.1007/s00268-020-05750-5
Nishi K, Takasu A, Shinozaki H, Yamamoto K, Sakamoto T (2015) Hypothermia does not hasten death during uncontrolled hemorrhagic shock presenting as the “triad of death” in rats. Acute Med Surg 2 (1): 29–34https://doi.org/10.1002/ams2.60
Gong P, Zhao Sh, Wang J, Yang Z, Qian J, Wu X, Cahoon J, Tang W (2015) Mild hypothermia preserves cerebral cortex microcirculation after resuscitation in a rat model of cardiac arrest. Resuscitation 97: 109–114. https://doi.org/10.1016/j.resuscitation.2015.10.003
Crandall C, Rickards C, Johnson B (2019) Impact of environmental stressors on tolerance to hemorrhage in humans. Am J Physiol Regul Integr Comp Physiol 316: R88–R100https://doi.org/10.1152/ajpregu.00235.2018
Shinichiro I, Takasu A, Sakamoto T (2010) Therapeutic mild hypothermia: effects on coagulopathy and survival in a rat hemorrhagic shock model. J Trauma 68 (3): 669–675. https://doi.org/10.1097/TA.0b013e3181a0fbb3
George M, Mulier K, Beilman G (2010) Hypothermia is associated with improved outcomes in a porcine model of hemorrhagic shock. J Trauma 68 (3): 662–668. https://doi.org/10.1097/TA.0b013e3181d3cbc0
Takasu A, Norio H, Sakamoto T, Okada Y (2002) Mild hypothermia prolongs the survival time during uncontrolled hemorrhagic shock in rats. Resuscitation 54 (3): 303–309. https://doi.org/10.1016/s0300-9572(02)00148-x
Truse R, Smyk M, Schulz J, Herminghaus A, Weber A, Mettler-Altmann T, Bauer I, Picker O, Vollmer C (2019) Regional hypothermia improves gastric microcirculatory oxygenation during hemorrhage in dogs. PLoS One 14 (12): e0226146. https://doi.org/10.1371/journal.pone.0226146
Frink M, Flohé S, van Griensven M, Mommsen P, Hildebrand F (2012) Facts and fiction: the impact of hypothermia on molecular mechanisms following major challenge. Mediators Inflamm 2012: 762840. https://doi.org/10.1155/2012/762840
Palmiere C, Bardy D, Letovanec I, Mangin P, Augsburger M, Ventura F, Iglesias K, Werner D (2013) Biochemical markers of fatal hypothermia. Forensic Sci Int 226 (1–3): 54–61. https://doi.org/10.1016/j.forsciint.2012.12.007
Курсов СВ, Никонов ВВ, Скороплет СН (2019) Кровопотеря. Медицина неотложных состояний 96 (1): 7–21. [Kursov SV, Nikonov VV, Skoroplit SM (2019) Blood loss. Emergency Medicine 96 (1): 7–21. (In Russ)].
Melnikova N (2020) Cerbral microcirculation during respiratory arrest in deep experimental rat hypothermia. J Stress Physiol Biochem 16 (3): 126–131.
Григорьев ЕВ, Лебединский КМ, Щеголев АВ, Бобовник СВ, Буланов АЮ, Заболотских ИБ, Синьков СВ, Шень НП, Корнелюк РА (2020) Реанимация и интенсивная терапия при острой массивной кровопотере у взрослых пациентов. Анестезиол реаниматол 1: 5–24. [Grigor’ev EV, Lebedinsky KM, Schegolev AV, Bobovnik SV, Bulanov AYu, Zabolotskikh IB, Sinkov SV, Shen NP, Kornelyuk RA (2020) Resuscitation and intensive care in acute massive blood loss in adults (clinical guidelines). Russ J Anaesthesiol Reanimatol 1: 5–24. (In Russ)]. https://doi.org/10.17116/anaesthesiology20200115
Wu X, Stezoski J, Safar P, Nozari A, Tisheman S (2003) After spontaneous hypothermia during hemorrhagic shock, continuing mild hypothermia (34 degrees C) improves early but not late survival in rats. J Trauma 55 (2): 308–316https://doi.org/10.1097/01.TA.0000079366.23533.1E2
Алябьев ФВ, Парфирьева АМ, Чесалов НП, Шамарин ЮА, Осипов АИ (2008) Функционально-морфологические изменения сердца при гипотермии. Сиб мед журн 1 (1): 68–71. [Alyabyev FV, Parfiryeva AM, Chesalov NP, Shamarin YA, Osipov AI (2008) Functional-morphologic changes of the heart in hypothermia. Siberian Med J 1 (1): 68–71. (In Russ)].
Murakami T, Yoshida T, Kurokochi A, Takamatsu K, Tera-nishi Yu, Shigeta K, Tamaki K, Morita S, Mizuno R, Oya M (2019) Accidental hypothermia treated by hemodialysis in the acute phase: three case reports and a review of the literature. Intern Med 58 (18): 2743–2748. https://doi.org/10.2169/internalmedicine.1945-18
Бочаров МИ (2015) Терморегуляция организма при холодовых воздействиях. Сообщение 1 Вестник САФУ сер Мед-биол науки (1): 5–15. [Bocharov MI (2015) Thermoregulation in cold environments. Report I Vestnik NAFU ser Med-Biol sci (1): 5–15. (In Russ)].
Луценко ДГ (2008) Микрогемоциркуляция головного мозга крыс после гипотермического воздействия. Пробл криобиол 18 (1): 81–84. [Lutsenko DG (2008) Rat’s brain microhemocirculation after hypothermic effect. Probl Cryobiol 18 (1): 81–84. (In Russ)].
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии


