Журнал эволюционной биохимии и физиологии, 2022, T. 58, № 5, стр. 391-401
ИНФАРКТ-ЛИМИТИРУЮЩИЙ ЭФФЕКТ ПОСТКОНДИЦИОНИРОВАНИЯ С ПОМОЩЬЮ L-ЛАКТАТА У МОЛОДЫХ И СТАРЫХ КРЫС ПРИ БЛОКАДЕ М-ХОЛИНОРЕЦЕПТОРОВ АТРОПИНОМ
Ф. И. Висмонт 1, С. Н. Чепелев 1, *, С. В. Губкин 2
1 Белорусский государственный медицинский университет
Минск, Беларусь
2 Институт физиологии НАН Беларуси
Минск, Беларусь
* E-mail: drserge1991@gmail.com
Поступила в редакцию 15.05.2022
После доработки 25.06.2022
Принята к публикации 29.06.2022
- EDN: MVZJSD
- DOI: 10.31857/S0044452922050102
Аннотация
Ишемическое повреждение является одним из наиболее неблагоприятных патогенных факторов, вызывающих необратимые изменения в органах и тканях. Защита сердца от ишемических и реперфузионных повреждений – важная задача современной экспериментальной и клинической медицины. Данный тип повреждения является ключевым звеном патогенеза ишемической болезни сердца и, прежде всего, острого инфаркта миокарда – социально-экономически значимого заболевания, являющегося одной из основных причин потери трудоспособности и смертности среди взрослого населения.
Целью исследования явилось выяснение инфаркт-лимитирующего эффекта посткондиционирования (Пост) с помощью L-лактата при ишемии-реперфузии миокарда у молодых и старых крыс при блокаде М-холинорецепторов атропином.
В опытах на крысах установлено, что Пост с помощью L-лактата оказывает инфаркт-лимитирующий эффект при ишемии-реперфузии миокарда как у молодых, так и у старых животных, однако в условиях системного действия атропина (2 мг/кг) инфаркт-лимитирующий эффект Пост с помощью L-лактата сохранялся только у старых крыс. По-видимому, активность периферических М-холинореактивных систем имеет значение в механизмах реализации кардиопротекторных эффектов Пост с помощью L-лактата у молодых, но не у старых крыс.
Согласно данным ВОЗ, ведущую причину смертности в мире занимают сердечно-сосудистые заболевания (ССЗ), на долю которых приходится 16% всех случаев смерти [1]. В настоящее время одним из самых распространенных видов ССЗ является ишемическая болезнь сердца (ИБС). Учитывая большую частоту инвалидизации и сложность реабилитации пациентов с инфарктом миокарда, ИБС представляет собой не только значимую медицинскую, но и важную государственную проблему. В связи с этим поиск новых эффективных методов предотвращения или ослабления ишемического повреждения миокарда и выяснение механизмов его реализации остаются актуальной задачей современной экспериментальной и клинической медицины [2–6].
В последние два десятилетия объектом повышенного интереса ведущих мировых исследователей в области экспериментальной и клинической кардиологии являются кардиопротекторные (противоишемический и антиаритмический) эффекты дистантного ишемического пре- и посткондиционирования (ДПост), которые воспроизводятся ишемией конечностей, осуществляемой до или после острой коронароокклюзии соответственно [2–6].
Для эффективного применения любого варианта прекондиционирования (Пре) как меры профилактической кардиопротекции необходимо точно знать, когда наступит ишемия, требующая защиты миокарда. Однако ввиду того, что это практически невозможно, мощный кардиопротекторный потенциал Пре, как правило, клинически не используется. Следовательно, ишемическое посткондиционирование (Пост), особенно ДПост, имеющее несомненное преимущество перед различными вариантами Пре, можно успешно применять в клинической практике наряду с другими рекомендациями. Во-первых, это чрезвычайно безопасно и дешево, а также малоинвазивно; во-вторых, его можно применять при оказании скорой медицинской помощи и ко всем пациентам с ишемией миокарда, получающим реперфузионное лечение.
Впервые ишемическое Пост было описано Zhao и соавт. в 2003 г., которые сообщили, что ишемическое Пост, состоящее из коротких прерывистых циклов ишемии, чередующихся с реперфузией, после острой коронароокклюзии может смягчить последствия реперфузионного повреждения [7].
Несколько позже, в 2012 г., Basalay и соавт. в экспериментах на крысах обнаружили, что кратковременная (15-минутная) ишемия задних конечностей оказывает выраженное инфаркт-лимитирующее действие на миокард не только в первые минуты реперфузии, но и при ее осуществлении на 10-й минуте после восстановления коронарного кровотока [8].
За последнее десятилетие данные ряда фундаментальных научных и клинических исследований подтвердили, что ишемическое Пост является эффективным методом снижения реперфузионного повреждения [8–11].
К настоящему времени накоплен достаточно большой объем знаний о феномене ишемического кондиционирования и его защитном влиянии на миокард. Однако биохимические механизмы кардиопротекции, лежащие в основе инфаркт-лимитирующего эффекта ишемического кондиционирования и особенно ДПост при ишемии-реперфузии миокарда, все еще остаются малоизученными [2, 3, 5, 6, 10].
Принимая во внимание известные факты о том, что гипоперфузия, ишемия органов и тканей приводят к повышению уровня молочной кислоты (лактата) в крови, а лактат, в свою очередь, оказывает коронарное сосудорасширяющее действие за счет выделения эндотелием сосудов монооксида азота (NO) [12, 13], а также способен ингибировать перекисное окисление липидов и свободнорадикальные процессы [14], выраженность которых при реперфузии возрастает, и может использоваться тканями, особенно миокардом, после гипоксии в большей степени, чем глюкоза [15], были основания полагать, что повышенный уровень лактата в крови (гиперлактатемия) сможет уменьшить реперфузионное повреждение миокарда.
Так, в проведенном нами в 2020 г. исследовании было установлено, что после воспроизведения ДПост у экспериментальных животных в крови повышается уровень L-лактата, а введение нейтрального L-лактата на 25-й минуте реперфузии в дозе 10 мг/кг частично имитирует инфаркт-лимитирующий эффект ДПост и приводит к снижению размеров зоны некроза в миокарде левого желудочка на 28.2% (p < 0.05 по сравнению с интактными животными), т.е. ослабляет повреждение сердца, вызываемое ишемией и реперфузией [16].
Учитывая, что в организме старых животных происходят значительные морфофункциональные и биохимические изменения [17, 18], были основания полагать, что возрастные изменения органов и тканей и, в частности, изменения в них активности периферических М-холинореактивных систем, могут оказывать существенное влияние на кардиопротекторную эффективность Пост с помощью L‑лактата у старых крыс.
В то же время в современной литературе отсутствуют сведения, касающиеся выяснения кардиопротекторной эффективности Пост с помощью L‑лактата при ишемии-реперфузии миокарда у молодых и старых крыс в условиях системного действия в организме животных блокатора М-холинореактивных систем атропина.
Целью данной работы было выяснить инфаркт-лимитирующий эффект Пост с помощью L-лактата при ишемии-реперфузии миокарда у молодых и старых крыс в условиях блокады М-холинорецепторов атропином.
МЕТОДЫ ИССЛЕДОВАНИЯ
Исследование проведено на наркотизированных нелинейных белых крысах-самцах (n = 101), разделенных на две возрастные группы: 43 молодых (молод) крыс массой 200–250 г в возрасте 4 ± 1 мес и 58 старых (стар) крыс массой 400–450 г в возрасте 24 ± 1 мес. Из них, с учетом выживаемости животных после острой ишемии миокарда (ОИМ) и последующих процедур, для обработки и анализа результатов исследования было отобрано 72 крысы (по 36 молодых и старых). Все животные в начале эксперимента перед 30-минутной ишемией и последующей 120-минутной реперфузией миокарда были разделены на 6 групп: 1-я (Контрольмолод) – группа молодых крыс, которым проводилась ишемия-реперфузия миокарда (n = 14); 2-я (Контрольстар) – группа старых крыс, которым проводилась ишемия-реперфузия миокарда (n = 22); 3-я (Лактатмолод) – группа молодых крыс, которым через 25 мин от начала реперфузии вводили в левую общую яремную вену L-лактат в дозе 10 мг/кг (n = 14); 4-я (Лактатстар) – группа старых крыс, которым через 25 мин от начала реперфузии вводили в левую общую яремную вену L-лактат в дозе 10 мг/кг (n = 17); 5-я (Атропин + Лактатмолод) – группа молодых крыс, которым проводилась ишемия-реперфузия миокарда, и за 10 мин до воспроизведения Пост с помощью L-лактата вводили в левую общую яремную вену 0.2% раствора М-холиноблокатора атропина (Sigma-Aldrich, США) в дозе 2 мг/кг (n = 15); 6-я (Атропин + Лактатстар) – группа старых крыс, которым проводилась ишемия-реперфузия миокарда, и за 10 мин до воспроизведения Пост с помощью L-лактата вводили в левую общую яремную вену 0.2% раствора М-холиноблокатора атропина (Sigma-Aldrich, США) в дозе 2 мг/кг (n = 19).
Все процедуры, выполненные в исследованиях с участием животных, соответствовали этическим стандартам, утвержденным правовыми актами Республики Беларусь, принципам Базельской декларации и рекомендациям комитета по биомедицинской этике учреждения образования “Белорусский государственный медицинский университет” (Протокол № 8 от 07.10.2019 г.).
Животные содержались в условиях вивария УО «Белорусский государственный медицинский университет» в соответствии с нормативами индивидуального размещения. Рацион крыс состоял из комбикорма, количество которого определялось нормами кормления лабораторных животных. Питьевой режим соответствовал принципу ad libitum, световой – естественному уровню освещенности в течение суток. Температуру воздуха в виварии поддерживали на уровне 20–25°C, что находится в пределах термонейтральной зоны для крыс. Относительная влажность воздуха составляла 50–70%. При выполнении работы особое внимание уделяли шумовому режиму содержания животных, так как высокий уровень шума способствует развитию стресса у крыс. Все манипуляции с животными проводили с 8.00 до 18.00. Экспериментальные группы животных формировали методом случайной выборки.
Для наркотизации животных использовали тиопентал натрия в дозе 50 мг/кг внутрибрюшинно с последующей внутривенной инфузией в левую общую яремную вену поддерживающей дозы 10 мг/кг · ч с помощью инъекционного насоса B. Braun (Германия). Адекватность выполненной общей анестезии оценивали по отсутствию рефлекторного отдергивания задней конечности животного на укол. Крыс переводили на искусственное дыхание атмосферным воздухом через трахеостому (частота дыхания 56–60 в мин, дыхательный объем 1.0–1.2 мл/100 г массы тела животного) при помощи аппарата искусственной вентиляции легких (Harvard, Великобритания). Наличие проходимости дыхательных путей контролировали по давлению в трахее, нормальным значением которого на вдохе считалось 10–15 мм рт.ст. В ходе экспериментов непрерывно регистрировали электрокардиограмму (ЭКГ) во II стандартном отведении и системное артериальное давление (АД), а полученные данные обрабатывали с помощью компьютерной программы Spike 4 (Великобритания). Для измерения АД прямым методом крысам канюлировали правую общую сонную артерию. Температуру тела измеряли в прямой кишке с помощью электротермометра (Harvard, Великобритания) и поддерживали электрогрелкой на уровне 37.0 ± 0.5°С. Грудную клетку наркотизированного животного вскрывали в IV межреберном промежутке слева. После периода 15-минутной стабилизации гемодинамики крысам выполняли 30-минутную окклюзию передней нисходящей ветви левой коронарной артерии (ЛКА) путем механического ее пережатия при помощи лигатуры. Согласно современным экспериментальным данным, длительность коронарной окклюзии у крыс, равная 30–40 мин, является достаточной для формирования зоны некроза миокарда, составляющей около 50% от зоны риска [8]. Принимая во внимание литературные данные о том, что Пост у крыс с длительностью ишемии миокарда 45 мин и более не оказывает инфаркт-лимитирующего эффекта [19], мы предположили, что длительность ишемии миокарда, превышающая 30 мин, может оказаться неприемлемой для изучения противоишемической эффективности Пост у крыс. Окклюзия артерии подтверждалась цианозом ишемизированной области, снижением АД (на 10–20 мм рт.ст.) и подъемом сегмента ST на ЭКГ. Реперфузия миокарда достигалась снятием лигатуры и сопровождалась исчезновением цианоза и возвращением сегмента ST к изолинии. Длительность реперфузии составляла 120 мин, поскольку, согласно имеющимся литературным данным, указанный интервал времени является достаточным для формирования в миокарде крыс зоны некроза [8, 20].
На протяжении эксперимента у животных изучались следующие показатели гемодинамики: среднее АД (АДср), частота сердечных сокращений (ЧСС) и двойное произведение (ДП). АДср рассчитывали как АД диастолическое + 1/3 (АД систолическое – АД диастолическое), ДП – как (ЧСС ‧ АД систолическое)/100. Показатели гемодинамики регистрировали непрерывно в течение эксперимента и оценивали в конце 15-минутной стабилизации гемодинамики после вскрытия грудной клетки, в начале 30-минутной окклюзии ЛКА, в начале реперфузии миокарда, а также каждые 30 мин в течение периода реперфузии. Значения гемодинамических показателей в конце 15-минутной стабилизации гемодинамики после вскрытия грудной клетки принимали в качестве исходных значений данных показателей.
Критериями исключения животных из эксперимента являлись ЧСС < 300 уд/мин до начала эксперимента и АДср < 60 мм рт.ст., а также наличие у животных желудочковых экстрасистол до начала ОИМ.
Для оценки антиаритмического эффекта подсчитывали общую длительность нарушений сердечного ритма во время 30-минутной острой коронарной окклюзии – фибрилляции желудочков (ФЖ), пароксизмальной желудочковой тахикардии (ПЖТ), парной желудочковой экстрасистолии, желудочковой экстрасистолии по типу бигеминии, а также определяли наличие реперфузионных нарушений сердечного ритма.
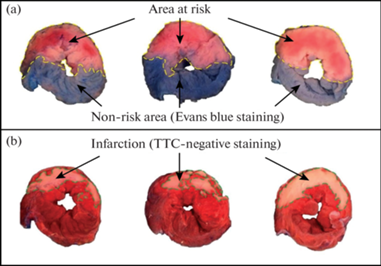
Зону риска определяли путем введения в левую общую яремную вену 0.5 мл 5%-ного раствора синьки Эванса (Sigma-Aldrich, США) в конце реперфузии при повторном кратковременном пережатии лигатурой ЛКА. Зону риска определяли как зону, не окрашенную в синий цвет (рис. 1). Затем сердце извлекали и отделяли от него левый желудочек. После замораживания в морозильной камере (при –20°С в течение 30 мин) левый желудочек разрезали на 6 поперечных срезов, которые в последующем взвешивали и сканировали с обеих сторон, используя сканер Epson.
Рис. 1.
Изображения ишемически-реперфузионного повреждения левого желудочка миокарда у крыс: (a) срезы, окрашенные красителем Evans Blue, на которых идентифицирована неперфузируемуая зона риска, выделенная желтым цветом, а также нормально перфузионный участок миокарда, окрашенный красителем Evans Blue; (b) срезы на 15 мин помещали в 1%-ный раствор 2,3,5-трифенилтетразолия хлорида (ТТС) и 24 ч инкубировали в 10%-ном растворе формалина при температуре 37.0°С, после чего измеряли участки зоны некроза бледно-розового цвета (окрашенные ТТС-негативно), выделенные зеленым контуром, в отличие от жизнеспособного ТТС-положительного миокарда, окрашенного в темно-красный цвет.
При помощи компьютерной планиметрии с использованием программы Adobe Photoshop CC 2017 для каждого среза определяли отношение средней площади зоны риска в каждом срезе к средней площади всего среза. Массу зоны риска (mриска) в каждом срезе вычисляли по формуле
Для расчета общей зоны риска (Зонариска, %) использовали следующую формулу:
Для идентификации зоны некроза в миокарде левого желудочка крыс использовали метод, основанный на определении активности дегидрогеназ [20]. Срезы помещали в 1%-ный раствор 2,3,5-трифенилтетразолия хлорида на 15 мин при температуре 37.0°С. Жизнеспособный миокард (клетки, сохранившие дегидрогеназную активность) окрашивался в кирпично-красный цвет, а некротизированная ткань была бледно-розовой (рис. 1). После 24-часовой инкубации срезов в 10%-ном растворе формалина в термостате при температуре 37.0°С срезы сканировали повторно для определения соотношения площадей зоны риска и зоны некроза. При помощи компьютерной планиметрии для каждого среза миокарда левого желудочка определяли отношение средней площади зоны некроза в каждом срезе $({{\bar {S}}_{{{\text{некроза}}}}})~$ к средней площади всего среза (${{\bar {S}}_{{{\text{среза}}}}})$. Массу зоны некроза (${{m}_{{{\text{некроза}}}}}$) для каждого отдельного среза вычисляли по формуле
Для расчета общей зоны некроза (Зонанекроза, %) в миокарде левого желудочка крыс использовали формулу
Изучение кардиопротекторной эффективности Пост с помощью L-лактата при ишемии-реперфузии миокарда у крыс проводилось у животных, которым через 25 мин от начала репефузии вводили в левую общую яремную вену 0.5 мл 40 мМоль нейтрализованного раствора L-(+)-молочной кислоты (Sigma-Aldrich, США), т.е. в дозе 10 мг/кг. Для изготовления нейтрализованного L-лактата для инъекций молочную кислоту растворяли в 0.9%-ном растворе NaCl с последующим доведением pH до 7.4 с помощью NaOH (10 N).
Доза L-лактата (10 мг/кг) была выбрана нами с целью обеспечить уровень L-лактата в крови, близкий к тому, что имел место после 15-минутного наложения лигатур на обеих бедренных артериях [16, 21]. Уровень L-лактата в цельной крови, взятой из левой общей яремной вены, определяли при помощи анализатора Lactate Pro 2 (Arkray, Япония) малообъемным методом с помощью тест-полосок Lactate Pro 2 Test Strip для биохимических исследований (Arkray, Япония).
Изучение кардиопротекторной эффективности Пост с помощью L-лактата при ишемии-реперфузии миокарда у старых и молодых крыс в условиях блокады М-холинореактивных систем проводилось у животных, которым за 10 мин до воспроизведения Пост с помощью L-лактата вводили в левую общую яремную вену 0.2% раствора М-холиноблокатора атропина (Sigma-Aldrich, США) в дозе 2 мг/кг.
Полученные в исследовании результаты анализировали с использованием стандартных пакетов статистических программ Statistica 13.3 и GraphPad Prism 9. Для оценки нормальности распределения анализируемых показателей применяли критерий Колмогорова–Смирнова. Статистическую значимость различий полученных данных в случае их параметрического распределения оценивали с помощью однофакторного дисперсионного анализа (ANOVA) с использованием тестов множественных сравнений Данна и Бонферрони. Результаты исследования при их параметрическом распределении представляли в виде среднего ± стандартная ошибка среднего (М ± m). Для оценки статистической значимости различий данных в случае их непараметрического распределения использовали критерий Краскала–Уоллиса и тест множественных сравнений Данна. При непараметрическом распределении результаты исследования были представлены в виде медианы и интерквартильного размаха (25-й; 75-й процентили). Уровень р < < 0.05 рассматривали как статистически значимый.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Выживаемость крыс после острой коронарной окклюзии составила 71.3% (29 крыс из 101 погибли в период ОИМ и последующей реперфузии). При этом в группе Контрольмолод выживаемость животных составила 85.7%; в группе Контрольстар – 54.5%; в группе Лактатмолод – 85.7%; в группе Лактатстар – 70.6%; в группе Атропин + Лактатмолод – 80.0%; в группе Атропин + Лактатстар – 63.2%. Так, у старых крыс за время 30-минутной коронароокклюзии и последующей 120-минутной реперфузии имело место значительное снижение выживаемости по сравнению с молодыми крысами (погибло 22 старых и 7 молодых крыс), что свидетельствует о более чем двукратном снижении устойчивости миокарда старых крыс к повреждению, вызванному его длительной ишемией, а также последующей реперфузией. Таким образом, с учетом выживаемости животных в экспериментальных группах осталось по 12 крыс в каждой.
Установлено, что в группах Контрольмолод, Контрольстар, Лактатмолод, Лактатстар, Атропин + Лактатмолод и Атропин + Лактатстар во время ОИМ имело место статистически значимое снижение показателя АДср (р < 0.05) по сравнению с его исходными значениями. В начале реперфузии в группах Контрольстар, Лактатстар, Атропин + Лактатмолод и Атропин + Лактатстар также имело место статистически значимое снижение показателя АДср (р < 0.05) по сравнению с его исходными значениями. У животных, которым осуществлялось введение в левую общую яремную вену 0.2% раствора М-холиноблокатора атропина в дозе 2 мг/кг за 10 мин до Пост с помощью L-лактата, отмечалось статистически значимое повышение показателя ЧСС (р < 0.01) по сравнению с его исходными значениями на 30, 60, 90 и 120 мин реперфузии. Изменение показателей гемодинамики на протяжении эксперимента у старых и молодых крыс представлено в табл. 1.
Таблица 1.
Изменение показателей гемодинамики у крыс исследуемых групп на протяжении эксперимента
| Показатели гемодинамики |
Контроль | Лактат | Атропин + лактат | ||||
|---|---|---|---|---|---|---|---|
| Молод. (n = 12) | Стар. (n = 12) | Молод. (n = 12) | Стар. (n = 12) | Молод. (n = 12) | Стар. (n = 12) | ||
| До начала ОИМ | АДср | 81 ± 5 | 88 ± 5 | 82 ± 3 | 87 ± 5 | 84 ± 3 | 89 ± 4 |
| ЧСС | 415 ± 16 | 448 ± 17 | 410 ± 15 | 439 ± 18 | 415 ± 13 | 435 ± 19 | |
| Начало ОИМ | АДср | 68 ± 4* | 70 ± 5* | 69 ± 4* | 71 ± 4* | 68 ± 5* | 72 ± 4* |
| ЧСС | 430 ± 14 | 408 ± 24 | 434 ± 16 | 404 ± 17 | 426 ± 19 | 424 ± 22 | |
| Начало реперфузии | АДср | 75 ± 5 | 73 ± 4* | 76 ± 4 | 74 ± 5* | 73 ± 3* | 77 ± 4* |
| ЧСС | 433 ± 23 | 407 ± 31 | 420 ± 23 | 399 ± 35 | 416 ± 17 | 427 ± 18 | |
| 30' реперфузии | АДср | 77 ± 4 | 76 ± 5 | 75 ± 4 | 77 ± 5 | 75 ± 5 | 78 ± 4 |
| ЧСС | 439 ± 19 | 404 ± 24 | 424 ± 21 | 403 ± 29 | 495 ± 21** | 514 ± 24** | |
| 60' реперфузии | АДср | 76 ± 5 | 78 ± 6 | 78 ± 5 | 78 ± 4 | 76 ± 4 | 79 ± 5 |
| ЧСС | 432 ± 16 | 398 ± 23 | 415 ± 21 | 406 ± 21 | 502 ± 20** | 521 ± 23** | |
| 90' реперфузии | АДср | 78 ± 4 | 78 ± 5 | 78 ± 4 | 80 ± 4 | 77 ± 5 | 81 ± 4 |
| ЧСС | 420 ± 16 | 393 ± 25 | 417 ± 18 | 416 ± 24 | 491 ± 17** | 512 ± 20** | |
| 120' реперфузии | АДср | 80 ± 5 | 79 ± 5 | 80 ± 3 | 81 ± 5 | 81 ± 4 | 83 ± 3 |
| ЧСС | 413 ± 17 | 387 ± 25 | 420 ± 17 | 421 ± 21 | 484 ± 22** | 503 ± 19** | |
При проведении исследования установлено, что величина ДП в анализируемых группах крыс до начала острой коронарной окклюзии статистически значимо не различалась. Следовательно, были основания полагать, что животные всех анализируемых групп до начала эксперимента характеризовались сходной потребностью миокарда в кислороде.
При изучении антиаритмической эффективности Пост с помощью L-лактата при ишемии-реперфузии миокарда у молодых и старых крыс в условиях системного действия в организме животных блокатора М-холинореактивных систем атропина (2 мг/кг) были получены следующие результаты продолжительности аритмий: Контрольмолод – 167 (49; 233) с; Контрольстар – 237 (128; 331) с; Лактатмолод – 145 (27; 192) с; Лактатстар – 97 (66; 154) с; Атропин + Лактатмолод – 182 (54; 258) с и Атропин + Лактатстар – 192 (77; 314) с.
В ходе исследования также установлено, что в группе Контрольмолод у 9 из 12 крыс отмечалась ФЖ, а у 11 животных данной группы была выявлена ПЖТ. Реперфузионные нарушения сердечного ритма имели место у 10 крыс данной группы. В группе Контрольстар в период острой коронарной окклюзии у 11 из 12 крыс отмечались ФЖ и ПЖТ. Во время реперфузии миокарда нарушения сердечного ритма наблюдались также у 11 животных данной группы. В группе Лактатмолод в период острой коронарной окклюзии у 9 из 12 крыс отмечались ФЖ и ПЖТ. Во время реперфузии миокарда нарушения сердечного ритма наблюдались у 7 животных данной группы. В группе Лактатстар в период острой коронарной окклюзии у 11 из 12 крыс отмечалась ФЖ, а ПЖТ имела место у 10 крыс. Во время реперфузии миокарда нарушения сердечного ритма наблюдались у 8 животных данной группы. В группе Атропин + Лактатмолод в период 30-минутной ишемии миокарда ФЖ и ПЖТ были выявлены у 11 из 12 животных. Реперфузионные аритмии имели место у 12 животных данной группы. В группе Атропин + Лактатстар в период острой коронарной окклюзии у 11 из 12 крыс отмечались ФЖ и ПЖТ. Во время реперфузии миокарда нарушения сердечного ритма наблюдались у 11 животных данной группы.
Таким образом, длительность ишемических нарушений сердечного ритма в исследуемых группах старых и молодых крыс, подвергнутых атропинизации и Пост с помощью L-лактата, сопоставима с таковой в группах контроля.
При изучении инфаркт-лимитирующего эффекта Пост с помощью L-лактата при ишемии-реперфузии миокарда у молодых и старых крыс в условиях системного действия в организме животных блокатора М-холинореактивных систем атропина статистически значимых различий между анализируемыми группами по показателю размера зоны риска в миокарде левого желудочка не выявлено. Так, зона ишемии в группе Контрольмолод составила 54 ± 3%, в группе Контрольстар – 55 ± 3%; в группе Лактатмолод – 52 ± 4%; в группе Лактатстар – 53 ± 3%; в группе Атропин + Лактатмолод – 50 ± 4% и в группе Атропин + Лактатстар – 54 ± 5%. Таким образом, во всех анализируемых группах крыс размеры зоны риска в миокарде левого желудочка были сопоставимы.
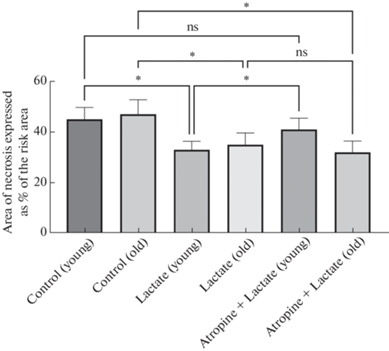
Размер инфаркта является важным показателем повреждения миокарда из-за его влияния на сократимость сердца. Установлено, что размер зоны некроза в миокарде левого желудочка у животных в группе Контрольмолод составил 45 ± 4%, а в группе Контрольстар – 47 ± 5%. После внутривенного введения животным L-лактата (10 мг/кг), которое осуществлялось через 25 мин после начала реперфузии, у крыс при ишемии и реперфузии миокарда в левом желудочке формировались следующие размеры зон некроза: в группе Лактатмолод – 33 ± 3% (р <0.05 по сравнению с группой Контрольмолод), а в группе Лактатстар – 35 ± 4% (р < 0.05 по сравнению с группой Контрольстар). Размер зоны некроза в группах молодых и старых животных, которым на 15-й минуте реперфузии вводили блокатора М-холинореактивных систем атропин (2 мг/кг), а затем внутривенно вводился лактат, был следующим: в группе Атропин + Лактатмолод – 41 ± 4%, а в группе Атропин + Лактатстар – 32 ± 4% (р < 0.05 по сравнению с группой Контрольстар) (рис. 2).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Достаточно долгое время лактат рассматривался как тупиковый метаболит, агент усталости или метаболический яд. В медицине было принято считать, что повышение уровня лактата в крови коррелирует с тяжестью заболевания или травмы. В последнее время в научной литературе стали появляться сведения о ранее неизвестных эффектах лактата и начали резко изменяться представления о роли лактата в физиологии и медицине. Так, в ряде исследований показано, что лактат участвует в регуляции метаболизма и играет ключевую роль в регулировании различных биологических процессов [22]. Выявлено, что L-лактат постоянно образуется и используется в различных клетках организма в полностью аэробных условиях [22]. Лактат, перемещаясь между клетками-продуцентами и клетками-потребителями, выполняет по крайней мере три важные функции: является основным источником энергии, предшественником глюкозы в глюконеогенезе и сигнальной молекулой [22]. Концепции “лактатного челнока” описывают роль лактата в доставке окислительных и глюконеогенных субстратов, а также в передаче сигналов клетками [22].
В современной литературе имеются также, хотя и немногочисленные, экспериментальные исследования, посвященные выяснению механизмов влияния лактата на сердечную деятельность. Zhang и соавт. в опытах на мышах показали, что лактат ускоряет поляризацию макрофагов M2, продуцирующих противовоспалительные цитокины, через сигнальный путь STAT3, а также оказывает кардиозащитное действие после инфаркта миокарда за счет улучшения фракции выброса и фракционного укорочения, снижения апоптоза кардиомиоцитов и увеличения плотности микрососудов в зоне ишемии [23].
Есть мнение, что во время покоя или физической нагрузки лактат является основным энергетическим субстратом для здорового сердца [22]. Фактически в качестве энергетического субстрата для сердца L-лактат предпочтительнее глюкозы и свободных жирных кислот [24]. В клинической практике в исследовании Nalos и соавт. показано, что инфузия полумолярного лактата натрия может улучшить работу сердца у пациентов с острой сердечной недостаточностью без какого-либо пагубного воздействия на функцию органов [25]. Кроме того, исследования Koyama и соавт. выявили, что Пост с кровью, обогащенной лактатом, обеспечивает потенциальную кардиопротекцию у пациентов с инфарктом миокарда с подъемом сегмента ST, которым выполнялось первичное чрескожное коронарное вмешательство [26]. Можно констатировать, что идет процесс накопления данных, свидетельствующих о том, что лактат может быть многообещающим средством лечения ССЗ.
За последние годы проведен ряд исследований, посвященных вопросу влияния пожилого возраста на воспроизводимость инфаркт-лимитирующего эффекта Пост у экспериментальных животных, однако выводы, сделанные на их основании неоднозначны и во многом являются противоречивыми. Так, результаты одних исследований свидетельствуют об отсутствии инфаркт-лимитирующего эффекта Пост у старых животных [27], а данные других исследований, наоборот, указывают о наличии у таких животных противоишемического эффекта Пост [28].
На сегодняшний день накоплено большое количество сведений, подчеркивающих важную роль парасимпатической регуляции сердечной деятельности в механизмах защиты миокарда от повреждений [29–32]. В частности, согласно современным представлениям, парасимпатическая регуляция сердечной деятельности имеет важное значение в механизмах защиты миокарда от ишемического и реперфузионного повреждений [33–35].
Известно, что процессы старения организма сопровождаются ослаблением влияния парасимпатической регуляции на сердце, что связано с деструкцией холинергических нервных окончаний, снижением интенсивности процессов синтеза ацетилхолина и числа М-холинорецепторов в миокарде [17, 18].
Полученные нами данные свидетельствуют о наличии выраженного инфаркт-лимитирующего эффекта Пост с помощью L-лактата у молодых крыс (p < 0.05). Однако в условиях системного действия в организме животных блокатора М-холинореактивных систем атропина (2 мг/кг) у молодых крыс Пост с помощью L-лактата оказывало менее выраженный противоишемический эффект (p > > 0.05). У старых животных в условиях системного действия в их организме атропина инфаркт-лимитирующий эффект Пост с помощью L-лактата сохранялся (p < 0.05).
Учитывая имеющиеся литературные данные о том, что у старых крыс имеет место выраженное снижение интенсивности процессов синтеза ацетилхолина и активности ацетилхолинтрансферазы, что может свидетельствовать о нарушении процессов холинергической регуляции сердечной деятельности у таких животных, данные выполненных исследований дают основания полагать, что активность периферических М-холинореактивных систем имеет значение в механизмах реализации инфаркт-лимитирующего эффекта Пост с помощью L-лактата у молодых, но не у старых крыс. В пользу сделанного предположения свидетельствуют и такие имеющиеся в литературе сведения, что при старении организма у животных происходит деструкция холинергических нервных окончаний и уменьшение числа М-холинорецепторов в миокарде, что в конечном итоге ведет к ослаблению парасимпатических влияний на сердце у старых животных [17, 18].
Таким образом, данные, полученные в настоящем исследовании, свидетельствуют о том, что Пост с помощью L-лактата оказывает инфаркт-лимитирующий эффект при ишемии-реперфузии миокарда как у молодых, так и у старых крыс, однако в условиях системного действия в организме животных атропина этот эффект Пост с помощью L-лактата сохранялся только у старых крыс. Установлено, что Пост с помощью L-лактата у старых крыс, после введения в организм животных атропина в дозе 2 мг/кг, приводит к уменьшению размеров зоны некроза в миокарде левого желудочка на 31.9% (р < 0.05) по сравнению с контрольной группой старых крыс. По-видимому, активность периферических М-холинореактивных систем имеет значение в механизмах реализации кардиопротекторных эффектов Пост с помощью L-лактата у молодых, но не у старых крыс.
Полученные знания о биохимических механизмах кардиопротекторной эффективности Пост с помощью L-лактата послужат научным обоснованием для разработки новых подходов к профилактике и лечению ССЗ, патогенез которых связан с недостаточным кровоснабжением миокарда и тканевой гипоксии.
Список литературы
WHO reveals leading causes of death and disability worldwide 2000–2019. Available at: https: //www.who.int/news/item/09-12-2020-who-reveals-leading-causes-of-death-and-disability-worldwide-2000-2019 (accessed 14.05.2022).
Shemarova IV, Nesterov VP, Korotkov SM, Silkin UA (2018) Evolutionary aspects of cardioprotection. J Evol Biochem Physiol 54 (1): 9–19. https://doi.org/10.1134/S0022093018010027
Баутин АЕ, Карпова ЛИ, Маричев АО, Ташханов ДМ, Науменко ВС, Галагудза ММ (2016) Кардиопротективные эффекты ишемического кондиционирования: современные представления о механизмах, экспериментальные подтверждения, клиническая реализация. Трансляцион медиц 3 (1): 50–62. [Bautin AE, Karpova LI, Marichev AO, Tashkhanov DM, Naumenko VS, Galagudza MM (2016) Cardioprotective effects of ischemic conditioning: current concepts of mechanisms, experimental evidence, clinical implementation. Translat med 3 (1): 50–62. (In Russ)]. https://doi.org/10.18705/2311-4495-2016-3-1-50-62
Маслов ЛН, Мрочек АГ, Халиулин ИГ, Хануш Л, Пей ЖМ, Жанг И (2013) Адаптивный феномен ишемического посткондиционирования сердца. Перспективы клинического применения. Вестн Росс акад мед наук 68 (1): 10–20. [Maslov LN, Mrochek AG, Khaliulin IG, Hanus L, Pei JM, Zhang Y (2013) Adaptive phenomenon of ischemic postconditioning of the heart. Perspectives of clinical use. Ann Russ Acad Med Sci 68 (1): 10–20 (In Russ)]. https://doi.org/10.15690/vramn.v68i1.532
Шляхто ЕВ, Нифонтов ЕМ, Галагудза ММ (2007) Ограничение ишемического и реперфузионного повреждения миокарда с помощью пре- и посткондиционирования: молекулярные механизмы и мишени для фармакотерапии. Креативн кардиол 1–2: 75–101. [Shlyakhto EV, Nifontov EM, Galagudza MM (2007) Limitation of ischemic and reperfusion injury of the myocardium using pre- and postconditioning: molecular mechanisms and targets for pharmacotherapy. Creative cardiol 1–2: 75–101. (In Russ)].
Galagudza MM, Blokhin IO, Shmonin AA, Mischenko KA (2008) Reduction of myocardial ischaemia-reperfusion injury with pre- and postconditioning: molecular mechanisms and therapeutic targets. Cardiovas Hematolog Dis-Drug Targ 8 (1): 47–65. https://doi.org/10.2174/187152908783884966
Zhao ZQ, Corvera JS, Halcos ME, Kerendi F, Wang NP, Guyton RA, Vinten-Johansen J (2003) Inhibition of myocardial injury by ischemic postconditioning during reperfusion: comparison with ischemic preconditioning. Am J Physiol – Heart Circulat Physiol 285: H579–H588. https://doi.org/10.1152/ajpheart.01064.2002
Basalay M, Barsukevich V, Mastitskaya S, Mrochek A, Pernow J, Sjöquist PO, Ackland GL, Gourine AV, Gourine A (2012) Remote ischaemic pre- and delayed postconditioning – similar degree of cardioprotection but distinct mechanisms. Experiment Physiol 97 (8): 908–917. https://doi.org/10.1113/expphysiol.2012.064923
Ferdinandy P, Hausenloy DJ, Heusch G, Baxter GF, Schulz R (2014) Interaction of risk factors, comorbidities, and comedications with ischemia/reperfusion injury and cardioprotection by preconditioning, postconditioning, and remote conditioning. Pharmacolog Rev 66 (4): 1142–1174. https://doi.org/10.1124/pr.113.008300
Heusch G (2015) Molecular basis of cardioprotection: signal transduction in ischemic pre, post, and remote conditioning. Circulat Res 116: 674–699. https://doi.org/10.1161/CIRCRESAHA.116.305348
Нарыжная НВ, Логвинов СВ, Курбатов БК, Мухомедзянов АВ, Сиротина МА, Чепелев СН, Висмонт ФИ, Маслов ЛН (2022) Эффективность дистантного ишемического посткондиционирования миокарда у крыс с индуцированным метаболическим синдромом зависит от уровня лептина. Вес Нац акад навук Беларусi Сер мед навук 19 (1): 38–47. [Naryzhnaya NV, Logvinov SV, Kurbatov BK, Mukhomedzyanov AV, Sirotina MA, Chepelev SN, Vismont FI, Maslov LN (2022) The efficiency of remote ischemic postconditioning of the myocardium in rats with induced metabolic syndrome depends on the leptin level. Proceed Nat Acad Sci Belarus Med series 19 (1): 38–47. (In Russ)]. https://doi.org/10.29235/1814-6023-2022-19-1-38-47
Montoya JJ, Fernández N, Monge L, Diéguez G, Villalón AL (2011) Nitric oxide-mediated relaxation to lactate of coronary circulation in the isolated perfused rat heart. J Cardiosvascul Pharmacol 5 (4): 392–398.https://doi.org/10.1097/FJC.0b013e318226bcf7
Чепелев СН, Висмонт ФИ (2020) О значимости монооксида азота в реализации инфаркт-лимитирующего эффекта дистантного ишемического посткондиционирования при ишемии-реперфузии миокарда у молодых и старых крыс. Вес Нац Акад Навук Беларусi Сер мед навук 17 (3): 353–364. [Chepelev SN, Vismont FI (2020) Significance of nitrogen monoxide in the implementation of the infarctlimiting effect of remote ischemic postconditioning in myocardial ischemia-reperfusion in young and old rats. Proceed Nat Acad Sci Belarus Med series 17 (3): 353–364. (In Russ)]. https://doi.org/10.29235/1814-6023-2020-17-3-353-363
Groussard C, Morel I, Chevanne M, Monnier M, Cillard J, Delamarche A (2000) Free radical scavenging and antioxidant effects of lactate ion: an in vitro study. J App Physiol (1985) 89 (1): 169–175. https://doi.org/10.1152/jappl.2000.89.1.169
Трекова НА, Аксельрод БА, Юдичев ИИ, Гуськов ДА, Маркин АВ, Попов АМ (2016) Клинические аспекты динамики лактата крови во время операции на сердце и аорте в условиях искусственного кровообращения. Анестезиол реанимац 61 (5): 324–329. [Trekova NA., Aksel’rod BA, Yudichev II, Gus’kov DA, Markin AV, Popov AM (2016) Clinical aspects of the dynamics of blood lactate during surgery on the heart and aorta under conditions of cardiopulmonary bypass. Anesthes Resuscitat 61 (5): 324–329. (In Russ)].
Чепелев СН, Висмонт ФИ, Губкин СВ (2020) О значимости гиперлактатемии в реализации инфаркт-лимитирующего эффекта дистантного ишемического посткондиционирования при ишемии-реперфузии миокарда в эксперименте. Докл Нац Акад Наук Беларуси 64 (3): 332–340. [Chepelev SN, Vismont FI, Goubkin SV (2020) On the significance of hyperlactatemia in the implementation of the infarct-limiting effect of remote ischemic postconditioning in myocardial ischemia-reperfusion in the experiment. Dokl Nat Acad Sci Belarus 64 (3): 332–340. (In Russ)]. https://doi.org/10.29235/1561-8323-2020-64-3-332-340
Аринчин НИ, Фролькис ВВ, Аршавский ИА (1982) Биология старения. Ленинград Наука. [Arinchin NI, Frol’kis VV, Arshavskiy IA (1982) Biology of aging. Leningrad Nauka. (In Russ)].
Фролькис ВВ, Верхратский НС, Шевчук ВГ (1977) Нервная регуляция функции сердца при старении. Физиол журн СССР 63 (8): 1134–1143. [Frol’kis VV, Verkhratskiy NS, Shevchuk VG (1977) Nervous regulation of heart function during aging. Sech Physiol J USSR 63 (8): 1134–1143. (In Russ)].
Tang XL, Sato H, Tiwari S, Dawn B, Bi Q, Li Q, Shirk G, Bolli R (2006) Cardioprotection by postconditioning in conscious rats is limited to coronary occlusions <45 min. Am J Physiol Heart Circulat Physiol 291 (5): H2308–H2317. https://doi.org/10.1152/ajpheart.00479.2006
Fishbein MC, Meerbaum S, Rit J, Lando U, Kanmatsuse K, Mercier JC, Corday E, Ganz W (1981) Early phase acute myocardial infarct size quantification: validation of the triphenyl tetrazolium chloride tissue enzyme staining technique. Am Heart J 101 (5): 593–600. https://doi.org/10.1016/0002-8703(81)90226-x
Чепелев СН, Висмонт ФИ, Губкин СВ, Маслов ЛН (2021) Кардиопротекторная эффективность фармакологического посткондиционирования с помощью молочной кислоты при ишемии-реперфузии миокарда у крыс с транзиторной гиперхолестеринемией. Вес Нац Акад Навук Беларусі Сер мед навук 18 (2): 135–146. [Chepelev SN, Vismont FI, Gubkin SV, Maslov LN (2021) Cardioprotective efficiency of pharmacological postconditioning using lactic acid in ischemia-reperfusion of the myocardium in rats with transitional hypercholesterolemia. Proc Nat Acad Sci Belarus Med series 18 (2): 135–146. (In Russ)].https://doi.org/10.29235/1814-6023-2021-18-2-135-146
Brooks GA (2018) The science and translation of lactate shuttle theory. Cell Metabolism 27 (4): 757–785. https://doi.org/10.1016/j.cmet.2018.03.008
Zhang J, Huang F, Chen L, Li G, Lei W, Zhao J, Liao Y, Li Y, Li C, Chen M (2021) Sodium lactate accelerates M2 macrophage polarization and improves cardiac function after myocardial infarction in mice. Cardiovascu Therapeutics 2021: 5530541. https://doi.org/10.1155/2021/5530541
Bergman BC, Tsvetkova T, Lowes B, Wolfel EE (2009) Myocardial glucose and lactate metabolism during rest and atrial pacing in humans. J Physiol 587 (9): 2087–2099https://doi.org/10.1113/jphysiol.2008.168286
Nalos M, Leverve XM, Huang SJ, Weisbrodt L, Parkin R, Seppelt IM, Ting I, Mclean AS (2014) Half-molar sodium lactate infusion improves cardiac performance in acute heart failure: a pilot randomised controlled clinical trial. Critical Care 18 (2): R48. https://doi.org/10.1186/cc13793
Koyama T, Munakata M, Akima T, Kageyama T, Shibata M, Moritani K, Kanki H, Ishikawa S, Mitamura H (2016) Impact of postconditioning with lactate-enriched blood on in-hospital outcomes of patients with ST-segment elevation myocardial infarction. Internat J Cardiol 220: 146–148. https://doi.org/10.1016/j.ijcard.2016.06.176
Donato M, Evelson P, Gelpi RJ (2017) Protecting the heart from ischemia/reperfusion injury: an update on remote ischemic preconditioning and postconditioning. Cur Opinion Cardiol 32 (6): 784–790. https://doi.org/10.1097/HCO.0000000000000447
Yin Z, Gao H, Wang H, Li L, Di C, Luan R, Tao L (2009) Ischaemic post-conditioning protects both adult and aged Sprague-Dawley rat heart from ischaemia-reperfusion injury through the phosphatidylinositol 3-kinase-AKT and glycogen synthase kinase-3beta pathways. Clin Exp Pharmacol Physiol 36 (8): 756–763. https://doi.org/10.1111/j.1440-1681.2009.05148.x
Rana OR, Schauerte P, Kluttig R, Schröder JW, Koenen RR, Weber C, Nolte KW, Weis J, Hoffmann R, Marx N, Saygili E (2010) Acetylcholine as an age-dependent non-neuronal source in the heart. Autonomic Neurosci 156 (1–2): 82–89. https://doi.org/10.1016/j.autneu.2010.04.011
Xiong J, Xue FS, Xu YC, Yang QY, Liao X, Wang WL (2009) Cholinergic agonists may produce preservation of myocardial ischaemia/reperfusion injury. Med Hypoth 73 (3): 312–314. https://doi.org/10.1016/j.mehy.2009.03.026
Ando M, Katare RG, Kakinuma Y, Zhang D, Yamasaki F, Muramoto K, Sato T (2005) Efferent vagal nerve stimulation protects heart against ischemia-induced arrhythmias by preserving connexin43 protein. Circulation 112 (2): 164–170. https://doi.org/10.1161/CIRCULATIONAHA.104.525493
Katare RG, Ando M, Kakinuma Y, Arikawa M, Handa T, Yamasaki F, Sato T (2009) Vagal nerve stimulation prevents reperfusion injury through inhibition of opening of mitochondrial permeability transition pore independent of the bradycardiac effect. J Thoracic Cardiovascul Surgery 137 (1): 223–231. https://doi.org/10.1016/j.jtcvs.2008.08.020
Donato M, Buchholz B, Rodriguez M, Perez V, Inserte J, Garcia-Dorado D, Gelpi RJ (2013) Role of the parasympathetic nervous system in cardioprotection by remote hindlimb ischaemic preconditioning. Exp Physiol 98 (2): 425–434. https://doi.org/10.1113/expphysiol.2012.066217
Мрочек АГ, Булгак АГ, Басалай МВ, Барсукевич ВЧ, Гурин АВ (2014) Механизмы парасимпатических влияний на сердце в развитии противоишемического эффекта дистантного кондиционирования миокарда. Евраз кард журн 1: 81–88. [Mrochek AG, Bulgak AG, Basalay MV, Barsukevich VC, Gurin AV (2014) Mechanisms of parasympathetic influences on the heart in the development of the anti-ischemic effect of distant myocardium conditioning. Euras Cardiol J 1: 81–88.
Intachai K, Chattipakorn SC, Chattipakorn N, Shinlapwittayatorn K (2018) Revisiting the cardioprotective effects of acetylcholine receptor activation against myocardial ischemia/reperfusion injury. Int J Mol Sci 19 (9): 2466. https://doi.org/10.3390/ijms19092466
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии