Журнал эволюционной биохимии и физиологии, 2022, T. 58, № 6, стр. 487-497
РОЛЬ P2Y-РЕЦЕПТОРОВ В РЕГУЛЯЦИИ АТРОФИЧЕСКИХ ПРОЦЕССОВ В M. SOLEUS ПРИ ФУНКЦИОНАЛЬНОЙ РАЗГРУЗКЕ
К. А. Зарипова 1, С. П. Белова 1, Б. С. Шенкман 1, Т. Л. Немировская 1, *
1 Институт медико-биологических проблем РАН
Москва, Россия
* E-mail: Nemirovskaya@bk.ru
Поступила в редакцию 06.07.2022
После доработки 18.08.2022
Принята к публикации 29.08.2022
- EDN: AEZDWJ
- DOI: 10.31857/S0044452922060134
Аннотация
Атрофия скелетных мышц при их функциональной разгрузке обусловлена снижением белкового синтеза и резким увеличением его распада. Накопление АТФ в мышце при разгрузке, обнаруженное на ранних сроках, может быть одним из стимулов, запускающих этот процесс. Показано, что паннексиновые каналы пропускают АТФ при разгрузке мышц из цитоплазмы во внеклеточное пространство. Внеклеточный АТФ может восприниматься P2Y2-рецепторами. Для проверки гипотезы об участии P2Y2-рецепторов в регуляции сигнальных процессов в скелетных мышцах на ранних этапах функциональной разгрузки был применен селективный ингибитор P2Y2-рецепторов AR-C 18925XX. Ингибирование P2Y2-рецепторов AR-C 18925XX при 3-дневной функциональной разгрузке крыс снижает атрофию m. soleus, предотвращает накопление АТФ в m. soleus, замедляет экспрессию мРНК Е3-лигазы MAFbx, убиквитина и рецепторов IL6, способствует повышению уровня фосфорилирования AMPK, а также увеличивает интенсивность белкового синтеза.
Скелетная мышца чрезвычайно пластична. Снижение сократительной активности, или ее полное прекращение приводит к снижению массы мышц, площади поперечного сечения мышечных волокон, снижению максимальной силы и скорости мышечного сокращения, а также работоспособности [1–3]. Атрофия обусловлена снижением белкового синтеза и резким увеличением белкового распада [4]. Беловой и соавт. показано, что даже трехнедельное нахождение крыс в клетках ограниченного размера вызывает атрофию скелетных мышц, изменения клеточных сигнальных путей и ускоренный набор массы тела животных [5]. Атрофия скелетных мышц при функциональной разгрузке развивается очень быстро, и масса мышцы снижается уже после 3 дней воздействия [6]. В то же время ранние этапы развития атрофии менее изучены. Негативные изменения в маркерах сигнальных путей мышц начинают проявляться уже через несколько часов функциональной разгрузки. Например, экспрессия основных мышечных Е3-лигаз, участвующих в процессе деградации белка (MuRF1, MAFbx), достоверно повышается через 24 ч разгрузки мышц и достигает пика к 3‑м суткам [7]. Поэтому мы исследовали триггерные механизмы, запускающие белковую деградацию, при 3-суточном воздействии функциональной разгрузки на мышцу. Мы предположили, что одним из таких механизмов может быть накопление АТФ в мышце при разгрузке, обнаруженное ранее нами и другими авторами [6, 8, 9]. Стимул, активирующий работу АТФ-зависимых путей регуляции сигналинга скелетных мышц при их разгрузке, может быть следующий. Функциональная разгрузка мышц ведет к снижению электрической мышечной активности, открытию дигидропиридиновых (DHPR) Са-зависимых каналов L-типа, которые плотно соединены с паннексиновыми каналами [10]. Ранее показано, что паннексиновые каналы пропускают АТФ из цитоплазмы во внеклеточное пространство [11]. В 2021 г. подтверждено, что внеклеточный АТФ при функциональной разгрузке может являться одним из основных сигналов в скелетных мышцах для регулирования различных процессов, среди которых – экспрессия генов [6]. Показано, что паннексин (Panx1) – опосредованный транспорт АТФ влияет на экспрессию мышечно-специфичных E3 убиквитинлигаз MuRF1 и MAFbx и регулирует сигнальные пути, контролирующие процессы трансляции и элонгации белка при функциональной разгрузке мышц [6]. Высказано предположение о возможном вовлечении пуринергических рецепторов P2Y2 в эти процессы. В литературе имеются данные о том, что внеклеточный АТФ может восприниматься как P2Y2-, так и P2Y1-рецепторами [10, 12–15]. Для проверки нашей гипотезы об участии пуринергических рецепторов P2Y2 в процессе атрофии мышц мы блокировали P2Y2-рецепторы (чувствительные к адениловым нуклеотидам) специфическим ингибитором AR-C 118925XX, животные при этом подвергались 3-дневной мышечной разгрузке путем вывешивания. Специфические ингибиторы пуринергических рецепторов появились недавно и используются впервые при моделировании функциональной разгрузки мышц крыс. Мы впервые показали, что при разгрузке мышц активация специфических транскрипционных программ запускается в том числе с помощью передачи АТФ-опосредованных сигналов и пуринергические рецепторы принимают в этом участие. Ингибирование пуринергических рецепторов P2Y2 при 3-дневной разгрузке снижает атрофию мышц.
МЕТОДЫ ИССЛЕДОВАНИЯ
Эксперимент был одобрен комиссией по биомедицинской этике Института медико-биологических проблем РАН (протокол № 585) и соответствует современным нормам и стандартам работы с животными.
24 самца крыс Вистар массой тела 190 ± 10 г случайным образом были распределены на 3 группы по 8 крыс в каждой: контроль (группа С) c введением плацебо (10%-ный раствор диметилсульфоксида в физиологическом растворе, объем инъекции – 400 мкл), 3-суточное вывешивание (группа HS) с введением плацебо, 3-суточное вывешивание с введением ингибитора P2Y2-рецепторов AR-C 118925XX (10 мг/кг в день в 10%-ном растворе диметилсульфоксида в физиологическом растворе, внутрибрюшинно ) (группа А). AR-C 118925XX –химическое наименование: 5-[[5-(2,8-Dimethyl-5H-dibenzo[a,d]cyclohepten-5-yl)-3,4-dihydro-2-oxo-4-thioxo-1(2H)-pyrimidinyl]methyl]-N-2H-tetrazol-5-yl-2-furancarboxamide. Первая инъекция вводилась одновременно с вывешиванием, последующие – через 24 ч, не снимая животных с экспериментального стенда.
Вывешивание задних конечностей по методике Ильина–Новикова в модификации Morey–Holton [16] делалось так, что задние конечности крыс не касались пола, а передние свободно опирались на пол, и животные свободно передвигались. Крысы были подвешены на специальных мягких шинках. Данные показывают, что при таком способе проведения вывешивания животные не подвергаются стрессу, кровообращение хвоста не нарушается. Пищу и воду животные получали ad libitum. Через 3 дня эксперимента крыс наркотизировали внутрибрюшинной инъекцией трибромэтанола (240 мг/кг массы тела), выделяли m. soleus, немедленно замораживали в жидком азоте и хранили при –85°С. Животных умерщвляли введением летальной дозы трибромэтанола (480 мг/кг).
ОБРАБОТКА БИОМАТЕРИАЛА
Электрофорез с последующим вестерн-блоттингом
С каждого образца m. soleus были сделаны срезы толщиной 20 мкм (10–15 мг) на микротоме–криостате фирмы Leica и немедленно прогомогенизированы в течение 25 мин в 125 мкл лизирующего буфера RIPA (Santa-Cruz, США), содержащего 50 мM Tris (pH 7.4), 150 мM NaCl, 0.1% Triton X-100, 0.1% SDS, 5 мM EDTA (pH 8.0) 1 мM DTT, 1 мM PMSF, 1 мМ Na3VO4, 1 мM PMSF, апротинин (10 мкг/мл), леупептин (10 мкг/мл), пепстатин А (10 мкг/мл), протеазный ингибиторный коктейль (Santa-Cruz, США) и фосфатазный ингибиторный коктейль (Santa-Cruz,США), либо 50 мМ NaF и 50 мМ бета-глицерофосфата. Затем образцы центрифугировали при 20 000 g в течение 15 мин. Часть супернатанта отбирали для определения концентрации общего белка с помощью реактива Бредфорда (Bio-Rad Laboratories, США). Определения проводились на современном планшетном фотометре Epoch при длине волны 595 нм. Остальная часть белковых образцов была разаликвотирована в пробирки для дальнейшего проведения электрофоретических анализов. Образцы для нанесения разводились в 2-кратном Laemmli буфере для образцов (5.4 мМ Tris-HCl (pH 6.8), 4%-ный Ds-Na, 20%-ный глицерин, 10%-ный β меркаптоэтанол, 0.02%-ный бромфеноловый синий).
Электрофорез проводили в 10%-ном разделяющем ПААГ (0.2%-ный метилбисакриламид, 0.1%-ный Ds-Na, 375 мМ Tris-HCl (pH 8.8), 0.05%-ный персульфат аммония, 0.1%-ный ТЕМЕД) и в 5%‑ном концентрирующем ПААГ (0.2%-ный метилбисакриламид, 0.1%-ный Ds-Na, 125 мМ Tris-HCl (pH 6.8), 0.05%-ный аммоний персульфат, 0.1%‑ный ТЕМЕД). Для проведения электрофореза был использован трис-глициновый буфер (192 мМ Tris-глицин (pH 8.6), 0.1%-ный Ds-Na). Образцы каждой группы загружались на один гель с контрольными образцами. Образцы загружались из расчета 25 мкг общего белка в каждой пробе на дорожку и нормировались относительно уровня GAPDH, содержащегося в той же пробе. При необходимости для некоторых белков объем нанесения мог подбираться индивидуально. Электрофорез проводился при 15 мА на гель в мини-системе Bio-Rad Laboratories при комнатной температуре.
Вестерн-блоттинг. Электроперенос белков проводился в буфере (25 мМ Tris (pH 8.3), 192 мМ глицин, 20%-ный метанол, 0.04%-ный Ds-Na) на нитроцеллюлозную мембрану при 100 V при температуре 4°C в системе mini Trans-Blot (Bio-Rad Laboratories) в течение 2 ч. После электропереноса нитроцеллюлозные мембраны инкубировались в течение 5 мин в 0.3%-ном растворе Ponceau Red в 5%-ной уксусной кислоте, затем отмывались в PBS (Биолот) с 0.1%-ным Tween20 (PBST) до появления четких белковых полос на мембране. Этот этап проводился для контроля эффективности переноса, а также для того, чтобы убедиться, что количества общего белка, внесенного в каждую дорожку, было одинаковым. Мембраны блокировались в растворе 5%-ного сухого молока (Bio-Rad Laboratories) в PBST в течение 1 ч при комнатной температуре, затем помещались в раствор первичных антител на ночь при 4°С. Для выявления белковых полос были использованы первичные антитела против pErk1/2 (1:1000, #9101), Erk1/2 (1:1000, #4695), pAMPK (1:500, #2535), AMPK (1:1000, #2532), pP90 (1:1000, #9344), P90 (1:1000, #8408) фирмы “Cell Signaling Technology” (США), Puromycin (1:3000, EQ0001) фирмы Kerafast Inc. (США), GapDH (1:10 000, #G401) фирмы ABM (США).
Затем мембрана отмывалась от первичных антител в PBST 3 раза по 5 мин на шейкере и инкубировалась 1 ч со вторичными антителами goat-anti-rabbit (1:30 000, Jackson Immuno Research, США) или goat-anti-mouse (1:20 000, Bio-Rad Laboratories, США). Потом мембрана отмывалась от вторичных антител в PBST 3 раза по 5 мин на шейкере. Выявление проводилось с помощью Clarity Western ECL Substrate (Bio-Rad Laboratories, США). Хемилюминесцентный сигнал детектировался с помощью сканера C-DiGit Blot Scanner (LI-COR, США). Затем полученные на сканере изображения обрабатывались с помощью прилагаемого программного обеспечения Image Studio Software (LI–COR) для получения количественных данных для анализа. Для каждого параметра электрофорез с последующим иммуноблоттингом был повторен не менее 3 раз. Хемилюминесцентный сигнал исследуемых белков нормировался на сигнал GapDH. Данные вестерн-блоттинга представлены в виде соотношения сигнала фосфорилированной формы белка и сигнала, детектирующего весь этот белок, лишь при условии, что последний не изменяется.
Содержания АТФ в мышце
Для определения содержания АТФ в мышце использовался набор ATP Colorimetric/Fluorometric Assay Kit (MAK190; Sigma, St. Louis, MO, США). Образец ткани взвешивали, добавляли в пробирку 2 Н хлорную кислоту, 10 мкл/мг ткани и гомогенизировали. Затем пробы выдерживались на льду 30–45 мин. После этого образцы центрифугировали при 13 000 g 2 мин при 4°C, супернатант переносился в чистую пробирку. Объем супернатанта измеряли, доводили до 500 мкл с помощью ATP Assay Buffer. Хлорную кислоту нейтрализовали добавлением 2 M KOH (KOH добавляли постепенно, перемешивая и проверяя pH с помощью индикаторной бумаги до тех пор, пока pH пробы не достигал 6.5–8). Далее пробы центрифугировали при 13 000 g в течение 15 мин при 4°C. Супернатант использовали для дальнейшего определения АТФ.
В лунки планшета вносили по 50 мкл образца (и по 50 мкл подготовленных стандартов в диапазоне 2–10 нмоль/лунка) и 50 мкл ATP Reaction Mix, затем инкубировали 30 мин в темноте. Оптическую плотность каждого образца измеряли с помощью планшетного спектрофотометра при 570 нм. Концентрация АТФ рассчитывалась по следующей формуле:
Концентрация АТФ = B * DDF/V, где
B – количество АТФ в лунке с образцом, рассчитанное по стандартной кривой;
V – объем пробы, добавленный в лунки (50 мкл в нашем случае);
DDF – deproteinization dilution factor – фактор разведения, считался по формуле:
DDF = (500 мкл + объем KOH (мкл))/начальный объем пробы.
Исследование интенсивности синтеза белка
Для определения общего синтеза белка применялась методика SUnSET (surface sensing of translation) [17, 18]. За полчаса до введения наркоза животным вводили внутрибрюшинно 500 мкл 0.8%‑ного раствора пуромицина, который ингибирует рост полипептидной цепи на рибосоме. При этом содержание пуромицина в скелетной мышце коррелирует с интенсивностью синтеза белка. Включение пуромициновой метки оценивалось с помощью вестерн-блоттинга. Пептиды, меченные пуромицином, выявляются с использованием антител против пуромицина. Скорость или общее количество включения пуромицина, обнаруженное антителом против пуромицина, служит прямым показателем синтеза белка.
Исследование экспрессии генов
Выделение мРНК из мышечной ткани. Для проведения ПЦР в реальном времени и оценки количества мРНК в экспериментальных группах была выделена РНК из образцов мышечной ткани. Для выделения тотальной РНК из скелетных мышц была использована методика выделения РНК на микроколонках RNeasy Micro (Qiagen, Германия). Производилась нарезка m. soleus крысы на микротоме при толщине срезов 20 мкм. 4–6 мкг нарезанной ткани помещались в эппендорф с 300 мкл лизирующего буфера RLT, содержащего гуанидин тиоцианат, сильный белковый детергeнт, в который добавлялось 10 мкл β-меркаптоэтанола. Гомогенат был перемешен в течение 1 мин на Microspin FV-2400 (Biosan, Латвия). Затем к гомогенату было добавлено 589 мкл воды, очищенной от РНКазы, и 11 мкл раствора протеиназы К (18.7 мг/мл) (Синтол, Россия). Далее раствор инкубировался в течение 15 мин при 55°С, а затем центрифугировался при комнатной температуре 3 мин при 10 000 g. Супернатант переносился в новую пробирку с 450 мкл 96–100%-ного этилового спирта, смесь перемешивалась пипетированием. Данный лизат был перенесен на колонку в пробирке и центрифугировался 15 с при ≥ 8000 g. Смыв был отброшен. Колонка промывалась 350 мкл буфера RW1 центрифугированием в течение 15 с при 13 000 g, далее на 20 мин на силикагелевую мембрану колонки было нанесено 80 мкл ДНКазы I. Затем колонка последовательно была промыта буферами RW1, RPE, 80%-ным этанолом. Для элюции колонка была перенесена в эппендорф, на мембрану нанесено 30 мкл воды, проведено центрифугирование в течение 1 мин при 10 000 g. Эппендорф с водным раствором РНК немедленно был помещен в лед, а затем на хранение в холодильник (–85°С). При помощи данного метода выделяются в основном молекулы мРНК.
Концентрация мРНК определялась по поглощению раствора мРНК при помощи спектрофотометра NanoPhotometer IMPLEN, способного проводить измерения в объеме 2 мкл. Снимались показания в диапазоне от 200 до 320 нм. Измерение каждой пробы проводилось не менее 3 раз. Чистота образцов была оценена, исходя из соотношений показателей поглощения при различных длинах волн. Соотношение А260/А230 экспериментальных образцов было >2.0, это указывает на то, что они являлись достаточно чистыми от углеводов, пептидов, фенолов или ароматических соединений.
Обратная транскрипция
Для проведения обратной транскрипции были использованы реагенты фирмы Синтол, Россия. Для подготовки кДНК водный раствор, содержащий 1 мкг тотальной РНК, 30 мкМ случайных гексануклеотидов и 17.4 мкМ олиго-d(T)15, инкубировался 3 мин при 70°С и немедленно переносился на лед. Далее к смеси было добавлено 11.5 мкл мастер-микса (1.3 мМ дНТФ, 0.02 ед/мкл ингибитора РНКазы, 6 ед/мкл M-MLV-ревертазы, 4 мкл 5х-буфера для M-MLV-ревертазы, Синтол). После этого пробы помещались в амплификатор (iQ5 Multicolor Real-Time PCR Detection System, Bio-Rad Laboratories) для проведения обратной транскрипции: 10 мин при 25°С, 60 мин при 37°С, 5 мин при 95°С, 30 мин при 4°С. После проведения реакции образцы, содержащие кДНК, хранились при –25°С.
Проведение ПЦР в реальном времени
Для проведения ПЦР в реальном времени смешивалось 2 мкл кДНК, 2 мкл праймеров с концентрацией 10 мкМ и 21 мкл мастер-микса (0.3 мМ дНТФ, 3 мМ MgCl2, 2.5 мкл 10x ПЦР-буфера Б (pH 8.8), 0.06 ед./мкл Taq ДНК-полимеразы, Синтол). Затем пробы были помещены в амплификатор для проведения реакции.
Используемые в работе праймеры:
5'-ctgccaggcacccgtgctctactt-3' и 5'-ctgaggtcaagtgatcggaaggag-3' для P2Y2;
5'-gccaatttggtgctttttgt-3' и 5'-aaattcagtcctctccccgt-3' для MuRF-1;
5’-ctacgatgttgcagccaaga-3' и 5'-ggcagtcgagaagtccagtc-3' для MAFbx/Atrogine-1;
5'-caccaagaaggtcaaacagga-3' и 5'-gcaagaactttattcaaag-tgcaa-3' для убиквитина;
5'- tca-cag-agc-aga-gaa-tgg-act -3' и 5'- gta-tgg-ctg-ata-cca-caa-ggt -3' для IL6R;
5'- gta-ccc-ttc-ctc-ttc-cct-atg-c -3' и 5'- caa-tgc-caa-ctc-tcg-tca-aca-g -3' для RPL19.
Все праймеры были синтезированы фирмой Синтол (Россия). Для анализа полученных с помощью ПЦР в реальном времени данных применялось относительное количественное определение исследуемого гена, нормализованное к референсному, метод 2-ΔΔСt (метод Ливака). В качестве референсного гена был использован RPL19, экспрессия которого постоянна в m. soleus в условиях эксперимента.
Анализ полученных данных и статистическая обработка данных
Статистическая обработка данных производилась с помощью программы REST 2009 v.2.0.12 и OpenOffice.org Calc, находящихся в свободном доступе. REST 2009 v.2.0.12 позволяет анализировать данные по нескольким референсным генам, что снижает вероятность ошибки. Достоверность отличий между группами определялась с помощью критерия Краскела–Уоллиса. В тексте и на гистограммах результаты анализа экспрессии представлены в виде медианы и интерквартильной широты, результаты анализа относительного содержания белков с помощью вестерн-блоттинга представлены в виде среднего значения и ошибки среднего.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Влияние введения ингибитора на массу разгруженной m. soleus, экспрессию мРНК P2Y2-рецепторов и энергетический гомеостаз
За время эксперимента изменения массы тела крыс ни в одной из групп не наблюдалось. В группе вывешенных без препарата крыс (HS) масса m. soleus через 3 дня вывешивания была достоверно снижена на 10 мг по отношению к группе контроля (p < 0.05, рис. 1), в то время как между группой крыс, вывешенных с введением ингибитора P2Y2-рецепторов (группа А) и контролем различий не наблюдалось.
Рис. 1.
Масса m. soleus крыс после 3-дневного вывешивания. C – контроль, HS – 3-суточное вывешивание с введением плацебо, A – 3-суточное вывешивание с введением AR-C 118925XX. * – Достоверные отличия от группы C (p < 0.05).

Мы обнаружили пониженную на 36% экспрессию мРНК P2Y2 (гр. А) при применении специфического ингибитора у вывешенных животных (p < 0.05) относительно контрольной группы (рис. 2). В группе HS отличий от контроля не наблюдалось. Результат свидетельствует о специфическом действии ингибитора на белок-мишень и снижении его экспрессии в мышце.
Рис. 2.
Экспрессия мРНК P2Y2 в m. soleus крыс после 3‑дневного вывешивания. С – контроль, HS – 3-суточное вывешивание с введением плацебо, A – 3-суточное вывешивание с введением AR-C 118925XX. * – достоверные отличия от группы C (p < 0.05); # – достоверные отличия от групп HS (p < 0.05).

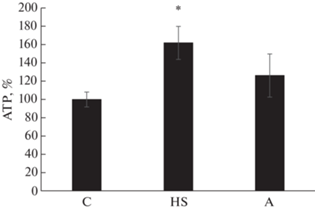
Уровень АТФ был существенно повышен только в группе вывешенных животных без введения препарата (HS) (на 62% по сравнению с группой контроля, p < 0.05, рис. 3). В группе А (с ингибированием P2Y2-рецепторов) этот параметр не отличался от группы контроля (рис. 3).
Рис. 3.
Содержание АТФ в m. soleus крыс после 3-дневного вывешивания. С – контроль, HS – 3-суточное вывешивание с введением плацебо, A – 3-суточное вывешивание с введением AR-C 118925XX. * – Достоверные отличия от группы C (p < 0.05).
В нашем исследовании содержание pAMPK в группе HS было существенно ниже, чем в группе контроля (рис. 4). Однако в группе A (c ингибированием P2Y2-рецепторов) ее уровень в m. soleus не отличался от контрольной группы.
Влияние введения ингибитора P2Y2-рецептора на маркеры белковой деградации
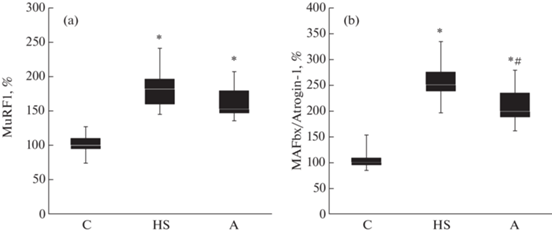
Мы определили уровень экспрессии мРНК Е3-убиквитинлигаз MuRF1 и MAFbx. Экспрессия MuRF1 у всех вывешенных животных была достоверно выше по сравнению с группой контроля (p < < 0.05, рис. 5a). Экспрессия мРНК MAFbx была высокой в вывешенных группах относительно уровня группы контроля (p < 0.05), однако в группе А экспрессия мРНК MAFbx была существенно ниже, чем в группе HS (вывешивания без препарата (p < 0.05, рис. 5b).
Рис. 5.
Экспрессия мРНК MuRF1 (a) и MAFbx/Atrogin (b) в m. soleus крыс после 3-дневного вывешивания. C – контроль, HS – 3-суточное вывешивание с введением плацебо, A – 3- суточное вывешивание с введением AR-C 118925XX. * – Достоверные отличия от группы C (p < 0.05); # – достоверные отличия от групп HS (p < 0.05).
Увеличение экспрессии мРНК убиквитина частично было предотвращено в группе животных, вывешенных с ингибированием P2Y2-рецепторов относительно группы контроля. В вывешенной без препарата группе HS его уровень был на 114% выше, чем в группе контроля, в то время как в группе с ингибированием P2Y2-рецепторов (т.е. в той группе, где не было атрофии камбаловидной мышцы) его экспрессия была повышена только на 48% (p < 0.05, рис. 6).
Рис. 6.
Экспрессия мРНК убиквитина в m. soleus крыс после 3-дневного вывешивания. С – контроль, HS – 3‑суточное вывешивание с введением плацебо, A – 3‑суточное вывешивание с введением AR-C 118925XX. * – достоверные отличия от группы C (p < 0.05); # – достоверные отличия от групп HS (p < 0.05).

Мы обнаружили увеличение экспрессии рецептора интерлейкина 6 (IL–6R) во всех m. soleus вывешенных животных (гр. HS и А) относительно группы контроля на 199 и 48% соответственно (рис. 7). Однако стоит отметить, что в группе А (где масса m. soleus не отличалась от группы контроля) экспрессия рецепторов IL-6 была значительно ниже, чем в группе вывешивания без препарата HS (p < 0.05).
Влияние введения ингибитора P2Y2-рецептора на маркеры, участвующие в регуляции белкового синтеза
Мы исследовали уровень фосфорилирования Erk1/2 (extracellular signal-regulated kinase) в m. soleus. Фосфорилирование Erk1/2 в m. soleus было снижено в группе вывешенных крыс (HS) на 63%. Введение ингибитора P2Y2-рецептора полностью предотвращало индуцированное разгрузкой снижение фосфорилирования Erk1/2 в группе А (рис. 8).
Рис. 8.
Содержание pErk1/2 в m. soleus крыс после 3‑дневного вывешивания. C – контроль, HS – 3-суточное вывешивание с введением плацебо, A – 3-суточное вывешивание с введением AR-C 118925XX. * – достоверные отличия от группы C (p < 0.05); # – достоверные отличия от групп HS (p < 0.05).

Уровень фосфорилирования p90RSK также был значительно снижен в вывешенной группе HS на 28% (p < 0.05) относительно группы контроля (рис. 9). Однако в группе А, вывешенной с ингибированием пуринергических рецепторов, уровень фосфорилирования p90RSK в m. soleus не отличался от группы контроля.
Рис. 9.
Содержание p-p90 в m. soleus крыс после 3-дневного вывешивания. C – контроль, HS – 3-суточное вывешивание с введением плацебо, A – 3-суточное вывешивание с введением AR-C 118925XX. * – достоверные отличия от группы C (p < 0.05); # – достоверные отличия от групп HS (p < 0.05).

Интенсивность синтеза белка была достоверно снижена на 60% в группе вывешивания HS (p < 0.05) относительно группы контроля. В группе А это снижение было почти в 2 раза ниже – 37% относительно контроля (рис. 10).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Нами обнаружено, что масса m. soleus была достоверно снижена относительно контроля только в группе вывешивания без препарата, указывая на замедление скорости атрофических процессов при ингибировании пуринергических рецепторов P2Y2. Мы впервые получили такой результат, так как ингибитор AR-C 118925XX рецепторов P2Y2 был выпущен недавно, и ингибирование пуринергических рецепторов при функциональной разгрузке мышц ранее не исследовалось. Наиболее близким способом (прототипом), направленным на предотвращение атрофии скелетных мышц при их функциональной разгрузке, можно считать способ Chen и соавт. [19]. В этой работе исследовали первичные мышечные фибробласты, выделенные из мышей дикого типа и мышей с отсутствием гена белка P2Y2, после повреждения у них нерва sciatic в течение 2, 4 и 6 нед. Авторы обнаружили меньшую атрофию мышцы у мышей при денервации, у которых отсутствовал ген белка P2Y2. Было показано, что P2Y2 усиливают атрофию скелетных мышц и активацию фибробластов после мышечного повреждения. Стоит отметить, что использование метода генных модификаций и воздействий на геном человека для предотвращения атрофии мышц у людей неприменимо. Можно полагать, что фармакологическое применение ингибиторов пуринергических рецепторов может быть использовано в медицине.
Рецепторы P2Y (в том числе Y1 и Y2) (связаны с рецептором, сопряженным с G-белком (GPCR)), активируются как ди-, так и трифосфат-пуриновыми или пиримидиновыми нуклеотидами. Мы исследовали роль рецепторов P2Y2 в регуляции клеточного сигналинга при функциональной разгрузке мышц. Экспрессия мРНК P2Y2- рецепторов при применении селективного ингибитора AR-C 118925XX была снижена относительно уровня группы контроля (рис. 2). Результат свидетельствует о специфическом действии ингибитора на белок-мишень и снижении его экспрессии в мышце. Так как этот рецептор взаимодействует с нуклеотидами, мы определили содержание АТФ в m. soleus всех экспериментальных групп. Уровень АТФ был существенно повышен только в группе вывешенных без введения препарата животных (HS), (на 62% по сравнению с группой контроля, рис. 3). О таком же повышении уровня АТФ при 3-дневном вывешивании крыс сообщалось ранее [6]. В группе с ингибированием P2Y2-рецепторов такого увеличения АТФ в m. soleus не было. Ранее показано, что АТФ вызывает увеличение Ca2+ путем активации рецептора P2Y2 и нижележащего пути IP3R специфически в медленной m. soleus [20]. Итак, ингибирование пуринергических P2Y2-рецепторов при разгрузке мышцы эффективно влияет на уровень в ней АТФ.
AMPK (аденозинмонофосфат-активируемая протеинкиназа) является ключевым регулятором энергетического гомеостаза. Уровень фосфорилирования AMPK может меняться в зависимости от продолжительности мышечной разгрузки [21–23]. В нашем исследовании содержание pAMPK в группе HS было значительно снижено относительно группы контроля (рис. 4). Однако в группе с ингибированием P2Y2-рецепторов (А) уровень ее фосфорилирования в m. soleus не отличался от уровня группы контроля. Фосфорилирование AMPK может регулироваться несколькими механизмами, включая метилирование [24] и содержание АМФ (аденозинмонофосфата). Активация AMPK регулируется также кальцием [25]. Можно отметить, что в группе с ингибированием P2Y2-пуринергических рецепторов снижение фосфорилирования AMPK при функциональной разгрузке m. soleus было полностью предотвращено. Можно предположить, что это произошло потому, что уровень АТФ, ингибирующий ее фосфорилирование, в этой группе не отличался от уровня группы интактного контроля (в отличие от группы HS).
Итак, ингибирование P2Y2-рецепторов в m. soleus при ее функциональной разгрузке замедляет развитие в ней атрофии, накопление АТФ и снижение фосфорилирования AMPK – ключевого регулятора энергетического гомеостаза.
Влияние введения ингибитора P2Y2-рецептора на маркеры белковой деградации
Экспрессия Е3-лигаз MuRF1 и MAFbx в m. soleus обеих групп вывешенных крыс была существенно выше, чем в группе контроля (рис. 5a, b). Однако в группе А увеличение экспрессии мРНК MAFbx (но не MuRF1) было значительно заторможено относительно группы вывешивания без препарата (рис. 5b). MAFbx является убиквитинлигазой, участвующей в убиквитинировании белков, что ведет к атрофии мышц [26]. Ранее было показано увеличение экспрессии мРНК этих Е3-лигаз при 3-дневном вывешивании крыс [6]. Увеличение экспрессии мРНК убиквитина частично предотвращалось в группе, вывешенной с ингибированием P2Y2-рецепторов, относительно группы контроля (рис. 6), т.е. в той группе, где не было атрофии камбаловидной мышцы. Убиквитинирование белков является меткой их дальнейшей деградации [26, 27].
Увеличение экспрессии мРНК рецептора интерлейкина 6 (IL-6R) было обнаружено в m. soleus всех вывешенных животных (рис. 7), но в группе А оно было в 2 раза ниже, чем в группе HS. Известно, что содержание интерлейкина-6 (IL-6), миокина увеличивается при функциональной разгрузке мышц, что ассоциируется с экспрессией в них атрогенов (MuRF1 и MAFbx) и атрофией [28]. Блокирование рецепторов IL-6 предотвращает развитие атрофии m. soleus [28], а введение IL-6 в мышцу, напротив, ведет к ее атрофии [29]. IL-6 способен влиять на генную экспрессию через эпигеномную модификацию [30].
Пуринергические рецепторы P2Y2 имеют отношение к регуляции экспрессии мРНК MAFbx и убиквитина, и их ингибирование при разгрузке m. soleus существенно замедляет в ней экспрессию мРНК IL-6R, что может способствовать снижению степени ее атрофии.
Влияние введения ингибитора P2Y2-рецептора на маркеры, участвующие в регуляции белкового синтеза
Мы исследовали маркер MAPK сигнального пути Erk1/2. MAPK фосфорилируют белки-мишени по остаткам серина и треонина и таким образом передают сигнал дальше. Фосфорилирование Erk1/2 (по сайтам Thr202/Tyr204) в m. soleus в нашем эксперименте было снижено в группе HS на 63%, p < 0.05. Ранее мы отмечали снижение уровня фосфорилирования Erk1/2 при 1- и 3-дневном вывешивании крыс [6]. Введение ингибитора P2Y2-рецептора полностью предотвратило индуцированное разгрузкой снижение фосфорилирования Erk1/2 в группе А. В большинстве случаев событие фосфорилирования Erk1/2 по сайтам Thr202/Tyr204 не зависит от рапамицина и, следовательно, считается, что оно происходит независимо от пути mTORC1 [31]. Активированный Erk1/2 может фосфорилировать и активировать p90RSK [31–33]. P90RSK (рибосомальная серин/треонин киназа p90) является маркером Erk1/2-сигнального пути и участвует в трансляции белка [34]. p90RSK регулирует активность mTORC1 и синтез белка посредством фосфорилирования TSC2 и Raptor [35–38]. Уровень ее фосфорилирования изменялся в нашем эксперименте синхронно с уровнем Erk1/2: был значительно снижен в вывешенной группе HS (на 28%) относительно группы контроля (рис. 9). Снижение содержания p-p90RSK при 3-дневном вывешивании выявляли ранее [6]. Однако в группе А уровень фосфорилирования p90RSK в m. soleus не отличался от группы контроля. Различия в уровне фосфорилирования p90RSK между группами HS и А указывают на то, что снижение атрофии m. soleus в группе А могло быть связано с лучшим регулированием процессов белкового синтеза в вывешенной с ингибированием P2Y2-рецепторов группе.
Оценивая интегральный показатель интенсивности синтеза белка с помощью введения пуромицина (метод SUnSET), мы также обнаружили существенно более высокий уровень интенсивности синтеза белка в группе А относительно группы вывешивания без препарата, что свидетельствует об активизации белкового синтеза в этой группе.
Вывод. Впервые показано, что активация атрофических процессов при разгрузке m. soleus запускается в том числе с помощью передачи АТФ-опосредованных сигналов, и пуринергические рецепторы P2Y2 принимают участие в ее регуляции.
Блокирование рецепторов P2Y2 замедляет развитие атрофии m. soleus при разгрузке как за счет снижения протеолитических процессов (экспрессии MAFbx и убиквитина), так и за счет увеличения интенсивности синтеза белка (в 1.5 раза) через сигнальный каскад ERK/p90RSK.
Список литературы
Baldwin KM, Haddad F (2002) Skeletal muscle plasticity: cellular and molecular responses to altered physical activity paradigms. Am J Phys Med Rehabil 81 (11 Suppl): S40–S51. https://doi.org/10.1097/01.PHM.0000029723.36419.0D
Fitts RH, Riley DR, Widrick JJ (2000) Physiology of a microgravity environment invited review: microgravity and skeletal muscle. J Appl Physiol (1985) 89 (2): 823–839. https://doi.org/10.1152/jappl.2000.89.2.823
Fluck M, Hoppeler H (2003) Molecular basis of skeletal muscle plasticity-from gene to form and function. Rev Physiol Biochem Pharmacol 146: 159–216. https://doi.org/10.1007/s10254-002-0004-7
Hodson N, West DWD, Philp A, Burd NA, Moore DR (2019) Molecular regulation of human skeletal muscle protein synthesis in response to exercise and nutrients: a compass for overcoming age-related anabolic resistance. Am J Physiol Cell Physiol 317 (6): C1061–C1078. https://doi.org/10.1152/ajpcell.00209.2019
Белова СП, Тыганов СА, Мочалова ЕП, Шенкман БС (2021) Ограничение двигательной активности и синтез белка в постуральных и локомоторных мышцах.Рос физиол журн им ИМ Сеченова 107: 842–853. [Belova SP, Tyganov SA, Mochalova EP, Shenkman BС (2021) Restricted Activity and Protein Synthesis in Postural and Locomotor Muscles. Russ J Physiol (2021) 107: 842–853. (In Russ)].https://doi.org/10.1134/S0022093021030194
Zaripova KA, Kalashnikova EP, Belova SP, Kostrominova TY, Shenkman BS, Nemirovskaya TL (2021) Role of Pannexin 1 ATP-Permeable Channels in the Regulation of Signaling Pathways during Skeletal Muscle Unloading. Int J Mol Sci 22 (19).https://doi.org/10.3390/ijms221910444
Shenkman BS (2020) How Postural Muscle Senses Disuse? Early Signs and Signals. Int J Mol Sci 21 (14).https://doi.org/10.3390/ijms21145037
Ohira Y, Yasui W, Kariya F, Wakatsuki T, Nakamura K, Asakura T, Edgerton VR (1994) Metabolic adaptation of skeletal muscles to gravitational unloading. Acta Astronaut 33: 113–117. https://doi.org/10.1016/0094-5765(94)90115-5
Gupta RC, Misulis KE, Dettbarn WD (1989) Activity dependent characteristics of fast and slow muscle: biochemical and histochemical considerations. Neurochem Res 14 (7): 647–655. https://doi.org/10.1007/BF00964874
Casas M, Buvinic S, Jaimovich E (2014) ATP signaling in skeletal muscle: from fiber plasticity to regulation of metabolism. Exerc Sport Sci Rev 42 (3): 110–116. https://doi.org/10.1249/JES.0000000000000017
Dahl G (2015) ATP release through pannexon channels. Philos Trans R Soc Lond B Biol Sci 370 (1672). https://doi.org/10.1098/rstb.2014.0191.
May C, Weigl L, Karel A, Hohenegger M (2006) Extracellular ATP activates ERK1/ERK2 via a metabotropic P2Y1 receptor in a Ca2+ independent manner in differentiated human skeletal muscle cells. Biochem Pharmacol 71 (10): 1497–1509. https://doi.org/10.1016/j.bcp.2006.02.003
Arias-Calderon M, Almarza G, Diaz-Vegas A, Contreras-Ferrat A, Valladares D, Casas M, Toledo H, Jaimovich E, Buvinic S (2016) Characterization of a multiprotein complex involved in excitation-transcription coupling of skeletal muscle. Skelet Muscle 6: 15. https://doi.org/10.1186/s13395-016-0087-5
Riquelme MA, Cea LA, Vega JL, Boric MP, Monyer H, Bennett MV, Frank M, Willecke K, Saez JC (2013) The ATP required for potentiation of skeletal muscle contraction is released via pannexin hemichannels. Neuropharmacology 75: 594–603. https://doi.org/10.1016/j.neuropharm.2013.03.022
Liu B, Cao W, Li J, Liu J (2018) Lysosomal exocytosis of ATP is coupled to P2Y2 receptor in marginal cells in the stria vascular in neonatal rats. Cell Calcium 76: 62–71. https://doi.org/10.1016/j.ceca.2018.09.006
Morey-Holton E, Globus RK, Kaplansky A, Durnova G (2005) The hindlimb unloading rat model: literature overview, technique update and comparison with space flight data. Adv Space Biol Med 10: 7–40. https://doi.org/10.1016/s1569-2574(05)10002-1
Goodman CA, Mabrey DM, Frey JW, Miu MH, Schmidt EK, Pierre P, Hornberger TA (2011) Novel insights into the regulation of skeletal muscle protein synthesis as revealed by a new nonradioactive in vivo technique. FASEB J 25 (3): 1028–1039. https://doi.org/10.1096/fj.10-168799
Ravi V, Jain A, Mishra S, Sundaresan NR (2020) Measuring Protein Synthesis in Cultured Cells and Mouse Tissues Using the Non-radioactive SUnSET Assay. Curr Protoc Mol Biol 133 (1): e127. https://doi.org/10.1002/cpmb.127
Chen M, Chen H, Gu Y, Sun P, Sun J, Yu H, Zheng H, Chen D (2021) P2Y2 promotes fibroblasts activation and skeletal muscle fibrosis through AKT, ERK, and PKC. BMC Musculoskelet Disord 22 (1): 680. https://doi.org/10.1186/s12891-021-04569-y
Ito N, Ruegg UT, Takeda S (2018) ATP-Induced Increase in Intracellular Calcium Levels and Subsequent Activation of mTOR as Regulators of Skeletal Muscle Hypertrophy. Int J Mol Sci 19 (9).https://doi.org/10.3390/ijms19092804
Vilchinskaya NA, Mochalova EP, Nemirovskaya TL, Mirzoev TM, Turtikova OV, Shenkman BS (2017) Rapid decline in MyHC I(beta) mRNA expression in rat soleus during hindlimb unloading is associated with AMPK dephosphorylation. J Physiol (London) 595 (23): 7123–7134. https://doi.org/10.1113/JP275184
Tyganov SA, Mochalova EP, Belova SP, Sharlo KA, Rozhkov SV, Vilchinskaya NA, Paramonova, II, Mirzoev TM, Shenkman BS (2019) Effects of Plantar Mechanical Stimulation on Anabolic and Catabolic Signaling in Rat Postural Muscle Under Short-Term Simulated Gravitational Unloading. Front Physiol 10: 1252. https://doi.org/10.3389/fphys.2019.01252
Stouth DW, Manta A, Ljubicic V (2018) Protein arginine methyltransferase expression, localization, and activity during disuse-induced skeletal muscle plasticity. Am J Physiol Cell Physiol 314 (2): C177–C190. https://doi.org/10.1152/ajpcell.00174.2017
Stouth DW, vanLieshout TL, Ng SY, Webb EK, Manta A, Moll Z, Ljubicic V (2020) CARM1 Regulates AMPK Signaling in Skeletal Muscle. iScience 23 (11): 101755. https://doi.org/10.1016/j.isci.2020.101755
Mathew TS, Ferris RK, Downs RM, Kinsey ST, Baumgarner BL (2014) Caffeine promotes autophagy in skeletal muscle cells by increasing the calcium-dependent activation of AMP-activated protein kinase. Biochem Biophys Res Commun 453 (3): 411–418. https://doi.org/10.1016/j.bbrc.2014.09.094
Bodine SC, Latres E, Baumhueter S, Lai VK, Nunez L, Clarke BA, Poueymirou WT, Panaro FJ, Na E, Dharmarajan K, Pan ZQ, Valenzuela DM, DeChiara TM, Stitt TN, Yancopoulos GD, Glass DJ (2001) Identification of ubiquitin ligases required for skeletal muscle atrophy. Science 294 (5547): 1704–1708. https://doi.org/10.1126/science.1065874
Glass DJ (2003) Signalling pathways that mediate skeletal muscle hypertrophy and atrophy. Nat Cell Biol 5 (2): 87–90. https://doi.org/10.1038/ncb0203-87
Yakabe M, Ogawa S, Ota H, Iijima K, Eto M, Ouchi Y, Akishita M (2018) Inhibition of interleukin-6 decreases atrogene expression and ameliorates tail suspension-induced skeletal muscle atrophy. PLoS One 13 (1): e0191318. https://doi.org/10.1371/journal.pone.0191318
Sun H, Sun J, Li M, Qian L, Zhang L, Huang Z, Shen Y, Law BY, Liu L, Gu X (2021) Transcriptome Analysis of Immune Receptor Activation and Energy Metabolism Reduction as the Underlying Mechanisms in Interleukin-6-Induced Skeletal Muscle Atrophy. Front Immunol 12: 730070. https://doi.org/10.3389/fimmu.2021.730070
Hodge DR, Cho E, Copeland TD, Guszczynski T, Yang E, Seth AK, Farrar WL (2007) IL-6 enhances the nuclear translocation of DNA cytosine-5-methyltransferase 1 (DNMT1) via phosphorylation of the nuclear localization sequence by the AKT kinase. Cancer Genomics Proteomics 4 (6): 387–398.
Hodson N, Philp A (2019) The Importance of mTOR Trafficking for Human Skeletal Muscle Translational Control. Exerc Sport Sci Rev 47 (1): 46–53. https://doi.org/10.1249/JES.0000000000000173
Cargnello M, Roux PP (2011) Activation and function of the MAPKs and their substrates, the MAPK-activated protein kinases. Microbiol Mol Biol Rev 75 (1): 50–83. https://doi.org/10.1128/MMBR.00031-10
Yu M, Blomstrand E, Chibalin AV, Krook A, Zierath JR (2001) Marathon running increases ERK1/2 and p38 MAP kinase signalling to downstream targets in human skeletal muscle. J Physiol 536 (Pt 1): 273–282. https://doi.org/10.1111/j.1469-7793.2001.00273.x
Mirzoev TM, Shenkman BS (2018) Regulation of Protein Synthesis in Inactivated Skeletal Muscle: Signal Inputs, Protein Kinase Cascades, and Ribosome Biogenesis. Biochemistry (Mosc) 83 (11): 1299–1317. https://doi.org/10.1134/S0006297918110020
Roux PP, Blenis J (2004) ERK and p38 MAPK-activated protein kinases: a family of protein kinases with diverse biological functions. Microbiol Mol Biol Rev 68 (2): 320–344. https://doi.org/10.1128/MMBR.68.2.320-344.2004
Kimball SR, Jefferson LS (2006) Signaling pathways and molecular mechanisms through which branched-chain amino acids mediate translational control of protein synthesis. J Nutr 136 (1 Suppl): 227S–231S. https://doi.org/10.1093/jn/136.1.227S
Carriere A, Ray H, Blenis J, Roux PP (2008) The RSK factors of activating the Ras/MAPK signaling cascade. Front Biosci 13: 4258–4275. https://doi.org/10.2741/3003
Carriere A, Cargnello M, Julien LA, Gao H, Bonneil E, Thibault P, Roux PP (2008) Oncogenic MAPK signaling stimulates mTORC1 activity by promoting RSK-mediated raptor phosphorylation. Curr Biol 18 (17): 1269–1277. https://doi.org/10.1016/j.cub.2008.07.078
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии





