Известия РАН. Физика атмосферы и океана, 2020, T. 56, № 1, стр. 89-96
О взаимовлиянии минеральных и органических компонентов в атмосферном аэрозоле
А. Н. Ермаков a, *, А. Е. Алоян b, В. О. Арутюнян b
a Институт энергетических проблем химической физики им. В.Л. Тальрозе Федерального исследовательского
центра химической физики им. Н.Н. Семенова РАН
Москва, Ленинский пр., 38, Россия
b Институт вычислительной математики им. Г.И. Марчука РАН
Москва, ул. Губкина, 8, Россия
* E-mail: polclouds@yandex.ru
Поступила в редакцию 21.06.2019
После доработки 07.08.2019
Принята к публикации 07.08.2019
Аннотация
В работе рассматривается влияние сульфата аммония ((NH4)2SO4) на конденсацию малолетучих органических компонентов в атмосферном аэрозоле. Физико-химический анализ проведен (модель UNIFAC) на примере конденсации продукта фотохимических превращений изопрена и α-пинена в атмосфере: ISNP. В работе приводятся расчетные данные об изменчивости массового содержания ISNP, массовой концентрации частиц аэрозоля и их фазовом состоянии при различных температурах (Т) и относительных влажностях воздуха (RH). Найдено, что переход органического компонента в водную фазу аммиачно-сульфатных частиц наблюдается лишь при определенных сочетаниях T и RH. При этом в сравнении с конденсацией в отсутствие сульфата аммония содержание ISNP при заданных T и RH оказывается как меньшим, так и более высоким. По результатам расчетов найдено также, что формирующиеся частицы смешанного состава характеризуются бóльшей гигроскопичностью и бóльшей склонностью к переходу в капли (miscible liquid phase) при влажности воздуха меньшей, чем для частиц, включающих лишь сульфат аммония.
ВВЕДЕНИЕ
Несмотря на важность учета климатообразующего потенциала частиц органического аэрозоля (ОА), их влияние на тепловой баланс атмосферы остается по-прежнему неопределенным [1, 2]. Причины видятся не только в разнообразии компонентов и морфологии этих частиц, но и в наличии в их составе минеральных соединений, в том числе воды. Их присутствие в составе ОА вызвано низким содержанием органических соединений (ОС) в атмосфере и их конденсацией на ядрах конденсации (preexisting particles) или частицах высохшей капельной влаги облаков (aerosol seed) [3]. Такой механизм возникновения ОА наряду с их старением заставляет считаться также и с возможными химическими реакциями между минеральными и органическими компонентами в частицах. Так, в [4–6] рассматривалась возможность гетерогенных каталитических процессов и процесса кислотного гидролиза с участием минеральных и органических компонентов частиц смешанного состава. В [7–10] сообщалось, что ОС в аэрозоле могут оказывать влияние на гигроскопичность неорганических компонентов аэрозоля. При этом масштабы и направление этого влияния остаются противоречивыми [3]. В [11] нами отмечалось положительное влияние влажности воздуха на конденсацию ISNP в аэрозольные частицы в атмосфере, что удалось связать с переходом его молекул в формирующуюся при этом водную фазу частиц. Цель данной работы – проследить за влиянием сульфата аммония – одной из главных компонент ядер конденсации и частиц высохших облачных капель на конденсацию в атмосфере малолетучего ISNP.
ПРЕДВАРИТЕЛЬНЫЕ СВЕДЕНИЯ
Источником малолетучих компонентов в атмосфере, конденсация которых на ядрах конденсации ведет к формированию частиц вторичного аэрозоля, служат химические и фотохимические превращения первичных ОС естественного и антропогенного происхождения (изопрен, α-пинен и мн. др.) [2]. Так, в [12, 13] сообщалось о регистрации в воздухе частиц неорганического аэрозоля “загрязненных” полиароматическими углеводородами (от 7 до 100 нг/м3). В [14] отмечалось, что массовая концентрация атмосферного аэрозоля в Пекине не менее чем на 2/3 обусловлена присутствием в частицах компонентов органического происхождения. В шлейфах природных пожаров содержащих сульфатные частицы фиксировались органические соединения, включающих нитро и сульфатные группы [15]. Их присутствие также свидетельствует о химических реакциях с участием ОС и минеральных компонентов в частицах. В [16] с применением 3D региональной модели нами исследовалась динамика формирования, а также пространственно-временная изменчивость содержания “загрязненных” ОС аэрозольных частиц над очагами лесных и торфяных пожаров. В отсутствие пересыщения конденсация ОС рассматривалась на инертных (сульфатных и генерируемых очагом горения сажевых) аэрозольных частицах. При этом исключалась присущая сульфатным частицам гигроскопичность, т.е. их склонность при колебаниях температуры и RH спонтанно поглощать или терять атмосферную влагу. Эти свойства характеризуют значениями относительной влажности воздуха, по достижению которых кристаллы таких соединений или их растворы самопроизвольно поглощают (efflorescence point, ${\text{RH}}_{{{\text{eff}}}}^{{298}}$ (0.32)) или теряют влагу (deliquescence point, ${\text{RH}}_{{{\text{del}}}}^{{298}}$ (0.8)), трансформируясь при этом в водный раствор или кристаллическое состояние. В скобках приводятся значения рассматриваемых ${\text{RH}}_{i}^{{298}}$ для сульфата аммония при T = 298.15 [17].
ТЕРМОДИНАМИЧЕСКАЯ МОДЕЛЬ
Для рассмотрения влияния аммиачно-сульфатных частиц на конденсацию ОС и их массовое содержание в аэрозольной фазе в атмосфере в работе использовалась модель UNIFAC (UNiversal Functional Activity Coefficient) [18]. Данная полуэмпирическая модель, базирующаяся на предложенной Ленгмюром концепции “group-contribution concept”, демонстрирует удовлетворительное согласие предсказываемых на ее основе свойств для широкого круга композиций ОС и минеральных соединений [18]. Более подробно основы этой модели были описаны нами в [11]. В настоящее время модель UNIFAC (Standard) интегрирована в Extended Atmospheric Inorganic Model (E-AIM [19]), что позволяет производить и вычисления необходимых при физико-химическом анализе абсолютных значений коэффициентов активности отдельных ионов. Рассматриваемые в E-AIM многокомпонентные системы включают в водной фазе как неорганические электролиты, в том числе кристаллические соли, гидраты и ионные компоненты, так и растворенные органические соединения (кислоты, спирты и др.), а гидрофобная фаза содержит только органические соединения, например, алканы и другие неполярные соединения. В качестве стандартного состояния для перечисленных выше веществ в водной фазе рассматривается их состояние при бесконечном разведении.
Рассматриваемый в качестве модельного ОС малолетучий компонент ISNP – продукт фотохимических преобразований в атмосфере первичных изопрена (C5H8) и α-пинена (C10H16), характеризующихся значительной эмиссией [20]:
Ключевую роль при этом играют т.н. “ночные” нитратные радикалы (NO3), а также радикалы НО2, высокие концентрации которых над очагами лесных и торфяных пожаров даже в дневное время (до ~109 см–3) обеспечиваются значительными концентрациями озона, оксидов азота и формальдегида [16]. Не слишком длинная углеродная цепь ISNP и несколько гидрофильных групп (–OH, –OOH, –NO2) в составе его молекул благоприятствуют их переходу в водную фазу аэрозоля.
При выполнении расчетов (“on line” в пакете Е-AIM) в соответствии с [21] и др. компонент ISNP рассматривался как переохлажденная жидкость. Предварительно были найдены температурные зависимости давления насыщения индивидуального ISNP ($P_{{{\text{ISNP}}}}^{^\circ }$) и его коэффициента распределения между газовой и безводной аэрозольной фазами в сухом воздухе (KISNP, м3/мкг [11]). При T = 298.15 К: $P_{{{\text{ISNP}}}}^{^\circ }$ = 1.23 × 10–10 атм и KISNP ≈ ≈1 м3/мкг [11]. Отсюда следует, что при T = 298.15 К для термодинамически равновесного распределения рассматриваемого компонента поровну между газовой в аэрозольной фазами содержание ISNP в сухом воздухе не должно превышать $2K_{{{\text{ISNP}}}}^{{ - 1}}$ (≈2 мкг/м3), а при T = 288 К приблизительно на порядок ниже (≈0.2 мкг/м3).
При расчетах парциальных давлений PISNP над трехкомпонентными частицами ISNP–(NH4)2SO4–Н2О, содержанием в них ISNP и сульфата аммония и их зависимости от температуры и RH производились, принимая во внимание процессы диссоциации электролитов и фазовые переходы, а также формирования продуктов их взаимодействия с водой. В их числе диссоциация сульфата аммония на ионы и выход в газовую фазу летучих компонентов: NH3(gas) + H2SO4(gas) $\mathop \to \limits^ \leftarrow $ (NH4)2SO4(cr); ($P_{{{\text{N}}{{{\text{H}}}_{3}}}}^{2}{{P}_{{{{{\text{H}}}_{2}}{\text{S}}{{{\text{O}}}_{4}}}}}$)T= 298.15 = 6.5708 × 10–40 атм3 и 3NH3(gas) ++ 2H2SO4(gas)$\mathop \to \limits^ \leftarrow $ (NH4)3H(SO4)2(cr), ($P_{{{\text{N}}{{{\text{H}}}_{3}}}}^{3}P_{{{{{\text{H}}}_{2}}{\text{S}}{{{\text{O}}}_{4}}}}^{2}$)T= 298.15 = = 5.713 × 10–69 атм5, NH3(аq)$\mathop \to \limits^ \leftarrow $ NH3(gas), H2SO4(аq) $\mathop \to \limits^ \leftarrow $ $\mathop \to \limits^ \leftarrow $ H2SO4(gas) [19], а также формирование гидратов серной кислоты (${{K}_{{{{{\text{H}}}_{2}}{\text{S}}{{{\text{O}}}_{4}} \cdot {{{({{{\text{H}}}_{2}}{\text{O}})}}_{n}}}}}$) в водной фазе аэрозоля: H2SO4 ⋅ H2O; 1.6468, H2SO4 ⋅ 4H2O; 9.4383 × 10–4, H2SO4 ⋅ 6.5H2O; 1.464 × 10–2 [22]. Здесь ($P_{{{\text{N}}{{{\text{H}}}_{3}}}}^{i}P_{{{{{\text{H}}}_{2}}{\text{S}}{{{\text{O}}}_{4}}}}^{i}$)T= 298.15 и (${{K}_{{{{{\text{H}}}_{2}}{\text{S}}{{{\text{O}}}_{4}} \cdot {{{({{{\text{H}}}_{2}}{\text{O}})}}_{n}}}}}$)T= 298.15 – константы равновесия фазовых переходов и константы равновесия формирования индивидуальных гидратов серной кислоты (в расчете на мольную долю компонентов) при T = 298.15 К. Как и ранее [11], расчеты производились при фиксированном содержании в атмосфере ISNP (mISNP_gas = 1.9715 мкг/м3).
РЕЗУЛЬТАТЫ РАСЧЕТОВ И ИХ ОБСУЖДЕНИЕ
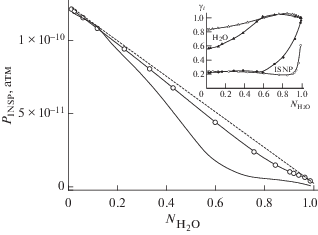
На рис. 1 в качестве примера приводится сравнение рассчитанных при T = 298.15 К зависимостей равновесных парциальных давлений ISNP (PISNP, атм) от мольной доли воды (${{N}_{{{{{\text{H}}}_{2}}{\text{O}}}}}$) в водной фазе аэрозольных частиц, включающих соответственно 2 и 3 компонента: “вода/ISNP” и “вода/ISNP/(NH4)2SO4”. Пунктиром и светлыми значками показаны PISNP над двухкомпонентными частицами. Их величины находились с использованием закона Рауля (пунктир) для идеальных растворов (PISNP_Rault = $P_{{{\text{ISNP}}}}^{^\circ }$(1 – ${{N}_{{{{{\text{H}}}_{2}}{\text{O}}}}}$)) и модели UNIFAC (светлые кружки). Темные кружки – рассчитанные PISNP над трехкомпонентными частицами, массовое содержание сульфата аммония в которых принималось равным ${{m}_{{({\text{N}}{{{\text{H}}}_{4}})2{\text{S}}{{{\text{O}}}_{4}}}}}$ ≈ 3.3 мкг/м3 (2.5 × 10–8 моль/м3). Отметим, что по данным натурных экспериментов содержание минеральных соединений в аэрозольных частицах в атмосфере колеблется в пределах 0.2–100 мкг/м3.
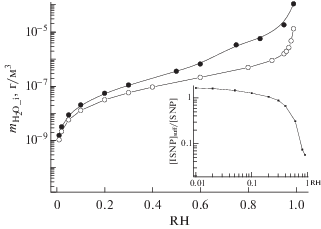
По результатам расчетов было найдено, что рост RH сопровождается увеличением массового содержания воды в водной фазе частиц обеих видов (см. рис. 2 ), а также их массового содержания в атмосфере (не показано). Наблюдаемое при 0.1 ≤ ${{N}_{{{{{\text{H}}}_{2}}{\text{O}}}}}$ ≤ 0.8 снижение парциального давления ISNP в ряду: PISNP_Rault > PISNP_UNIFAC_2 > PISNP_UNIFAC_3 отражает отклонения от аддитивности при переходе от идеальных (PISNP_Rault) к реальным двухкомпонентным (PISNP_UNIFAC_2) и трехкомпонентным (PISNP_UNIFAC_3) растворам. Здесь и далее цифры в подстрочнике обозначает принадлежность к двухкомпонентным и трехкомпонентным частицам аэрозоля. Внимание привлекает также, что частицы смешанного состава поглощают атмосферную влагу при влажностях воздуха, значительно уступающих по абсолютной величине ${\text{RH}}_{{{\text{eff}}}}^{{298}}$((NH4)2SO4) ≈ 0.3–0.35. Подобный рост гигроскопичности частиц смешанного состава отмечался и в лабораторных экспериментах при изучении конденсации продуктов фотоокисления изопрена на частицах сульфата аммония [3]. Возвращаясь к обсуждению результатов наших расчетов, отметим, что, вопреки низким влажностям воздуха ($ \ll {\text{RH}}_{{{\text{ef}}}}^{{298}}$), содержание воды в водной фазе частиц смешанного состава при заданной влажности превышает таковое в двухкомпонентных частицах. Так, при RH = 0.3, например, ${{m}_{{{{{\text{H}}}_{2}}{\text{O}}{\kern 1pt} \_{\kern 1pt} 2}}}$ = 0.06, а ${{m}_{{{{{\text{H}}}_{2}}{\text{O}}{\kern 1pt} \_{\kern 1pt} 3}}}$ = 0.12 мкг/м3 (см. рис. 2 ).
В [11] нами отмечалось, что причиной конденсации ISNP и поглощения частицами атмосферной влаги, ведущей к формированию двухкомпонентных частиц в атмосфере, является переход его молекул в растворенное состояние. Это обеспечивает благоприятный энергетический баланс суммы взаимодействий в водной фазе частиц гидрофильных и гидрофобных групп молекул ISNP друг с другом и с молекулами воды. В результате действующая концентрация H2O в водной фазе, т.е. активность воды (aW, безразмерная) и давление паров воды над частицами, снижается, что при постоянстве RH обеспечивает их поступление из воздуха, а вместе с этим рост размеров частиц и их массовой концентрации (см. рис. 2 ). На снижение aW указывают рассчитанные коэффициенты активности воды (${{\gamma }_{{{{{\text{H}}}_{2}}{\text{O}}{\kern 1pt} \_{\kern 1pt} 2}}}$), см. вставку на рис. 1 . Их значения оказываются меньшими по абсолютной величине, чем найденные из выражения ${{\gamma }_{{{{{\text{H}}}_{2}}{\text{O}}}}}$ = ${{{{P}_{{{{{\text{H}}}_{2}}{\text{O}}}}}} \mathord{\left/ {\vphantom {{{{P}_{{{{{\text{H}}}_{2}}{\text{O}}}}}} {P_{{{{{\text{H}}}_{2}}{\text{O}}}}^{^\circ } \cdot {{N}_{{{{{\text{H}}}_{2}}{\text{O}}}}}}}} \right. \kern-0em} {P_{{{{{\text{H}}}_{2}}{\text{O}}}}^{^\circ } \cdot {{N}_{{{{{\text{H}}}_{2}}{\text{O}}}}}}}.$ Здесь ${{\gamma }_{{{{{\text{H}}}_{2}}{\text{O}}}}}$ и ${{P}_{{{{{\text{H}}}_{2}}{\text{O}}}}}$ – коэффициент активности воды (в расчете на мольную долю) и давление паров воды над двухкомпонентными частицами, рассчитанное в соответствии с законом Рауля для идеальных растворов, т.е. в отсутствие межмолекулярных взаимодействий ISNP/вода, ведущих к отклонениям от аддитивности.
Найденный в аналогичных условиях (Т, RH, mISNP) прирост содержания воды в трехкомпонентных частицах следует единственно связывать с усилением гигроскопичности сульфата аммония в водной фазе частиц в присутствии ISNP. Причиной выступает высокая растворимость сульфата аммония, что обуславливает электролитическая диссоциация его молекул на ионы. Вместо одной молекулы сульфата аммония в водной фазе возникает два аммонийных и один сульфатный ион, т.е. три частицы. Появление этих ионов в дополнение к межмолекулярным взаимодействиям в двухкомпонентных частицах порождает множественные межионные (двух, трех и более частичные), а также ион-дипольные взаимодействия в концентрированной по сульфатным и аммонийным ионам водной фазе частиц. Их энергетика и служат причиной снижения ${{\gamma }_{{{{{\text{H}}}_{2}}{\text{O}}{\kern 1pt} \_{\kern 1pt} 3}}}$ и aW_3 (не показано), в том числе и при невысоких ${{N}_{{{{{\text{H}}}_{2}}{\text{O}}}}}$ (см. вставку на рис. 1 ). На значимую роль этих взаимодействий в изменениях ${{\gamma }_{{{{{\text{H}}}_{2}}{\text{O}}{\kern 1pt} \_{\kern 1pt} 3}}}$ и aW_3 в водной фазе аэрозоля при RH $ \ll $ ${{\left( {{\text{RH}}_{{{\text{del}}}}^{{298}}} \right)}_{{{{{({\text{N}}{{{\text{H}}}_{4}})}}_{2}}{\text{S}}{{{\text{O}}}_{4}}}}}$ указывает и найденный в расчетах пропорциональный рост aW_3 с увеличением ${{N}_{{{\text{NH}}_{4}^{ + }}}}$ ≤ 0.1 (не показано). Композиции ISNP и (NH4)2SO4 характеризуются бóльшей гигроскопичностью, чем каждый компонент в отдельности. Их совместное присутствие в частицах ведет к изменению свободной энергии Гиббса воды в водной фазе частиц смешанного состава. Как результат, в расчетах отмечается и бóльшее по абсолютной величине падение давления паров воды (${{P}_{{{{{\text{H}}}_{2}}{\text{O}}{\kern 1pt} \_{\kern 1pt} 3}}}$) над частицами (${{\gamma }_{{{{{\text{H}}}_{2}}{\text{O}}{\kern 1pt} \_{\kern 1pt} 3}}}$ = ${{{{P}_{{{{{\text{H}}}_{2}}{\text{O\_3}}}}}} \mathord{\left/ {\vphantom {{{{P}_{{{{{\text{H}}}_{2}}{\text{O\_3}}}}}} {P_{{{{{\text{H}}}_{2}}{\text{O}}}}^{^\circ } \cdot {{N}_{{{{{\text{H}}}_{2}}{\text{O}}}}}}}} \right. \kern-0em} {P_{{{{{\text{H}}}_{2}}{\text{O}}}}^{^\circ } \cdot {{N}_{{{{{\text{H}}}_{2}}{\text{O}}}}}}}$), чем ${{P}_{{{{{\text{H}}}_{2}}{\text{O}}{\kern 1pt} \_{\kern 1pt} 2}}}.$ При постоянстве RH это обеспечивает бóльшее поглощение влаги из воздуха и бóльшие поэтому величины ${{m}_{{{{{\text{H}}}_{2}}{\text{O}}{\kern 1pt} \_{\kern 1pt} 3}}},$ чем ${{m}_{{{{{\text{H}}}_{2}}{\text{O}}{\kern 1pt} \_{\kern 1pt} 2}}}$ (см вставку на рис. 1 и данные рис. 2 ).
Несмотря на рост гигроскопичности частиц смешанного состава и вызванное этим увеличение содержания воды в водной фазе трехкомпонентных частиц, основная масса сульфата аммония в рассматриваемых условиях (Т, RH, mISNP, ${{m}_{{{{{({\text{N}}{{{\text{H}}}_{4}})}}_{2}}{\text{S}}{{{\text{O}}}_{4}}}}}$) и при относительно невысоких ${{N}_{{{{{\text{H}}}_{2}}{\text{O}}}}}$ остается в форме кристаллических солей: (NH4)2SO4(cr) и (NH4)3H(SO4)2(cr). Так, при RH = 0.3, например, в форме не растворившихся солей в частицах находится более 98% по весу от содержания сульфата аммония. Рассчитанное его содержание в водной фазе частиц, нарастает пропорционально массе/объему поглощаемой воды увеличивающейся по мере роста RH. Это говорит о постоянстве концентраций в водной фазе сульфатных (${\text{HSO}}_{4}^{--}$ и ${\text{SO}}_{4}^{{2--}}$) и аммонийных ионов. Напротив, в кристаллической фазе мольное соотношение аммонийных солей при этом изменяется в пользу (NH4)2SO4(cr) от ≈6 до ≈23, что говорит о неустойчивости в таких условиях соединения (NH4)3H(SO4)2(cr) обусловленном, главным образом, смещением вправо равновесия диссоциации сульфатных ионов: ${\text{HSO}}_{4}^{--}\,\,\mathop \to \limits^ \leftarrow \,\,{\text{SO}}_{4}^{{2--}}$ + H+ по мере поглощения влаги из воздуха.
Подытоживая, можно констатировать, что глубокий спад PISNP над трехкомпонентными частицами при конденсации ISNP (0.2 ≤ ${{N}_{{{{{\text{H}}}_{2}}{\text{O}}}}}$ ≤ 0.6) обусловлен ростом массового содержания водной фазы в частицах (${{m}_{{{{{\text{H}}}_{2}}{\text{O}}{\kern 1pt} \_{\kern 1pt} 3}}}$). При этом для самых малых ${{N}_{{{{{\text{H}}}_{2}}{\text{O}}}}}$ (<0.2) в расчетах отмечается рост содержания ISNP в трехкомпонентных частицах в сравнении с двухкомпонентными частицами, что связано с усилением их гигроскопичности. При бóльших ${{N}_{{{{{\text{H}}}_{2}}{\text{O}}}}}$, напротив, в трехкомпонентных частицах наблюдается более низкое его содержание (см. вставку рис. 2 ). Здесь показано соотношение концентраций ISNP в водной фазе частиц в присутствии сульфата аммония к таковой в его отсутствие. Видно, что присутствие сульфата аммония в водной фазе частиц заметно сказывается на концентрации ISNP в водной фазе частиц за счет изменения гигроскопичности частиц. Об этом говорят и данные расчетов индивидуальных коэффициентов активности ISNP (γISNP_i), см. вставку на рис. 1 . При 0.2 ≤ ${{N}_{{{{{\text{H}}}_{2}}{\text{O}}}}}$ ≤ 0.6 и равенстве ${{N}_{{{{{\text{H}}}_{2}}{\text{O\_3}}}}}$ и ${{N}_{{{{{\text{H}}}_{2}}{\text{O\_2}}}}}$ соотношение коэффициентов активности в присутствии и в отсутствие сульфата аммония: γISNP_3/γISNP_2 > 1.
Чем обусловлено снижение растворимости ISNP в трехкомпонентных частицах при 0.2 ≤ ${{N}_{{{{{\text{H}}}_{2}}{\text{O}}}}}$ ≤ 0.6? Причиной служит различие свободных энергий Гиббса растворенного ISNP в воде и в водной фазе аэрозольных частиц, представляющих собой концентрированные водные растворы сульфата аммония (около 40 вес. %). Вызванное этим изменение энергии Гиббса водной фазы частиц, ведущее к изменениям aW, эквивалентно формированию энергетического барьера препятствующего переходу молекул ISNP в водную фазу трехкомпонентных частиц. Принимая в первом приближении, что переход молекул ISNP из воды в концентрированный раствор сульфата аммония (при T = 298.15 К, ≈40 вес. %) сопровождается близким к нулю изменением энтропии (Δ298S ≈ 0) для величины энергетического барьера такого перехода молекул ISNP (Δ298H) при минимальных ${{N}_{{{{{\text{H}}}_{2}}{\text{O}}}}}$ (≈0.01), например, будем иметь Δ298H ≈ Δ298G ≈ RT × × ln(${{{{\gamma }_{{{{{\text{H}}}_{2}}{\text{O}}\_{\text{Rault}}}}}} \mathord{\left/ {\vphantom {{{{\gamma }_{{{{{\text{H}}}_{2}}{\text{O}}\_{\text{Rault}}}}}} {{{\gamma }_{{{{{\text{H}}}_{2}}{\text{O}}\_3}}}}}} \right. \kern-0em} {{{\gamma }_{{{{{\text{H}}}_{2}}{\text{O}}\_3}}}}}$) ≈ 0.33 ккал/моль. Здесь Δ298G – изменение свободной энергии Гиббса, отвечающей рассматриваемому переходу молекул ISNP. Несмотря на кажущийся малым, этот энергетический барьер существенно сказывается на растворимости ISNP. Так, при рассматривавшейся выше влажности воздуха RH = 0.3, т.е. при значительно бóльших ${{N}_{{{{{\text{H}}}_{2}}{\text{O}}}}}$, наличие такого барьера снижает растворимость ISNP приблизительно на треть.
Влияние этого барьера ослабевает и практически исчезает при переходе к более высоким RH и ${{N}_{{{{{\text{H}}}_{2}}{\text{O}}}}}$. В таких условиях коэффициент активности и активность воды, а также их ход с ростом ${{N}_{{{{{\text{H}}}_{2}}{\text{O}}}}}$ в двух- и трехкомпонентных частицах оказываются практически идентичными (см. вставку на рис. 1 ), что указывает на разбавление водой водной фазы частиц и снижение концентраций в ней ISNP и сульфата аммония. Одновременно с этим при содержании воды в водной фазе частиц, отвечающем таким условиям (${{N}_{{{{{\text{H}}}_{2}}{\text{O}}}}}$ > 0.6), наблюдается ослабление влияния сульфата аммония на растворимость ISNP. На вставке рис. 1 этому ослаблению отвечает приближение γISNP_3 к γISNP_Rault. Подобный рост, хотя и при гораздо бóльших ${{N}_{{{{{\text{H}}}_{2}}{\text{O}}}}}$, обнаруживаетcя в двухкомпонентных частицах, см. кривую, отвечающую γISNP_2. Их величины при наращивании ${{m}_{{{{{\text{H}}}_{2}}{\text{O}}\_2}}}$ в аэрозольных частицах также приближаются к значениям, отвечающим идеальным растворам (закон Рауля, γISNP= ${{\gamma }_{{{{{\text{H}}}_{2}}{\text{O}}}}}~$ = 1). Парциальные давления ISNP при этом над частицами обеих видов приближаются при этом к рассчитанным с применением закона Рауля и снижаются с уменьшением его мольной доли в смеси линейно с ростом ${{N}_{{{{{\text{H}}}_{2}}{\text{O}}}}}$ (PISNP ∼ $P_{{{\text{ISNP}}}}^{^\circ }$ ⋅(1 – ${{N}_{{{{{\text{H}}}_{2}}{\text{O}}}}}$)), см. рис. 1 .
В рассматриваемых условиях, т.е. при высокой влажности воздуха, наблюдается полное растворение сульфата аммония в трехкомпонентных частицах; двухфазные первоначально частицы, включающие не растворившийся сульфат аммония, при $N_{{{{{\text{H}}}_{2}}{\text{O\_3}}}}^{{298}}$ > 0.6 трансформируются в капли трехкомпонентного раствора: ISNP–(NH4)2SO4–Н2О (miscible liquid phase [3]). Это происходит при весовой доле органического компонента по отношению к минеральной составляющей ≈0.4. Отметим, что такой переход в частицах смешанного состава осуществляется при меньшей влажности воздуха в сравнении с подобным переходом в отсутствие органического компонента: ${{({\text{RH}}_{{{\text{del}}}}^{{298}})}_{(}}_{{{\text{N}}{{{\text{H}}}_{4}}{{)}_{2}}{\text{S}}{{{\text{O}}}_{4}}}}$ = 0.8. С полным переходом в растворенное состояние (NH4)2SO4 и его разбавлением при высоких RH (больших ${{N}_{{{{{\text{H}}}_{2}}{\text{O}}}}}$) и связан наблюдаемый на вставке рис. 1 рост γISNP_3 в трехкомпонентных частицах. Суммируя вышесказанное, приходим к выводу, что раз сформировавшиеся частицы вторичного ОА оказываются в атмосфере устойчивыми при широких вариациях T и RH и могут переноситься, по-видимому, на гораздо бóльшие расстояния, чем аммиачно-сульфатные частицы.
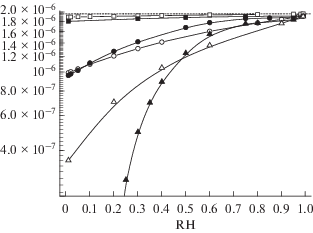
Как могут проявить себя изменения свойств рассматриваемых композиций сульфата аммония и ISNP при формировании частиц органического аэрозоля в атмосфере? Рисунок 3 показывает результаты расчетов влияния относительной влажности атмосферного воздуха на содержание ISNP в аэрозольной фазе для двухкомпонентных (светлые точки) и трехкомпонентных (темные точки) частиц при T = 288.15, 298.15 и 303.15 К. Как и ранее, расчеты производились при фиксированном содержании в атмосфере ISNP (mISNP_gas = 1.9715 мкг/м3).
Видно, что рост RH при заданной температуре сопровождается увеличением содержания ISNP в частицах, т.е. перераспределением этого соединения в атмосфере в пользу аэрозоля. При этом повышение температуры требует для конденсации ISNP все бóльшей влажности воздуха. Внимание привлекает различия глубин перераспределения ISNP в двухкомпонентных и трехкомпонентных частицах, а также различия хода зависимостей mISNP_i = f(RH). Так, при низкой температуре (Т = = 288.15 К), несмотря на фиксируемый в расчетах рост mISNP_3, с увеличением RH его величина оказывается меньше mISNP_2 при всех рассматриваемых RH (см. рис. 3 ). Подобная ситуация, хотя и в более узком диапазоне RH, наблюдается и при других температурах. При T = 298 К, например, mISNP_2/mISNP_3 > 1 лишь при RH ≤ 0.1, а при T = = 303 K вплоть до RH ≤ 0.6. Эти данные с очевидностью указывают на существование особых условий (особых сочетаний T и RH) необходимых для формирования частиц вторичного органического аэрозоля в атмосфере, т.е. при конденсации малолетучих ОС на ядрах конденсации и высохших облачных каплях. При T = 303 К и влажности меньшей 0.6, например, конденсация ISNP на частицах сульфата аммония практически не происходит; наблюдается ингибирование сульфатом аммония формирования частиц вторичного ОА.
Найденные различия mISNP в составе двухкомпонентных и трехкомпонентных частиц при вариациях T и RH обусловлены совокупным влиянием температуры на растворимость сульфата аммония и энергетику межионных взаимодействий в водной фазе частиц и давление насыщенных паров ISNP. Так, понижение температуры, например, приводит к росту растворимости сульфата аммония [3] и снижению $P_{{{\text{ISNP}}}}^{^\circ }$. В отсутствие сульфата аммония в водной фазе при T = 288.15 K оказывается около 96% ISNP по массе (см. сплошную линию на рис. 3 ). Причина – снижение давления насыщения ISNP и рост KISNP. При этом переход в конденсированную фазу оставшихся ≈4% ISNP требует повышения влажности вплоть до RH = 1 (см. рис. 3 ). Содержание жидкой влаги при этом в частицах возрастает до ≈13 мкг/м3, что составляет около 87% по массе.
В присутствии сульфата аммония такому росту концентрации ISNP с увеличением RH при низкой температуре противостоит т.н. “высаливание” ISNP минеральным компонентом, т.е. уменьшение активности воды, в водной фазе аэрозольных частиц, влекущее за собой снижение растворимости ISNP (см. вставку на рис. 1 и рис. 3 ). Это “высаливание” ISNP обусловлено ростом содержания в водной фазе продуктов диссоциации сульфата аммония, сопровождающееся усилением межионных и ион-дипольных взаимодействий и снижением активности воды. По этой причине содержание ISNP в трехкомпонентных частицах при T = 288.15 К уступает таковому в двухкомпонентных частицах при всех рассматриваемых RH (наблюдается ингибирование конденсации ISNP). Этот эффект следует иметь в виду при рассмотрении опытных данных и при их сопоставлении с результатами моделирования.
Наблюдаемое снижение mISNP_3 в сравнении с mISNP_2 в атмосфере при более высоких температурах обусловлено ростом давления насыщения ISNP и снижением растворимости сульфата аммония. Так, при T = 303.15 K и RH = 0.01, например, в отсутствие сульфата аммония в аэрозольной фазе по данным расчетов оказывается лишь около 20% по массе ISNP; сказывается рост давления насыщения. В таких условиях присутствие в водной фазе аэрозоля сульфатных и аммонийных ионов ведущее к понижению активности воды формируют за счет межионных и др. взаимодействий столь высокий энергетический барьер для перехода молекул ISNP в водную фазу, что практически исключает их поступление из воздуха. Это приводит к тому, что в недостаточно влажной атмосфере конденсация ISNP оказывается затрудненной, что и приводит к mISNP_3/mISNP_2$ \ll $ 1. Присутствие сульфата аммония в частицах и связанное с ним высаливание ингибирует конденсацию ISNP. Положение меняется при бóльших RH, отвечающих формированию частиц с большим содержанием воды. При T = 303.15 К это достигается, как отмечалось, при RH > 0.53, а при T = 298.15 К при RH > 0.1. При этом отмечается увеличение содержания ISNP в водной фазе частиц аэрозоля, т.е. промотирование сульфатом аммония конденсации ISNP, а вместе с этим и промотирование формирования в атмосфере частиц вторичного органического аэрозоля.
ЗАКЛЮЧЕНИЕ
В работе рассматривается влияние минеральных соединений на формирования в атмосфере аэрозольных частиц смешанного состава возникающих при конденсации малолетучих органических соединений на ядрах конденсации и др. источниках минеральных соединений в атмосфере. Исследование природы этого влияния проведено на примере конденсации, малолетучего ISNP, возникающего при фотохимических превращениях изопрена и α-пинена в атмосфере на частицах сульфата аммония. По результатам расчетов получены данные об изменчивости массового содержания ISNP, массовой концентрации частиц аэрозоля смешанного состава и их фазового состояния при вариациях температуры (Т) и относительной влажности (RH) в атмосфере. Показано, что их формирование, т.е. конденсация ISNP на частицах сульфата аммония, происходит лишь при определенных сочетаниях T и RH. При этом массовое содержание ISNP в частицах оказывается как большим, так и меньшим в сравнении с частицами не содержащих сульфат аммония. Такая изменчивость содержания ISNP в частицах свидетельствует о том, что присутствие сульфата аммония в ядрах конденсации, например, может оборачиваться как промотированием, так и ингибированием конденсации малолетучих соединений, а вместе с этим и формирования частиц вторичного органического аэрозоля в атмосфере. В расчетах обнаруживается также, что формирующийся при конденсации органических соединений на сульфатных частицах аэрозоль характеризует высокая гигроскопичность. При меньшей влажности воздуха в таких частицах наблюдается и фазовый переход в капли трехкомпонентных растворов (miscible liquid phase). По результатам физико-химического рассмотрения сделан предварительный вывод, что частицы вторичного органического аэрозоля устойчивы к колебаниям метеопараметров и могут переноситься в атмосфере на дальние расстояния, что следует принимать во внимание при рассмотрении данных натурных наблюдений.
Работа выполнена при поддержке Российского фонда фундаментальных исследований №№ 18-05-00289, 19-05-50007, 20-05-00044, а также при финансировании Госзаданий ИВМ РАН и ИНЭП ХФ РАН им. В.Л. Тальрозе ФИЦ им. Н.Н. Семенова (тема AAAA-0047-2018-0012).
Список литературы
Seinfeld J.H., Pandis S.N. Atmospheric Chemistry and Physics: From Air Pollution to Climate Change. New York: John Wiley & Sons, 2006.
Kanakidou M., Seinfeld J.H., Pandis S.N. et al. Organic aerosol and global climate modeling: a review // Atmos. Chem. Phys. 2005. V. 5. № 4. P. 1053–1123.
Smith M.L., Bertram A.K., Martin S.T. Deliquescence, efflorescence, and phase miscibility of mixed particles of ammonium sulfate and isoprene-derived secondary organic material // Atmos. Chem. Phys. 2012. V. 12. № 19. P. 9613–9628.
Jang M., Czoschke N.M., Lee S., Kamens R.M. Heterogeneous atmospheric aerosol production by acid-catalyzed particle-phase reactions // Science. 2002. V. 298. P. 814–817.
Kroll J.H., Chan A.W.H., Ng N.L., Flagan R.C., Seinfeld J.H. Reactions of semivolatile organics and their effects on secondary organic aerosol formation. // Environ. Sci. Technol. 2007. V. 41. № 10. P. 3545–3550.
Lu Z.F., Hao J.M., Takekawa H., Hu L.H., Li J.H. Effect of high concentrations of inorganic seed aerosols on secondary organic aerosol formation in the m-xylene/NOx photooxidation system // Atmos. Environ. 2009. V. 43. № 4. P. 897–904.
Saathoff H., Naumann K.H., Schnaiter M., Schock W., Mohler O., Schurath U., Weingartner E., Gysel M., Baltensperger U. Coating of soot and (NH4)2SO4 particles by ozonolysis products of alpha-pinene // J. Aerosol Sci. 2003. V. 34. № 10. P. 1297–1321.
Takahama S., Pathak R.K., Pandis S.N. Efflorescence transitions of ammonium sulfate particles coated with secondary organic aerosol // Environ. Sci. Technol. 2007. V. 41. № 7. P. 2289–2295.
Bertram A.K., Martin S.T., Hanna S.J. et al. Predicting the relative humidities of liquid-liquid phase separation, efflorescence, and deliquescence of mixed particles of ammonium sulfate, organic material, and water using the organic-to-sulfate mass ratio of the particle and the oxygen-to-carbon elemental ratio of the organic component // Atmos. Chem. Phys. 2011. V. 11. № 21. P. 10995–11006.
Smith M.L., Kuwata M., Martin S.T. Secondary organic material produced by the dark ozonolysis of alpha-pinene minimally affects the deliquescence and efflorescence of ammonium sulfate // Aerosol Sci. Tech. 2011. V. 45. № 2. P. 244–261.
Ермаков А.Н., Алоян А.Е., Арутюнян В.О. О влиянии влажности воздуха на формирование частиц органического аэрозоля в атмосфере // Оптика атмосферы и океана. 2019. Т. 32. № 2. С. 141–146.
Горшков А.Г., Маринайте И.И., Оболкин В.А., Барам Г.И., Ходжер Т.В. Полициклические ароматические углеводороды в снежном покрове побережья оз. Байкал // Оптика атмосферы и океана. 1998. Т. 11. № 8. С. 913–918.
Рапута В.Ф., Ходжер Т.В., Горшков А.Г., Куценогий К.П. Некоторые закономерности загрязнения окрестностей Иркутска полиароматическими углеводородами // Оптика атмосферы и океана. 1998. Т. 11. № 6. С. 650–653.
He K.B., Yang F.M., Ma Y.L., Zhang Q., Yao X.H., Chan C.K., Cadle S., Chan T., Mulawa P. The characteristics of PM2.5 in Beijing, China // Atmos. Environ. 2001. V. 35. № 29. P. 4959–4970.
Linuma Y., Muller C., Boдe O., Gnauk T., Herrmann H., The formation of organic sulfate esters in the limonene ozonolysis secondary organic aerosol (SOA) under acidic conditions. Atmos. Environ. 2007. V. 41. № 27. P. 5571–5583.
Aloyan A.E., Yermakov A.N., Arutyunyan V.O. Dynamics of gas admixtures and aerosols in forest and peat fires // Russ. J. Numer. Anal. Math. Modell. 2014. V. 29. № 2. P. 79–92.
Brooks S.D., Wise M.E., Cushing M., Tolbert M.A. Deliquescence behavior of organic/ammonium sulfate aerosol // Geophys. Res. Lett. 2002. V. 29. № 19. P. 23-1–23-4.
Hansen H.K., Rasmussen P., Fredenslund A., Schiller M., Gmehling J. Vapor-Liquid Equilibria by UNIFAC Group-Contribution. 5. Revision and Extension // Ind. Eng. Chem. Res. 1991. V. 30. № 10. P. 2352–2355.
http://www.aim.env.uea.ac.uk/aim/aim.php.
Amiro B.D., Todd J.B., Wotton B.M. et al. Direct carbon emissions from Canadian forest fires, 1959–1999 // Can. J. Forest Res. 2001. V. 31. № 3. P. 512–515.
Pankow J.F. An absorption model of gas/particle partitioning of organic compounds in the atmosphere // A-tmos. Environ. 1994. V. 28. № 2. P. 185–188.
Koop Th., Carslaw K.S., Peter Th. Thermodynamic stability and phase transitions of PSC particles // Geophys. Res. Lett. 1997. V. 24. № 17. P. 2199–2202.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Физика атмосферы и океана