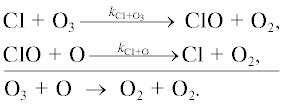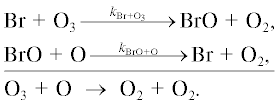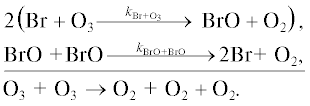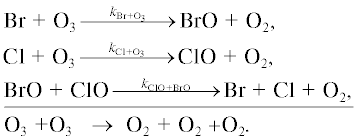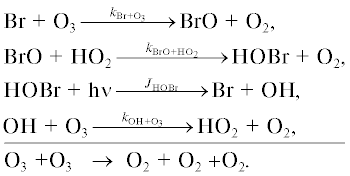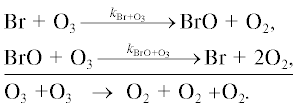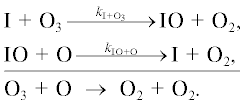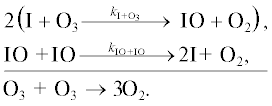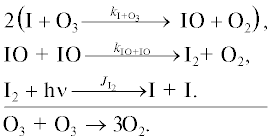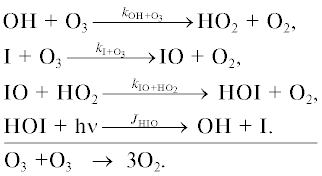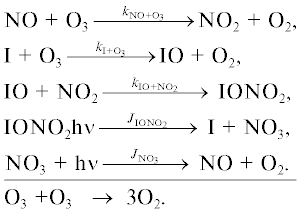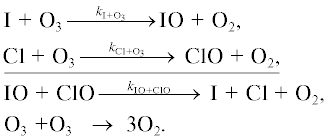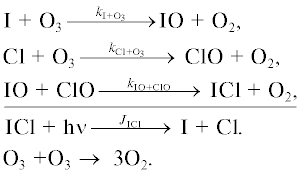Известия РАН. Физика атмосферы и океана, 2022, T. 58, № 4, стр. 456-466
Длина цепи галоидных каталитических циклов разрушения озона
И. К. Ларин *
Институт энергетических проблем химической физики им. В.Л. Тальроз Федерального исследовательского центра химической физики им. Н.Н. Семенова РАН
119334 Москва, Ленинский просп., 38, корп. 2, Россия
* E-mail: iklarin@narod.ru
Поступила в редакцию 24.11.2021
После доработки 11.03.2022
Принята к публикации 11.04.2022
- EDN: CJSPYB
- DOI: 10.31857/S0002351522040083
Аннотация
Представлены данные о длине цепи каталитических циклов разрушения озона ClOx, BrOx и IOx для условий июня и января 2000-го года. Расчет высотных профилей концентраций малых атмосферных составляющих и температуры, необходимых для определения скорости продолжения и обрыва цепи в циклах, производился с помощью интерактивной двумерной модели SOCRATES и одномерной модели АТМО для условий июня и январе 2000-го года на широте 50° с.ш. в диапазоне высот 0–50 км. В качестве начальных данных для расчетов использовались прогнозы атмосферного содержания парниковых газов Межправительственной группы экспертов по изменению климата RCP 4.5 для тех же условий.
ВВЕДЕНИЕ
Влияние каталитических циклов разрушения стратосферного озона ClOx и BrOx на озоновый слой неоднократно обсуждалась в литературе [1–15]. Несколько меньшее внимание уделялось йодному циклу, что объясняется с одной стороны естественным происхождением атмосферных йодных частиц, а с другой стороны более, чем скромным вкладом этого цикла в общую гибель атмосферного озона. Тем не менее, можно привести несколько примеров [см. 16–19], в которых обсуждаются вопросы участия IOx цикла в атмосферный химии и, в частности, в химии озоносферы. Что же касается длины цепи галоидных и других циклов, то этому вопросу, насколько известно автору, уделялось довольно скромное внимание. Во всяком случае, этот вопрос не рассматривался ни в одной из приведенных выше монографий (за исключением авторской книги [6]). Что касается отдельных публикаций (таких, как, например, [20]), то мы рассмотрим их содержание в свое время. Теперь же остановимся на некоторых методических вопросах решения задачи, которая вынесена в заголовок настоящей статьи.
Как известно из химической кинетики (см., например, [21]), длину цепи неразветвленного цепного процесса ν можно рассчитать по формуле (1):
(1)
$v = \frac{{{\text{скорость}}\,\,{\text{продолжения}}\,\,{\text{цепи}}}}{{{\text{скорость}}\,\,{\text{обрыва}}}}.$Таким образом, для решения нашей задачи необходимо определить “скорость продолжения цепи” и “скорость обрыва цепи”.
Чтобы найти “скорость продолжения цепи”, рассмотрим цепной процесс разрушения озона, который в простейшем случае можно представить следующим образом:
Поскольку реакции продолжения цепи 2 и 3 протекают последовательно, то скорость разрушения нечетного кислорода (т.е. О3 и О) согласно [21] будет определяться так называемой лимитирующей стадией процесса. Как это показано в [6], при наличии двух реакций продолжения цепи, 2 и 3, скорость лимитирующей стадии (равная “скорости продолжения цепи”, используемой в (1)), ${{W}_{{{\text{lim}}}}}( - {{{\text{O}}}_{3}})$, определяется выражением (2):
(2)
$\begin{gathered} {{W}_{{\lim }}}( - {{{\text{O}}}_{3}}) = {{\left( {\frac{1}{{{{W}_{{\text{2}}}}}} + \frac{1}{{{{W}_{{\text{3}}}}}}} \right)}^{\begin{gathered} - 1 \hfill \\ \end{gathered} }}, \\ {\text{или}}\,\,\,{{W}_{{{\text{lim}}}}}( - {{{\text{O}}}_{3}}) = \frac{{{{W}_{{\text{2}}}}{{W}_{{\text{3}}}}}}{{{{W}_{{\text{2}}}} + {{W}_{{\text{3}}}}}}, \\ \end{gathered} $При трeх реакциях продолжения цепи, идущих со скоростями W2, W3 и W4, выражение для ${{W}_{{{\text{lim}}}}}( - {{{\text{O}}}_{3}})$ будет (аналогично (2) иметь вид:
(3)
$\begin{gathered} {{W}_{{{\text{lim}}}}}( - {{{\text{O}}}_{3}}) = {{\left( {\frac{{\text{1}}}{{{{W}_{{\text{2}}}}}}{\text{ + }}\frac{{\text{1}}}{{{{W}_{{\text{3}}}}}}{\text{ + }}\frac{{\text{1}}}{{{{W}_{{\text{4}}}}}}} \right)}^{{ - 1}}} \times \\ \times \,\,\frac{{{{W}_{{\text{2}}}}{{W}_{{\text{3}}}}{{W}_{{\text{4}}}}}}{{{{W}_{{\text{2}}}}{{W}_{{\text{3}}}} + {{W}_{{\text{3}}}}{{W}_{{\text{4}}}} + {{W}_{{\text{2}}}}{{W}_{{\text{4}}}}}}. \\ \end{gathered} $Подобным же образом можно рассчитать скорость продолжения цепи при любом числе реакций.
Для скорости обрыва цепи, Wd, (в соответствии с реакцией 4), получаем выражение (4), а для длины цепи, ν, (в соответствии с формулой (1) − выражение (5):
(5)
$v = \frac{{{{W}_{{{\text{lim}}}}}{\text{(}}{\kern 1pt} - {\kern 1pt} {{{\text{O}}}_{{\text{3}}}}{\text{)}}}}{{{{W}_{{\text{d}}}}}}.$Обрыв цепи, скорость которого определяется по формуле (4), можно назвать “химическим обрывом”. Здесь следует пояснить, что под обрывом цепи каталитического цикла понимается процесс, в результате которого активные компоненты, участвующие в реакциях продолжения цепи, тем или иным способом выводятся из игры. Согласно этому определению химический обрыв будет приводить к потере активных компонент только в том случае, когда время жизни продуктов реакции 4 будет больше, чем характеристическое время турбулентного переноса, τd, определяемого по формуле (6)
где H – высота однородной атмосферы, равная $\frac{{RT}}{{mg}}$ (R –универсальная газовая постоянная, T – абсолютная температура, m – средний молекулярный вес воздуха, g – ускорение свободного падения), а kzz – коэффициент турбулентной диффузии по высоте. Это объясняется тем, что при таком соотношении времен основную роль в переносе частиц будет играть именно турбулентный перенос (за счет более короткого времени). Тогда уже реакция 4 приведет к уводу активных частиц из стратосферы в тропосферу (или из тропосферы на земную поверхность). При обратном соотношении времен продукты реакции 4 за счет более короткого времени жизни по сравнению с τd имеют возможность пройти по реакции 4 в обратном направлении и восстановить активные компоненты, ведущие цепь. Понятно, что никакого обрыва цепи в этом случае не будет. В этой ситуации будет доминировать так называемый “физический обрыв”, связанный с турбулентным переносом самих активных компонент, скорость которого будет определяться временем τd, вычисляемым по формуле (6) [22]. Переходим к основной части работы.1. ДЛИНА ЦЕПИ ГАЛОИДНЫХ ЦИКЛОВ
1а. Цикл ClOx
Хлорный цикл был впервые и одновременно предложен в работах [1, 13] и был предметом рассмотрения во многих других работах [2–12]. Основные реакции этого цикла показаны на рис. 1.
Рис. 1.
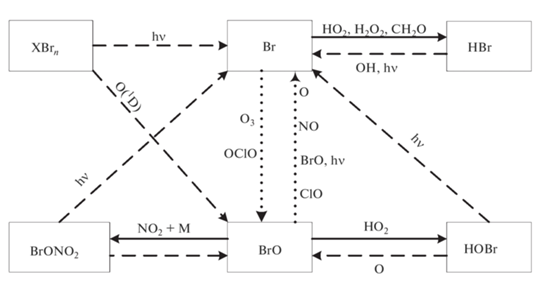
Взаимные превращения частиц в хлорном цикле. Сплошными стрелками показан сток частиц хлорного цикла, пунктирными – источники, точечными – взаимные превращения. Принимается, что группа нечётного хлора, ClOx, включает Cl и ClO.
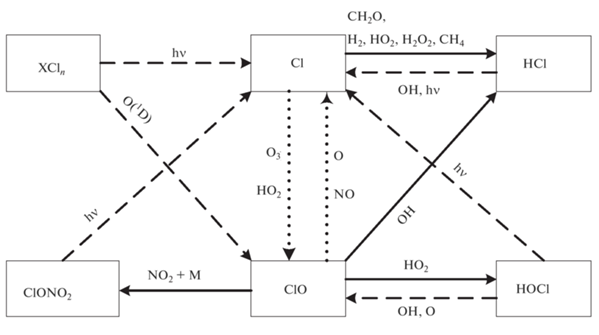
Под XCln понимаются любые соединения естественного и антропогенного происхождения, содержащие атомы хлора. Но для нашего анализа их идентификация не требуется.
Разрушение озона происходит в двух каталитических циклах.
Цикл I.
Цикл II.
В соответствии с правилами (2) и (3) скорость продолжения цепи в этих циклах будет определяться выражениями (7) и (8):
(7)
${{W}_{{{\text{limI}}}}} = {\text{ }}\left( {1{\text{/}}{{W}_{8}} + 1{\text{/}}{{W}_{9}}} \right),$(8)
${{W}_{{{\text{limII}}}}} = \left( {1{\text{/}}{{W}_{{{\text{10}}}}} + {\text{ }}1{\text{/}}{{W}_{{11}}} + {\text{ }}1{\text{/}}{{W}_{9}}} \right),$(9)
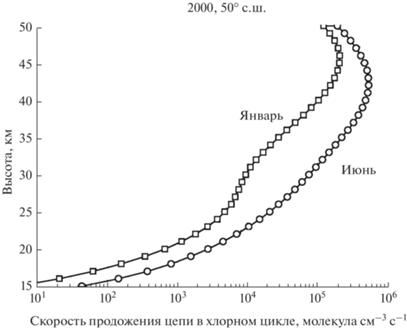
$W_{p}^{{{\text{Cl}}{{{\text{O}}}_{x}}}} = {{W}_{{{\text{limI}}}}}{\text{ + }}{{W}_{{{\text{limII}}}}}.$Высотный профиль скорости продолжения цепи в хлорном цикле, рассчитанный по формуле (9) для условий января и июня 2000-го года на широте 50° с.ш., показан на рис. 2.
Рис. 2.
Суммарная скорость продолжения цепи в хлорном цикле для условий июня и января 2000-го года на широте 50° с.ш.
Для расчета скорости обрыва, необходимо определить его тип (химический или физический) и рассчитать его абсолютную величину.
Химический обрыв связан с образованием временных резервуаров атомов хлора ‒ HCl, HOCl и ClONO2. Их времена жизни (как это следует из рис. 1) можно определить с помощью выражений (10)–(12):
(10)
$\begin{gathered} \tau \left( {{\text{HCl}}} \right) = \\ = {1 \mathord{\left/ {\vphantom {1 {\left( {{{k}_{{{\text{OH + HCl}}}}}[{\text{OH}}] + {{k}_{{{\text{O + HCl}}}}}[{\text{O}}] + {{J}_{{{\text{HCl}} \to {\text{Cl}}}}}} \right)}}} \right. \kern-0em} {\left( {{{k}_{{{\text{OH + HCl}}}}}[{\text{OH}}] + {{k}_{{{\text{O + HCl}}}}}[{\text{O}}] + {{J}_{{{\text{HCl}} \to {\text{Cl}}}}}} \right)}}, \\ \end{gathered} $(11)
$\begin{gathered} \tau \left( {{\text{HOCl}}} \right) = \\ = \,\,{1 \mathord{\left/ {\vphantom {1 {\left( {{{J}_{{{\text{HOCl}} \to {\text{Cl}}}}} + {{k}_{{{\text{HOCl + OH}}}}}[{\text{OH}}] + {{k}_{{{\text{HOCl + O}}}}}[{\text{O}}]} \right)}}} \right. \kern-0em} {\left( {{{J}_{{{\text{HOCl}} \to {\text{Cl}}}}} + {{k}_{{{\text{HOCl + OH}}}}}[{\text{OH}}] + {{k}_{{{\text{HOCl + O}}}}}[{\text{O}}]} \right)}}. \\ \end{gathered} $(12)
$\tau ({\text{ClON}}{{{\text{O}}}_{2}}){\text{ }} = {\text{ }}{1 \mathord{\left/ {\vphantom {1 {{{J}_{{{\text{ClON}}{{{\text{O}}}_{2}}}}}_{{ \to {\text{Cl}}}}}}} \right. \kern-0em} {{{J}_{{{\text{ClON}}{{{\text{O}}}_{2}}}}}_{{ \to {\text{Cl}}}}}}.$Результаты расчетов τ(HCl), τ(HOCl), τ(ClONO2) и τd для условий июня 2000-го года показаны на рис. 3.
Рис. 3.
Атмосферные времена жизни HCl, HOCl и ClONO2 для условий июня 2000-го года на широте 50° с.ш.
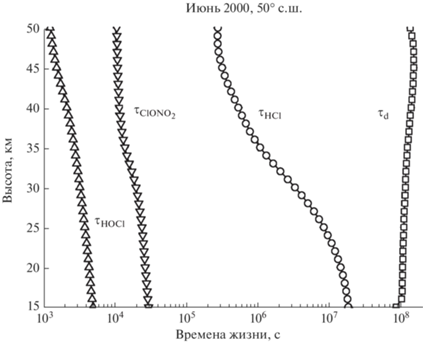
Можно видеть, что времена жизни всех трех компонент в диапазоне высот 15‒50 км заметно меньше времени переноса τd. Это означает, что в наших условиях обрыв цепи определяется процессами турбулентного переноса активных частиц, скорость которого можно задать как
(13)
${\text{скорость обрыва цепи}} = {{([{\text{Cl}}]\,\, + \,\,[{\text{ClO}}])} \mathord{\left/ {\vphantom {{([{\text{Cl}}]\,\, + \,\,[{\text{ClO}}])} {{{\tau }_{{\text{d}}}}}}} \right. \kern-0em} {{{\tau }_{{\text{d}}}}}}{\text{ }}.$Аналогичные результаты были получены и для условий января.
Таким образом, в соответствии с (1) длину цепи, ${{\gamma }_{{{\text{Cl}}{{{\text{O}}}_{x}}}}}$, как для июня, так и для января, можно рассчитать по формуле (14)
(14)
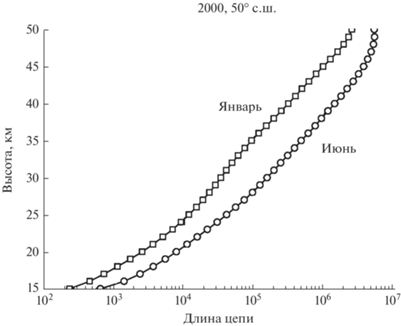
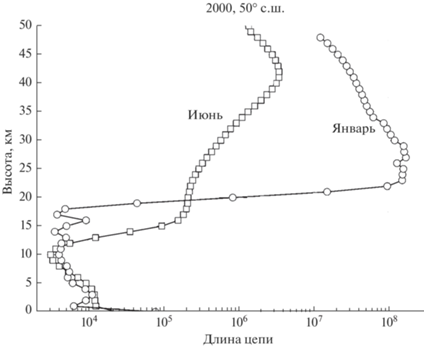
${{\gamma }_{{{\text{Cl}}{{{\text{O}}}_{x}}}}} = \frac{{W_{p}^{{{\text{Cl}}{{{\text{O}}}_{x}}}}{{\tau }_{{\text{d}}}}}}{{\left[ {{\text{Cl}}} \right] + \left[ {{\text{ClO}}} \right]}},$Длина цепи хлорного цикла для условий июня и января показана на рис. 4.
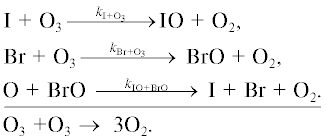
1б.Цикл BrOx
Основные процессы бромного цикла показаны на рис. 5. Обозначения здесь те же, что и на рис. 1.
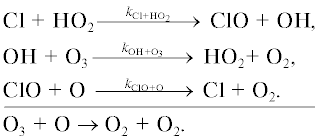
Разрушение озона происходит в следующих каталитических циклах.
Цикл I. [14]
Цикл II.
Цикл III. [15]
Цикл IV.
Цикл V.
Цикл VI.
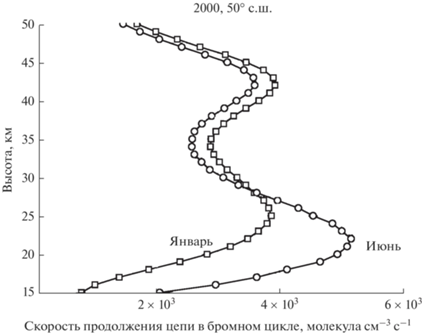
Скорость продолжения цепи в бромном цикле рассчитывалась по формулам (2) и (3). Результаты расчетов суммарной скорости продолжения цепи всех циклов для условий января и июня 2000-го года на широте 50° с.ш. показаны на рис. 6.
Рис. 6.
Суммарная скорость продолжения цепи в бромном цикле для июня и января 20000-го года на широте 50° с.ш.
Расчет времен жизни резервуаров атомарного брома – HBr, HOBr и BrONO2 – показал, что эти времена существенно меньше времени турбулентного переноса τd. Поэтому скорость обрыва цепи рассчитывалась по формуле (15):
(15)
${\text{скорость обрыва цепи}} = ([{\text{Br]}}\,\,{\text{ + }}\,\,{\text{[BrO}}]){\text{/}}{{\tau }_{{\text{d}}}}.$Длина цепи рассчитывалась по формуле (1). Результаты расчетов показаны на рис. 7.
1в. Цикл IOx
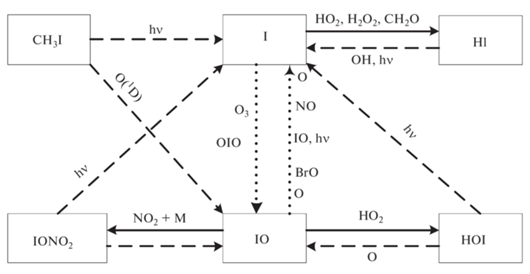
Основные процессы йодного цикла показаны на рис. 8.
Йодный цикл включает следующие каталитические циклы.
Цикл I
Цикл II
Цикл III
Цикл IV
Цикл V
Цикл VI
Цикл VII
Цикл VIII
Первые шесть циклов разрушения озона йодными частицами были предложены в [16], где учитывались взаимные превращения йодных частиц и их взаимодействие с азотноокисным (NOx) и водородным (HOx) циклами. В [17] к этим циклам были добавлены еще два цикла, учитывающих взаимодействие IOx цикла с ClOx и BrOx циклами.
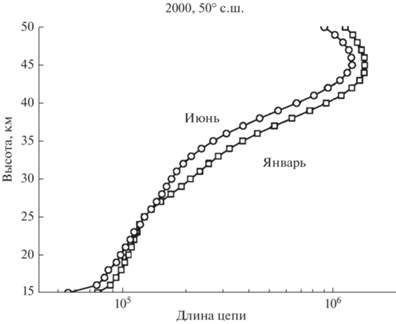
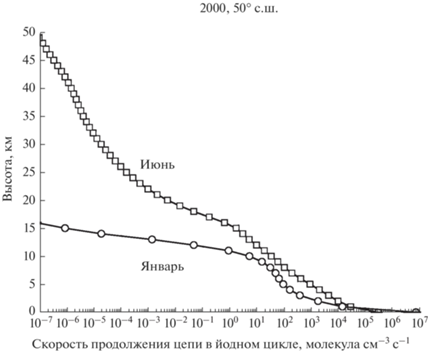
Расчет скорости продолжения цепи в йодных циклах производился по формулам (2) и (3). Все данные для расчетов были получены с помощью одномерной модели ATMO, описанной в [24]. Результаты расчета для января и июня 2000-го года нп широте 50° с.ш. показаны на рис. 9.
Рис. 9.
Суммарная скорость продолжения цепи в йодном цикле для января и июня 2000-го года на широте 50° с.ш.
Атмосферное время жизни резервуаров атомарного йода ‒ HI, HOI и IONO2 в январе и июне оказывается существенно меньше времени турбулентного переноса τd. Поэтому скорость обрыва цепи в йодном цмкле рассчитывалась по формуле (16)
(16)
${\text{скорость обрыва цепи}} = {{([{\text{I}}]\,\, + \,\,[{\text{IO}}])} \mathord{\left/ {\vphantom {{([{\text{I}}]\,\, + \,\,[{\text{IO}}])} {{{\tau }_{{\text{d}}}}}}} \right. \kern-0em} {{{\tau }_{{\text{d}}}}}}{\text{ }}.$Длина цепи йодного цикла рассчитывалась по формуле (1). Результаты расчета показаны на рис. 10.
Хотя длина цепи йодного цикла сравнима и даже превосходит длину цепи хлорного и бромного циклов в средней и верхней стратосфере, однако, судя по данным о скорости продолжения цепи, представленным на рис. 9, йодный цикла может сколько-нибудь заметно воздействовать на озон только в тропосфере, поскольку выше 15 км это воздействие быстро убывает с высотой. Что же касается высоких значений длины цепи йодного цикла в стратосфере, то она обусловлена изменением суммы ([I] + [IO]), стоящей в знаменателе формулы (1) и быстро падающей с высотой (особенно зимой).
2. ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Вопрос о длине цепи в хлорном и бромном циклах рассматривался в [20]. Можно констатировать, что качественно наши результаты согласуются с результатами, приведенными в этой работе. Однако это согласие ограничивается тем, что длина цепи в обоих случаях растет с высотой. Количественно же длины цепей в [20] оказываются заметно меньше приведенных в настоящей работе. Это различие объясняется тем, что в [20] под обрывом цепи понимаются процессы образования резервуаров активных частиц, ведущих цепь (таких, например, как HCl в хлорном цикле или BrONO2 в бромном), и не учитывается возможность их распада, приводящего к возвращению активных частиц в цепной процесс. Как показано выше, в реальных условиях время жизни резервуаров оказывается существенно меньше времени турбулентного переноса, которое в этом случае и определяет скорость обрыва, что приводит к соответствующему увеличению длины цепи цикла. Укажем здесь, что в [20] скорость разрушения озона в данном цикле рассчитывалась через определение лимитирующей стадии (т.е. одной какой-нибудь реакции продолжения цепи, идущей с наименьшей скоростью) в некотором высотном диапазоне. Это не противоречит законам химической кинетики, но может заметно снизить точность расчетов, если выбор наиболее медленной реакции затруднен из-за наличия двух и более реакций продолжения цепи, идущих с близкими скоростями. Укажем также, что наша методика лишена этого недостатка и позволяет рассчитать скорость гибели озона в цикле при любом количестве реакций продолжения цепи и любой близости скоростей этих реакций. Мало того, она учитывает вклад всех реакций продолжения цепи, включая самые быстрые, что обеспечивает максимальную корректность расчетов.
Вопрос о длине цепи в йодном цикле ранее (насколько известно автору) не рассматривался, хотя (см. выше) в ряде работ анализировалось участие йодных компонент в озоносферной химии. При качественной близости литературных и наших данных (речь в данном случае идет о скорости разрушения озона в йодных циклах) их количественное сравнение представляет значительные трудности, что объясняется рядом факторов, таких, как различные схемы расчета воздействия йодных частиц на атмосферный озон, различие в начальных данных и др. В качестве примера рассмотрим, каким образом рассчитывалось действие на озон йодных и других семейств в работе [25].
Методика расчета в [2, 5] представлена в табл. 5 , которая озаглавлена, как реакции потери нечетного кислорода в циклах семейств. В табл. 5 сообщается, в частности, что реакция O(1D) + H2O → → OH + OH приводит к гибели одной частицы нечетного кислорода, что противоречит теории Чепмена, согласно которой нечетный кислород погибает только в случае одновременной гибели двух частиц Ox. Далее в табл. 5 приводятся две реакции семейства HOx с участием HO2, O3 и O ‒ ‒ HO2 + O → OH + O2 и HO2 + O3 → OH + 2O2, которые не только не образуют цепного процесса, но и вообще не разрушают озон, поскольку в результате образуется радикал OH, содержащий одну частицу нечетного кислорода ‒ атом O, который может покинуть OH, например, в результате фотодиссоциации. Реакции NOx семйства ‒ NO2 + + O → NO + O2 и NO3 + hν → NO + O2 также не создают цепи и не разрушают озон, из-за присутствия атома O в NO. Что касается BrOx и ClOx циклов в [23], то не вызывает вопросов только реакции ClO + O → Cl + O2 и BrO + O → Br + O2, в которых действительно погибают две частицы нечетного кислорода (два атома O). Реакция же Cl2O2 + hν → 2Cl + O2 не приводит к гибели Ox потому, что частицы нечетного кислорода в этой реакции не участвуют. Реакции с образованием HOCl и HOBr также не разрушают озон из-за присутствия атома O в HOCl и HOBr. Приведенные реакции йодного семейства вызывают вопросы, которые приводились выше по поводу других семейств. Главное замечание заключается в том, что эти реакции не имеют отношения к цепному разрушению озона. Можно также указать на то, что о реакции OIO + hν → I + O2 автору не удалось найти никаких сведений. Зато хорошо описана реакция OIO + hν → O + IO, образующая озон и идущая с заведомо большей скоростью, чем приведенная выше [26]]. Из сказанного следует, что сравнение количественных данных, представленных в настоящей работе и в [23] по понятным причинам не имеет особого смысла, в то же время сравнение относительных данных показывает, что они различаются гораздо меньше.
В другой работе [18] рассматривалось разрушение озона в реакциях с участием йодных компонент. Принималось, что разрушение озона происходит в реакциях
По непонятным причинам ни количественного, ни качественного согласия с нашими данными не обнаружено. В связи с этим можно указать на то, что если в первых трех реакциях действительно происходит гибель озона, то этого нельзя сказать о последней реакции, поскольку в ее продуктах содержится HOI, включающий атом кислорода. Не ясно также, каким образом скорость гибели озона в приведенных реакциях может оставаться постоянной на высльах 10–50 км, имея в виду, что концентрация IO падает с высотой, а на высоте 50 км она практически равна нулю.
ВЫВОДЫ
1. Рассчитаны длины цепей в галоидных циклах разрушения озона, включая ClOх, BrOх и IOx циклы для условий 2000-го года на широте 50° с.ш.
2. Показано, что в стратосфере длина цепи хлорного и бромного циклов растет с высотой и в верхней стратосфере превышает 106 звеньев, что объясняется малой скоростью обрыва цепи, определяемой скоростью турбулентного переноса. Длина цепи йодного цикла в средней стратосфере превышает 108 звеньев, что объясняется малой величиной концентраций йодных компонент на этих высотах.
Список литературы
Stolarski R.S., Cicerone R.J. Stratospheric Chlorine: a Possible Sink for Ozone // Can. J. Chem. 1974. V. 52. P. 1610–615.
Molina M.J., Rowland F.S. Stratospheric sink for chlorofluoromethanes: Chlorine catalyzed destruction of ozone // Nature. 1974. V. 249. P. 810–814.
Atmospheric Ozone 1985. World.Meteorological Organization Global Ozone Research and Monitoring Project—Report № 16.
Jacob Daniel J. Introduction to Atmospheric Chemistry. Princeton. Princeton University Press. 1999. P. 261.
Brasseur G.P., Solomon S. Aeronomy of the Middle Atmosphere. Dordrecht. Springer. 2005. P. 644.
Ларин И.К. Химическая физика озонового слоя. M.: Российская академия наук, 2018. 208 с.
Larin I.K. On the theory of chain processes in the ozone layer // Russian Journal of Physical Chemistry B. 2019. V. 13. № 3. P. 548–553.
Larin I.K. Unresolved Problems in the Chemistry of the Middle Atmosphere // Russian Journal of Physical Chemistry B. 2018. V. 12. № 4. P. 791–796.
Larin I.K. Contribution of the Ox-, HOx-, NOx-, CLOx-, and BROx-cycles to to the Stratospheric ozone depletion in the XXI century // Russian Journal of Physical Chemistry B. 2017. V. 11. № 1. P. 189–194.
Larin I.K. On the recovery of the ozone layer in the Northern hemisphere in the XXIXI century // Russian Journal of Physical Chemistry B. 2015. V. 9. N № 1. P. 157–162.
Larin I.K.1, Kuskov M.L. Mechanismso fthe stratospheric ozone depletion: II. Chain length and the rate of the ozone depletion in the main stratospheric cycles // Russian Journal of Physical Chemistry B. 2013. V. 7. № 5. P. 580–588.
Larin I.K., Kuskov M.L. Mechanismsof the stratospheric Ozone Depletion: I. On chain processes in the stratosphere // Russian Journal of Physical Chemistry B2013. V. 7. № 4. P. 509–513.
Wofsy S.C., McElroy M.B. HO, NO, and ClO: Their Role in Atmospheric Photochemistry // Can. J. Chem. 1974. V. 52. P. 1582–1591.
Wofsy S.C., McElroy M.B., and Yung Y.L. The characteristic time for the depletion events. The chemical cycling of inorganic bromine // Geophys. Res. Lett. 1975. V. 2. P. 215–218.
Yung Y.L., Pinto J.P., Watson R.T., and Sander S.P. Atmospheric bromine and ozone perturbations in the lower stratosphere //Journal of the Atm. Sci. 1980. V. 37. P. 339–353.
Chameides W.L., Davis D.D. Iodine: Its possible role in Tropospheric Photochemistry // J. Geophys. Res., 1980. V. 85. № C12. P. 7383–7397.
Li Y., Patten K.O., Youn D., and Wuebbles D.J. Potential impacts of CF3I on ozone as a replacement for CF3Br in aircraft applications // Atmospheric Chemistry and Physics. European Geosciences Union. 2006. V. 6. № 12. P. 4559–4568.
S olomon S, Garcia R.R., Ravishankara A.R. On the role of iodine in ozone depletion // J. Geophys. Res. 1994. V. 99. P. 20491–20499.
Carpenter L.J. Iodine in the Marine Boundary Layer // Chem. Rev. 2003. V. 103. № 12. P. 4953–4962.
Lary D.J. Catalytic destruction of stratospheric ozone // J. Geophys. Res. 1997. V. 102. P. 21515–21526.
Пурмаль А.П. А,Б,В… Химической кинетики. M.: ИКЦ “Академкнига”. 2004. 277.с.
Larin I. On the chain length and rate of ozone depletion in the Main stratospheric cycles // Atmospheric and Climate Sciences. 2013. V. 3. P. 141–149.
http://acd.ucar.edu/models/SOCRATES/.
Ларин И.К., Угаров А.А Климатический прогноз на 200–2100 годы. 2. Роль атмосферных химических процессов в изменении климата // Химическая физика. 2003. Т. 22. № 4. С. 211–228.
Saiz-Lopez A. Fernandez1 R.P., Ordóñez C., Kinnison D.E., Gómez Martín1 J.C., Lamarque J.-F., and Tilmes S. Iodine chemistry in the troposphere and its effect on ozone // Atmos. Chem. Phys. 2014. V. 14. P. 13119–13143.
/https://jpldataeval.jpl.nasa.gov/.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Физика атмосферы и океана