Журнал физической химии, 2019, T. 93, № 1, стр. 5-10
Термодинамическое описание ионного обмена и сверхэквивалентного поглощения в трехкомпонентной системе АВ-17-2П-Сl-ОН-аминокислотаО. Н. Хохлова
a Воронежский государственный университет
Воронеж, Россия
* E-mail: okxox@yandex.ru
Поступила в редакцию 27.10.2017
Аннотация
Приведены результаты экспериментального исследования и термодинамического описания трехкомпонентных сорбционных систем типа АВ-17-2П-Сl-OH-аминокислота. Показано, что обмен минерального иона на ион цвиттерлита соответствуют ряду сорбции в бинарных системах His < Phe < Trp, а для сверхэквивалентного поглощения соответствует ряду His < Trp < Phe; обмен Сl–OH подавляется конкурирующим обменом минерального иона на ион аминокислоты.
Реальные процессы разделения и очистки аминокислот являются многокомпонентными. Для оптимизации и прогнозирования поведения таких систем необходимо знание закономерностей взаимного влияния компонентов смесей, а также термодинамическое описание равновесия в многокомпонентных сорбционных системах [1, 2].
Для ионного обмена с участием органических ионов, в частности аминокислот, характерно наличие специфических взаимодействий. Аминокислоты (АК) взаимодействуют друг с другом, с растворителем и с фазой ионообменника различными способами, включающими одновременно электростатические, гидрофобные и гидрофильные эффекты [3, 4]. При рассмотрении сорбционных систем, содержащих органо-минеральные смеси, необходимо учитывать не только конкуренцию ионов за обменные места, но и протолитические, ассоциативные и другие процессы в растворе и сорбенте, а при возможной сверхэквивалентной сорбции – взаимодействие как частиц одного сорта, так и образование смешанных ассоциатов.
К настоящему времени существует ряд работ, посвященных трехионным равновесиям с участием аминокислот [5–7], исследований в области многокомпонентного ионного обмена минеральных веществ и аминокислот на ионообменниках, учитывающих как ионный обмен, так и сверхэквивалентную сорбцию компонентов практически нет. Стартовыми в изучении особенностей многокомпонентной сорбции по различным механизмам могут являться сорбционные системы с обменивающимися однозарядными ионами и одним компонентом, способным к сверхэквивалентному поглощению.
Поэтому, целью данной работы явилось термодинамическое описание ионного обмена и сверхэквивалентного поглощения аминокислот (триптофан, гистидин, фенилаланин) анионообменником АВ-17-2П в трехкомпонентных сорбционных системах Сl-ОН-АК.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Исследована группа систем, содержащих анионообменник АВ-17-2П в Сl-форме и щелочной раствор аминокислоты (фенилаланин, триптофан, гистидин). Сорбцию проводили в статических условиях. Навески ионообменника, массой 0.5000 ± 0.0002 г, заливали 50 см3 раствора, содержащим аминокислоту в диапазоне концентраций от 0.005 до 0.05 моль/дм3 и фоновый электролит (0.01 M NaOH). Для установления количества сверхэквивалентно поглощенной аминокислоты проводили десорбцию, заливая сорбент 100 см3 дистиллированной воды.
Равновесные растворы после сорбции и десорбции анализировали на содержание ионов. Анализ аминокислот проводили спектрофотометрически, хлоридов – меркуриметрически, ОН-ионов – потенциометрически. Содержание компонентов в сорбенте рассчитывали с учетом эквивалентности обмена минеральных ионов, а так же массы и объема контактирующих сорбента и раствора соответственно. Общее количество поглощенной аминокислоты определяли по разности концентраций в растворе до и после сорбции, количество необменно поглощенного цвиттерлита – по десорбции водой, а количество ионообменно поглощенной аминокислоты – по разнице между общим и необменно поглощенным количеством вещества.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
При сорбции аминокислот из щелочных растворов (0.01 М NaOH фон) анионообменником АВ-17-2П в Cl-форме рН исходных растворов составлял 11.55–9.10. В этой области рН триптофан и фенилаланин существуют преимущественно в виде однозарядного аниона. В результате в системе присутствует три сорта ионов, способных к обмену Сl–, OH–, AK–, один из которых – аминокислота, способен к специфическим взаимодействиям и сверхэквивалентному поглощению.
Ионообменная сорбция:
(1)
$\begin{gathered} {\text{R}}{\kern 1pt} - {\kern 1pt} {{{\text{N}}}^{ + }}{{({\text{C}}{{{\text{H}}}_{{\text{3}}}})}_{{\text{3}}}}{\text{C}}{{{\text{l}}}^{ - }} + {\text{A}}{{{\text{K}}}^{ - }} \to \\ \to {\text{R}}{\kern 1pt} - {\kern 1pt} {{{\text{N}}}^{ + }}{{({\text{C}}{{{\text{H}}}_{{\text{3}}}})}_{{\text{3}}}}{\text{A}}{{{\text{K}}}^{ - }} + {\text{C}}{{{\text{l}}}^{ - }}, \\ \end{gathered} $(2)
$\begin{gathered} {\text{R}}{\kern 1pt} - {\kern 1pt} {{{\text{N}}}^{ + }}{{({\text{C}}{{{\text{H}}}_{{\text{3}}}})}_{{\text{3}}}}{\text{C}}{{{\text{l}}}^{ - }} + {\text{O}}{{{\text{H}}}^{ - }} \to \\ \to {\text{R}}{\kern 1pt} - {\kern 1pt} {{{\text{N}}}^{ + }}{{({\text{C}}{{{\text{H}}}_{{\text{3}}}})}_{{\text{3}}}}{\text{O}}{{{\text{H}}}^{ - }} + {\text{C}}{{{\text{l}}}^{ - }}. \\ \end{gathered} $Необменная сорбция:
(3)
$\begin{gathered} {\text{R}}{\kern 1pt} - {\kern 1pt} {{{\text{N}}}^{ + }}{{({\text{C}}{{{\text{H}}}_{{\text{3}}}})}_{{\text{3}}}}{\text{A}}{{{\text{K}}}^{ - }} + ({\text{A}}{{{\text{K}}}^{ - }}{\text{N}}{{{\text{a}}}^{ + }}) \to \\ \to {\text{R}}{\kern 1pt} - {\kern 1pt} {{{\text{N}}}^{ + }}{{({\text{C}}{{{\text{H}}}_{{\text{3}}}})}_{{\text{3}}}}{\text{A}}{{{\text{K}}}^{ - }}({\text{N}}{{{\text{a}}}^{ + }}{\text{A}}{{{\text{K}}}^{ - }}), \\ \end{gathered} $(4)
$\begin{gathered} {\text{R}}{\kern 1pt} - {\kern 1pt} {\text{C}}{{{\text{H}}}_{{\text{2}}}}{\kern 1pt} - {\kern 1pt} {\text{CH}}{\kern 1pt} - {\kern 1pt} {\text{CO}}{{{\text{O}}}^{ - }} + {\text{N}}{{{\text{a}}}^{ + }}{\text{C}}{{{\text{l}}}^{ - }} \to \\ {\mathbf{|}} \\ {\text{NH}}_{3}^{ + } \\ \to {\text{R}}{\kern 1pt} - {\kern 1pt} {\text{C}}{{{\text{H}}}_{{\text{2}}}}{\kern 1pt} - {\kern 1pt} {\text{CH}}{\kern 1pt} - {\kern 1pt} {\text{CO}}{{{\text{O}}}^{ - }}{\text{N}}{{{\text{a}}}^{ + }}. \\ {\mathbf{|}} \\ {\text{NH}}_{3}^{ + }{\text{C}}{{{\text{l}}}^{ - }} \\ \end{gathered} $Таким образом, на анионообменнике происходит ионообменная сорбция аниона аминокислоты (1), обмен минеральных ионов (2) и сверхэквивалентная сорбция аминокислоты (3). Кроме того, согласно литературным данным [8], необходимо учитывать образование органоминеральной соли в соотношении АК : NaСl 1 : 1 по представленной схеме (4).
Образование в фазе раствора органо-минеральной соли из вытесняющегося в процессе ионного обмена Сl-иона и имеющейся там аминокислоты (4), с одной стороны, приводит к смещению равновесия (2) вправо, а, с другой стороны, ухудшает сорбцию цвиттерлита по обоим механизмам (1) и (3) [8].
На рис. 1 показаны изотермы суммарной и ионообменной сорбции цвиттерлитов, разница между этими величинами соответствует необменному поглощению. Как видно из рисунков, необменное поглощение сопровождает ионный обмен во всей исследуемой области концентраций. Величина необменной сорбции для триптофана меньше чем ионообменной, в то время как для фенилаланина эти составляющие практически равны по величине.
Рис. 1.
Изотермы сорбции триптофана (а), фенилаланина (б) и гистидина (в) в системе R–N+(CH3)3Cl– + АК– + OH–: 1 – суммарная сорбция, 2 – ионообменная сорбция, 3 – сверхэквивалентная сорбция.
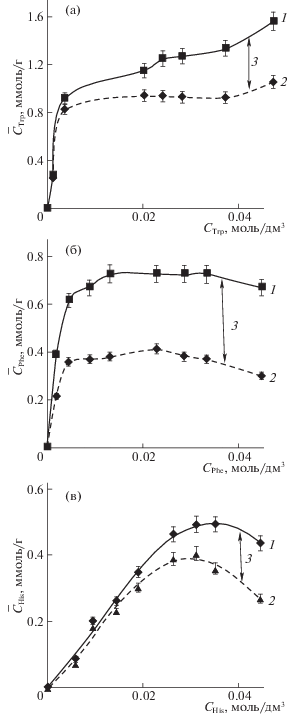
При сорбции гистидина из щелочных растворов, с использованием фонового электролита NaOH с концентрацией 0.01 моль/дм3 протекание сорбции аминокислоты по обоим механизмам не наблюдалось, поэтому концентрацию фонового электролита увеличили до 0.2 моль/дм3. рН раствора при этом составлял 10.70–10.80. В данной области рН гистидин преимущественно существует в виде однозарядного аниона и примеси двузарядного аниона. Как и в предыдущих системах протекает ионообменное и необменное поглощение аминокислоты, при этом величина последнего меньше (рис. 1в).
Во всех рассматриваемых системах ионный обмен минеральных ионов Cl–ОН практически не происходит.
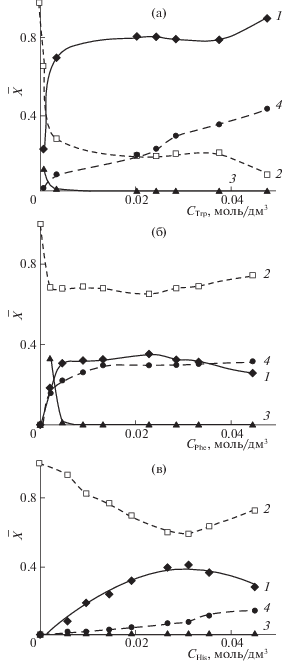
Рассчитана степень заполнения анионообменника ионами, присутствующими в системе. Для удобства представления состава фазы сорбента для сверхэквивалентно поглощенной аминокислоты была рассчитана аналогичная характеристика, как отношение концентрации необменно поглощенного вещества к полной обменной емкости анионита.
Рассматривая степень заполнения сорбента аминокислотой и минеральными ионами (рис. 2) видно, что при сорбции из щелочных растворов преимущественно ионообменно поглощается аминокислота, а ОН-ион не входит в сорбент. При этом хлориды вытесняются в раствор в количестве эквивалентном поглощенной аминокислоте. Количество сверхэквивалентно поглощенных цвиттерлитов невелико как относительно количества функциональных групп, так и относительно ионообменно поглощенного вещества.
Рис. 2.
Состав фазы сорбента в системе R–N+(CH3)3Cl– +АК– + OH– (а–в): 1 – ${\;}{{\bar {X}}_{{{\text{AK}}}}}{\;}$, 2 – ${\;}{{\bar {X}}_{{{\text{C}}{{{\text{l}}}^{ - }}}}}{\;}$, 3 – ${\;}{{\bar {X}}_{{{\text{O}}{{{\text{H}}}^{ - }}}}}{\;}$, 4 – ${\;}\bar {X}_{{{\text{AK}}}}^{{{\text{с в е р х э к в и в }}{\text{.}}}}{\;}$.
Описание исследуемых процессов необходимо проводить с привлечением термодинамики многоионных равновесий [9] и представлений о стехиометричности процесса необменного поглощения как представлено в термодинамическом подходе, описанном в [10, 11].
Процессы ионного обмена (1) и (2) описываются константами равновесия (5) и (6) соответственно
(5)
$K_{{1(3)}}^{2} = \frac{{{{{\bar {a}}}_{2}}{{a}_{1}}}}{{{{{\bar {a}}}_{1}}{{a}_{2}}}} = \frac{{{{{\bar {C}}}_{2}}{{a}_{1}}}}{{{{{\bar {C}}}_{1}}{{a}_{2}}}}\frac{{{{{\bar {f}}}_{2}}}}{{{{{\bar {f}}}_{1}}}} = \tilde {K}_{{1(3)}}^{2}\frac{{{{{\bar {f}}}_{2}}}}{{{{{\bar {f}}}_{1}}}},$(6)
$K_{{1(2)}}^{3} = \frac{{{{{\bar {a}}}_{3}}{{a}_{1}}}}{{{{{\bar {a}}}_{1}}{{a}_{3}}}} = \frac{{{{{\bar {C}}}_{3}}{{a}_{1}}}}{{{{{\bar {C}}}_{1}}{{a}_{3}}}}\frac{{{{{\bar {f}}}_{3}}}}{{{{{\bar {f}}}_{1}}}} = \tilde {K}_{{1(2)}}^{3}\frac{{{{{\bar {f}}}_{3}}}}{{{{{\bar {f}}}_{1}}}},$Необменное поглощение аминокислоты (3) описывается константой равновесия
(7)
${{K}_{{{н е о б м \;}}}} = \frac{{{{{\bar {a}}}_{{{\text{RAK}}}}}}}{{{{{\bar {a}}}_{{\text{R}}}}{{a}_{{{\text{AK}}}}}}} = \frac{{{{{\bar {C}}}_{{{\text{RAK}}}}}}}{{{{{\bar {C}}}_{{\text{R}}}}{{a}_{{{\text{AK}}}}}}}\frac{{{{{\bar {f}}}_{{{\text{RAK}}}}}}}{{{{{\bar {f}}}_{{\text{R}}}}}} = {{\tilde {K}}_{{{н е о б м \;}}}}\frac{{{{{\bar {f}}}_{{{\text{RAK}}}}}}}{{{{{\bar {f}}}_{{\text{R}}}}}},$Для нахождения термодинамических констант равновесия необходимо знание коэффициентов активности компонентов фазы сорбента. Однако, нахождение этих величин – трудоемкий процесс, поэтому константы равновесия можно найти путем интегрирования зависимости логарифма исправленного коэффициента равновесия от состава сорбента [9–11].
Используя уравнения для расчета коэффициентов активности компонентов фазы сорбента в трехкомпонентной системе, полученные в [9], подставив их в формулу логарифмированной константы равновесия каждого псевдобинарного обмена в трехионной системе, представленные там же [9], с учетом равнозарядности обмена получены формулы для расчета интегральных термодинамических констант равновесия псевдобинарных обменов в трехкомпонентной системе
(8)
$\ln K_{{1(3)}}^{2} = \mathop \smallint \limits_{(1,0,0)}^Q \ln \tilde {K}_{{1(3)}}^{2}d{{\bar {x}}_{2}} - \mathop \smallint \limits_{(0,1,0)}^Q \ln \tilde {K}_{{1(3)}}^{2}d{{\bar {x}}_{2}},$(9)
$\ln K_{{1(2)}}^{3} = \mathop \smallint \limits_{(1,0,0)}^Q \ln \tilde {K}_{{1(2)}}^{3}d{{\bar {x}}_{3}} - \mathop \smallint \limits_{(0,0,1)}^Q \ln \tilde {K}_{{1(2)}}^{3}d{{\bar {x}}_{3}},$Аналогично получена формула для расчета термодинамической константы необменной сорбции согласно представлениям о стехиометричности процесса
(10)
$\ln {{K}_{{{н е о б м \;}}}} = \mathop \smallint \limits_1^Q \ln {{\tilde {K}}_{{{\text{н е о б м }}}}}d\quad{{\bar {N}}_{{\text{R}}}} + \mathop \smallint \limits_0^Q \ln {{\tilde {K}}_{{{н е о б м \;}}}}d\quad{{\bar {N}}_{{{\text{RAК }}}}},$Для расчета по формулам (8)–(10) из экспериментальных данных рассчитывали коэффициенты равновесия, используя первое приближение теории Дебая–Хюккеля рассчитывали коэффициенты активности ионов в растворе и находили исправленные коэффициенты равновесия, затем строили зависимости логарифмов этих величин от степени заполнения сорбента и представляли в виде полиномиальной зависимости.
Интегрирование вели от состояния сравнения до данного состава сорбента. За отсчетное состояние принято равновесие ионообменника в минеральной моноионной форме с водой: при ионном обмене согласно обозначениям, используемым в (5), (6) – ${{\bar {C}}_{1}}$ = ПОЕ, ${{\bar {f}}_{1}}$ = 1, ${{\bar {C}}_{2}}$, ${{\bar {C}}_{3}}$ → 0, ${{\bar {f}}_{2}}$, ${{\bar {f}}_{3}}$ → 1; C2, C3 → 0, f2, f3 = 1; при необменной сорбции, согласно обозначениям, используемым в (7) – ${{\bar {c}}_{{\text{R}}}} \to {\text{П О Е }}$, ${{\bar {c}}_{{{\text{RAK}}}}} \to 0$, ${{\bar {f}}_{{\text{R}}}},\;{{\bar {f}}_{{{\text{RAK}}}}} \to 1$, САК → 0, fАК = 1.
Наличие или образование в растворе органо-минеральной соли АК : NaCl (1 : 1) не оказывает влияние на ход расчета термодинамических характеристик, но влияет на их величины, так как в расчетах используются величины концентраций компонентов системы в фазе раствора и сорбента в состоянии равновесия.
В таблице 1 приведены значения рассчитанных термодинамических констант и энергий Гиббса ионного обмена и необменной сорбции. Как видно из рис. 1, 2, термодинамические константы обмена минерального иона на ион аминокислоты соответствуют ряду сорбции, характерному для бинарного обмена His < Phe < Trp [3, 4], а для сверхэквивалентной сорбции соответствует ряду His < Trp < Phe. Ряд необменной сорбции не соответствует ряду гидрофобности аминокислот [13], согласно которому наиболее гидрофобным является триптофан. Вероятно, в силу дифильного строения фенилаланина и способности его к мицеллообразованию [14–16], эта аминокислота лучше сорбируется сверхэквивалентно за счет структурирования внутреннего раствора в фазе сорбента.
Таблица 1.
Значения интегральных термодинамических характеристик в исследуемых системах
| Система | $K_{{{\text{Cl}}}}^{{{\text{AK}}}}$ | $\Delta G_{{{\text{Cl}}}}^{{{\text{AK}}}}$, кДж/моль | Kнеобм | ΔGнеобм, кДж/моль |
|---|---|---|---|---|
| Триптофан AB-17-2 П (Cl) + Trp + 0.01 М NaOH | 3.48 | –3.03 | 2.36 | –2.09 |
| Фенилаланин AB-17-2 П (Cl) + Phe + 0.01 М NaOH | 1.04 | –1.04 | 5.24 | –4.03 |
| Гистидин AB-17-2 П (Cl) + His + 0.2 М NaOH | 0.69 | 0.91 | 1.96 | –1.64 |
Таким образом, из трех исследуемых аминокислот по ионообменному механизму лучше всего сорбируется триптофан, по необменному механизму – фенилаланин, что согласуется с литературными данными по сорбции из индивидуальных растворов [3, 4].
Интегральные характеристики сорбции описывают процесс в целом и не дают представления об изменении энергии в ходе сорбции. Наиболее информативными являются дифференциальные характеристики, относящиеся к ионообменнику определенного состава [17].
Непосредственно по экспериментальным значениям исправленных коэффициентов равновесия можно оценивать дифференциальные термодинамические функции. Записав связь исправленного коэффициента равновесия ионного обмена с термодинамической константой обмена, и выразив все слагаемые через химические потенциалы компонентов, получают соотношение для расчета дифференциальной энергии Гиббса [17]:
(11)
$\Delta {{G}_{{\bar {n}{\text{и }}{\text{.о }}{\text{.}}}}} = - RT\ln \tilde {K}_{{i(k)}}^{j} + RT\ln \frac{{{{{\bar {c}}}_{j}}}}{{{{{\bar {c}}}_{i}}}}$(11')
$\Delta {{G}_{{\bar {n}{\text{и }}{\text{.о }}{\text{.}}}}} = RT\ln \frac{{{{а }_{j}}}}{{{{а }_{i}}}},$Аналогично получена формула для расчета дифференциальной энергии Гиббса для процесса необменного поглощения аминокислот согласно представлениям о стехиометричности процесса [11]:
(12)
$\Delta {{G}_{{\bar {n},{\text{н е о б м }}}}} = - RT\ln {{\tilde {K}}_{{{\text{н е о б м }}}}} + RT\ln \frac{{{{{\bar {c}}}_{{{\text{RAK}}}}}}}{{{{{\bar {c}}}_{{\text{R}}}}}}$Результаты расчетов по формулам (11) и (11'), а так же по формулам (12) и (12') совпадают. На рис. 3 представлены зависимости изменения дифференциальных энергий Гиббса от равновесной концентрации аминокислоты.
Рис. 3.
Дифференциальные энергии Гиббса ионного обмена и необменного поглощения в исследуемых системах 1 и 1' – триптофан, 2 и 2' – фенилаланин, 3 и 3' – гистидин (1, 2, 3 – ионный обмен, 1', 2', 3' – необменное поглощение).
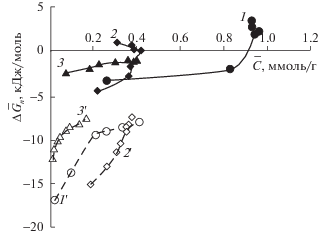
Как видно из рис. 3 дифференциальная энергия Гиббса обмена Сl-триптофан и Сl-фенилаланин при низких концентрациях аминокислоты имеет отрицательные значения, а при переходе к более высоким концентрациям меняет знак. Такая зависимость характерна для ионного обмена аминокислот, что связано с ухудшением доступности ионообменных групп [3, 4]. Энергия обмена Сl-гистидин, в отличие от предыдущих систем, имеет отрицательные значения во всем диапазоне концентраций, вероятно, из-за присутствия в растворе доли двухзарядных анионов аминокислоты.
Дифференциальная энергия необменного поглощения отрицательна, изменяется в одном диапазоне значений для всех аминокислот при различном содержании цвиттерлита в сорбенте и увеличивается по ходу сорбции. Близкие значения дифференциальных энергий необменной сорбции свидетельствуют об идентичности закрепления необменно поглощенной аминокислоты – за счет ион-дипольных взаимодействий и водородных связей между функциональной группой ионообменника и отрицательно заряженной карбоксильной группой аниона аминокислоты с участием молекул воды [18, 19].
Таким образом, установлено, что в системе АВ-17-2П-Сl-ОН-АК при одинаковом исходном составе фаз (ионная форма сорбента и состав раствора) закономерности ионного обмена и сверхэквивалентной сорбции аналогичны при участии различных цвиттерлитов, а количественные характеристики обоих процессов зависят от природы аминокислоты. Характеристики обмена минерального иона на ион аминокислоты соответствуют ряду сорбции бинарного обмена His < Phe < < Trp, а для сверхэквивалентного поглощения соответствует ряду His < Trp < Phe, определяемому способностью аминокислоты образовывать ассоциаты. Во всех исследованных системах обмен минеральных ионов подавляется конкурирующим обменом минерального иона на ион аминокислоты.
Список литературы
Ионообменные методы очистки веществ / Под ред. Г.А. Чикина, О.Н. Мягкого. Воронеж: ВГУ, 1984. 372 с.
Чикин Г.А., Шамрицкая И.П., Селеменев В.Ф. // Прикладная хроматография. М., 1984. С. 141.
Селеменев В.Ф., Хохлов В.Ю., Бобрешова О.В. и др. Физико-химические основы сорбционных и мембранных методов выделения и разделения аминокислот. Воронеж: Изд-во Воронеж. гос. ун-та, 2001. 299 с.
Selemenev V.F., Khokhlov V.Yu., Chikin G.A. // “Ion Exchange” edited by D. Muraviov, V. Gorshkov, A. Warshawsky. Marcel Dekker. New York. 2000. P. 615.
Котова Д.Л. и др. // Журн. физ. химии. 2007. Т. 81. № 1. С. 113.
Хохлов В.Ю., Казначеев А.В., Селеменев В.Ф. // Там же. 2001. Т. 75. № 1. С. 120.
Казначеев А.В., Хохлов В.Ю., Селеменев В.Ф. и др. // Там же. 2001. Т. 75. № 4. С. 727.
Хохлова О.Н., Немчинова Е.В., Нефедова Т.Н. // Сорбционные и хроматографические процессы. Воронеж, 2010. Т. 10. Вып. 5. С. 753.
Солдатов В.С., Бычкова В.А. Ионообменные равновесия в многокомпонентных системах. Минск: Наука и техника, 1988. 358 с.
Хохлова О.Н. // Журн. физ. химии. 2014. Т. 88. № 7–8. С. 1247–1250.
Хохлова О.Н. // Там же. 2014. Т. 88. № 7–8. С. 1243.
Хохлова О.Н., Хохлов В.Ю., Башлыкова О.Ю. и др. // Там же. 2017. Т. 17. № 4. С. 720.
Демин А.А., Чернова И.А., Шатаева Л.К. Ионообменная сорбция биологически активных веществ. СПб.: Изд-во С.-Петерб. ун-та, 2008. 154 с.
Трунаева Е.С., Хохлова О.Н., Хохлов В.Ю. // Журн. структур. химии. 2015. Т. 56. № 6. С. 1111.
Хохлова О.Н., Селеменев В.Ф., Кузнецова Л.В. и др. // Журн. физ. химии. 2001. Т. 75. № 11. С. 2011.
Васильева В.И., Голева Е.А., Селеменев В.Ф. // Там же. 2016. Т. 90. № 10. С. 1548.
Иванов В.А., Карпюк Е.А. // Сорбционные и хроматографические процессы. 2015. Т. 15. Вып. 1. С. 19.
Хохлова О.Н., Хохлов В.Ю., Трунаева Е.С. и др. // Журн. физ. химии. 2016. Т. 90. № 7. С. 1054.
Хохлова О.Н., Хохлов В.Ю., Трунаева Е.С. // Там же. 2015. Т. 89. № 2. С. 292.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии


