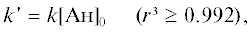Журнал физической химии, 2019, T. 93, № 1, стр. 158-160
Хемилюминесценция в реакции озонированного окисления анилинаА. Н. Шишкина, А. Р. Шигапова, И. Б. Абдрахманов, Ю. С. Зимин, А. Г. Мустафин
А. Н. Шишкина a, *, А. Р. Шигапова a, И. Б. Абдрахманов b, Ю. С. Зимин a, А. Г. Мустафин a
a Башкирский государственный университет
Уфа, Россия
b Российская академия наук, Уфимский институт химии
Уфа, Россия
* E-mail: anastasia.shishkina1993@mail.ru
Поступила в редакцию 16.04.2018
Аннотация
Впервые обнаружена хемилюминесценция в видимой области спектра при окислении анилина озон-кислородной смесью в солянокислых водных растворах. Изучена кинетика изменения интенсивности свечения в интервале температур 284–327 K и определены активационные параметры процесса.
Общеизвестно широкое промышленное применение анилина. Одна из причин столь большого значения этого ароматического соединения – почти неограниченные возможности его преобразования в востребованные на практике продукты: лекарственные препараты, красители, полимеры [1–6]. Весьма перспективным способом получения новых целевых продуктов является окислительная модификация анилина. К настоящему времени имеются данные по окислительным превращениям анилина под действием персульфата и пероксидисульфата аммония [7, 8], бихромата калия [9], нитрата и сульфата церия [10], хлорида железа [11] и др.
Один из удобных окислителей, который можно использовать для окисления анилина, – озон. Его преимущество в рассматриваемом процессе состоит в том, что в реакционной среде отсутствуют загрязняющие целевой продукт соединения – итог восстановления окислителя. Поскольку озон в процессах окисления либо полностью расходуется, либо восстанавливается до свободно улетучивающегося из зоны реакции кислорода, данный факт часто является решающим при выборе окислителя. Ранее [12] была обнаружена хемилюминесценция в видимой области спектра (ХЛ) в процессе озонированного окисления азотсодержащего соединения – 6-метилурацила.
Настоящая работа посвящена обнаружению хемилюминесценции в реакции озона с анилином в солянокислых водных растворах и изучению кинетики изменения интенсивности свечения.
ЭКСПЕРИМЕНТАЛЬАЯ ЧАСТЬ
Использовали анилин фирмы “Aldrich”. Озон-кислородную смесь получали с помощью озонатора, конструкция которого описана в работе [13]. Растворителем служил 0.1 н. водный раствор соляной кислоты, приготовленный из свежеперегнанной бидистиллированной воды и НCl квалификации “х. ч.”.
Реакцию озона с анилином в солянокислом водном растворе изучали на установке, позволяющей наблюдать свечение в видимой области спектра. Хемилюминесцентная установка состояла из светонепроницаемой камеры, в которую помещали стеклянный термостатируемый реактор с обратным холодильником и барботером для подачи озон-кислородной смеси. Кинетику исследуемой реакции изучали следующим образом: 14 мл солянокислого водного раствора анилина определенной концентрации наливали в оптически прозрачный реактор, который затем помещали в термостатируемую ячейку. Температуру в ячейке поддерживали с помощью термостата с точностью ±0.5 K. После предварительного термостатирования раствора в течение 15 мин в реактор подавали озон-кислородную смесь со скоростью 6 л/ч и наблюдали за интенсивностью сигнала ХЛ.
Опыты по уменьшению интенсивности свечения проводили в тех же условиях. Отличие заключалось лишь в том, что при достижении интенсивности сигнала ХЛ определенного значения, подачу смеси О3–О2 прекращали и наблюдали за изменением хемилюминесценции в видимой области спектра. Данные исследования проводили в интервале температур от 284 до 327 K. Начальные концентрации анилина изменяли в диапазоне (1.0–5.0) × 10–4 моль/л.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В настоящей работе впервые обнаружено, что барботаж озон-кислородной смеси через солянокислые водные растворы анилина приводит к хемилюминесценции в видимой области спектра. В качестве примера на рис. 1 приведены экспериментальные результаты (кривые 1, 2) по кинетике изменения интенсивности сигнала ХЛ в условиях постоянного барботажа смеси О3–О2 через солянокислые растворы анилина. Следует отметить, что при пропускании озон-кислородной смеси через водные растворы HCl свечения не наблюдалось.
Рис. 1.
Изменение интенсивности сигнала ХЛ от времени в процессе озонированного окисления анилина при 303 K и различных значениях [Ан]0, моль/л: 1 – 1 × 10–3, 2 – 5 × 10–4, 3 – 1 × 10–4. Стрелками обозначены моменты начала (↑) и прекращения (↓) подачи озон-кислородной смеси.
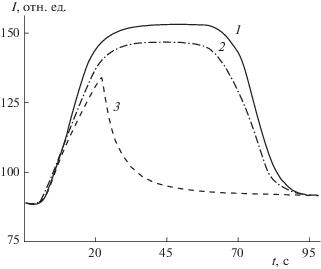
Обращает на себя внимание тот факт, что интенсивность ХЛ зависит от начальной концентрации анилина (рис. 1). Прекращение подачи озон-кислородной смеси в реакционную смесь приводит к спаду интенсивности свечения (рисунок 1, кривая 3). Анализ приведенных данных свидетельствует о том, что хемилюминесценция в видимой области спектра однозначно связана с окислительными превращениями анилина. При этом эмиттер свечения является промежуточным соединением (интермедиатом) исследуемого процесса.
Установлено, что интенсивность свечения после прекращения подачи окислителя (рисунок 1, кривая 3) в исследуемую реакционную систему спадает по экспоненциальному закону. Данный вывод подтверждается хорошим спрямлением (коэффициенты корреляции r ≥ 0.994) кинетических кривых изменения интенсивности ХЛ в координатах реакции первого порядка:
где I0 и It – начальная и текущая интенсивности свечения (относительные единицы), k' – эффективная константа скорости уменьшения интенсивности хемилюминесценции (с–1). Значения k' находили по тангенсам углов наклона полулогарифмических анаморфоз (табл. 1). Анализ данных табл. 1 свидетельствует о том, что эффективные константы скорости k' связаны с начальной концентрацией анилина (Ан) линейной зависимостью: где k – константа скорости второго порядка (л моль–1 с–1).Таблица 1.
Зависимость эффективных констант скоростей (k' × 102, c–1) от начальной концентрации анилина при разных температурах
| [Ан] × 104, моль/л | 284 K | 296 K | 303 K | 313 K | 327 K |
|---|---|---|---|---|---|
| 1.0 | 3.9 | 4.9 | 5.3 | 5.6 | 4.1 |
| 2.0 | 8.8 | 7.6 | 11.3 | 15.3 | 16.2 |
| 3.0 | 10.4 | 10.7 | 15.1 | 16.4 | 16.6 |
| 4.0 | 12.9 | 16.4 | 17.3 | 18.5 | 23.5 |
| 5.0 | 16.4 | 20.8 | 28.2 | 31.0 | 29.5 |
Отметим, что выявленные закономерности уменьшения интенсивности сигнала хемилюминесценции выполняются для исследуемого субстрата – анилина – во всем изученном диапазоне условий проведения процесса (284–333 K, [Ан]0 = = (1–5) × 10–4 моль/л). Значения констант скоростей k второго порядка, найденные по тангенсам углов наклона зависимостей k' от [Ан]0 при разных температурах, представлены в табл. 2. По данным табл. 2 были рассчитаны параметры уравнения Аррениуса, характеризующие процесс уменьшения интенсивности хемилюминесценции:
где θ = 2.303RT (кДж/моль).Таблица 2.
Температурная зависимость константы скорости k реакции озона с анилином в солянокислых водных растворах
| T, K | 284 | 296 | 303 | 313 | 327 |
|---|---|---|---|---|---|
| k × 10–2, л моль–1 с–1 |
2.3 ± 0.3 | 4.1 ± 0.5 | 5.2 ± 0.7 | 5.3 ± 0.7 | 5.8 ± 0.7 |
Таким образом, впервые обнаружена хемилюминесценция в видимой области спектра при озонированном окислении анилина в солянокислых водных растворах. Установлено, что прекращение подачи смеси О3–О2 в реакционную смесь приводит к уменьшению интенсивности свечения, которое происходит по закону реакции первого порядка. Найдено, что эффективные константы скорости k' прямо пропорциональны начальным концентрациям анилина. Изучена температурная зависимость константы скорости k второго порядка в интервале 287–333 K и определены активационные параметры уменьшения хемилюминесценции в исследованной нами реакции.
Список литературы
Мелентьева Г.А. Фармацевтическая химия. М.: Медицина, 1976. 826 с.
Абдрахманов И.Б., Мустафин А.Г., Шарафутдинов В.М. Перегруппировка Кляйзена в ряду ароматических аминов. Уфа: Гилем, 2014. 167 с.
Салихов Р.Б. и др. // Письма в Журн. техн. физики. 2013. Т. 39. № 19. С. 25.
Мустафин А.Г. и др. // Химия природн. соед. 1989. № 6. С. 816.
Мельников Б.Н., Виноградова Г.И. Применение красителей. М.: Химия, 1986. 240 с.
Степин С.Н., Ситнов С.А., Толстошеева С.И., Михеев С.П. // Практика противокорроз. защиты. 2014. № 4. С. 44.
Genies E., Syed A., Tsintavis C. // Mol. Cryst. Liq. Cryst. 1985. V. 121. № 1–4. P. 181.
Macdiarmid A.G., Chiang J.C., Halpern M. et al. // Ibid. 1985. V. 121. № 1–4. P. 173.
Genies E.M., Boyle A., Lapkowski M., Tsintavis C. // Synthetic Metals. 1990. V. 36. № 2. P. 139.
Hand R.L., Nelson R.F. // J. Electrochem. Soc. 1978. V. 125. № 7. P. 1059.
Евстифеев Е.Н., Пугачев А.Д., Рассохин Г.И. // Современные тенденции развития науки и технологий. 2015. С. 27.
Zimin Yu.S., Khairullina L.R., Kutlugil’dina G.G., Mustafin A.G. // Russ. J. Phys. Chem. A. 2015. V. 89. № 12. P. 2210.
Вендилло В.П., Емельянов Ю.М., Филиппов Ю.В. // Заводск. лаборатория. 1959. Т. 25. № 11. С. 1401.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии