Журнал физической химии, 2019, T. 93, № 11, стр. 1661-1667
Окисление этана на медь-содержащем оксиде циркония, модифицированном кислотными добавками
П. А. Донюш a, А. Л. Кустов a, b, *, В. Д. Ниссенбаум b, А. Л. Тарасов b, Л. М. Кустов a, b
a Московский государственный университет имени М.В. Ломоносова, Химический факультет
Москва, Россия
b Российская академия наук, Институт органической химии имени Н.Д. Зелинского
Москва, Россия
* E-mail: st@list.ru
Поступила в редакцию 01.11.2018
После доработки 08.03.2019
Принята к публикации 12.03.2019
Аннотация
Исследована реакция полного окисления этана на катализаторах, содержащих 1, 3, 5 мас. % CuO, нанесенного на 4 носителя: оксид циркония, сульфатированный и вольфрамированный оксид циркония и оксид циркония, стабилизированный La2O3. Носители и катализаторы охарактеризованы методами БЭТ, РФА и термического анализа. Показано, что уже при температуре 300°С достигается 100%-ная конверсия этана. Установлено, что температура 100%-ной конверсии понижается с увеличением содержания меди, наименьшая температура получена на катализаторах на основе немодифицированного оксида циркония. По каталитической активности образцы, содержащие наибольший процент меди, расположены следующим образом: 5%Cu/ZrO2 > 5%Cu/5%La2O3/ZrO2 > 5%Cu/15%WO3/ZrO2 > 5%Cu/5%SO4/ZrO2; температуры 100%-ной конверсии этана для этих катализаторов составляют 305, 385, 410 и 419°С соответственно.
Легколетучие органические соединения (ЛОС) – большая группа органических веществ, к которым относятся некоторые галогенсодержащие углеводороды, альдегиды, спирты, ароматические углеводороды, алканы, алкены, кетоны, простые и сложные эфиры [1]. Многие ЛОС являются канцерогенами, парниковыми газами, ответственны за разрушение озонового слоя, фотохимический смог [2]. Поэтому актуальны контроль за выбросами ЛОС и их нейтрализация. Для удаления органических веществ широко используются окислительные реакции. Как правило, для нейтрализации ЛОС применяют термическое окисление при температурах выше 900°С. Однако, в промышленности термическое окисление постепенно заменяется каталитическим, которое может быть проведено при существенно более низких температурах, обычно ниже 500°С [3].
Катализаторы, содержащие благородные металлы (Pt, Pd, Rh, Au и др.), показывают высокую эффективность в окислении ЛОС при низких температурах [4, 5]. Их недостатки – высокая стоимость, дезактивация из-за спекания частиц активной фазы, отравление сернистыми соединениями [3]. Альтернатива металлическим катализаторам – оксиды металлов, как индивидуальные, так и нанесенные на различные носители, комбинации оксидов металлов и сложные оксиды, например, перовскиты [6–8]. Нанесенные катализаторы более эффективны в реакциях полного окисления органических соединений благодаря диспергированию активного компонента [3]. В качестве металлов используют переходные и редкоземельные элементы. В промышленности наиболее распространены оксиды меди, марганца, железа, никеля, хрома и кобальта [9–12]. Металл-оксидные катализаторы менее активны по сравнению с благородными металлами, но характеризуются невысокой стоимостью и возможностью регенерации [3].
Оксид меди – высокоэффективный катализатор полного окисления CO, метана [12], этанола, ацетальдегида, дизельной сажи [13] и других органических соединений [14]. Решеточный кислород O2– в CuO играет важную роль в окислительных реакциях [14]. В работе [15] было показано, что медь-содержащие катализаторы проявляют высокую активность в реакциях полного окисления ряда углеводородов, в частности, толуола. Как правило, оксид меди наносится на носитель с большой площадью поверхности, например, CeO2, ZrO2, цеолиты. Согласно литературным данным, для CuO в качестве носителя, в основном, используют Al2O3, CeO2, ZrO2, твердые растворы на основе Ce–Zr [14]; наиболее интересен оксид циркония [16].
Оксид циркония более эффективен в так называемой стабилизированной форме, для получения которой к нему добавляют оксиды металлов и неметаллов (SiO2, La2O3, CaO, Y2O3, Ce2O3), образующие твердый раствор с ZrO2 [15]. Такая стабилизация приводит к тому, что оксид циркония кристаллизуется в тетрагональной фазе, имеющей большую удельную поверхность, чем более термодинамически стабильная моноклинная фаза. Установлено, что в окислительном катализе, лучшими промоторами оксида циркония служат оксиды иттрия Y2O3 и лантана La2O3. В результате их добавления значительно увеличивается количество анионных вакансий и, следовательно, способность к адсорбции кислорода. Содержание 1–10 мол. % Y2O3/La2O3 в оксиде циркония обеспечивает максимальную ионную проводимость [15].
Другой эффективный способ модификации поверхности оксида циркония – его промотирование сульфат-ионами ${\text{SO}}_{4}^{{2 - }}$ и вольфрамат-ионами ${\text{WO}}_{4}^{{2 - }}$ с образованием так называемых твердых суперкислот. При этом наблюдается стабилизация оксида циркония и увеличение его поверхности. Исследования этих систем показали, что в случае ряда оксидов металлов, в том числе и ZrO2, каталитическая активность в результате промотирования увеличивается и превосходит активность 100%-ной серной кислоты в классических реакциях кислотного катализа [17]. Литературные данные по использованию твердых суперкислот в реакциях полного окисления ЛОС немногочисленны. В работе [4] была исследована реакция полного окисления метана на сульфатированном оксиде циркония с нанесенной платиной, однако не было сделано сравнение с использованием несульфатированного носителя для обоснования целесообразности его модификации для данной реакции.
В настоящей работе исследовано полное окисление модельного ЛОС, этана, на катализаторах, содержащих 1, 3, 5 мас. % CuO, нанесенного на оксид циркония, сульфатированный и вольфрамированный оксид циркония, и ZrO2, стабилизированный оксидом лантана.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез образцов
При синтезе образцов использовали следующие реактивы: нитрат цирконила ZrO(NO3)2 · · H2O (“Acros”, 99%), нитрат меди Cu(NO3)2 · · 3H2O (“Acros”, 99%), нитрат лантана La(NO3)3 · · 6H2O (“Acros”, 99%), пара-вольфрамат аммония (NH4)10[H2W12O42] · 4H2O (“Acros”, 99%), 25%-ный водный раствор аммиака NH3 · H2O (“Acros”, “х. ч.”), серную кислоту H2SO4 конц. раствор (“Химмед”, “х. ч.”). Синтез оксида циркония проводили по методике [18]. Готовили 0.5 М раствор нитрата цирконила ZrO(NO3)2. При интенсивном перемешивании к нему по каплям добавляли 25%-ный водный раствор аммиака NH3 · H2O до значения pH 8.4. Полученный гель гидроксида циркония Zr(OH)4 · xH2O сушили 24 ч при 120°С и прокаливали 4 ч при 400°С.
Для получения сульфатированного оксида циркония SO4/ZrO2 использовали ранее описанную методику [19]. Гидроксид циркония многократно пропитывали по влагоемкости 1 М раствором серной кислоты для того, чтобы полученный образец содержал 5 мас. % сульфат-анионов, затем сушили 24 ч при 120°С и прокаливали 4 ч при 650°С. Синтез системы WO3/ZrO2 проводили по методике [20]. Навеску пара-вольфрамата аммония (NH4)10[H2W12O42] · 4H2O растворяли в дистиллированной воде при нагревании до 70°С и интенсивном перемешивании. Затем раствором пропитывали по влагоемкости гидроксид циркония, сушили 24 ч при 120°С и прокаливали 4 ч при 750°С. Полученный образец содержал 15 мас. % вольфрамат-анионов. Оксид циркония, стабилизированный оксидом лантана, получали следующим образом. Навеску нитрата лантана La(NO3)3 · 6H2O растворяли в дистиллированной воде. Затем раствором пропитывали по влагоемкости гидроксид циркония, сушили 24 ч при 120°С и прокаливали 4 ч при 400°С. Полученный образец содержал 5 мас. % La2O3.
Синтез медьсодержащих катализаторов проводили следующим образом. Готовили три водных раствора нитрата меди для нанесения соответственно 1, 3 и 5 мас. % металла на каждый из синтезированных носителей: ZrO2, 5%SO4/ZrO2, 15%WO3/ZrO2, 5%La2O3/ZrO2. Затем данными растворами пропитывали по влагоемкости каждый носитель, сушили 24 ч при 120°С и прокаливали 4 ч при 400°С. Порошки синтезированных образцов прессовали в таблетки под давлением 15 МПа, фракционировали и в каталитическом эксперименте использовали фракцию с размером частиц 0.25–0.5 мм.
Методы исследования
Термический анализ проводили на приборе Derivatograph-C фирмы “MOM”. Навеску массой 100 мг помещали в тигель из алунда. Кривые ТГ-ДТГ-ДТА регистрировали в режиме линейного подъема температуры со скоростью 10 K/мин в интервале температур от 20 до 800°С на воздухе. Эталоном служил α-Al2O3. Рентгенофазовый анализ проводили на дифрактометре DRON-2 с использованием CuKα-излучения (λ = 1.514 Å). Образцы сканировали в области 2Θ = 20°–70° со скоростью 1 град/мин. Удельную поверхность рассчитывали по методу БЭТ, исходя из изотерм адсорбции воздуха, полученных при 77 K [21].
Каталитическая активность
Каталитическую активность образцов оценивали в реакции окисления этана в проточном реакторе с неподвижным слоем катализатора при атмосферном давлении. Образец катализатора (0.5 г) загружали в реактор в виде фракции 0.25–0.5 мм и при комнатной температуре подавали на катализатор поток реакционной смеси, содержащей 22.2 об. % этана и 77.8 об. % кислорода. Мольное соотношение O2/C2H6 = 3.5, что соответствует стехиометрии реакции полного окисления этана C2H6 + 3.5O2 = 2CO2 + 3H2O. Объемная скорость подачи смеси составляла 5000 ч–1. Далее реактор нагревали в термопрограмируемом режиме и хроматографически анализировали состав газа на выходе из реактора в ходе повышения температуры в слое катализатора. Анализ газообразных продуктов превращения проводили на газовом хроматографе “М-3700” с детектором по теплопроводности и набивной колонкой “HayeSep-Q” длиной 2 м в изотермическом режиме при температуре 60°С.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Физико-химические свойства носителей и катализаторов
Синтезированные носители и 5%-ные медьсодержащие катализаторы были охарактеризованы методом порошковой рентгенографии. На рис. 1 представлены дифрактограммы четырех синтезированных носителей: ZrO2, 5%SO4/ZrO2, 15%WO3/ZrO2, 5%La2O3/ZrO2. Во всех случаях идентифицируется смесь моноклинной (с дифракционными максимумами при 2θ = 28.17° и 31.46°) и тетрагональной (дифракционные максимумы при 2θ = 30.27°, 35.25°, 50.37°, 60.20°, 62.96°) фаз ZrO2. Дифрактограммы сульфатированного оксида циркония и оксида циркония, промотированного оксидом лантана, практически идентичны дифрактограмме ZrO2. На дифрактограмме отсутствуют рефлексы, характерные для сульфатов. Невозможность детектирования нанесенных сульфат-анионов данным методом показана в работе [17], La2O3 предположительно находится в рентгеноаморфном состоянии. На рентгенограмме образца 15%WO3/ZrO2 наблюдаются рефлексы, характерные для фазы оксида вольфрама WO3 (с максимумами при 2θ = 22° и 24.03°). На рис. 2 приведены дифрактограммы катализаторов, содержащих 5% Cu. Для всех образцов идентифицируются рефлексы, которые можно отнести к оксиду меди CuO (с максимумами при 2θ = 38.47 и 42.20°).
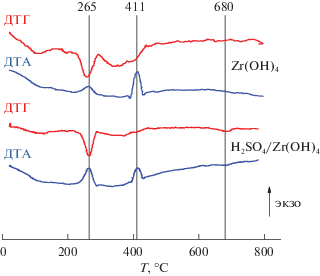
На рис. 3 приведено сравнение дериватограмм гидроксида циркония и гидроксида циркония, пропитанного серной кислотой. Суммарная потеря массы свежеприготовленного гидрооксида циркония при нагревании от 20 до 800°С составила 22%. Потеря массы происходит в несколько этапов. На первом этапе до 200°С происходит удаление адсорбированной воды [22], далее происходит разложение нитрата аммония, которому, вероятно, соответствует пик на ДТГ-кривой при 265°С и незначительный экзоэффект [23]. Наконец, в интервале температур 300–400°С происходят отщепление координационной воды [22] и кристаллизация оксида циркония ZrO2, которой соответствует четко выраженный экзоэффект при 410°С [18]. Суммарная потеря массы свежеприготовленного гидрооксида циркония, пропитанного серной кислотой при нагревании от 20 до 800°С, составила 26.5%. ДТГ-кривая, полученная для гидроксида циркония, пропитанного серной кислотой, в целом, аналогична описанной выше ДТГ-кривой гидроксида циркония. Различие состоит в том, что при 680°С на ДТГ-кривой присутствует пик без четко выраженного теплового эффекта, предположительно соответствующий удалению нанесенной серы в виде SO3 [24].
На рис. 4 представлены дериватограммы гидроксида циркония, пропитанного паравольфраматом аммония и нитратом лантана. Суммарная потеря массы в первом случае составила 21.2%. Характер ДТГ-кривой пропитанного паравольфраматом аммония гидроксида циркония, в целом, аналогичен характеру кривой для гидроксида циркония. Отличие состоит в том, что в области температур 240–320°С происходит разложение (NH4)10[H2W12O42] с образованием аммиака и WO3 [25]. Во втором случае суммарная потеря массы составила 34.5%. На ДТГ-кривой пропитанного нитратом лантана гидроксида циркония отчетливо виден максимум при 273°С, сопровождающийся экзоэффектом. В остальном ход кривой аналогичен ходу кривой гидроксида циркония.
На рис. 5 представлены дериватограммы оксида циркония и лантанированного оксида циркония, пропитанные нитратом меди. Суммарные потери массы составили 5.2 и 5.5% соответственно. На ДТГ-кривых наблюдаются пики с температурой в максимуме при 242 и 255°С, обусловленные удалению слабосвязанной воды, кристаллогидратной воды Cu(NO3)2 · 3H2O и последующим разложением нитрата меди. Эти процессы сопровождаются эндоэффектом.
Методом низкотемпературной адсорбции азота были определены удельные площади поверхности исходного гидроксида циркония, четырех синтезированных носителей и 5%-ных медьсодержащих катализаторов, результаты представлены в табл. 1. Как видно из таблицы, немодифицированный оксид циркония имеет наибольшую удельную поверхность. Результаты коррелируют с температурой прокаливания при синтезе образцов. В случае 5%SO4/ZrO2 температура прокаливания составляла 650°С, в случае 15%WO3/ZrO2 – 750°C. По данным результатам можно сделать вывод, что нанесение меди немного уменьшает удельную поверхность носителя. Это может быть связано с тем, что CuO занимает поры в структуре подложки, а также со спеканием частиц при проведении повторного прокаливания.
Каталитическое окисление этана
На рис. 6 приведены зависимости конверсии этана от температуры для следующей серии образцов: ZrO2, 1%Cu/ZrO2, 3%Cu/ZrO2, 5%Cu/ZrO2. Результаты показывают, что во всех случаях была достигнута 100%-ная конверсия этана. Температура зажигания реакции на чистом оксиде циркония составила 375°С. Нанесение меди ведет к уменьшению температуры зажигания реакции и температуры 50%- и 100%-ной конверсии.
Рис. 6.
Зависимости конверсии этана (α) от температуры на образцах: 1 – ZrO2, 2 – 1%Cu/ZrO2, 3 – 3%Cu/ZrO2, 4 – 5%Cu/ZrO2.

На рис. 7 представлены зависимости конверсии этана от температуры для следующей серии образцов: 5%SO4/ZrO2, 1%Cu/5%SO4/ZrO2, 3%Cu/5%SO4/ZrO2, 5%Cu/5%SO4/ZrO2. Данные результаты показывают, что для медьсодержащих катализаторов во всех случаях в условиях эксперимента была достигнута 100%-ная конверсия этана. Однако для носителя, сульфатированного оксида циркония, каталитическая активность оказалась существенно хуже, и в температурных условиях (Tmax = 650°C) конверсия этана составила только 85%. Тем самым, мы наблюдали дезактивацию сульфатированного оксида циркония, описанную в [17]. Нанесение меди ведет к заметному уменьшению температуры зажигания реакции и температур 50%- и 100%-ной конверсии.
Рис. 7.
Зависимости конверсии этана (α) от температуры на образцах: 1 – 5%SO4/ZrO2, 2 – 1%Cu/5%SO4/ZrO2, 3 – 3%Cu/5%SO4/ZrO2, 4 – 5%Cu/5%SO4/ZrO2.

На рис. 8 приведены конверсионные кривые для следующей серии образцов: 15%WO3/ZrO2, 1%Cu/15%WO3/ZrO2, 3%Cu/15%WO3/ZrO2, 5%Cu/15%WO3/ZrO2. Видно, что для всех медьсодержащих катализаторов в условиях эксперимента была достигнута 100%-ная конверсия этана. Носитель, вольфрамированный оксид циркония, как и в предыдущем случае, показал очень низкую каталитическую активность. При Т = 650°С была достигнута лишь 50%-ная конверсия этана. Дезактивация вольфрамированного оксида циркония соответствует данным [17]. Несмотря на то, что носитель оказался менее активным, чем сульфатированный оксид циркония, данная серия медных катализаторов показала несколько более высокую активность.
Рис. 8.
Зависимости конверсии этана (α) от температуры на образцах: 1 – 15%WO3/ZrO2, 2 – 1%Cu/15%WO3/ZrO2, 3 – 3%Cu/15%WO3/ZrO2, 4 – 5%Cu/15%WO3/ZrO2.

На рис. 9 представлены конверсионные кривые для серии лантан-содержащих образцов: 5%La2O3/ZrO2, 1%Cu/5%La2O3/ZrO2, 3%Cu/5%La2O3/ZrO2, 5%Cu/5%La2O3/ZrO2. Результаты показывают, что во всех случаях в условиях эксперимента была достигнута 100%-ная конверсия этана. Лантанированный оксид циркония как носитель лучше двух предыдущих, но уступает немодифицированному оксиду циркония. Данная серия медь-содержащих катализаторов также показывает более высокую каталитическую активность, чем две предыдущие серии, но уступает первой. По каталитической активности образцы располагаются следующим образом: 5%Cu/ZrO2 > > 5%Cu/5%La2O3/ZrO2 > 5%Cu/15%WO3/ZrO2 > > 5%Cu/5%SO4/ZrO2. Температуры 100%-ной конверсии этана составляют 305, 385, 410 и 419°С соответственно.
Рис. 9.
Зависимости конверсии этана (α) от температуры на образцах: 1 – 5%La2O3/ZrO2, 2 – 1%Cu/5%La2O3/ZrO2, 3 – 3%Cu/5%La2O3/ZrO2, 4 – 5%Cu/5%La2O3/ZrO2.

Таким образом, было установлено, что наибольшую активность в реакции окисления этана демонстрируют катализаторы на основе немодифицированного оксида циркония. Это может быть обусловлено большей удельной поверхностью данных образцов. С помощью методов БЭТ, РФА и ТГ-ДТА было показано, что сульфатирование, вольфрамирование и добавление лантана к оксиду циркония приводят к стабилизации тетрагональной фазы оксида циркония. Разложение исходных соединений и кристаллизация оксида циркония происходит до 410°С. Можно также предположить, что оксид меди, нанесенный на модифицированные носители, взаимодействует с добавками с образованием сульфата, вольфрамата или купрата, которые менее активны, чем оксид меди.
Список литературы
Janssen F.J., Santen R.A. Environmental Catalysis. Imperial College Press, 1999. 369 p.
Matejova L., Topka P., Jiratova K., Solcova O. // Applied Catalysis A: General. 2012. V. 443. P. 40.
Kamal M.S., Razzak S.A., Hossain M.M. // Atmospheric Environment. 2016. V. 140. P. 117.
Кустов Л.М., Скупов К.М., Горященко С.С., Маслобойщикова О.В. // Журн. физ. химии. 2014. Т. 88. № 5. С. 891.
Kucherov A.V., Tkachenko O.P., Kirichenko O.A. et al. // Top Catal. 2009. V. 52. P. 351.
Макшина Е.В., Боровских Л.В., Кустов А.Л. и др. // Журн. физ. химии. 2005. Т. 79. № 2. С. 253.
Kustov A.L., Tkachenko O.P., Kustov L.M., Romanovsky B.V. // Environment International. 2011. V. 37. P. 1053.
Davshan N.A., Kustov A.L., Tkachenko O.P. et al. // ChemCatChem. 2014. V. 6. P. 1990.
Отрощенко Т.П., Туракулова А.О., Вобликова В.А. и др. // Журн. физ. химии. 2013. Т. 87. № 11. С. 1836.
Семушина Ю.П., Печенюк С.И., Кузьмич Л.Ф., Князева А.И. // Там же. 2017. Т. 91 № 1. С. 30.
Каплин И.Ю., Локтева Е.С., Голубина Е.В. и др. // Там же. 2016. Т. 90. № 11. С. 1634.
Slovetskaya K.I., Greish A.A., Vorob’eva M.P., Kustov L.M. // Russ. Chem. Bull. International Edition. 2001. V. 50. P. 1589.
Пушкин А.Н., Гулиш О.К., Кощеева Д.А., Шебанов М.С. // Журн. физ. химии. 2013. Т. 87. № 1. С. 27.
Fang Y., Guo Y. // Chin. J. Catalysis. 2018. V. 39. P. 566.
Bialas A., Kondratovicz T., Drozdec M., Kustrowski P. // Catalysis Today. 2015. V. 257. P. 144.
Aguila G., Gracia F., Cortes J., Araya P. // Applied Catalysis B: Environmental. 2008. V. 77. P. 325.
Иванов А.В., Кустов Л.М. // Росс. хим. журн. 2000. Т. 2. С. 21.
Arata K. // Advances in Catalysis. 1990. V. 37. P. 165.
Ivanov A.V., Khelkovskaya-Sergeeva E.G., Vasina T.V. // Russ. Chem. Bull. 1999. V. 48. №7. P. 1266.
Scheifauer M., Grasselli R., Knozinger H. // Langmuir. 1998. V. 14. P. 30.
Клячко-Гурвич А.Л. // Изв. АH СССР. Отделение химических наук. 1961. № 10. С. 1884.
Clearfield A., Serrette G.P.D., Khazi-Syed A.H. // Catalysis Today. 1994. V. 20. P. 295.
Kirichenko O., Kapustin G., Nissenbaum V. et al. // J. Thermal Analysis and Calorimetry. 2018. V. 134. P. 233.
Reddy B., Patil M. // Chem. Rev. 2009. V. 109. P. 2185.
Колмакова Л.П., Ковтун О.Н., Довженко Н.Н. // J. Siberian Federal University. Engineering & Technologies. 2010. V. 3. P. 293.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии