Журнал физической химии, 2019, T. 93, № 11, стр. 1668-1673
Кинетика и механизм синтеза бензилбутилового эфира в присутствии медьсодержащих катализаторов
К. Ф. Коледина a, b, *, И. М. Губайдуллин a, b, С. Н. Коледин a, А. Р. Байгузина a, b, Л. И. Галлямова a, Р. И. Хуснутдинов a, b
a Российская академия наук, Уфимский федеральный исследовательский центр, Институт нефтехимии и катализа
Уфа, Россия
b Уфимский государственный нефтяной технический университет
Уфа, Россия
* E-mail: koledinakamila@mail.ru
Поступила в редакцию 17.01.2019
После доработки 17.01.2019
Принята к публикации 12.02.2019
Аннотация
Математическими методами исследована реакция синтеза бензилбутилового эфира межмолекулярной дегидратацией бензилового и н-бутилового спиртов под действием медьсодержащих катализаторов. Предложен механизм реакции синтеза бензилбутилового эфира, определены значения кинетических параметров. Проведен сравнительный анализ энергий активаций возможных стадий химических превращений, определены возможные пути протекания реакции и каталитические циклы реакции. Проанализированы изменения скоростей стадий и изменения концентраций всех веществ, участвующих в реакции.
Бензилбутиловый эфир, обладающий фруктовым и цветочным запахами, является ценным душистым веществом и широко используется для ароматизации продуктов парфюмерной и косметической промышленности. Бензилбутиловый эфир – крупнотоннажный промышленный продукт, он разрешен во многих странах для применения в качестве ароматизатора пищевых продуктов (мороженого, льда, напитков, десертов, выпечки и т.д.) [1].
В работе [2] установлено, что межмолекулярную дегидратацию бензилового спирта с алифатическими спиртами с образованием эфиров могут катализировать соединения меди, лучшим из которых является CuBr2. В настоящей работе механизм сложной химической реакции синтеза бензилбутилового эфира межмолекулярной дегидратацией бензилового спирта с н-бутанолом под действием катализатора CuBr2 исследован путем построения кинетической модели на основе решений обратных задач химической кинетики [3–7].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для выполнения кинетических экспериментов использовали следующие реактивы: н-бутиловый и бензиловый спирты, CuBr2 (фирма “Aсros”). Эксперименты по изучению кинетики межмолекулярной дегидратации бензилового спирта и н-бутанола под действием катализатора CuBr2 проводили в стеклянной ампуле (V = 10 мл), помещенной в микроавтоклав из нержавеющей стали (V = 17 мл) при постоянном перемешивании и регулируемом нагреве. Состав реакционной массы анализировали методом газожидкостной хроматографии на приборе “Shimadzu GC-9A” (колонка размером 2 м × 3 мм, неподвижная фаза – силикон SE-30 (5%) на Chromaton N-AW-HMDS, температурный режим от 50 до 270°С со скоростью программирования 8 К/мин, газ-носитель – гелий (47 мл/мин)).
Для описания кинетики и механизма синтеза бензилбутилового эфира под действием медьсодержащих катализаторов применяли методы математического моделирования. Математическая модель задач химической кинетики представляет собой систему дифференциальных уравнений, описывающих изменение концентраций веществ во времени, в соответствии со скоростями протекания стадий реакции. Система дифференциальных уравнений имеет начальные данные и представляет собой задачу Коши [8]. Численное решение такой системы уравнений – прямая задача химической кинетики. Определение кинетических параметров стадий реакции путем сопоставления расчетных значений концентраций веществ их экспериментальным значениям – обратная задача химической кинетики. Математически задача представляет собой минимизацию функционала отклонения расчетных значений от экспериментальных данных. Для данной задачи функционал минимизации определен как сумма абсолютных отклонений расчетных концентраций от экспериментальных данных:
(1)
$F = \sum\limits_{i = 1}^I {\sum\limits_{p = 1}^P {\left| {x_{{ij}}^{{{\text{calc}}}} - x_{{ij}}^{{\exp }}} \right|} } \to \min ,$Решение поставленной задачи проводили, используя ранее разработанные программные комплексы [9, 10], в которых решение прямой кинетической задачи проводится многошаговым методом Гира переменного порядка, неявным методом Розенброка [11, 12]. А для решения обратной кинетической задачи в зависимости от ее сложности использовали генетический алгоритм, метод прямого поиска Хука–Дживса, метод отжига, метод мультистарта или их комбинации [13, 14].
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Межмолекулярная дегидратация бензилового и н-бутилового спиртов может привести к образованию трех эфиров: бензилбутилового, дибензилового и дибутилового:
Как показали эксперименты, в присутствии каталитических количеств CuBr2 основным продуктом реакции является бензилбутиловый эфир. Учитывая известный механизм образования простых эфиров из спиртов в условиях кислотного катализа, предусматривающий генерирование из спиртов карбкатионов, можно предположить, что роль CuBr2 заключается в образовании бензильного и бутильного карбкатионов из PhCH2OH и н-BuOH в виде комплексов с CuBr2:
Очевидно, что образование [PhCH2]+ более предпочтительно, чем образование катиона [Bu]+, так как в первом случае катион стабилизирован за счет сопряжения с ароматическим кольцом.
Возможны два маршрута образования бензилбутилового эфира, которые отличаются строением атакующего субстрата: в первом – происходит атака н-бутанола бензильным катионом, комплексно-связанным с CuBr2, а во втором – бутильный катион атакует бензиловый спирт:
Последующее математическое моделирование кинетики реакции позволило определить, что образование бензилбутилового эфира возможно по обоим маршрутам, но с разной степенью вероятности.
Данные стадии являются ключевыми для исследуемой реакции. Указанным реакциям сопутствуют конкурирующие превращения, приводящие к образованию побочных продуктов: дибензилового PhCH2OCH2Ph (X6), дибутилового эфиров BuOBu (X12), наблюдаемых экспериментально.
Окончательно механизм реакции состоит из девяти стадий. В табл. 1 приведены стадии химических превращений и соответствующие кинетические уравнения. Значения констант скоростей определяются по уравнению [15, 16]:
Здесь ${{w}_{j}}$ – скорость j-й стадии, 1/с; ${{E}_{j}}$ – энергии активации стадий, кал/моль; R – газовая постоянная, 1.986 кал/(моль К); T – температура, K; kj – константы скоростей стадий, $k_{j}^{0}$– предэкспоненциальные множители.Таблица 1.
Стадии химических превращений и кинетические уравнения каталитического синтеза бензилбутиловых эфиров
| N | Стадии химических превращений | Уравнения |
|---|---|---|
| 1 | PhCH2OH(X1) + CuBr2(X2) → [PhCH2]+[CuBr2(OH)]–(X3) | w1 = k1x1x2 |
| 2 | [PhCH2]+[CuBr2(OH)]–(X3) + BuOH(X4) → [PhCH2OBu]H+ [CuBr2(OH)]–(X5) | w2 = k2x3x4 |
| 3 | [PhCH2OBu]H+[CuBr2(OH)]–(X5) → PhCH2OBu(X6) + H2O(X7) + CuBr2(X2) | w3 = k3x5 |
| 4 | [PhCH2]+[CuBr2(OH)]-(X3) + PhCH2OH(X1) → [PhCH2OHCH2Ph]+ [CuBr2(OH)]–(X8) | w4 = k4x3x1 |
| 5 | [PhCH2OHCH2Ph]+ [CuBr2(OH)]–(X8) → PhCH2OCH2Ph (X9) + H2O(X7) + CuBr2(X2) | w5 = k5x8 |
| 6 | BuOH(X4) + CuBr2(X2) → [Bu]+[CuBr2(OH)]– (X10) | w6 = k6x2x4 |
| 7 | [Bu]+[CuBr2(OH)]– (X10) + BuOH(X4) → [BuOHBu]+[CuBr2(OH)]– (X11) | w7 = k7x1x4 |
| 8 | [BuOHBu]+[CuBr2(OH)]– (X11) → BuOBu(X12) + H2O(X7) + CuBr2(X2) | w8 = k8x11 |
| 9 | [Bu]+[CuBr2(OH)]– (X10) + PhCH2OH(X1) → [PhCH2OBu]H+ [CuBr2(OH)]–(X5) | w9 = k9x1x10 |
Для механизма реакции, представленного в табл. 1 рассчитаны значения кинетических параметров описанными выше методами. В табл. 2 приведены значения констант скоростей стадий, энергий активации и логарифм предэкспоненциального множителя.
Таблица 2.
Значения кинетических параметров каталитического синтеза бензилбутилового эфира
| Стадия | kj | Ej, ккал/моль | $\ln k_{j}^{0}$ | ||
|---|---|---|---|---|---|
| 140°C | 160°C | 175°C | |||
| 1 | 1.701 | 2.469 | 2.8 | 5.366 | 7.049 |
| 2 | 2.056 | 3.911 | 6.54 | 12.18 | 15.45 |
| 3 | 0.052 | 0.081 | 0.1411 | 10.31 | 9.49 |
| 4 | 1.922 | 5.101 | 7.02 | 13.96 | 17.61 |
| 5 | 0.113 | 0.491 | 0.85 | 21.69 | 24.15 |
| 6 | 0.0006 | 0.00081 | 0.0028 | 15.029 | 10.67 |
| 7 | 0.117 | 0.6031 | 0.62 | 18.46 | 20.38 |
| 8 | 1.95e–004 | 0.0021 | 0.005 | 35.108 | 34.14 |
| 9 | 0.15 | 0.1631 | 0.5 | 11.93 | 12.38 |
На рис. 1 приведена кинетическая модель (схема протекания стадий и соответствующие энергии активации стадий) каталитической реакции синтеза бензилбутилового, дибензилового и дибутилового эфиров под действием медьсодержащих катализаторов. Механизм реакции состоит из четырех каталитических циклов (рис. 1, а–г).
Каталитические циклы, приведенные на рис. 1а,б приводят к образованию целевого продукта – бензилбутилового эфира. Образование бензилбутилового эфира возможно в результате атаки н‑бутанола бензильным катионом, который генерируется из бензилового спирта под действием CuBr2 – [PhCH2]+[CuBr2(OH)]– (X3) (рис. 1а) (E1 = = 5.366 ккал/моль), или путем атаки бензилового спирта комплексом, содержащим бутильный катион [Bu]+[CuBr2(OH)]– (X10) (E6 = 15.029 ккал/моль) (рис. 1б). Как видно из значений энергий активации стадий каталитических циклов, приведенных на рис. 1а и 1б, реакция, в которой атакующим интермедиатом является бензильный катион (комплексно-связанный с CuBr2) (стадии 1–3) протекает значительно легче, чем реакция с участием бутильного катиона (стадии 6, 9, 3) [2]. Значения энергий активации стадий 1 и 6 соответствуют теоретическому предположению о более легком протекании стадии 1. Стадии 1–3 являются целевыми и имеют меньшие значения энергий активации.
Каталитический цикл, приведенный на рис. 1в (стадии 1, 4, 5) приводит к образованию дибензилового эфира по реакции комплекса [PhCH2]+[CuBr2(OH)]– (X3) с бензиловым спиртом и образованием промежуточного комплекса [PhCH2OHCH2Ph]+ [CuBr2(OH)]–(X8) (E4 = 13.96 ккал/моль). Последний разлагаясь, выделяет дибензиловый эфир и воду, с замыканием каталитического цикла (E5 = 21.69 ккал/моль). Каталитический цикл, приведенный на рис. 1г (стадии 6, 7, 8) приводит к образованию дибутилового эфира по реакции комплекса [Bu]+[CuBr2(OH)]– (X10) с н-бутанолом и образованием промежуточного комплекса [BuOHBu]+[CuBr2(OH)]– (X11) (E7 = = 18.46 ккал/моль). Данный комплекс, разлагаясь, образует дибутиловый эфир и воду с замыканием каталитического цикла (E8 = 35.1 ккал/моль). Рассчитанные значения энергий активации стадий 6, 7, 8 свидетельствуют об энергетически затратном пути образования дибутилового эфира, что соответствует экспериментальным данным, согласно которым, выход дибутилового эфира не превышает 1% [2].
Таким образом, стадии, приводящие к образованию побочных продуктов имеют большие значения энергий активации и маловероятны, по сравнению со стадиями образования целевого бензилбутилового эфира.
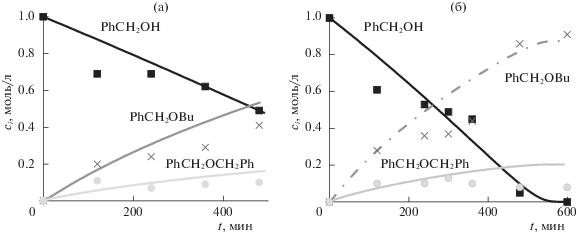
На рис. 2 приведено соответствие экспериментальных данных с расчетными значениями измеряемых субстратов реакции синтеза бензилбутилового эфира. Наблюдаемые субстраты – исходный бензиловый спирт PhCH2OH(X1) и продукты реакции PhCH2OBu(X6), PhCH2OCH2Ph (X9), BuOBu(X12) (последний на графиках не приводится вследствие незначительного выхода). На графиках представлены значения концентраций веществ по отношению к сумме всех значений наблюдаемых веществ (мол. доли) при различных температурах. Описание экспериментальных данных (рис. 2) в основном удовлетворительное (относительная ошибка не превышает 15%). Таким образом, расчетные значения, полученные по схеме из табл. 1 описывают экспериментальные данные в пределах допустимой погрешности. Это дает основания сделать вывод о достоверности данного механизма для реакции каталитического синтеза бензилбутилового эфира.
Рис. 2.
Соответствие экспериментальных данных (точки) и расчетных значений (линии) изменения концентрации (ci) наблюдаемых субстратов при 160 (а) и 175°С (б).
На рис. 3 приведены графики изменения скоростей стадий реакции синтеза бензилбутилового эфира в течение эксперимента. Одновременно с уменьшением скорости первой стадии, запускающей каталитический цикл, происходит увеличение скоростей стадий 2, 3 (рис. 3а), а также стадий 4, 5 (рис. 3б). Скорости стадий 6, 7, 8, 9 имеют монотонный рост и резкое увеличение после 450 мин. Наименьшая скорость наблюдается у стадии 8 при всех температурах, наибольшая – у стадии 1.
Рис. 3.
Изменение скоростей стадий (wi) каталитического синтеза бензилбутилового эфира при T = 175°C.

На рис. 4а,б приведены расчетные изменения концентраций всех субстратов, участвующих в реакции при Т = 175°C. Наблюдается монотонный рост концентрации целевого продукта PhCH2OCH2Ph (X6) с замедлением к 500 мин, в связи с уменьшением концентрации X5. Наряду с этим происходит увеличение концентрации побочного продукта BuOBu (X12) после 500 мин, т.е. оптимальная продолжительность реакции – 500 мин.
Рис. 4.
Изменение концентраций (хi) всех субстратов каталитического синтеза бензилалкиловых эфиров при T = 175°C.

Таким образом, предложен механизм каталитической реакции синтеза бензилбутилового эфира, определены значения кинетических параметров. Проведен сравнительный анализ энергий активаций возможных стадий схемы химических превращений, определены возможные пути протекания реакции и каталитические циклы реакции. Проанализированы изменения скоростей стадий и изменения концентраций всех веществ, участвующих в реакции.
Работа выполнена при частичной финансовой поддержке грантов РФФИ № 18-07-00341, № 18-37-00015, № 17-43-020155р_а, РНФ № 19-71-00006, Стипендии Президента РФ СП-669.2018.5.
Список литературы
Войткевич С.А. // 865 Душистых веществ для парфюмерии и бытовой химии. M.: Пищевая промышленность. 1994. 594 с.
Байгузина А.Р., Гималетдинова Л.И., Хуснутдинов Р.И. // Журн. орган. химии. 2018. Т. 54. № 8. С. 1140. (А.R. Bayguzina, L.I. Gimaletdinova, R.I. Khusnutdinov // Russ. J. Org. Chem. 2018. V. 54. № 8. P. 1148. )https://doi.org/10.1134/S1070428018080055
Nurislamova L.F., Gubaydullin I.M., Koledina K.F. // React. Kinet. Mech. Catal. 2015. V. 116. № 1. P. 79. https://doi.org/10.1007/s11144-015-0876-6
Nurislamova L.F., Gubaydullin I.M., Koledina K.F. et al. // Ibid. 2016. V. 117. № 1. P. 1. https://doi.org/10.1007/s11144-015-0927-z
Koledina K.F., Koledin S.N., Schadneva N.A. et al. // Ibid. 2017. V. 121. № 2. P. 425. https://doi.org/10.1007/s11144-017-1181-3
Коледина К.Ф., Губайдуллин И.М. // Журн. физ. химии. 2016. Т. 90. № 5. С. 673. (K.F. Koledina, I.M. Gubaidullin // Russ. J. Phys. Chem. A. 2016.V. 90. № 5. P. 914. )https://doi.org/10.1134/S0036024416050186
Коледина К.Ф., Коледин С.Н., Щаднева Н.А. и др. // Журн. физ. химии. 2017 Т. 91. № 3. С. 422. (K.F. Koledina, S.N. Koledin, N.A. Shchadneva et al. // Russ. J. Phys. Chem. A. 2017. V. 91. № 3. P. 444. ).https://doi.org/10.1134/S003602441703013X
Gubaydullin I.M., Koledina K.F., Sayfullina L.F. // Eng. J. 2014. V. 18. № 1. 13 p.https://doi.org/10.4186/ej.2014.18.1.13
Коледина К.Ф., Коледин С.Н., Губайдулин И.М. Оптимизация констант кинетической модели сложной химической реакции с выбором параметров. Свидетельство о регистрации программы для ЭВМ № 2018619164 от 01.08.2018 // Программы для ЭВМ. Базы данных. Топологии интегральных микросхем. 2018. № 8. С. 1.
Новичкова А.В., Бобренева Ю.О., Губайдуллин И.М. и др. Программа расчета интервалов неопределенности кинетических параметров “INTKIN”. Свидетельство о регистрации электронного ресурса № 19951. Дата регистрации 24 февраля 2014 г. А.C. 19951 РФ // Хроники объединенного фонда электронных ресурсов. Наука и образование. 2014. Т. 1. № 2 (57). С. 52.
Альшин А.Б., Альшина А.Е., Калиткин Н.Н. и др. // ЖВММФ. 2006. Т. 46. № 8. С. 1392.
Коледин С.Н., Карпенко А.П., Коледина К.Ф. и др. // Электротехнические и информационные комплексы и системы. 2017. Т. 13. № 4. С. 71.
Спивак С.И., Коледина К.Ф., Коледин С.Н. и др. // Прикладная информатика. 2017. Т. 12. № 1(67). С. 39.
Коледина К.Ф., Коледин С.Н., Губайдуллин И.М. и др. // Системы управления и информационные технологии. 2015. № 3(61). С. 79.
Димитров В.И. Простая кинетика. Новосибирск: Наука, 1982. 380 с.
Чокендорф И., Наймантсведрайт Х. Современный катализ и химическая кинетика: Научное издание. Долгопрудный: Издательский дом “Интеллект”, 2010. 504 с.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии



