Журнал физической химии, 2019, T. 93, № 12, стр. 1838-1845
Влияние паров циклических углеводородов на структуру YBa2Cu3Oy
И. Б. Бобылев a, *, Н. А. Зюзева a, С. В. Наумов a
a Российская академия наук, Уральское отделение, Институт физики металлов
имени М.Н. Михеева
Екатеринбург, Россия
* E-mail: bobylev@imp.uran.ru
Поступила в редакцию 30.01.2019
После доработки 14.03.2019
Принята к публикации 09.04.2019
Аннотация
Исследовано влияние паров простейших циклических углеводородов при низких температурах (200–300°C) на структуру YBa2Cu3Oy (123) с высоким (у = 6.96) и низким (у = 6.3) содержанием кислорода. Установлено, что при низкотемпературной обработке в парах этих углеводородов происходит гидратация 123. При этом в YBa2Cu3Oy образуется оптимальное количество планарных дефектов упаковки, а также появляются включения вторых фаз за счет восстановления меди, которые, являясь центрами пиннинга, способны улучшать критические свойства ВТСП-материалов в высоких магнитных полях.
В настоящее время активно ведутся исследования, направленные на создание искусственных центров пиннинга в ВТСП-материалах на основе соединений YBa2Cu3Oy (123). Помимо образующихся в процессе синтеза микрочастиц примесных фаз [1, 2], перспективны эндогенные структурные дефекты и включения вторых фаз, которые могут быть созданы путем низкотемпературной обработки в различных газовых средах [3–6]. Кроме того, интеркаляция некоторых химических примесей может приводить к появлению дополнительных центров пиннинга и, как следствие, к увеличению критического тока [7].
В [8–16] было установлено, что гидрирование и гидратирование 123 при температурах 150–200°C существенно изменяют его структуру. В частности, обработка в парах воды или в атмосфере водорода приводит к расщеплению Cu–O-цепочек и к переходу 123 в фазу псевдо-124. Данная фаза отличается от фазы YBa2Cu4O8 (124) наличием в расщепленных цепочках вакантных позиций меди и кислорода [15].
В [14, 16] было показано, что последующий после обработки в парах воды или в водороде высокотемпературный отжиг текстурированных образцов YBa2Cu3O6.96 существенно улучшает их токонесущую способность в высоких магнитных полях. Это связано с появлением в ходе низкотемпературного отжига планарных дефектов упаковки (расщепленные Cu–O-цепочки), являющихся центрами пиннинга. Положительный фактор гидрирования – появление вследствие частичного восстановления меди включений посторонних фаз, которые могут служить точечными центрами пиннинга [14]. В [17, 18] исследовано взаимодействие ВТСП с нафталином и бензопирилом. Были обнаружены свидетельства того, что внедрение плоских органических молекул между слоями решетки Bi2Sr2CaCu2O8 заметно улучшает их критические характеристики.
В настоящей работе исследовали влияние паров простейших циклических органических соединений на структуру и свойства YBa2Cu3Oy с различным содержанием кислорода (у = 6.3 и 6.96). Органические соединения могут служить источниками воды в случае протекания реакции их окисления [19]. Поэтому обработка в парах циклических углеводородов может повлиять на структуру 123, аналогично обработке в парах воды. Предполагаем, что взаимодействие паров циклических соединений с 123 будет протекать по другому механизму по сравнению с действием паров воды и может позволить минимизировать негативные явления, связанные с гидролизом на межзеренных границах. Данное предположение основано на том, что в осушенной атмосфере, содержащей только пары органических соединений, на поверхности зерен не адсорбируются молекулы воды, а, следовательно, исключается развитие гидролиза. Кроме того, эти органические соединения могут проявлять восстановительные свойства.
Взаимодействие циклических углеводородов с 123 может протекать по различным механизмам, но при относительно низких температурах химические процессы в присутствии оксидов переходных металлов всегда носят каталитический характер [19]. Поэтому в работе исследуется также возможность катализа реакции окисления циклических углеводородов соединениями, содержащими оксид меди.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для исследования использовали таблетки CuO и YBa2Cu3Oy массой ∼0.5 г, полученные по стандартной керамической технологии [20]. Образцы YBa2Cu3Oy имели кислородный индекс y = 6.96 и 6.3. Заданное содержание кислорода достигали в ходе отжига при t = 400 и 900°C соответственно. Термообработку образцов проводили при t = 200 и 300°C в течение 10–70 ч в атмосфере сухого воздуха, насыщенного парами бензола, толуола или анилина. Изменение массы образцов определяли методом гравиметрии. Погрешность измерения составляла 0.005%. После низкотемпературной обработки некоторые образцы подвергали отжигу в сухом воздухе при t = 200–900°C в присутствии индикатора CoCl2, который изменяет окраску в зависимости от влажности атмосферы и позволяет качественно судить о появлении в ней воды.
Рентгенографическое исследование проводили на дифрактометре “Empyrean” фирмы PANalytical в медном излучении (CuKα). Расчеты кристаллической структуры, уточнение структурных параметров, а также расчет количественного содержания вторых фаз осуществляли с использованием программного пакета PowderCell 2.3 [21].
Температурные зависимости магнитной восприимчивости измеряли на СКВИД магнитометре MPMS XL5 на частоте 80 Гц в переменном поле 4Э. Хроматографический анализ газообразных продуктов взаимодействия YBa2Cu3Oy и CuO с парами углеводородов проводили с помощью хроматографа “Shimadzu” GC 2010” и хромато-масс-спектрометра “Adgilent GC 7890A MS 9575C Inert XL EI/CI”. Анализировали растворенные в соответствующих углеводородах пробы газа, отобранные на выходе из реакционной камеры. Кроме того, там же помещали резистивный датчик влажности, позволяющий качественно судить о наличии в атмосфере влаги.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Полученные результаты показали, что при t ≤ ≤ 300°C пары циклических углеводородов практически не способны восстанавливать CuO (табл. 1). Это свидетельствует о том, что они являются слабыми восстановителями. Более того, циклические соединения при t = 200°C слабо восстанавливают и содержащуюся в YBa2Cu3O6.96 трехвалентную медь, на что указывают небольшие изменения массы образцов (табл. 2). Если исключить интеркаляцию органических соединений в 123, то увеличение массы может быть связано только с поглощением воды, образующейся в ходе восстановления трехвалентной меди. В упрощенном виде такая реакция может быть представлена как
Таблица 1.
Изменение массы (Δm) образцов после обработки в течение времени τ1 (при 200°C) и τ2 (при 300°C), фазовый состав образцов CuO
| Обработка образцов | τ1, ч | τ2, ч | Δm, % |
|---|---|---|---|
| в парах бензола | 15 | – | 0 |
| – | 30 | –0.02 | |
| в парах толуола | 25 | – | 0 |
| – | 15 | –0.03 | |
| в парах анилина | 15 | – | 0 |
| – | 15 | 0.02 |
Таблица 2.
Условия обработки, изменения массы и параметры решетки YBa2Cu3O6.96
| Обработка образцов | τ1, ч (200°С) | τ2, ч (300°С) | Δm, % | а | b | c | Vяч | (b – a)/(b + + a) × 103 |
|---|---|---|---|---|---|---|---|---|
| исходный | – | – | – | 3.8240 | 3.8875 | 11.6883 | 173.76 | 8.23 |
| в парах бензола | 25 | – | 0.20 | 3.8268 | 3.8898 | 11.6819 | 173.89 | 8.16 |
| – | 25 | –0.39 | 3.8687 | – | 11.7411 | 175.48 | 0 | |
| в парах толуола | 45 | – | 0.17 | 3.8269 | 3.8863 | 11.6858 | 173.79 | 7.70 |
| 10 | –0.23 | – | – | – | – | – | ||
| 70 | –0.92 | 3.8475 | 3.8720 | 11.7226 | 174.64 | 2.02 | ||
| в парах анилина | 15 | – | 0.10 | 3.8230 | 3.8890 | 11.6876 | 173.77 | 8.56 |
| – | 15 | –0.71 | 3.8409 | 3.8769 | 11.7399 | 174.82 | 4.66 | |
| в парах карбамида | 15 | – | 0.22 | 3.8259 | 3.8906 | 11.6883 | 173.98 | 8.38 |
Расчеты показывают, что изменения массы образцов после термообработки слишком малы и не соответствуют полному восстановлению имеющейся в YBa2Cu3O6.96 трехвалентной меди.
Согласно данным рентгеноструктурного анализа, после обработки YBa2Cu3O6.96 в парах бензола и толуола уменьшается ромбическое искажение решетки (табл. 2). Это указывает на снижение в нем содержания кислорода. Однако фазы с расщепленными Cu–O цепочками (псевдо-123.5 и псевдо-124) практически не образуются (рис. 1, кривые 2), что, вероятно, связано с недостаточным количеством поглощенной воды. Кроме того, после термообработки уменьшается параметр с и увеличивается объем элементарной ячейки, как это наблюдается после обработки в парах воды. Параметр с обычно связывают с содержанием в соединении YBa2Cu3Oy кислорода, но в данном случае его изменение, а также увеличение объема ячейки свидетельствуют о вхождении воды в его структуру.
Рис. 1.
Дифрактограммы в интервале 2θ = 6–80 (а) и 6–8 град (б) образцов YBa2Cu3O6.96 после обработок в парах циклических соединений; 1 – исходное состояние, 2 и 3 – в парах бензола при t = 200 и 300°C соответственно, 4 – в парах толуола при t = 300°C . Примесные фазы: • – CuO, * – Y2BaCuO5.

При температуре 300°C процесс восстановления меди в YBa2Cu3O6.96 циклическими углеводородами идет интенсивнее и сопровождается значительным изменением массы образцов (табл. 2). При этом вследствие потери кислорода сильнее снижается ромбическое искажение решетки, увеличиваются параметр с и объем элементарной ячейки вплоть до перехода 123 из орторомбической фазы в тетрагональную (табл. 2). Фазовый переход свидетельствует о том, что восстанавливается, прежде всего, трехвалентная медь. В данном случае, в отличие от обработки при t = 200°C, процесс восстановления сопровождается потерями массы образцами, так как образующаяся вода выделяется в сухую атмосферу [22]. Помимо данных гравиметрии, о выделении в газовую фазу воды свидетельствуют также показания датчика влажности. Однако часть воды встраивается в структуру и расщепляет Cu–O-цепочки. Это приводит к появлению фаз псевдо-123.5 и псевдо-124 (рис. 1, кривые 3, 4).
Согласно данным рентгенофазового анализа, после обработки YBa2Cu3O6.96 при t = 300°C в парах бензола и толуола появляются дополнительные фазы (Y2BaCuO5 и CuO) (рис. 1а, кривые 3, 4). Причиной этого может быть восстановление не только трехвалентной, но и двухвалентной меди, что приводит к частичному разложению 123.
Взаимодействие дефицитного по кислороду соединения YBa2Cu3O6.3 с циклическими углеводородами при t = 200°C также приводит к поглощению воды (табл. 3). Это свидетельствует о том, что в YBa2Cu3O6.3 двухвалентная медь способна восстанавливаться, несмотря на то, что при обработке CuO в этих условиях она практически не восстанавливается (табл. 1). При этом параметр с и объем элементарной ячейки YBa2Cu3O6.3 увеличиваются (табл. 3), что связано со снижением в нем содержания кислорода. На рентгенограммах появляется только слабый рефлекс от фазы псевдо-123.5 (рис. 2б, кривая 2), свидетельствующий о поглощении воды и образовании дефектов упаковки.
Таблица 3.
Условия обработки, изменения массы и параметры решетки YBa2Cu3O6.3
| Обработка образцов | τ1, ч (200°С) | τ2, ч (300°С) | Δm, % | а | с | Vяч |
|---|---|---|---|---|---|---|
| исходный | – | – | – | 3.8619 | 11.7903 | 175.844 |
| в парах бензола | 25 | – | 0.33 | 3.8614 | 11.8069 | 176.05 |
| – | 25 | –0.02 | 3.8621 | 11.7966 | 175.96 | |
| в парах толуола | 35 | – | 0.07 | 3.8618 | 11.7978 | 175.95 |
| – | 40 | –0.06 | 3.8606 | 11.7944 | 175.79 | |
| в парах анилина | 15 | – | 0.33 | – | – | – |
| 40 | – | 0.84 | 3.8603 | 11.8001 | 175.84 | |
| – | 15 | –0.23 | 3.8634 | 11.8094 | 176.27 | |
| в парах карбамида | 15 | – | 0.34 | 3.8633 | 11.8060 | 176.20 |
Рис. 2.
Дифрактограммы образцов YBa2Cu3O6.3 после обработок в парах циклических соединений; обозначения см. рис. 1.
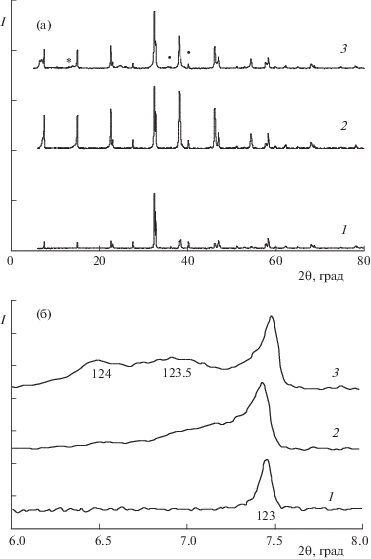
В случае обработки YBa2Cu3O6.3 при t = 300°C восстановительный процесс идет менее интенсивно по сравнению с YBa2Cu3O6.96. На это указывают небольшие потери массы образцов (табл. 3). По-видимому, это связано с отсутствием в YBa2Cu3O6.3 трехвалентной меди. Вхождение воды в структуру YBa2Cu3O6.3 приводит к расщеплению Cu–O-цепочек и к переходу 123 в псевдо-123.5 и псевдо-124. При этом также образуются Y2BaCuO5 и CuO (рис. 2, кривые 3).
Таким образом, обработка 123 в парах циклических углеводородов приводит к восстановлению не только трехвалентной, но и части двухвалентной меди. Можно предположить, что, в отличие от CuO, двухвалентная медь в YBa2Cu3Oy способна восстанавливаться в связи с ее иным структурным положением в данном соединении.
Анилин проявляет более сильные восстановительные свойства по сравнению с бензолом и толуолом, так как является амином (содержит группу NH2). Известно, что амины – восстановители, подобно аммиаку [19]. Кроме того, анилин способен медленно разлагаться даже при комнатной температуре. Более высокая температура, очевидно, способствует его разложению с выделением аммиака. Присутствие аммиака в атмосфере отжига приводит к более сильному восстановлению меди в 123 по сравнению с бензолом и толуолом (табл. 3). Вследствие этого при обработке в парах анилина имеет место параллельная реакция, сопровождающаяся выделением воды:
Для сравнения соединения YBa2Cu3O6.96 и YBa2Cu3O6.3 были обработаны при t = 200°C в парах карбамида (CO(NH2)2), который, разлагаясь при t = 174°C, выделяет в газовую фазу только аммиак, воду и углекислый газ [19]. Как и при обработке в парах анилина, оба соединения поглощают выделяющуюся воду, но в существенно большей степени (табл. 2, 3). Это свидетельствует о сильном влиянии аминной группы на процесс взаимодействия 123 с органическими соединениями.
Результаты хроматографического анализа показали, что при взаимодействии CuO и YBa2Cu3Oy с бензолом и толуолом при t = 300°C образуется небольшое количество ацетона, что свидетельствует о протекании реакции их окисления кислородом воздуха:
По-видимому, реакция с образованием ацетона является параллельной, а CuO и YBa2Cu3Oy , возможно, служат катализаторами. Основная же реакция – окисление циклических соединений с образованием воды и оксидов углерода:
В этой реакции CuO и YBa2Cu3Oy, по-видимому, также служат катализаторами. Это согласуется с данными работы [23], где детально описано окисление бензола в присутствии CuO. В пользу того, что CuO и 123 являются катализаторами данной реакции, также свидетельствуют показания датчика влажности, фиксирующие появление в атмосфере воды.
Результаты измерений магнитной восприимчивости показывают, что после обработки YBa2Cu3O6.96 при t = 200°C в парах бензола или анилина имеет место сильная деградация межзеренных границ. На это указывают расширение перехода в сверхпроводящее состояние и раздвоение максимума на зависимости χ'' = f(T), как и для указанных образцов после обработки в парах воды (рис. 3). Вероятная причина деградации границ – повышенная дефектность структуры в приграничных областях зерен в связи с расщеплением Cu–O-цепочек.
Рис. 3.
Температурные зависимости магнитной восприимчивости χ' (а) и χ'' (б) образцов YBa2Cu3O6.96; исходное состояние (1) и после обработки при t = 200°C в парах анилина (2), бензола (3), воды (4) и в атмосфере водорода (5).
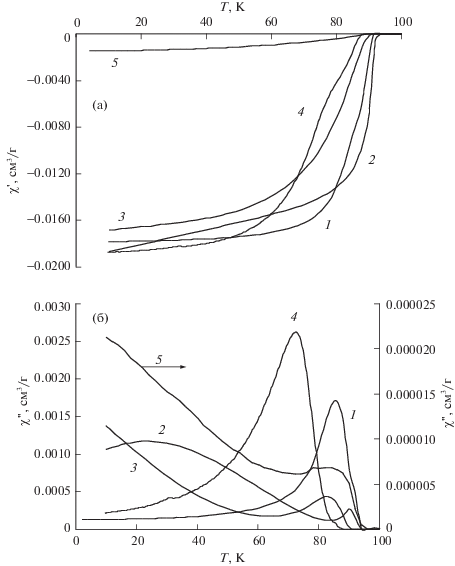
На рис. 3 также показаны температурные зависимости магнитной восприимчивости после обработки 123 в парах воды и в атмосфере водорода [5, 14] (кривые 4, 5). Сравнение приведенных зависимостей позволяет предположить, что основной процесс при обработке в парах циклических соединений – гидратирование. Из рис. 3 видно, что зависимости магнитной восприимчивости для случая гидрирования (кривая 5) значительно отличаются от остальных. По-видимому, в случае обработки в парах циклических углеводородов водород не входит в решетку 123, так как взаимодействие YBa2Cu3Oy с органическими соединениями и молекулярным водородом происходит по различным механизмам.
Отжиг в сухом воздухе при t = 200–400°C образцов YBa2Cu3Oy, предварительно обработанных при t = 300°С в парах циклических соединений, также указывает на то, что они поглощали воду. Об этом свидетельствуют показания индикатора влажности. Однако, согласно данным гравиметрии, вода при этих температурах выделяется в атмосферу только частично. Лишь после отжига при t = 900°C она полностью удалялась. После гидратирования 123 в парах воды последующая термообработка в сухом воздухе при t ≤ 400°C также приводила лишь к частичному выделению воды. Только при температуре 600°C вода полностью удалялась, хотя измененная структура сохранялась до температуры 900°C [24]. Эти результаты свидетельствуют о том, что поглощенная в ходе гидратирования вода весьма прочно связана в структуре 123. Структурные превращения 123, связанные с воздействием паров воды, могут быть устранены только при температурах, близких к температуре синтеза (∼930°C), что, по-видимому, обусловлено слабой подвижностью катионов при температурах ниже 900°C.
ЗАКЛЮЧЕНИЕ
Низкотемпературная обработка соединений YBa2Cu3Oy в парах циклических углеводородов – наиболее оптимальный способ их гидратирования по сравнению с обработкой в парах воды. В его основе лежат реакции окисления циклических соединений и восстановления меди с образованием воды и оксидов углерода. Основной реакцией взаимодействия циклических углеводородов с CuO и YBa2Cu3Oy при t = 200°C является окисление органических соединений кислородом воздуха. Соединения CuO и YBa2Cu3Oy в этих реакциях служат катализаторами. При t = 300°C значительный вклад в гидратирование 123 вносит вода, образующаяся при восстановлении меди. Кроме того, при обработке в парах анилина и карбамида происходит восстановление меди аммиаком, которое также сопровождается выделением воды.
Соединения YBa2Cu3Oy поглощают воду, образующуюся при взаимодействии с парами циклических соединений. При этом в структуре 123 появляются планарные дефекты упаковки (расщепленные Cu–O-цепочки), что приводит к образованию фаз псевдо-123.5 и псевдо-124. Поглощенная вода прочно связана в структуре 123 и способна полностью удаляться только при t > > 600°C. В процессе восстановления меди в YBa2Cu3Oy образуются оксидные фазы, которые могут быть точечными центрами пиннинга. Пары циклических углеводородов – слабые восстановители. Они не способны восстанавливать оксид меди при t = 200–300°C. Обработка YBa2Cu3Oy в парах циклических органических соединений может быть применена для улучшения полевых зависимостей критической плотности тока. По-видимому, бензол наиболее эффективен при образовании как планарных, так и точечных центров пиннинга.
Работа выполнена в рамках государственного задания МИНОБРНАУКИ России по темам “Давление” № АААА-А18-118020190104-3, “Спин” № АААА-А18-118020290104-2, при частичной финансовой поддержке Проекта УрО РАН (№ 18-10-2-24).
Рентгенографические и магнитометрические измерения выполнены на оборудовании центра коллективного пользования “Испытательный центр нанотехнологий и перспективных материалов” ИФМ УрО РАН. Хроматографическое исследование выполнено в центре коллективного пользования “САОС” ИОС УрО РАН.
Авторы выражают благодарность сотрудникам ЦКП А.В. Королеву, В.С. Гавико за проведение магнитометрических и рентгенографических измерений, а также М.Г. Первовой за проведение хроматографического анализа.
Список литературы
Maiorov B., Baily S.A., Zhou H. et al. // Nature Mater. 2009. V. 8. № 5. P. 398.
Selvamanickam V., Yao Y., Chen Y., Shi T. et al. // Supercond. Sci. Technol. 2012. V. 25. № 12. P. 125013.
Kupfer H.K., Zhukov A.A., Kresse R. et al. // Phys. Rev. B. 1995. V. 52. № 10. P. 7689.
Koblischka M.R., Murakami M. // Supercond. Sci. Technol. 2000. V. 13. № 6. P. 738.
Бобылев И.Б., Зюзева Н.А. // Физика металлов и металловедение. 2011. Т. 112. № 2. С. 134.
Кузнецова Е.И., Блинова Ю.В., Сударева С.В. и др. // Физика металлов и металловедение. 2003. Т. 95. № 1. С. 71.
Макаршин Л.Л., Андреев Д.В., Пармон В.Н. // Успехи химии. 2000. Т. 69. № 4. С. 307.
Günther W., Schollhorn R., Epple M. et al. // Philosophical Mag. A. 1999. V. 79. № 4. P. 449.
Günther W., Schollhorn R., Siegle H., Thomsen Ch. // Solid State Ionics. 1996. V. 84. № 1–2. P. 23.
Байков Ю.М. // Физика тв. тела. 2000. Т. 42. № 6. С. 995.
Foltyn S.R., Civale L., MacManus-Driscoll J.L. et al. // Nature Mater. 2007. V. 6. № 9. P. 631.
Bobylev I.B., Ponosov Yu.S., Zyuzeva N.A. // Mater. Chem. and Phys. 2015. V. 167. P. 1.
Бобылев И.Б., Зюзева Н.А. // Физика тв. тела. 2013. Т. 55. № 5. С. 855.
Бобылев И.Б., Герасимов Е.Г., Зюзева Н.А., Терентьев П.Б. // Физика металлов и металловедение. 2017. Т. 118. № 10. С. 1001.
Zhao R., Goringe M.J., Myhra S., Turner P.S. // Philosophical Mag. A. 1992. V. 66. № 4. P. 491.
Bobylev I.B., Gerasimov E.G., Zyuzeva N.A. // Cryogenics. 2015. V. 72-1. P. 36.
Белоусов Н.С., Макаршин Л.Л., Пармон В.Н. // Сверхпроводимость: физика, химия, техника. 1991. Т. 4. № 8. С. 1614.
Grigorian L.S., Kumar R., Malik S.K. et al. // Physica C. 1993. V. 205. № 3−4. P. 296.
Физер Л., Физер М. Органическая химия. Т. 2. М.: Химия, 1970. 800 с.
Murakami M. // Supercond. Sci. Technol. 1992. V. 5. № 4. P. 185.
Kraus W., Nolze G. // J. Appl. Cryst. 1996. V. 9. P. 301.
Бобылев И.Б., Герасимов Е.Г., Зюзева Н.А. // Физика металлов и металловедение. 2017. Т. 118. № 8. С. 779.
Бойков Е.В., Вишнецкая М.В., Емельянов А.Н. и др. // Хим. физика. 2007. Т. 26. № 8. С. 38.
Бобылев И.Б., Зюзева Н.А., Романов Е.П. // Физика металлов и металловедение. 2008. Т. 106. № 4. С. 388.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии


