Журнал физической химии, 2019, T. 93, № 12, стр. 1830-1837
Влияние алкильных и алкоксильных заместителей на комплексообразующую способность фосфорсодержащих катионитов по отношению к катионам индия и галлия
Б. К. Радионов a, Ю. А. Лейкин b, А. Л. Смирнов a, И. А. Свирский a, *
a Уральский Федеральный университет им. Б.Н. Ельцина
Екатеринбург, Россия
b Российский химико-технологический университет им. Д.И. Менделеева
Москва, Россия
* E-mail: sviskill.171993@gmail.com
Поступила в редакцию 14.01.2019
После доработки 22.05.2019
Принята к публикации 09.06.2019
Аннотация
С использованием катионитов на стиролдивинилбензольной матрице, обеспечивающей беспрепятственный перенос сорбируемых ионов, изучено влияние природы заместителей в ряду свободных и этерифицированных фосфоново- и фосфиновокислотных групп на особенности сорбционного поведения катионов индия (III) и галлия (III) в сернокислых растворах. В результате комплексного исследования установлена взаимосвязь сорбционных показателей катионитов с изменяющейся функциональной силой фосфорильного и кислотного центров ионогенных систем. Их комплексообразующая способность по отношению к целевым ионам зависит от электронодонорных и гидратационных свойств, введенных у атома фосфора нейтральных заместителей алкоксильного и алкильного характера.
Нейтральные и кислые органорастворимые продукты этерификации фосфиновых и фосфоновых кислот (ТБФ, Д2ЭГФК, ФОР) известны как селективные экстрагенты. Соединения этого класса позволяют регулировать извлекательную способность и избирательность действия реагентов путем целенаправленного введения электронодонорных заместителей, повышающих избыточную плотность на фосфорильном кислороде и ослабляющих силу кислотного центра (рKα в интервале 3.5–6.6), а также регулировать заполнение вблизи фосфорильного и кислотного фрагментов за счет присутствия алкильных и алкоксильных заместителей различного объема и разветвленности.
Для трехмерных полимерных объектов установление взаимосвязи сорбционных свойств с химическим строением функциональных групп осложняется избирательной проницаемостью матрицы к сорбат-ионам различного размера, создающих “ситовой эффект” и матричную селективность, что сказывается на равновесных, кинетических и динамических способностях ионитов.
В качестве ионитов, способных селективно и с высокими сорбционными показателями поглощать катионы индия и галлия из растворов кислородсодержащих минеральных кислот, предложены фосфоновокислотные катиониты как пористой [1–7], так и гелевой структур [8–10]. На сорбционное поведение рассеянных элементов наряду со специфическим действием функциональных групп имеет влияние эффект сетчатой матрицы. Матричная селективность полимерного геля катионита олефинового ряда (типа КФ-7) на основе дихлорэтилового эфира винилфосфоновой кислоты (винифос), винилацетата и дивинилбензола (ДВБ) исключается путем использования при синтезе эквимолярного соотношения винифоса и винилацетата (1 : 1) с 10% сшивки ДВБ за счет присутствия достаточного количества вторичных спиртовых групп [11]. Сорбционная способность катионитов на полистирольной основе (типа КФП, КФ, СФ-5) по отношению к трехзарядным катионам металлов определяется их поровыми свойствами, а они, в свою очередь, зависят от содержания сшивающего агента и порообразующего неполимеризующегося растворителя, которые применяются при структурообразовании сополимера стирола с ДВБ и, как следствие, максимальной степенью реализации сорбционной емкости обладают комплекситы, содержащие 12–20% ДВБ и с пористостью эквивалентной 0.6–1.0 массовой доли изооктана. Степень развития пористой структуры и изменение морфологии бензилфосфоновых катионитов, варьированием содержания компонентов в реакционной смеси при их синтезе, подтверждается данными электронной микроскопии [12].
Что касается собственно реакций взаимодействия катионов индия (III) и галлия (III) с фосфоновокислотными группами этих катионитов, то принципиального отличия в типе координации рассеянных элементов не наблюдается. Как показывают результаты изучения сорбатных комплексов Ме3+ с катионитами КФП и КФ-7 методами ИК-спектроскопии [9], в том числе с привлечением теоретического анализа спектров [13, 14], после их интерпретации [15], а также рентгенофотоэлектронной спектроскопии [14, 16] и ЯМР [14], для данного вида лигандного центра, по всей вероятности, характерно хелатообразование с участием фосфорильного кислорода и одной из кислотных групп после вытеснения протона, сопровождающееся выравниванием электронной плотности на координированных атомах кислорода, согласно модели:
Такая ионно-координационная структура преимущественно реализуется в случае сорбции индия.
Роль непосредственно не участвующего в процессе комплексообразования второго кислотного остатка можно оценить путем замены его на иную реакционную группу. С этой целью и из стремления оказать электронное влияние на активный фосфорильный центр привлечены к исследованию макропористые полистирольные полимеры с развитой внутренней поверхностью и с регулируемой силой ионогенных и координирующих групп полимергомологических структур в ряду фосфорсодержащих катионитов (20% ДВБ; 0.8 масс. долей изооктана). В этом случае универсальная высокопроницаемая матрица с исключенным ситовым эффектом и матричной селективностью приемлема для установления взаимосвязи сорбционных свойств и химического строения функциональных фрагментов. При этом установлено [17], что пористое пространство ионитов, формирующееся в основном на стадии синтеза полимерной матрицы, сохраняется в процессе полимераналогичных превращений. Более того, показано, что введение объемных функциональных групп приводит к некоторому увеличению объема и поверхности пор, а порометрические характеристики таких объектов определены и в набухшем состоянии. И, следовательно, опасения в возможной ограниченности проницаемости катионита и доступности его комплексообразующих фрагментов при сорбции рассеянных элементов практически полностью исключаются.
Кислотная сила ионогенных групп для трехмерного катионита определяется суммой физико-химических факторов. Физические факторы – степень сшивки и гидрофильность полимерного каркаса ионита – обусловливают количество свободной и гидратационной воды. Влагосодержание, формально говоря, это степень разбавления концентрированного слабокислотного электролита, а поскольку разбавление влияет на степень диссоциации, то для исследования были использованы иониты с весьма близкими гидратационными свойствами. Экспериментально установлено, что кислотные свойства как гелевых, так и пористых фосфоновокислотных катионитов полистирольного типа ослабевают по мере увеличения содержания сшивающего агента [18, 19].
К химическим факторам относятся электрические и стерические внутримолекулярные эффекты заместителей, определяющих смещение электронной плотности в системах двухосновных полистиролфосфоновых и одноосновных фосфиновых кислот:
Влияние электронных эффектов при замене полимерного заместителя Res одновременно приводит к изменению структуры и гидрофильности матрицы, что делает эти системы мало приемлемыми для изолированного изучения химических факторов. Бифункциональность системы позволяет заменить одну кислотную группу на эфирную и тем самым исключить снижение аддитивных показателей, не привнося существенных изменений в структуру матрицы. Кроме того, [20, 21], это дает возможность в небольших пределах варьировать кислотную силу оставшегося гидроксила, хотя изменение электронодонорности в ряду эфирных заместителей (ОR) сравнительно невелико. В более широких пределах (от 3.5 до 5.8) удается изменять рKα при переходе к алкильным заместителям в фосфиновых кислотах –P(R)(О)(OH). Еще одна аномальная возможность для систем катионитов с группами фосфоновых и фосфиновых кислот заключается в образовании с ионами поливалентных металлов прочных четырехчленных гетеронуклеарных циклов с выровненной электронной плотностью. Прочность подобных структур обусловливается свойствами комплексуемого металла и оптимальностью валентных углов комплекса. Вероятность их реализации возрастает для более электронодонорных заместителей с увеличением рKα и выравниванием заряда на обеих гидроксильных группах. Образование двух четырехчленных циклов позволяет достигать наиболее высокого сродства к многозарядным катионам. Корреляция кислотной силы фосфорильной системы в зависимости от электрических эффектов заместителей ранее рассмотрена Кабачник М.И. [22] и фактически изучена [23], при этом возможна и количественная оценка эффектов заместителя в катионитах [24], что сделано и в настоящем сообщении на примере сорбции ионов рассеянных элементов.
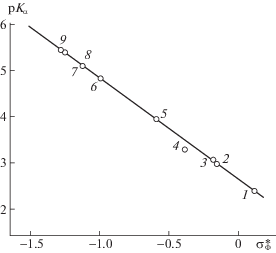
Следует добавить, что для серии фосфорсодержащих катионитов общей формулы Res –Р(R)(О)ОН удалось рассчитать и связать кислотную силу со способностью к комплексообразованию с использованием значений электронных эффектов заместителей (R) различных шкал по Кабачнику или Тафту и Гаммету: рKα = 2.687 + + 2.291Σσф, где рKо = 2.687 – кислотный показатель базового заместителя серии R = Н; ρ = 2.291 – трансмиссионный коэффициент передачи электронных эффектов, зависящий от поляризуемости фосфорильной системы; σф – электронный эффект заместителя. В итоге на рис. 1 представлена линейная корреляционная зависимость с разными величинами электронного влияния заместителей при атоме фосфора по Кабачнику с коэффициентом корреляции 0.997 [25 гл. 2.5.3].
Рис. 1.
Корреляция значений кислотных свойств pKα с величинами электронных эффектов заместителей R ($\sigma _{{\text{ф}}}^{*}$) катионитов формулы Ar-P(O)(OH)R: 1 – Ar(NO2)-P(O)(OH)2 (СФН-5), 2 – ОСН3 (СМФ), 3 – ОС2Н5 (СЭФ), 4 – ОН (СФ-5), 5 – СН2ОН (СФМ-1), 6 – СН3 (СФМ), 7 – С2Н5 (СФЭ), 8 – С3Н7 (СФП), 9 – С4Н9 (СФБ).
Электронное влияние строения функциональных групп на сорбционную активность изучалось путем варьирования кислотной и координирующей способности этих центров. В качестве объектов выбраны катионы индия (III), галлия (III) и меди (II), позволяющие проверить изменение эффекта химической структуры фосфинового сегмента на индивидуальность сорбции в сравнении с типичной примесью Cu2+, обладающей признаками, которые свойственны большой группе двухвалентных переходных металлов, обычно сопутствующих рассеянным элементам в технологических процессах их получения.
ЭКСПЕРИМЕНТАЛЬАЯ ЧАСТЬ И РЕАГЕНТЫ
Все катиониты монофункциональные и получены полимераналогичными превращениями на основе одной и той же макропористой матрице полистирольного типа с 20% ДВБ, где в качестве порообразователя использован изооктан в количестве 80% от суммы мономеров [25–27 гл. 2.4]:
КФ-11 – фосфоновокислотный катионит – это результат окисления и омыления фосфорилированного макропористого сополимера стирола с ДВБ;
СФ-5 – фосфоновокислотный катионит, структурный и химический аналог катионита КФ-11 (отличаются технологическими условиями производителя);
СФ-3 – катионит с группами фосфонистой кислоты, получаемый гидролизом (без окисления) поливинилдихлорфенилфосфинового сополимера, т.е. полупродукт синтеза катионита СФ-5. При проведении кислотного гидролиза он преобразуется в катионит СФ-5 с группами двухосновной кислоты;
алкиленмонозамещенные иониты СФМ, СФЭ и СФБ – полимергомологи с алкильными заместителями –СН3, –С2Н5 и –С4Н9 у фосфинового центра, синтезированы посредством обработки полистирольных фосфиндихлорангидридов металлоорганическими соединениями (реактив Гриньяра) с дальнейшим водным гидролизом и окислением азотной кислотой;
катиониты СМФ и СЭФ – представляют собой моноэфиры фосфиновой кислоты с алкоксильными заместителями –ОСН3, –ОС2Н5, появление этих групп происходит при этерификации диалкилсульфатами (R2SO4) полупродуктов синтеза катионита СФ-5;
СФМ-1 – катионит с группами α-оксиметилфосфиновой кислоты, является продуктом оксиметилирования катионита СФ-3, последующая модификация последнего осуществляется обработкой формальдегидом;
СГФ – катионит с группами 2,4-диоксибутилфосфиновой кислотой, где глицеридный остаток при атоме фосфора вводят путем реакции алкилирования катионита СФ-3 эпихлоргидрином и кислотного гидролиза;
СФН-5 – катионит, содержащий фосфоновокислотные и нитрогруппы (–NО2), видоизмененный нитрованием солями щелочных металлов в минеральных кислотах катионит СФ-5. При этом образуется поливинилнитрофенилфосфоновый катионит, содержащий 5 групп фосфоновой кислоты и 9 нитрогрупп на каждые 10 бензольных ядер;
СФА – амфолит с группами аминофениленфосфоновой кислоты, который их приобретает в результате восстановления нитрогрупп катионита СФН-5;
СТФ – катионит с группами тиофосфоновой кислоты производится подобно фосфоновокислотным катионитам типа КФ-11 и СФ-5 на базе поливинилдихлорфенилфосфинового сополимера (Ar–PCl2), образующегося при фосфорилировании бензольных колец, а завершается окислением реакционной смеси элементарной серой с последующим гидролизом.
Стандартную характеристику полной обменной емкости ионитов (ПОЕ, мг-экв/г) измеряли типовым методом путем алкалиметрического титрования протонированной формы катионитов раствором 0.1 М NаОН [29 С. 145–152].
Кажущиеся константы диссоциации pKα, определены по обычной для катионитов методике на фоне 1 М NaCl [30], и расчет параметров уравнения Грегора проводился по специально составленной программе линейно кусочной аппроксимации с уточнением точки перехода ступеней [20].
Количественные значения эффектов заместителей фосфиновокислотных катионитов (константы Кабачника $\sigma _{{\text{ф}}}^{*}$) заимствованы из [22, 28 с. 217], которые выведены из констант ионизации фосфорорганических кислот при помощи уравнения Гаммета [31].
Сорбируемость из индивидуальных растворов сульфатов индия, галлия и переходных металлов с концентрацией 0.026 N при различной кислотности изучалась фосфорсодержащими катионитами в Н-форме. Статическую обменную емкость катионитов (С, мг-экв/г) рассчитывали по изменению концентрации целевых ионов в растворе после установления состояния равновесия в системе “катионит – раствор” при соотношении 1 : 200 (г : см3). Массовый коэффициент распределения каждого из ионов металлов (Kр, см3/г) и коэффициент избирательности ионных пар (Kи) оценивали по общепринятым отношениям [32 с. 37–38]. Количественный анализ элементов производили атомно-абсорбционным методом.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Исследования статического сорбционного равновесия, проведенные в ряду катионитов общей формулы:
для алкильных и алкоксильных заместителей R = = H, CH3, C2H5, C4H9, OCH3, OC2H5, где Res-фенильный радикал с постоянным электродонорным эффектом, свидетельствует, что для ионов металлов наблюдается разный характер зависимости приведенной величины сорбируемости от кислотных свойств фосфиновокислотных групп катионов (рис. 2). Ионам индия (III) свойственно практическое безразличие величины его сорбируемости от рKα ионизации катионитов, ионы галлия (III) проявляют отчетливо выраженную по правилу линейности тенденцию к снижению сорбируемости, подобную, но более стремительно нисходящую зависимость обнаруживают ионы меди (II). При анализе полученных закономерностей следует учитывать влияние нескольких факторов, связанных с заменой радикала R. С одной стороны, чем меньше электронодонорные свойства заместителя, тем ниже рKα и больше сила кислот в ряду заместителей при фосфорильной группировке: C4H9 > C2H5 > CH3 > OC2H5 > OCH3 > > H, а, с другой стороны, в этой же последовательности снижается избыточная электронная плотность фосфорильного кислорода ≡Р=${\ddot {O}}$ и, как следствие, способность к комплексообразованию. При этом возможность фиксации ионов по кислотному центру Р–О– возрастает, а по координационному ≡Р=${\ddot {O}}$, наоборот, снижается. Причем подобные изменения реакционной активности хорошо корреспондируют с величинами рKα и полосами ИК-поглощения свободной фосфорильной группы ≡Р=${\ddot {O}}$. Эти противоположно действующие факторы, взаимно компенсируясь, обуславливают, малую зависимость сорбируемости катионов индия (III) от влияния алкильных и алкоксильных заместителей. Для ионов галлия (III) ослабление кислотных свойств фосфиновокислотных групп является превалирующим фактором, влияющим на величину сорбции, над увеличением электронной плотности на фосфорильном кислороде. Ионы меди (II) в процессе взаимодействия с фосфиновой (или фосфоновой) группой, вероятно, в большей мере индифферентны к фосфорильному кислороду, поэтому снижение силы кислотного центра затрудняет течение обменных реакций, происходящих по диссоциированным гидроксильным группам, что приводит к снижению степени заполнения ионита. Таким образом, величина и селективность сорбции определяется степенью диссоциации кислотных ионогенных групп и реакционной способностью свободной пары электронов фосфорила.Рис. 2.
Зависимости удельной сорбируемости ионов индия (III), галлия (III) и меди (II) от кислотных свойств (pKα) и констант заместителей ($\sigma _{{\text{ф}}}^{*}$) катионитов с группами замещенных фосфиновых кислот Ar–P(O)(OH)R (R = Н, ОСН3, ОС2Н5, СН3, С2Н5, С4Н9): 1– In (0,1 N H2SO4), 2 – In (0.5 N H2SO4), 3 – Ga (0.1 N H2SO4), 4 – Ga (0.5 N H2SO4), 5 – Cu (10–3 N H2SO4).

Необходимо подчеркнуть, что в рассматриваемые зависимости не вписываются параметры полистиролфосфонового катионита СФ-5. Возможно, это обстоятельство объясняется его кислотной бифункциональностью и несколько большими гидратационными свойствами по сравнению с остальными катионитами полистиролфосфинового ряда. Значительная гидратируемость фосфоновокислотных сорбентов и большее разбавление геля происходит за счет гидратации двух ОН-групп и фосфорильной связи ≡Р=${\ddot {O}}$, которая также акватируется в водных растворах с образованием водородных мостиков типа:
≡Р=О…Н+, существование последних подтверждается данными ИК-спектров фосфоновых кислот при их взаимодействии с молекулами воды [33, 34]. Вероятно, к активному гидратационному влиянию сводится участие второй кислотной группы в сорбционной реакции. При этом известно, что две ступени диссоциации фосфоновых кислот –P(О)(OH)2 показывают противоположные селективности в ряду Хофмайстера, соответственно прямой и обратный ряд, что в конечном результате резко снижает аддитивные показатели.
К изложенной интерпретации воздействия заместителей имеет смысл добавить то, что алкильным и алкоксильным радикалам свойственно некоторое негативное действие. Оно проявляется в снижении гидратируемости функциональных групп вследствие увеличения гидрофобного алифатического сегмента СnН2n + 1, а также возможных пространственных затруднений при транспортировке сорбата к реакционным центрам, особенно при больших значениях “n”. Последнее обстоятельство, вероятно, сказывается на величинах фактической сорбционной емкости таких катионитов по ионам индия и галлия (табл. 1).
Таблица 1.
Сорбируемость ионов индия и галлия фосфиновокислотными катионитами и на основе макропористого сополимера стирола и дивилбензола
| Марка ионита | Функциональные группы | Сорбируемость, мг-экв/г | |||
|---|---|---|---|---|---|
| 0.1 н. H2SO4 | 0.5 н. H2SO4 | ||||
| In(III) | Ga(III) | In(III) | Ga(III) | ||
| СФ-3 | Аr-Р(О)(ОН)Н | 1.72 | 1.25 | 1.16 | 0.94 |
| СМФ | Аr-Р(О)(ОН)ОСН3 | 1.89 | 1.37 | 1.31 | 1.11 |
| СЭФ | Аr-Р(О)(ОН)ОС2Н5 | 1.76 | 1.26 | 1.30 | 1.02 |
| СФМ | Аr-Р(О)(ОН)СН3 | 1.82 | 0.99 | 1.41 | 0.69 |
| СФЭ | Аr-Р(О)(ОН)С2Н5 | 1.76 | 0.96 | 1.42 | 0.62 |
| СФБ | Аr-Р(О)(ОН)С4Н9 | 1.49 | 0.73 | 1.29 | 0.45 |
| СФМ-1 | Аr-Р(О)(ОН)СН2ОН | 1.94 | 1.41 | 1.37 | 0.97 |
| СФГ | Аr-Р(О)(ОН)СН2СН(ОН)СН2ОН | 2.18 | 1.58 | 1.51 | 1.01 |
| СФГ-2 | Аr-Р(О)[ОСН2СН(ОН)СН2ОН][СН2СН(ОН)СН2ОН] | 2.89 | 2.17 | 2.22 | 0.90 |
| СТФ | Аr-Р(S)(ОН)2 | 1.94 | 1.81 | 1.21 | 0.72 |
| СФ-5 | Аr-Р(О)(ОН)2 | 2.48 | 2.47 | 1.73 | 1.33 |
| КФ-11 | Аr-Р(О)(ОН)2 | 1.58 | 1.34 | 1.19 | 0.72 |
С целью устранения упомянутого отрицательного действия более рационально использовать в качестве алкильных заместителей метилольные радикалы с гидроксильными группами –СН2ОН, которые не только увеличивают донорные свойства фосфорильного кислорода, но и повышают степень гидрофильности сетчатого полимера. Известно [35], что гидратация благоприятствует уменьшению степени экранирования радикалом R группы Р = О при наличии в заместителе дополнительных центров, взаимодействующих с молекулами воды. Величины интегральной энергии гидратации, рассчитанные из изопиест, составляют соответственно для таких заместителей как C4H9(СФБ), OCH3(СМФ), C2H5(СФЭ), OH(СФ-5) и CH2OH(СФМ-1): 0.683, 1.405, 1.585, 1.763 и 1.840 ккал/экв [36]. Этим синергетическим эффектом могут быть объяснены более высокие сорбционные показатели оксиалкилфосфиновых ионитов.
Увеличение значений удельной (отнесенной к ПОЕ) сорбируемости ионов рассеянных металлов в ряду фосфоновых и фосфиновых катионитов КФ-11, (СФ-5) < СФМ-1 < СФГ находится в соответствии с усилением электоронодонорности введенного заместителя в фосфорсодержащий центр: ОН < CH2OH < CH2CH(OH)CH2OH. Катиониты с группами α-оксиметиленфосфиновой и 2,4-диоксибутилфосфиновой кислот также обладают высокой избирательностью сорбции ионов индия и галлия (табл. 2). Очень хорошие сорбционные свойства имеет и нейтральный сорбент, содержащий активный фрагмент 1-2,4-диоксибутил-2,4-диоксибутилфосфонат (СФГ-2). Сорбция в данном случае, по-видимому, не носит ионообменный характер, а протекает по фосфорильному кислороду с образованием сольватов. Совершенно противоположное поведение проявляют аналогичные неионогенные иониты на основе сополимеров диэфиров стиролфосфоновой кислоты с реакционными центрами диметил- и диэтилстирилфосфоната. Для водных растворов неравноценность замены глицидных остатков при фосфоре на алкоксил и, особенно, на алкил приводит к тому, что уменьшение гидратации реакционной группы перекрывает увеличение электронной плотности фосфонатного центра, который в отсутствии ОН-групп в заместителе не обеспечивает достаточную гидратируемость пространственному полимеру, а в результате затрудняется и полностью прекращается доставка сорбат-ионов к реакционноспособной ≡Р=${\ddot {O}}$ группе [37]. А как указано выше, степень проницаемости катионитов и доступности их хелатогенных групп является ключевым моментом при сорбционной координации таких высокогидратированных аквакатионов, какими являются и галлий [38 гл. 2], и индий [39 гл. 2].
Таблица 2
. Избирательность сорбции рассеянных элементов фосфиновокислотными 1,1, катионитами и на основе макропористого сополимера стирола и дивинилбензола
| Марка ионита | Сорбируемость металлов, мг-экв/г | Коэффициенты распределения (Kр) | Коэффициенты избирательности (Kи) | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| In(III) | Ga(III) | Cu(II) | Zn(II) | Cd(II) | In(III) | Ga(III) | Cu(II) | Zn(II) | Cd(II) | In/Cu | In/Zn | In/Cd | Ga/Cu | Ga/Zn | Ga/Cd | |
| СФМ-1 | 1.94 | 1.41 | 0.019 | 0.021 | 0.020 | 72.7 | 51.7 | 1.06 | 1.05 | 1.33 | 68.6 | 69.2 | 54.7 | 48.8 | 59.2 | 38.9 |
| СФГ | 2.18 | 1.58 | 0.079 | 0.080 | 0.199 | 107.9 | 80.9 | 4.2 | 4.7 | 14.1 | 25.7 | 23.0 | 7.6 | 19.3 | 17.2 | 5.7 |
Проведенная таким образом модификация фосфиновокислотных катионитов не сказывается на селективности их действия, и целевые рассеянные металлы обладают гораздо бóльшим сорбционно-избирательным преимуществом перед катионами металлов первого переходного ряда, поскольку последние не способны к комплексообразованию с фосфорильным кислородом.
Принимая во внимание умеренную халькофильность рассеянных элементов, представляет интерес проследить фактор замены фосфоновой группы на тиофосфоновую. Изменение природы координирующего атома фосфорильного центра изучено на катионите СТФ с группами полистиролтиофосфоновой кислоты Ar–P(S)(OH)2, избыточная электронная плотность на фосфорильной сере которого вследствие меньшей электроотрицательности атома серы по сравнению с кислородом уступает таковой на фосфорильном кислороде в фосфоновокислотном катионите СФ-5 с группами фенилфосфоновой кислоты при сравнительно равной кислотной силе их ионогенных групп [25]. Для устранения возможного влияния электронодонорности полимерного арил-заместителя и различия в гидратационно-диффузионных характеристиках сетчатого полимера использовали свойство катионита СТФ легко гидролизоваться в щелочных средах (5–10% раствор NaOH) через таутомерную тиольную форму с образованием катионита подобного СФ-5. Сорбируемость ионов индия и галлия фосфонтионовым катионитом оказывается ниже, чем фосфоновокислотным, полученным гидролитической обработкой первого, что, по всей вероятности, является следствием уменьшения реакционной способности свободной пары электронов фосфорильной серы ≡Р=Ṡ и осложнения образования четырехчленных хелатов с подобными группами, а также определенной слабости химического сродства ионов индия и галлия к атомом серы.
Как можно предполагать из данных по модельным соединениям, влияние матрицы на силу кислот в случае фосфорсодержащих кислот Ar–Р≡ несколько меньше, чем для арсоновых и карбоновых кислот, по причине того, что через атом фосфора электронный эффект передается слабее [40]. Несмотря на это, имеет место определенное воздействие электронодонорности полимерного носителя при фосфоновокислотной группе в ряду нитрополистирольная, аминополистирольная и полистирольная матрицы. Введение электроноакцепторных заместителей –NO2 и –NH2 в бензольное ядро, пусть и в незначительной мере, способствует повышению сорбции ионов индия и галлия. Рост величины сорбируемости металлов на ядернозамещенных ионитах с группами нитро- и аминофениленфосфоновой кислоты (СФН-5, СФА-5), по-видимому, обязан увеличению степени диссоциации фосфорнокислых групп и повышению гидратируемости ионита за счет присутствия дополнительных гидрофильных –NO2- и –NH2-групп. Последнее обстоятельство совместно с распутыванием полимерной сетки благодаря ее большему заряду при сочетании ароматического кольца с полярной группой способствует добавочной проницаемости пространственно сшитого полимера.
Меньшая зависимость сорбируемости галлия и, особенно, индия фосфиновокислотными катионитами с алкоксильными заместителями от кислотности внешнего раствора косвенным образом подтверждает ионно-координационный характер их взаимодействия с привитыми группировками (рис. 3).
Рис. 3.
Зависимости сорбируемости ионов индия и галлия катионитами с фосфиновыми СФГ-2 (1, 2), СФГ (3,4), СФМ-1 (5) и фосфоновыми группами КФ-11 (6, 7) от кислотности раствора: 1, 3, 5 и 7 – индий (III); 2, 4 и 6 – галлий (III).

Таким образом, влияние строения фосфорилсодержащих группировок на их сорбционные свойства по отношению к рассеянным элементам определяется тремя факторами: координационной способностью, нуклеофильностью и пространственной доступностью фосфорильных групп, а также наличием дополнительных центров гидратации в заместителях при атоме фосфора.
Классом нейтральных соединений не заканчивается возможность влиять на комплексообразование замещенных фосфиновых групп ионитов, и логично, что особый интерес вызывают заместители основного и кислого характера.
Список литературы
Кудрявский Ю.П., Казанцев Е.И. // Изв. вузов. Цв. металлургия. 1974. № 6. С. 76.
Казанцев Е.И., Леканов Л.П., Пилипчук И.А. и др. // Цветные металлы.1974. № 2. С. 27.
Ласкорин Б.Н., Павлов Ю.И., Алексанянц И.В., Малахов Г.В. // Изв.вузов. Цв. металлургия. 1972. № 7. С. 29.
Ласкорин Б.Н., Штейнгард Г.М., Павлов Ю.И. // Там же. 1972. № 9. С. 30.
Павлов Ю.И., Комарова Л.А., Зданович И.Д., Пожигалова Г.В. // Зав. лаб. 1973. Т. 39. № 11. С. 1317.
Алейникова М.А., Суворовская Н.А., Лейкин Ю.А., Черкасова Т.А. // Проблемы обогащения твердых горючих ископаемых. Тр. Ин-та обогащения твердого топлива. 1971. Т. 2. Вып. 1. С. 93.
Marhol M., Beranová H., Cheng K.L. // J. Radioanalyt. Chem. 1974. V. 21. № 1. P. 177.
Казанцев Е.И., Кудрявский Ю.П., Леканов Л.П. // Изв. вузов. Цв. металлургия.1974. № 5. С. 94.
Фирсова Л.А., Чувелева Э.А., Назаров П.П. и др. // Журн. физ. химии. 1977. Т. 51. № 7. С. 1742.
Морозова Е.Г., Казанцев Е.И., Никашина В.А. // Там же. 1976. Т. 50. № 2. С. 501.
Радионов Б.К. // Журн. прикл. химии. 1990. Т. 63. № 4. С. 868.
Радионов Б.К., Рубштейн А.П. // Там же. 1989. Т. 62. № 7. С. 1546–1151.
Носкова М.П., Радионов Б.К., Васянина Н.С. и др. // Журн. физ. химии. 1983. Т. 57. № 3. С. 707.
Молочников Л.С., Радионов Б.К., Носкова М.П. и др. // Там же. 1990. Т. 64. № 4. С. 987.
Носкова М.П., Радионов Б.К., Казанцев Е.И., Слабкая Л.Д. // Там же. 1980. Т. 54. № 10. С. 2504.
Радионов Б.К., Молочников Л.С. // Там же. 1985. Т. 59. № 4. С. 992.
Лейкин Ю.А., Гладков С.Ю., Камнев Ю.В., Тевлина А.Б. // Журн. прикл. химии. 1980. Т. 53. № 8. С. 1755.
Коршунова С.П., Шарапова Н.К., Чмутов К.В. // Журн. физ. химии. 1971. Т. 45. № 6. С. 1543.
Копылова В.Д., Салдадзе К.М., Меквабишвили Т.В. // Там же. 1972. Т. 46. № 4. С. 990.
Лейкин Ю.А., Черкасова Т.А. // Сорбционные и хроматографические процессы. 2004. Т. 4. Вып. 2. С. 625.
Лейкин Ю.А. // Там же. 2010. Т. 10. Вып. 4. С. 622–632.
Кабачник М.И. // Химия и применение фосфорорганических соединений. Труды второй конференции. М.: Изд-во АН СССР. 1962. С. 24.
Разумов А.И., Сим До-Хер. О некоторых закономерностях в ряду фосфорсодержащих кислот. 1956. Т. 26. № 8. С. 2233.
Лейкин Ю.А., Даванков А.Б., Коршак В.В., Черкасова Т.А. // Изв. АН СССР. Сер. хим. 1971. № 2. С. 273.
Лейкин Ю.А. Физико-химические основы синтеза полимерных сорбентов. М.: БИНОМ. Лаборатория знаний. 2011. 413 с.
Лейкин Ю.А., Ратайчак В. // Химия и технология высокомолекулярных соединений. 1971. Т. 3. С. 86.
Селективные иониты. Каталог / Под ред. Пашкова А.Б. НИИТЭХИМ. НПО “Пластмассы”. г. Черкассы. 191. С. 23.
Маловик В.В., Ильинский А.А., Лейкин Ю.А. и др. // Хим. технология. 1976. № 4. С. 21.
Полянский Н.Г., Горбунов Г.В., Полянская Н.Л. Методы исследования ионитов. М.: Химия, 1976. 208 с.
Лейкин Ю.А., Мейчик Н.Р., Соловьев В.К. // Журн. физ. химии. 1978. Т. 52. № 6. С. 1420.
Кабачник М.И. // Докл. АН СССР. 1956. Т. 110. № 3. С. 393.
Лебедев К.Б., Казанцев Е.И., Розманов В.М. и др. Иониты в цветной металлургии. М.: Металлургия, 1975. 352 с.
Карякин А.В., Мурадова Г.А. // Журн. физ. химии. 1971. Т. 45. № 5. С. 1054.
Карякин А.В., Кривенцова Г.А. // Докл. АН СССР. 1973. Т. 208. № 1. С. 107.
Осипенко Н.Г., Петров Э.С., Цветков Е.Н. и др. // Журн. общ. химии. 1976. Т. 46. № 12. С. 2647.
Лейкин Ю.А., Черкасова Т.А., Филиппов Е.А., Ильинский А.А. // Тр. МХТИ. “Современные проблемы экстракции и ионообменной адсорбции”. 1975. Вып. 89. С. 118.
Холкина И.Д., Лейкин Ю.А., Грибанова И.Н. и др. // Журн. физ. химии. 1970. Т. 44. № 5. С. 1256.
Радионов Б.К., Мальцев Г.И. Галлий в водных растворах. Химия редких и рассеянных элементов / Germany, Saarbrücker: LAP LAMBERT Academic Publishig. 2014. С. 313.
Радионов Б.К., Мальцев Г.И. Индий в водных растворах. Химия редких и рассеянных элементов / Germany, Saarbrücker: LAP LAMBERT Academic Publishig. 2014. С. 352.
Хадсон Р. Структура и механизм реакций фосфорорганических соединений. М.: Мир, 1967. С. 105.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии