Журнал физической химии, 2019, T. 93, № 2, стр. 176-181
Термодинамика и кинетика реакции пиридоксаль-5-фосфата с гидразидами 2-метил-3-фуранкарбоновой, тиофен-3-карбоновой кислот в водном растворе
Г. А. Гамов a, *, М. Н. Завалишин a, Д. Н. Кабиров a, Т. Р. Усачева a, В. А. Шарнин a
a Ивановский государственный химико-технологический университет
Иваново, Россия
* E-mail: oxt705@isuct.ru
Поступила в редакцию 29.03.2018
Аннотация
Спектрофотометрическим методом определены константы устойчивости гидразонов, образованных пиридоксаль-5-фосфатом и 2-метил-3-фуранкарбогидразидом, тиофен-3-карбогидразидом в водном растворе при рН среды 1.9, 6.6, 7.0, 7.4. Исследована кинетика процессов образования и гидролиза оснований Шиффа, из электронных спектров поглощения вычислены константы прямой и обратной реакции. По их отношению рассчитаны константы устойчивости оснований Шиффа. Калориметрическим методом определены термодинамические параметры реакции образования (lg K, ΔH, TΔS) обоих гидразонов при рН 6.6. Обсуждаются причины различий между константами равновесия, рассчитанными из данных спектрофотометрического и кинетического эксперимента, анализируется надежность полученных результатов.
Гидразоны различного состава и строения привлекают внимание исследователей, благодаря широким возможностям их использования в аналитической химии в качестве сенсоров анионов и ионов металлов [1, 2], антибактериальных и противогрибковых агентов [2, 3], переключателей молекулярных машин [1], чувствительных к изменениям рН, УФ-облучению, а также катализаторов [3]. Гидразоны, производные витамина B6, пиридоксаля или его витамера, пиридоксаль-5-фосфата (PLP), обладают биологической активностью, в частности, могут ингибировать вызываемое ионами меди(II) окисление аскорбиновой кислоты [4, 5].
Предполагаемые полезные свойства гидразонов пиридоксаль-5-фосфата могут быть усилены путем изменения гидразидного остатка. Прогнозирование биологической активности, выполненное при помощи программного обеспечения PASS [6–8] показало, что гидразоны, образованные PLP и гидразидами 2-метил-3-фуранкарбоновой, тиофен-3-карбоновой кислот (в дальнейшем, 2MF3H и T3CH соответственно) являются потенциальными ингибиторами киназы бета-адренорецептора. Сердечная недостаточность ассоциирована с гиперактивностью бета-адренорецепторов [9–11], и разработку новых ингибиторов для них некоторые авторы считают перспективным направлением в борьбе с болезнями сердечно-сосудистой системы [9].
Гидролиз гидразонов способен существенно изменять их действие на организм [12], таким образом, необходимо исследовать устойчивость оснований Шиффа, а также кинетику их образования и разложения.
Целью настоящей работы является определение термодинамических и кинетических характеристик реакции между PLP и 2MF3H, T3CH в водном растворе при условиях, имитирующих физиологические (pH 6.6–7.4, ионная сила 0.25 [13]).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Реактивы. Пиридоксаль-5-фосфат (abcr GmbH, Германия), 2-метил-3-фуранкарбогидразид, тиофен-3-карбогидразид (Sigma-Aldrich, США) с заявленной чистотой >99 мас. % были использованы без предварительной подготовки. Отсутствие примесей контролировали при помощи 1H ЯМР спектроскопии. Буферные растворы с рН 6.6, 7.0, 7.4 готовили с использованием Na2HPO4 · · 12H2O и NaH2PO4 · 2H2O (Спектр-Хим, Россия). Значение рН1.9 создавалось при помощи предварительно стандартизированной HCl. Кислотность буферных растворов контролировалась потенциометрически. Все растворы готовились на бидистиллированной воде (κ = 1.7 мкСм/см, pH 6.6). Значение ионной силы I = 0.25, близкое к величине I в эритроцитах, задавалось за счет компонентов буферной смеси (при pH 6.6, 7.0, 7.4) или KNO3 (pH 1.9).
Приборы. Электронные спектры поглощения растворов PLP, 2M3FH, T3CH концентрацией 1.5 × 10–5–1.5 × 10–4 моль/л, а также растворов смесей PLP+2MF3H, PLP+T3CH были зарегистрированы на двухлучевом спектрофотометре Shimadzu UV1800 (США) в диапазоне длин волн 190–500 нм и оптической плотности. Соответствующий буфер (при рН 1.9 дистиллированная вода) использовались как растворы сравнения. Ошибка определения длины волны не превышала 0.5 нм, максимальная погрешность измерения оптической плотности составляла ±0.006 единиц. Температура 298.2 ± 0.1 K поддерживалась при помощи внешнего термостата. Использовались 1 см кварцевые кюветы.
Константы равновесия и изменения энтальпии реакции образования гидразонов при значении рН 6.6 определялись при помощи микрокалориметра титрования TAM III (TA Instruments, США), снабженного ячейкой объемом 20 мл. Калибровка калориметра проводилась аналогично описанному [14].
Методики определения констант устойчивости. Процесс образования гидразона описывается схемой 1.
Схема 1. Образование гидразона в результате реакции между пиридоксаль-5-фосфатом и 2-метил-3-фуранкарбогидразидом, тиофен-3-карбогидразидом.
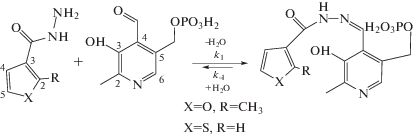
Константы устойчивости оснований Шиффа PLP-2MF3H, PLP-T3CH определялись по методике, описанной в работе [5] по электронным спектрам наборов из 9–10 растворов, в которых соотношение общих концентраций PLP : 2MF3H, PLP : T3CH изменялось от 10 : 1 до 1 : 1. После приготовления все растворы выдерживались в течение 24 ч, чтобы система достигла состояния равновесия. Спектральные данные обрабатывались при помощи программы FTMT (см. описание принципа расчета констант в [5]). Начальные концентрации PLP были постоянными ((1.5 ± 0.03) × 10–4 моль/л), в то время как общие концентрации 2MF3H, T3CH изменялись от (1.5 ± 0.03) × 10–5 до (1.5 ± 0.03) × 10–4 моль/л.
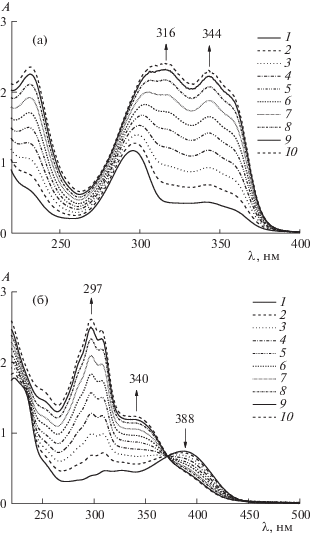
Расчеты проводились по экспериментальным зависимостям оптической плотности при трех длинах волн от общих концентраций реагентов (см. примеры спектров на рис. 1а, б).
Рис. 1.
Электронные спектры смесей PLP+2MF3H (a), PLP+T3H (б) при pH 1.9 (а), 6.6 (б). Общие концентрации (PLP+гидразид): 1 – 1.5 × 10–4 + 1.4 × 10–5; 2 – 1.5 × 10–4 + 2.9 × 10–5; 3 – 1.5 × 10–4 + 4.4 × 10–5; 4 – 1.5 × 10–4 + 5.9 × 10–5; 5 – 1.5 × 10–4 + 7.3 × 10–5; 6 – 1.5 × 10–4 + 8.7 × 10–5; 7 – 1.5 × 10–4 + 1.0 × 10–5; 8 – 1.5 × 10–4 + 1.2 × 10–5; 9 – 1.5 × 10–4+1.3 × 10–5; 10 – 1.5 × 10–4 + 1.5 × 10–5.
Молярные коэффициенты светопоглощения PLP, 2MF3H, T3CH, необходимые для расчета в FTMT при каждом значении pH и длины волны предварительно определялись методом градуировочного графика. Значения ε для оснований Шиффа рассчитывались программой при определении констант устойчивости.
Калориметрическое определение констант устойчивости и ΔH реакции образования гидразонов PLP-2MF3H, PLP-T3CH при pH 6.6 было проведено аналогично описанному [15]. Аликвота (15.00 мл) раствора PLP с концентрацией (7.29–8.66) × 10–4 моль/л помещалась в калориметрическую ячейку, раствор 2MF3H или T3CH с концентрацией 0.04358–0.05949 моль/л в соответствующем буфере служил в качестве титранта. Титрант вводили в ячейку, осуществляя 15–20 инъекций (каждая объемом 25 мкл). Тепловой эффект разведения гидразидов на объем ячейки учитывали при помощи холостого эксперимента, в ходе которого 15.00 мл буферной смеси титровали раствором 2MF3H или T3CH. Результаты эксперимента обрабатывали при помощи программы TAM Assistant [16]. Пример обработки данных приведен на рис. 2.
Рис. 2.
Экспериментальная (точки) и расчетная (сплошная линия) кривые калориметрического титрования раствора 0.000866 моль/л PLP раствором 0.05949 моль/л T3CH, pH 6.6.

Методика определения констант скорости реакции. Спектрофотометрические кинетические эксперименты проводились аналогично описанным в работе [15], за исключением общих концентраций. В настоящей работе они задавались на уровне ((1.5 ± 0.03) × 10–4 моль/л) для обоих реагентов (PLP с одной стороны, 2MF3H или T3CH с другой стороны). Концентрации гидразона и обоих реагентов в каждый момент времени рассчитывались из значений оптической плотности при фиксированной длине волны с использованием коэффициентов молярного светопоглощения исходных соединений и продукта реакции, определенных независимо по методу градуировочного графика и с помощью программы FTMT соответственно. Чтобы определить константы скорости образования и гидролиза гидразона, мы обрабатывали зависимости концентрации PLP и основания Шиффа от времени при помощи программы Kinet, разработанной профессором А.В. Абраменковым [17, 18]. При этом предполагалось, что протекают следующие процессы:
где “Hydrazide” обозначает 2MF3H либо T3СH; “SB” означает основание Шиффа.Примеры расчетных и экспериментальных зависимостей оптической плотности от времени, а также кинетических кривых приведены на рис. 3а, б.
Рис. 3.
Экспериментальные (точки) и расчетные (сплошная линия) зависимости: a – оптической плотности при λ = 297 нм; б – равновесных концентраций PLP, 2MF3H и их гидразона от времени при pH 7.0: 1 – [PLP]эксп, 2 – [2MF3H]эксп, 3 – [SB]эксп, 4 – [PLP]расч, 5 – [2MF3H]расч, 6 – [SB]расч, рН 7.0.

При рН 1.9 надежно определить кинетические характеристики реакций образования и гидролиза гидразона не удалось вследствие быстрого протекания процесса.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Результаты определения констант равновесия из спектрофотометрических данных (Kсф), а также констант скорости образования (k1) и гидролиза (k–1) оснований Шиффа при разных значениях рН сведены в табл. 1. Кроме того, в ней даны значения констант равновесия, определенные путем деления константы скорости прямой реакции на k обратной реакции (Kкин), а также значения критерия Фишера (F), характеризующие адекватность математической модели эксперимента. Результаты калориметрического исследования реакции образования гидразонов при pH 6.6 сведены в табл. 2.
Таблица 1.
Константы устойчивости, константы скорости реакции образования и гидролиза оснований Шиффа, производных пиридоксаль-5-фосфата и 2MF3H, T3CH при разных значениях рН
| Гидразон | pH | 1.94 | 6.6 | 7.0 | 7.4 |
|---|---|---|---|---|---|
| PLP-2MF3H | lg Kсф (F) | 5.30 ± 0.10 (0.04) | 5.41 ± 0.08 (0.03) | 5.21 ± 0.08 (0.04) | 4.93 ± 0.16 (0.08) |
| k1, л/моль мин (F) | – | 81 ± 3 (0.02) | 43.8 ± 1.0 (0.01) | 26.5 ± 1.1 (0.03) | |
| k–1, 1/мин | – | (8 ± 2) × 10–4 | (4.3 ± 0.5) × 10–4 | (3.8 ± 0.7) × 10–4 | |
| lg Kкин | – | 5.01 ± 0.15 | 5.01 ± 0.10 | 4.84 ± 0.11 | |
| PLP-T3CH | lg Kсф (F) | 5.27 ± 0.09 (0.10) | 5.39 ± 0.11 (0.06) | 4.78 ± 0.10 (0.04) | 4.77 ± 0.12 (0.21) |
| k1, л/моль мин (F) | – | 67.3 ± 1.5 (0.03) | 39.1 ± 1.0 (0.01) | 24.1 ± 0.9 (0.01) | |
| k–1, 1/мин | – | (3.1 ± 0.8) × 10–4 | (1.4 ± 0.6) × 10–3 | (2.1 ± 0.7) × 10–4 | |
| lg Kкин | – | 5.34 ± 0.14 | 4.45 ± 0.22 | 5.06 ± 0.19 |
Таблица 2.
Константы устойчивости, изменения энтальпии и энтропии реакции образования оснований Шиффа пиридоксаль-5-фосфата и 2MF3H, T3CH при рН 6.6, Т = 298.2 K по данным изотермической калориметрии титрования
| Гидразон | lg K | –ΔH, кДж/моль | –ΔS, Дж/(моль K) |
|---|---|---|---|
| PLP-2MF3H | 5.41 ± 0.10 | 49.9 ± 1.0 | 63.7 ± 1.1 |
| PLP-T3CH | 5.42 ± 0.09 | 50.8 ± 1.0 | 67.3 ± 1.1 |
Величины погрешностей (табл. 1, 2) представляют полуширину доверительного интервала при доверительной вероятности 0.95 и размере выборки 3 эксперимента.
Устойчивость гидразонов PLP-2MF3H, PLP-T3CH высока при всех изученных значениях рН среды. Для исследованных к настоящему моменту оснований Шиффа пиридоксаль-5-фосфата, включая продукты взаимодействия с производными пиридина и пиразола [5, 19], также характерны величины lg K порядка 4.2–5.2. Таким образом, константа равновесия реакции образования оснований Шиффа пиридоксаль-5-фосфата относительно слабо зависит от природы ароматического ядра в остатке гидразида.
Оба основания Шиффа (PLP-2MF3H и PLP-T3CH) становятся менее стабильными при переходе от рН 6.6 к 7.4. Скорость образования гидразонов значительно уменьшается при переносе реакции из слабокислой в слабощелочную среду.
В слабокислой среде значения lg K, определенные спектрофотометрически и калориметрически хорошо согласуются друг с другом для обоих гидразонов. Однако, значения констант равновесия, определенные в кинетическом эксперименте с использованием известного отношения:
отличаются.Разность между константами устойчивости гидразонов, определенных в спектрофотометрическом и кинетическом экспериментах, связана с особенностями вычисления значения величины k–1, которая мала. Во всех случаях, процесс (2) может быть исключен из математической модели, используемой для описания экспериментальных данных. Это приводит к изменению значения константы скорости прямой реакции, однако, это изменение меньше статистической погрешности определения k1 (см. рис. 4 и ср. с рис. 3).
Рис. 4.
Экспериментальные (точки) и расчетные (сплошные линии) зависимости: a – оптической плотности при λ = 297 нм; б – равновесных концентраций PLP, 2MF3H и их гидразона от времени при pH 7.0: 1 – [PLP]эксп, 2 – [2MF3H]эксп, 3 – [SB]эксп, 4 – [PLP]расч, 5 – [2MF3H]расч, 6 – [SB]расч, рН 7.0. Предполагается протекание только прямой реакции.

Следует отметить, что исключение процесса (2) (который точно протекает в исследуемой системе) не изменяет существенно ни сумму квадратов отклонений экспериментальной зависимости оптической плотности от расчетной, ни значение дисперсии адекватности, ни величину критерия Фишера. Следовательно, обе модели (1 – предполагающая обратимость реакции образования гидразона, 2 – предполагающая необратимое образование основания Шиффа) являются адекватными. Опираясь только на результат F-теста, можно принять ложноотрицательное решение о протекании гидролиза гидразона в растворе.
Таким образом, значения k–1, определяемые непосредственно из результатов кинетического эксперимента, могут быть ненадежными. По всей вероятности, их следует вычислять по уравнению (3), используя значения lg Kсф и k1 (табл. 1), т.е. k–1 = k1/Kсф.
Существует также риск принятия ложноположительных решений. Например, при обработке результатов исследования взаимодействия PLP c 2MF3H при рН 7.4, процесс может быть задан вместо реакции гидролиза гидразона:
Модель, включающая реакцию (1) и заведомо абсурдный процесс (4), допускает расчет k2 и также является адекватной (k1 = 26.0 л/моль мин, k2 = 8 × 10–4 л/моль мин, F = 0.01).При расчете константы устойчивости из спектрофотометрических данных также могут быть сделаны ложноположительные заключения. Например, при расчете константы устойчивости гидразона PLP-2MF3H при рН 7.0 в математическую модель в дополнение к реакции образования основания Шиффа (схема 1) может быть введен процесс :
что даже несколько повышает адекватность модели (F = 0.03).Приведенные примеры иллюстрируют хорошо известный факт, что адекватность модели не дает оснований считать ее истинной [20]. Отметим, что при исследовании простой системы, в которой протекают только процессы образования гидразонов и их гидролиза, возможность ошибиться невелика. Однако, в более сложных случаях, в которых возможно протекание набора реакций с неизвестными константами равновесия, вероятность принятия ложных решений возрастает.
Более высокая устойчивость обоих гидразонов при pH 6.6 по сравнению с растворами с pH 7.0, 7.4 означает, что 2MF3H и T3CH могут связывать PLP в большей степени в тканях, межклеточная жидкость которых имеет пониженный рН (например, некоторые опухоли [21, 22] или ишемические ткани [23], что представляет дополнительный интерес, с учетом потенциальной активности оснований Шиффа как ингибиторов киназы бета-адренорецептора).
Данные табл. 2 показывают, что основной вклад в устойчивость оснований Шиффа при рН 6.6 вносит энтальпийная составляющая. Отрицательные значения изменения энтропии являются ожидаемыми, поскольку молекула гидразона обладает меньшим числом степеней свободы, чем реагенты.
Величины ΔH реакции образования гидразонов пиридоксаль-5-фосфата и пятичленных гетероциклов (табл. 2) близки к изменению энтальпии реакции между PLP и изониазидом [15].
Работа выполнена в НИИ термодинамики и кинетики химических процессов Ивановского государственного химико-технологического университета при поддержке РФФИ (проект 16-33-60017), Министерства науки и высшего образования РФ (проект 4.7305.2017/8.9) и Совета по грантам при Президенте Российской Федерации (проект 14.Z56.18.877-MK). Калориметрический эксперимент был выполнен на установке, относящейся к центру коллективного пользования ИГХТУ.
Список литературы
Su X., Aprahamian I. // Chem. Soc. Rev. 2014. V. 43. P. 1963. doi 10.1039/C3CS60385G
Suvarapu L.N., Seo Y.K., Baek S.-O., Ammireddy V.R. // E-Journal of Chemistry. 2012. V. 9. Iss. 3. P. 1288. doi 10.1155/2012/534617
Shakdofa M.M.E., Shtaiwi M.H., Morsy N., Abdel-rassel T.M.A. // Main Group Chemistry. 2014. V. 13. Iss. 3. P. 187. doi 10.3233/MGC-140133
Hermes-Lima M., Gonçalves M.S., Andrade Jr. R.G. // Mol. Cell. Biochem. 2001. V. 228. P. 73. doi 10.1023/A:1013348005312
Gamov G.A., Kiselev A.N., Aleksandriiskii V.V., Sharnin V.A. // J. Mol. Liq. 2017. V. 242. P. 1148. doi 10.1016/ j.molliq.2017.07.106
http://way2drug.com/PassOnline/predict.php (Дocтyп 20.03.2018).
Fliz O.A., Poroikov V.V. // Russ. Chem. Rev. 2012. V. 81. Iss. 2. P. 158. doi 10.1070/ RC2012v081n02ABEH004222
Poroikov V.V., Filimonov D.A., Borodina Yu.V. et al. // J. Chem. Inf. Comput. Sci. 2000. V. 40 Iss. 6. P. 1349. doi 10.1021/ci000383k
Cannavo A., Komici K., Bencivenga L. et al. // Expert Opinion on Therapeutic Targets. 2018. V. 22. Iss. 1. P. 75. doi 10.1080/14728222.2018.1406925
Thal D.M., Yeow R.Y., Schoenau C. et al. // Mol. Pharmacol. 2011. V. 80. P. 294. doi 10.1124/mol.111.071522
Waldschmidt H.V., Homan K.T., Cruz-Rodríguez O. et al. // J. Med. Chem. 2016. V. 59 Iss. 8. P. 3793. doi 10.1021/acs.jmedchem.5b02000
Buss J.L., Ponka P. // Biochim. Biophys. Acta – Gen. Sub. 2003. V. 1619. Iss. 2. P. 177. doi 10.1016/S0304-4165(02)00478-6
Mouat M.F., Manchester K.L. // Compar. Haematol. Int. 1998. V.8 Iss. 1. P. 58. doi 10.1007/BF02628107
Wadso I., Goldberg R.N. // Pure&Appl. Chem. 2001. V. 73. Iss. 10. P. 1625. doi 10.1351/pac200173101625
Gamov G.A., Zavalishin M.N., Usacheva T.R., Sharnin V.A. // Russ. J. Phys. Chem. A. 2017. V. 91. Iss. 5. P. 843. doi 10.1134/S0036024417050107
http://www.tainstruments.com/support/software-downloads-support/downloads/ (Дocтyп 20.03.2018).
Практикум по физической химии. Кинетика и катализ. Электрохимия / Под ред. В.В. Лунина, Е.П. Агеева / M.: Академия, 2012. С. 70–102.
http://www.chem.msu.su/rus/teaching/KINET2012/ (Дocтyп 20.03.2018).
Gamov G.A., Aleksandriiskii V.V., Zavalishin M.N. et al. // Russ. J. Gen. Chem. 2017. V. 87. No. 6. P. 1161. doi 10.1134/S1070363217060093
Асатурян В.И. Теория планирования эксперимента / М.: Радио и связь. 1983. С. 91.
Kato Y., Ozawa S., Miyamoto C., Maehata Y. et al. // Canc. Cell Int. 2013. V. 13. Номер статьи 89. doi 10.1186/1475-2867-13-89
Estrella V., Chen. T., Lloyd M. et al. // Cancer Res. 2013. V. 73. Iss. 5. P. 1524. doi 10.1158/0008-5472.CAN-12-2796.
Lazzeri C., Valente S., Chiostri M. et al. // Intern. Emerg. Med. 2010. V. 5. P. 61. doi 10.1007/s11739-009-0338-0
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии


