Журнал физической химии, 2019, T. 93, № 2, стр. 220-224
Растворимость и экстракция ионов металлов в системах неорганическая кислота–хлорид алкилбензилдиметиламмония–вода
Ю. И. Исаева a, *, А. М. Елохов a, b, С. А. Денисова a, О. С. Кудряшова b, А. Е. Леснов c, d
a Пермский государственный национальный исследовательский университет
Пермь, Россия
b Естественнонаучный институт Пермского государственного национального исследовательского университета
Пермь, Россия
c Пермский государственный аграрно-технологический университет им. Д.Н. Прянишникова
Пермь, Россия
d Российская академия наук, Уральское отделение, Институт технической химии
Пермь, Россия
* E-mail: elhalex@yandex.ru
Поступила в редакцию 02.04.2018
Аннотация
Изучена растворимость в системах, образованных катионным ПАВ хлоридом алкилдиметилбензиламмония (катамином АБ), неорганической кислотой и водой. Показано, что максимальной высаливающей способностью обладают азотная и хлорная кислоты, анионы которых имеют низкую энергию гидратации. Определены оптимальные параметры экстракции в системе HNO3–катамин АБ–вода и показана перспективность ее использования для концентрирования таллия(III).
Катионные поверхностно-активные вещества (КПАВ) широко используются в экстракции. Расслаивание водных растворов КПАВ возможно при введении высаливателей, например, предложено использовать цетилтриметиламмоний бромид в присутствии иодида калия для концентрирования урана(VI) с эриохром цианином R [1], трикаприлметиламмоний бромид для извлечения бисфенола А в присутствии сульфата натрия в качестве высаливателя [2].
Другим подходом является использование смеси КПАВ и анионных ПАВ в определенной концентрации, приводящих к образованию ионных ассоциатов с низкой величиной критической концентрации мицеллообразования и способностью к расслаиванию. В подобных системах изучены экстракции бензола [3], теанина [4] и сульфаниламидов [5]. Если в качестве анионного компонента использовать органические кислоты или их соли, то возможно получение ионных жидкостей, несмешивающихся с водой и способных концентрировать ионы металлов. В работах [6–8] изучена экстракция меди, никеля, кобальта, цинка, кадмия и свинца ионными жидкостями N-лауроилсаркозинатом тетраоктиламмония и салицилатом триоктилметиламмония как без дополнительных комплексообразующих реагентов, так и в присутствии кисленолового оранжевого и 4-(2-пиридилазо)резорцина. КПАВ могут использоваться для концентрирования биологически активных веществ. Например, показана возможность извлечения бычьего сывороточного альбумина обратными мицеллами ди(N-додецилглюкозиламмоний) дикарбоксилата [9] или лизоцима – цетилдиметиламмоний бромидом [10].
Одним из перспективных технических катионных ПАВ является алкилбензилдиметиламмоний хлорид (катамин АБ), который нашел применение при экстракции хлоридных и тиоцианатных комплексов металлов в присутствии высаливателей – хлоридов щелочных металлов [11, 12]. Показана возможность использования смесей катамина АБ и анионного ПАВ бис(алкилполиоксиэтилен)фосфата калия (оксифоса Б) для извлечения металлов без высаливателя при температуре 50°С [13].
Настоящая работа посвящена изучению возможности применения катамина АБ для экстракции ионов металлов при использовании в качестве высаливателя неорганических кислот.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использован технический катионный ПАВ – алкилбензилдиметиламмония хлорид ([CnH2n + 1N+(CH3)2CH2C6H5]Cl, n = 10–18, катамин АБ, ТУ 9392-003-48482528-99, водный раствор, содержащий основного вещества – 50 мас. %), неорганические кислоты (серная, азотная, хлорная, фосфорная) квалификации ч.д.а., неорганические соли (сульфаты индия, железа(III), тория(IV), нитраты иттрия, лантана, хлорид натрия и калия, сульфат и нитрат натрия) квалификации “ч.д.а.”. Сульфат таллия(III) готовили растворением оксида таллия(III) квалификации “х.ч.” в серной кислоте с последующим разбавлением.
Высаливающую способность оценивали путем построения бинодальной кривой систем неорганическая кислота–катамин АБ–вода методом изотермического титрования. Растворы катамина АБ с различной известной концентрацией титровали раствором кислоты заданной концентрации и, наоборот, раствор неорганической кислоты переменной концентрации – раствором ПАВ с концентрацией 250 г/л. Конец титрования определяли по появлению устойчивой опалесценции. Погрешность определения растворимости составляла ±1.0%.
Ноды в области расслаивания строили при 25°С с помощью изотермического метода сечений. В качестве физического свойства жидкой фазы использовали показатель преломления, который измеряли на рефрактометре ИРФ-454Б2М с точностью ±0.0005. Положение критических точек определяли по правилу Алексеева, согласно которому линия, соединяющая середины нод, пересекает бинодальную кривую в критической точке.
Экстракцию в системе азотная кислота–катамин АБ–вода осуществляли в делительных воронках, куда вносили 4.0 мл раствора катамина АБ с концентрацией 500.0 г/л, расчетное количество азотной кислоты (10.0 моль/л), 2.0 мл 0.1 моль/л раствора соли металла, и доводили объем дистиллированной водой до 20.0 мл. Полученную смесь встряхивали в течение 1 мин и после полного расслаивания фазы разделяли. Степень извлечения металлов определяли комплексонометрическим титрованием рафината. Наличие в титруемом растворе катамина АБ не влияет на точность определения.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Методом изотермического титрования исследовано влияние кислот на высаливание катамина АБ из водных растворов. Введение в раствор катамина АБ хлороводородной или фосфорной кислот не приводит к образованию второй жидкой фазы. Системы остаются гомогенными во всем изученном интервале концентраций компонентов. Серная, хлорная или азотная кислота расслаивает раствор катамина АБ на две жидкие фазы.
Область расслаивания в системе с серной кислотой имеет замкнутую бинодальную кривую (рис. 1а). Содержание катамина АБ и H2SO4 в расслаивающихся смесях варьируется от 43 до 198 г/л и от 138 до 275 г/л соответственно. Ноды в области расслаивания расположены практически параллельно оси абсцисс и расходятся в направлении оси ординат, что свидетельствует о доминирующем взаимодействии в системе вода–H2SO4.
Концентрационные интервалы области расслаивания в системах с азотной (рис. 1б) и хлорной кислотой существенно шире, чем с серной. Диаграмма растворимости системы HClO4–катамин АБ–вода практически идентична диаграмме с HNO3. Минимальная концентрация азотной кислоты в расслаивающихся смесях составляет 10 г/л, хлорной кислоты – 2.5 г/л. Характер расположения нод в области расслаивания системы HNO3–катамин АБ–вода аналогичен системе с серной кислотой. Состав фазы ПАВ не определялся.
Высаливание катамина АБ неорганическими кислотами можно объяснить адсорбцией их анионов на поверхности мицелл катамина АБ, несущих избыточный положительный заряд. Вследствие переноса воды с гидратной оболочкой аниона изменяется и гидратация мицелл ПАВ. Так, введение в растворы катамина АБ кислот, анионы которых гидратируются в большей степени, чем хлорид-ион (табл. 1) и последующая их адсорбция приводит к росту гидратации мицелл, в результате чего расслаивание не наблюдается или площадь области расслаивания незначительна. Введение кислот, анионы которых гидратируются в меньшей степени, чем хлорид-ион приводит к частичному обезвоживанию мицелл, вследствие адсорбции анионов, последующей их агрегации и образованию собственной фазы. Введение хлороводородной кислоты не влияет на растворимость катамина АБ, изменения в гидратации мицелл в этом случае незначительны.
Таблица 1.
Энергия гидратации (∆Ghyd), количество молекул воды в гидратной оболочке (n) и ее ширина (∆r) для анионов [14]
| Анион | ${\text{PO}}_{4}^{{3 - }}$ | ${\text{SO}}_{4}^{{2 - }}$ | Cl– | ${\text{NO}}_{3}^{ - }$ | ${\text{ClO}}_{4}^{ - }$ |
|---|---|---|---|---|---|
| ∆Ghyd, кДж/моль | –2765 | –1080 | –340 | –300 | –242 [15] |
| n | 4.5 | 3.1 | 2.0 | 2.0 | 1.4 |
| ∆r, нм | 0.054 | 0.043 | 0.043 | 0.044 | 0.019 |
Для осуществления экстракции выбрана система c азотной кислотой, обладающая рядом преимуществ: высокая высаливающая способность кислоты, быстрое установление равновесия и образование прозрачных подвижных фаз. Исходя из положения нод в области расслаивания (рис. 1б), увеличение концентрации кислоты при постоянной концентрации катамина АБ не должно приводить к существенному изменению относительного объема экстракта, поэтому возможно осуществление экстракции при фиксированной концентрации катамина АБ с изменением содержания азотной кислоты. Экспериментально установлено, что относительный объем экстракта (Vотн, отношение объема экстракта к общему объему системы) при концентрации азотной кислоты 1.0 моль/л линейно связан с содержанием катамина АБ (СПАВ, г/л): Vотн = 0.0007СПАВ + 0.005. Для осуществления экстракции выбрана концентрация катамина АБ равная 100 г/л, при которой относительный объем экстракта составляет 0.08.
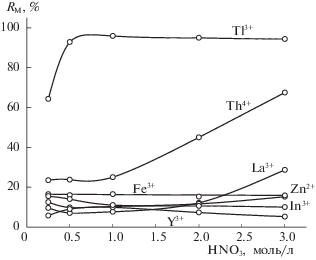
В указанных условиях исследовано распределение ряда катионов (рис. 2). Железо(III), иттрий, индий и цинк извлекаются менее чем на 20%, в то время как рост степени извлечения лантана и тория наблюдается при концентрации кислоты 2 и 1 моль/л соответственно. Наибольший интерес вызывают таллий(III), который при концентрации азотной кислоты выше 0.5 моль/л извлекается более чем на 90%. Предположительно таллий(III) концентрируется по анионообменному механизму в виде тетрахлороталлат-иона, благодаря его высокой устойчивости:
Рис. 2.
Экстракция катионов металлов в системе HNO3–катамин АБ–вода (СПАВ = 100 г/л, СМ = = 0.01 моль/л , Vоб = 20 мл).
Для повышения степени извлечения катионов целесообразным является использование неорганических солей в качестве высаливателя. Исследовано влияние сульфата и нитрата натрия, хлоридов калия и натрия на извлечение таллия(III) и железа(III). Выбор металлов обусловлен их способностью извлекаться в виде хлоридных ацидокомплексов, при этом представляло интерес установить влияние высаливателя на селективность концентрирования таллия.
Следует отметить, что неорганическая соль может оказывать влияние и на расслаивание в системе. Исходя из литературных данных, сульфаты практически не влияют на расслаивание катамина АБ, нитраты высаливают катамин АБ при гораздо меньших концентрациях, чем хлориды [16]. Экспериментально установлено, что введение высаливателей во всем изученном интервале концентраций мало влияет на относительный объем экстракта.
Введение хлоридов натрия и калия в концентрации более 0.25 моль/л создают оптимальные условия для количественного извлечения таллия(III), при этом, не влияя на извлечение железа(III) (рис. 3). Нитрат и сульфат натрия незначительно влияют на экстракцию таллия(III), но несколько снижают степень извлечения железа(III).
Рис. 3.
Экстракция Tl(III) (1) и Fe(III) (2) в системе HNO3–катамин АБ–вода в присутствии высаливателей (СПАВ = 100 г/л, ${{C}_{{{\text{HN}}{{{\text{O}}}_{3}}}}}$ = 0.5 моль/л, СМ = = 0.01 моль/л, Vоб = 20 мл).

Представляло интерес сравнить экстракцию в различных системах на основе катамина АБ в присутствии неорганических кислот, которые в зависимости от природы различным образом влияют на извлечение металлов (табл. 2). Исключение из экстракционной системы неорганического высаливателя приводит к уменьшению степени извлечения большинства изученных элементов за исключением таллия(III), при этом упрощается процедура экстракции. Близкие степени извлечения изученных элементов за исключением железа в системах NH4NO3–катамин АБ–вода–H2SO4 и HNO3–катамин АБ–вода связано с низкой концентрацией хлорид-ионов, единственным источником которых в указанных экстракционных системах является катамин АБ.
Таблица 2.
Степени извлечения катионов металлов (RM) при экстракции в системах на основе катамина АБ
| Экстракционная система | Ион металла | |||
|---|---|---|---|---|
| Tl(III) | Zn(II) | Fe(III) | In(III) | |
| HNO3–катамин АБ–вода | 93 (>0.5)* | 12 (>0.25) | 18 (>0.25) | 17 (>0.25) |
| NaCl–катамин АБ–вода–HCl [11] | >99 (>0.1) | 70–80 (<1.0) | 90 (2.0) | –** |
| NaCl–катамин АБ–вода–H2SO4 [11] | >99 (>0.5) | 78 (0.0–0.5) | 80 (2.0) | – |
| NH4NO3–катамин АБ–вода–HCl [17] | >99 (>0.0) | 90 (1.5–3.0) | 55 (3.0) | 50 (3.0) |
| NH4NO3 – катамин АБ – вода – H2SO4 [17] | >99 (>0.0) | <10 (0.0–3.0) | 90–95 (0.0–3.0) | <5 (0.0–3.0) |
Исследование влияния неорганических кислот на высаливание катамина АБ показало, что образование области расслаивания во многом определяется степенью гидратации анионов кислот. Наиболее сильными высаливателями являются неорганические кислоты, содержащие слабогидратирующиеся анионы, такие как нитрат и перхлорат. На основании полученных данных по растворимости оптимизированы параметры экстракции в системе HNO3–катамин АБ–вода и показана ее перспективность для извлечения таллия(III).
Работа выполнена при финансовой поддержке Министерства образования и науки Российской Федерации (задания 4.5947.2017/6.7 и 5.6881.2017/8.9).
Список литературы
Akl Z.F. // J. Radioanal. and Nucl. Chem. 2016. V. 308. № 2. P. 693.
Yi-Jun Y.U., Guan-Yong S., Michael H.W., Paul K.S., Hong-Xia Y.U. // Chin. J. Anal. Chem. 2012. V. 37. № 12. P. 1717.
Weschayanwiwat P., Kunanupap O., Scamehorn J.F. // Chemosphere. 2008. V. 72. P. 1043.
Zhang J., Wang Y., Peng Q. // Korean J. Chem. Eng. 2013. V. 30. № 6. P. 1284.
Chen D., Zhang P., Li Y., Mei Zh., Xiao Yu. // Anal. and Bioanal. Chem. 2014. V. 406. P. 6051.
Смирнова С.В., Самарина Т.О., Ильин Д.В., Плетнев И.В., Золотов Ю.А. // Доклады академии наук. 2016. Т. 469. № 6. С. 691.
Смирнова С.В., Баулин В.Е., Торочешникова И.И., Плетнев И.В. // Вестник Московского университета. Серия 2. Химия. 2016. Т. 57. № 1. С. 11.
Egorov V.M., Djigailo D.I., Momotenko D.S., Chernyshov D.V., Torocheshnikova I.I., Smirnova S.V., Pletnev I.V. // Talanta. 2010. V. 80. № 3. P. 1177.
Chen L., Dong J., Guo X. // Process Biochemistry. 2017. V. 60. P. 108.
Noh K.H., Imm J.Y. // Food chemistry. 2005. V. 93. № 1. P. 95.
Кудряшова О.С., Бортник К.А., Чухланцева Е.Ю., Денисова С.А., Леснов А.Е. // Журн. неорган. химии. 2013. Т. 58. № 2. С. 290.
Леснов А.Е., Денисова С.А., Чухланцева Е.Ю., Заболотных С.А., Останина Н.Н. // Химия в интересах устойчивого развития. 2015. Т. 23. С. 361.
Елохов А.М., Богомолов Н.В., Денисова С.А., Кудряшова О.С., Леснов А.Е. // Изв. Академии наук. Сер. хим. 2018. № 2. С. 206–210.
Marcus Y. // J. Chem. Soc. Faraday Trans. 1991. V. 87. Is. 18. P. 2995–2999.
Межов Э.А., Реймаров Г.А., Хананашвили Н.Л. // Радиохимия. 1992. Т. 34. № 1. С. 9–50.
Леснов А.Е., Денисова С.А., Кудряшова О.С., Чепкасова А.В., Катаева Е.Ю., Мохнаткина Н.Н. // Журн. прикл. химии. 2010. Т. 83. № 8. С. 1379.
Чухланцева Е.Ю. Фазовые и экстракционные равновесия в системах вода–катамин АБ–высаливатель. Дисс. … канд. хим. наук. Пермь, 2016. 170 с.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии



