Журнал физической химии, 2019, T. 93, № 2, стр. 244-252
О кратности связей Te–Te в теллурсодержащих соединениях лантанидов
В. Н. Сережкин a, *, М. Албакаджажи a, Л. Б. Сережкина a
a Самарский национальный исследовательский университет имени академика С.П. Королева
Самара, Россия
* E-mail: serezhkin@samsu.ru
Поступила в редакцию 04.05.2018
Аннотация
С помощью полиэдров Вороного–Дирихле (ВД) проведен анализ строения 272 соединений, содержащих в структурах кристаллов 337 координационных полиэдров LnTen, где Ln – любой лантанид от La до Lu. Показано, что параметры полиэдров ВД позволяют определять валентное состояние атомов Ln. Установлено, что в теллуридах содержатся атомы Ln(II) и Ln(III), связывающие от 4 до 9 атомов теллура, которые существуют в виде ионов Te2– или Tе–. Охарактеризованы полиэдры ВД атомов Te и выяснено, что гомоатомные связи Te–Te возникают только при дефиците электронодонорных атомов металлов в составе кристаллических веществ. С помощью параметров полиэдров ВД выявлена зависимость кратности ковалентной связи Te–Te от ее длины, работоспособность которой апробирована на примере некоторых соединений, в том числе полителлуридов, содержащих сетки 44 из атомов теллура.
Теллурсодержащие соединения лантанидов (Ln) активно изучаются в последние десятилетия благодаря практически значимым особенностям их оптических, электрофизических, магнитных и некоторых других свойств. Имеющиеся данные показывают, что в структурах кристаллов между атомами теллура часто реализуются межатомные контакты, длина которых лежит в широком диапазоне от ≈2.7 Å (ковалентная связь Te–Te) до ≈4.1 Å (ван-дер-ваальсовы взаимодействия Te···Te) [1–3]. Склонность теллура к гомоатомным взаимодействиям – важная особенность его стереохимии, которая оказывает влияние и на свойства соединений. Неоднократно отмечалось, что наличие в структурах кристаллов широкого спектра межатомных контактов Te–Te затрудняет или делает невозможным однозначное определение формальных зарядов атомов [1–5]. Например, LnTe3 и Ln2Te5 демонстрируют валентные флуктуации с необычным распределением формальных валентностей ([LnTe]+Te2]– и ([LnTe]+)2([Te]1/2–)2[Te]–) и соответственно одно- и двумерным поведением волн зарядовой плотности [4, 5]. Дополнительным фактором, который усложняет кристаллохимический анализ и также влияет на свойства теллурсодержащих соединений, является известная способность атомов некоторых Ln реализовывать не только трех-, но и двух- или четырехваленное состояние. Примером могут служить LnTe, которые при стандартных условиях изоструктурны, так как независимо от природы Ln (от лантана до лютеция) кристаллизуются в структурном типе NaСl. В то же время в зависимости от валентного состояния Ln большинство из них (LnIIITe(ē)) обладает металлической проводимостью, тогда как некоторые (LnIITe) – полупроводники [6–8].
На примере соединений, содержащих более 3900 кристаллографически неэквивалентых комплексов LnOn, было показано [9], что параметры полиэдров Вороного–Дирихле (ВД) позволяют четко различать атомы Ln(II), Ln(III) и Ln(IV), сосуществующие в структурах ряда кристаллов. Результаты [9] позволяют предположить, что характеристики полиэдров ВД могут быть использованы для оценки валентного состояния атомов и в теллурсодержащих соединениях Ln. Экспериментальная проверка указанного предположения – основная цель данной работы.
ОБЪЕКТЫ ИССЛЕДОВАНИЯ И МЕТОДИКА КРИСТАЛЛОХИМИЧЕСКОГО АНАЛИЗА
Объектами анализа были все соединения Ln, сведения о структурах кристаллов которых имеются в базах данных [10, 11] и удовлетворяют двум требованиям. Во-первых, все кристаллографически неэквивалентные атомы Ln образуют координационные полиэдры (КП) или “комплексы” LnTen. Во-вторых, отсутствует какое-либо разупорядочение в размещении атомов любых элементов. Указанным условиям соответствовали сведения для 272 соединений, которые содержали соответственно 337 и 586 кристаллографических сортов атомов Ln и Te. Кристаллохимический анализ проводили c позиций стереоатомной модели структуры кристаллов (СМСК), в рамках которой геометрическим образом любого атома был соответствующий ему полиэдр ВД [9, 12–14]. На основании сведений о симметрии кристаллов, параметрах их элементарных ячеек и координатах базисных атомов были рассчитаны характеристики полиэдров ВД всех атомов, а по методу пересекающихся сфер 13] – их координационные числа (КЧ). Все расчеты проводили с помощью комплекса программ TOPOS-InterMol [15].
Краткая характеристика 22 типов комплексов [LnnTem]х–, обнаруженных в структурах рассмотренных соединений, указана в табл. 1. Для этих комплексов по методике [15] определены кристаллохимические формулы (КХФ), характеризующие кристаллоструктурную роль атомов Te в связывании атомов Ln. Отметим, что указанные КХФ не отражают наличия гомоатомных связей между атомами Te в структурах кристаллов. По данным метода [13], связи Te–Te имеются в структурах только четырех электронейтральных ([LnTe2], [Ln2Te5], [LnTe3], [Ln10Te19], табл. 1) и двух анионных ([Ln3Te8]–, [LnTe4]–) комплексов.
Таблица 1.
Некоторые характеристики комплексов [LnnTem]х– в структурах кристаллов
| № | КЧ Ln в ком-плексе | Состав “комплекса” [LnnTem]х– | Отношение Te : Ln в комплексе | Размер-ность комплекса | КХФ*** | Природа атомов Ln в составе комплексов | Природа атомов R в составе соединений**** |
|---|---|---|---|---|---|---|---|
| 1 | 6 | [LnTe] | 1 | 3D | AM6 | La, Ce, Pr, Nd, Sm, Eu, Gd, Tb, Dy, Ho, Er, Tm, Yb, Lu | – |
| 2 | 8** | 3D | AM8 | Pr, Nd, Sm, Eu | – | ||
| 3 | 8 | [Ln3Te4] | 1.33 | 3D | A3M$_{4}^{6}$ | La, Ce, Pr, Nd, Sm, | – |
| 4 | 7, 8 | [Ln2Te3] | 1.5 | 3D | A2M$_{3}^{5}$ | Ce, Nd, Sm, Gd, | – |
| 5 | 6 | 3D | A2M$_{3}^{4}$ | Tb, Dy, Ho, Er, Tm, Yb, Lu | – | ||
| 6 | 6 | [Ln21Te34]5– | 1.62 | 3D | A21M$_{2}^{5}$M$_{{20}}^{4}$M$_{{12}}^{3}$ | Dy, Ho | Cs |
| 7 | 6 | [Ln11Te18]3– | 1.64 | 3D | A11M$_{4}^{5}$M$_{4}^{4}$M$_{{10}}^{3}$ | Tm | Cs |
| 8 | 6 | [Ln3Te5]– | 1.67 | 3D | A3M5M4M$_{3}^{3}$ | Ho | Cs |
| 9* | 8, 9 | [Ln10Te19] | 1.9 | 3D | A10M$_{{10}}^{5}$M$_{9}^{4}$ | Ce | – |
| 10* | 9 | [LnTe2] | 2 | 3D | AM5M4 | La, Ce, Pr, Nd, Sm, Gd, Tb, Dy, Ho, Er, Tm, Yb, Lu | – |
| 11 | 4 | [LnTe2]– | 2 | 1D | AM$_{2}^{2}$ | Ce | Tl |
| 12 | 6 | 2D | AM$_{2}^{3}$ | La, Ce, Pr, Nd, Sm, Gd, Tb, Dy, Ho, Er, Tm, Lu | Na, K, Rb, Cs, Tl, Ag | ||
| 13 | 6 | 3D | AM$_{2}^{3}$ | Pr, Sm, Gd, Tb, Dy, Ho, Er, Tm, Lu | Na, Ag, Ba | ||
| 14* | 9 | [Ln2Te5] | 2.5 | 2D | A2M$_{2}^{5}$M4M$_{2}^{2}$ | La, Ce, Pr, Nd, Sm, Gd, Dy, Ho, Tm | – |
| 15 | 6 | [Ln2Te5]4– | 2.5 | 2D | A2M$_{2}^{3}$M$_{3}^{2}$ | Gd, Tb, Dy, Ho, Er | Rb, Cs, Ag, |
| 16* | 8, 9 | [Ln3Te8]– | 2.67 | 2D | A3M$_{3}^{5}$M$_{5}^{2}$ | Pr, Nd | K |
| 17* | 9 | [LnTe3] | 3 | 2D | AM5M$_{2}^{2}$ | La, Ce, Pr, Nd, Sm, Gd,Tb, Dy, Ho, Er, Tm, Lu | – |
| 18 | 6 | [LnTe3]3– | 3 | 2D | AM$_{3}^{2}$ | Pr, Nd, Sm, Gd,Tb, Dy, Ho, Er, Tm, Lu | Cs, Zn, Cd, Ba, Cu |
| 19* | 8 | [Ln(Te2)2]– | 4 | 2D | AM$_{4}^{2}$ | Pr, Nd, Gd | K, Rb, Cs |
| 20 | 6 | [LnTe4]5– | 4 | 1D | AM$_{2}^{2}$M$_{2}^{1}$ | Ce, Nd, Sm, Gd, Dy, Er, | K, Ag, Ba, Ga, In |
| 21 | 8 | [LnTe4]6– | 4 | 3D | AM$_{4}^{2}$ | Eu | Ga, In |
| 22 | 6 | [LnTe6]9– | 6 | 0D | AM$_{6}^{1}$ | La, Ce, Sm, Gd | Tl |
* Комплексы, в структурах которых имеются связи Te–Te. ** При давлении 90–110 кбар [8]. *** КХФ – кристаллохимическая формула комплекса. Во всех случаях A = Ln, M = Te. Надстрочные цифры указывают число связей Te–Ln, образованных одним атомом теллура. Подстрочные цифры – стехиометрические индексы. **** RZ+ – катионы, компенсаторы заряда анионных комплексов [LnnTem]х-.
ПОЛИЭДРЫ ВД АТОМОВ ЛАНТАНИДОВ
В теллурсодержащих соединениях атомы Ln образуют КП LnTen при n = 4, 6, 7, 8 или 9 (табл. 2). Наиболее характерны КЧ 6 и 9 (соответственно ≈62 и 23%). Тетраэдры LnTe4, связанные двумя взаимно перпендикулярными ребрами в цепи LnTe4/2, содержатся в единственной структуре Tl[CeTe2] {622280} [16]. Здесь и далее в фигурных скобках указан цифровой код соединения в базе данных [10]. Все комплексы с КЧ 6 имеют форму октаэдра, а при КЧ 7 – одношапочной тригональной призмы. При КЧ 8 чаще всего реализуются комплексы LnTe8 в виде тригональных додекаэдров, кроме которых встречаются КП в виде двухшапочной тригональной призмы, квадратной антипризмы или куба. При КЧ 9 КП имеют форму одношапочной квадратной антипризмы.
Таблица 2.
Важнейшие характеристики полиэдров ВД атомов Ln
| Ln | КЧ | Число атомов | Nf | Rsd, Å | DA, Å | G3 | d(Ln–Te), Å | ||
|---|---|---|---|---|---|---|---|---|---|
| диапазон | среднее | μ | |||||||
| La3+ | 6 | 5 | 8(4) | 1.985(29) | 0.009(19) | 0.0828(14) | 3.19–3.26 | 3.22(2) | 30 |
| 8 | 6 | 16(0) | 1.955(1) | 0 | 0.0809(0) | 3.33–3.34 | 3.332(4) | 48 | |
| 9 | 17 | 13(0) | 1.918(11) | 0.035(15) | 0.07986(6) | 3.25–3.46 | 3.35(6) | 153 | |
| Ce3+ | 4 | 1 | 14 | 1.927 | 0 | 0.08444 | 2.849 | 2.849 | 4 |
| 6 | 11 | 9(5) | 1.965(22) | 0.010(18) | 0.0826(13) | 3.07–3.35 | 3.19(4) | 66 | |
| 7 | 1 | 13 | 1.937 | 0.082 | 0.08329 | 3.19–3.26 | 3.20(3) | 7 | |
| 8 | 7 | 16(1) | 1.939(6) | 0.024(42) | 0.0812(5) | 3.24–3.72 | 3.30(6) | 56 | |
| 9 | 9 | 13(0) | 1.903(8) | 0.025(12) | 0.07980(5) | 3.22–3.44 | 3.32(6) | 81 | |
| Pr3+ | 6 | 11 | 8(3) | 1.958(14) | 0 | 0.0832(5) | 3.14–3.20 | 3.17(2) | 66 |
| 8 | 6 | 13(3) | 1.919(9) | 0.039(61) | 0.0812(8) | 3.21–3.33 | 3.27(2) | 48 | |
| 8* | 1 | 14 | 1.852 | 0 | 0.07854 | 3.257 | 3.257 | 8 | |
| 9 | 7 | 13(0) | 1.892(8) | 0.020(12) | 0.07982(6) | 3.20–3.43 | 3.30(8) | 63 | |
| Nd3+ | 6 | 14 | 8(3) | 1.951(16) | 0.003(12) | 0.0833(5) | 3.04–3.31 | 3.15(3) | 84 |
| 7 | 3 | 13(0) | 1.909(6) | 0.153(63) | 0.0839(5) | 2.89–3.54 | 3.17(18) | 21 | |
| 8 | 11 | 14(2) | 1.915(12) | 0.049(63) | 0.0813(8) | 3.02–3.72 | 3.27(9) | 88 | |
| 9 | 13 | 13(0) | 1.881(10) | 0.032(32) | 0.0798(1) | 3.12–3.41 | 3.28(8) | 117 | |
| Sm2+ | 6 | 5 | 6(0) | 2.045(2) | 0 | 0.08333(3) | 3.29–3.30 | 3.296(4) | 30 |
| 8* | 1 | 14 | 1.800 | 0 | 0.07854 | 3.166 | 3.166 | 8 | |
| Sm3+ | 6 | 11 | 11(3) | 1.929(24) | 0.019(38) | 0.0830(10) | 3.02–3.28 | 3.13(5) | 66 |
| 7 | 1 | 13 | 1.889 | 0.188 | 0.08419 | 2.87–3.49 | 3.14(23) | 7 | |
| 8 | 2 | 16(0) | 1.921(13) | 0.037(52) | 0.0814(6) | 3.19–3.69 | 3.28(12) | 16 | |
| 9 | 5 | 13(0) | 1.868(8) | 0.020(19) | 0.07979(5) | 3.17–3.38 | 3.26(8) | 45 | |
| Eu2+ | 6 | 6 | 6(0) | 2.045(1) | 0 | 0.08333(3) | 3.29–3.30 | 3.297(2) | 36 |
| 8 | 2 | 17(1) | 2.000(64) | 0 | 0.08393 | 3.30–3.48 | 3.38(8) | 16 | |
| 8* | 2 | 14(0) | 1.845(6) | 0 | 0.07854 | 3.24–3.25 | 3.245(7) | 16 | |
| Gd3+ | 6 | 14 | 10(3) | 1.909(19) | 0.017(31) | 0.0828(9) | 2.96–3.23 | 3.10(4) | 84 |
| 7 | 2 | 13(0) | 1.879(14) | 0.138(81) | 0.0838(8) | 2.81–3.51 | 3.12(17) | 14 | |
| 8 | 5 | 12(3) | 1.882(12) | 0.028(39) | 0.0810(7) | 3.16–3.71 | 3.22(11) | 40 | |
| 9 | 4 | 13(0) | 1.856(12) | 0.025(26) | 0.07982(6) | 3.15–3.36 | 3.24(8) | 36 | |
| Tb3+ | 6 | 18 | 10(3) | 1.892(18) | 0.016(28) | 0.0827(8) | 3.02–3.15 | 3.08(3) | 108 |
| 9 | 2 | 13(0) | 1.849(9) | 0.034(27) | 0.07980(7) | 3.18–3.30 | 3.23(5) | 18 | |
| Dy3+ | 6 | 29 | 11(3) | 1.891(17) | 0.017(22) | 0.0829(7) | 2.93–3.24 | 3.07(4) | 174 |
| 9 | 5 | 13(0) | 1.845(9) | 0.023(23) | 0.07980(6) | 3.13–3.34 | 3.22(8) | 45 | |
| Ho3+ | 6 | 24 | 11(3) | 1.887(14) | 0.019(22) | 0.0831(6) | 2.93–3.16 | 3.05(4) | 144 |
| 9 | 5 | 13(0) | 1.867(39) | 0.021(23) | 0.07980(6) | 3.12–3.45 | 3.26(11) | 45 | |
| Er3+ | 6 | 18 | 10(3) | 1.881(17) | 0.016(23) | 0.0830(7) | 2.96–3.23 | 3.05(4) | 108 |
| 9 | 3 | 13(0) | 1.839(18) | 0.021(9) | 0.07979(7) | 3.09–3.30 | 3.21(7) | 27 | |
| Tm2+ | 6 | 8 | 6(0) | 1.970(3) | 0 | 0.08333(3) | 3.17–3.18 | 3.176(5) | 48 |
| Tm3+ | 6 | 18 | 11(3) | 1.877(13) | 0.021(26) | 0.0832(6) | 2.95–3.16 | 3.04(4) | 108 |
| 9 | 4 | 13(0) | 1.871(52) | 0.021(20) | 0.07980(4) | 3.11–3.46 | 3.27(12) | 36 | |
| Yb2+ | 6 | 7 | 6(0) | 1.973(2) | 0 | 0.08333(3) | 3.18–3.19 | 3.181(3) | 42 |
| Yb3+ | 6 | 2 | 14(5) | 1.973(8) | 0.004(5) | 0.08333(1) | 3.17–3.19 | 3.18 (1) | 12 |
| 9 | 1 | 13 | 1.803 | 0.049 | 0.07982 | 3.09–3.22 | 3.15(5) | 9 | |
| Lu3+ | 6 | 8 | 10(4) | 1.876(33) | 0.015(28) | 0.0832(5) | 2.98–3.15 | 3.03(6) | 48 |
| 9 | 2 | 13(0) | 1.821(22) | 0.039(31) | 0.07983(9) | 3.09–3.26 | 3.18(6) | 18 | |
Примечание. Для каждого типа атомов Ln указаны: КЧ – координационное число по отношению к атомам Te; Nf – среднее число граней полиэдра ВД; DA – смещение ядра атома Ln из геометрического центра тяжести его полиэдра ВД; G3 – безразмерный второй момент инерции полиэдра ВД; d(Ln–Te) – длина связей в координационных полиэдрах LnTen, µ – общее число связей Ln–Te. В скобках даны стандартные отклонения. * Данные для кристаллов LnTe (Ln = Pr, Sm или Eu) со структурой типа CsCl, которые охарактеризованы при высоком (90–110 кбар [8]) давлении.
Как правило, в структурах кристаллов содержатся атомы Ln(III) (исключение – Eu, существующий в теллуридах только в виде Eu(II), и Pm, сведения о соединениях которого отсутствуют). Атомы Ln(II) содержатся только в структурах нескольких представителей упоминавшегося изоструктурного ряда LnTe (при Ln = Sm, Eu, Tm или Yb). Свидетельством может служить рис. 1, на котором показана зависимость среднего радиуса сферического домена Rsd атомов Ln с КЧ 6 в кристаллах LnTe от атомного номера лантанида (пунктирная кривая). Для сравнения сплошной линией на рис. 1 показана аналогичная зависимость для атомов Ln(III) с КЧ 6 в структурах всех остальных комплексов, указанных в табл. 1. Отметим, что Rsd является одномерным аналогом объема полиэдра ВД, поскольку Vvdp = (4πRsd)3/3. Для большинства Ln обе кривые на рис. 1 практически совпадают. Исключением являются только LnTe при Ln = Sm, Eu, Tm или Yb, для которых Rsd скачкообразно увеличивается (на ~0.1Å) по сравнению с кривой для Ln(III). С учетом данных [9] этот факт позволяет считать, что в структурах кристаллов SmTe, EuTe, TmTe и YbTe содержатся атомы Ln(II), а не Ln(III). Заметим, что в комплексах LnOn переход LnIII → LnII сопровождается увеличением Rsd соответственно на ≈0.11, 0.13 и 0.10 Å для Sm, Eu и Yb [9].
Рис. 1.
Зависимости Rsd атомов Ln от их атомного номера Z (Z = 57 и 71 для La Lu соответственно); а – структуры кристаллов LnTe с КЧ 6 при атмосферном давлении (пунктир, черные маркеры), б – структуры всех теллуридов, содержащих атомы Ln(III) c КЧ 6 (сплошная линия, светлые маркеры). Данные для кривой б не учитывают характеристики атомов Ln в структурах LnTe, использованные при построении кривой а.
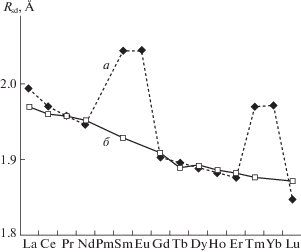
Согласно [9], в соединениях, содержащих комплексы LnOn, с ростом Z величина Rsd для атомов Ln закономерно уменьшается, наглядно демонстрируя известный эффект лантанидного сжатия. Такой же эффект, как показывает сплошная кривая для Ln(III) на рис. 1, наблюдается и в теллуридах. Однако в случае комплексов LnTe6 имеется одна особенность, связанная с Yb. Как видно из табл. 2, для атомов Yb(II) и Yb(III) с КЧ 6 в теллуридах величины Rsd совпадают. Именно поэтому для упрощения рис. 1 точка, отвечающая Yb(III), не указана. Зависимость Rsd от Z для атомов Ln(III) с КЧ 6 и 9, учитывающая все имеющиеся данные, представлена на рис. 2. На кривой для КЧ 6 точка с аномально большим Rsd для Yb(III) характеризует два кристаллографически разных атома в единственной структуре Yb2Te3 {653188} [17]. В той же работе [17] описана и структура YbTe2 {653189}; это – единственный источник информации об атоме Yb(III) c КЧ 9, который имеет аномально низкую величину Rsd (соответствующая точка почти соприкасается с горизонтальной осью на рис. 2). Заметим, что как Yb2Te3, так и YbTe2 имеют по несколько изоструктурных аналогов с иными Ln (соответственно все комплексы 5 и 10 в табл. 1), данные для которых согласуются с результатами независимых работ и, в отличие от результатов для Yb, хорошо ложатся на единые для всех Ln кривые, показанные на рис. 2. Поэтому аномальные кристаллоструктурные характеристики для Yb2Te3 и YbTe2, которым соответствуют скачкообразные изменения Rsd атомов Yb(III) на рис. 2, требуют дополнительной проверки.
Рис. 2.
Зависимости Rsd атомов Ln(III) c КЧ 6 (а) и КЧ 9 (б) в теллуридах от атомного номера лантанида. Тонкие пунктирные линии связывают атомы Tm и Lu (а) или Dy и Lu (б) в приближении стандартного лантанидного сжатия.

В повторном исследовании структуры кристаллов нуждаются также Ho2Te5 {639768} [18] и Tm2Te5 {653111} [19], характеристики которых обусловливают наличие еще двух аномальных максимумов у кривой для КЧ 9 на рис. 2. Отметим, что эти соединения – члены изоструктурного ряда теллуридов Ln2Te5 (комплексы 14 в табл. 1). Однако, если при переходе от La2Te5 к Dy2Te5 объем элементарной ячейки с ростом Z закономерно уменьшается (от ≈890 до 800 Å3), то при переходе к Ho2Te5 или Tm2Te5 он скачкообразно увеличивается (соответственно до ≈876 или 887 Å3). Вследствие этого увеличения происходит значительный рост Rsd для двух кристаллографически неэквивалентных атомов Ln в Ho2Te5 и Tm2Te5. Если данные для этих двух теллуридов исключить из рассмотрения, то для остающихся атомов Ho и Tm с КЧ 9 значения Rsd попадают на линию, которая на рис. 2 соединяет точки для Dy и Lu на нижней кривой, при этом исчезнут два указанных максимума и почти в 3 раза уменьшатся стандартные отклонения Rsd для атомов Ho и Tm в табл. 2.
Полиэдры ВД 337 атомов Ln в теллуридах в сумме имеют 3742 грани, 2344 из которых соответствует связям Ln-Te (табл. 2). На зависимости телесных углов (Ω), под которыми грани “видны” из ядра атома Ln или Te, от межатомных расстояний Ln–Te (рис. 3), связям Ln–Te соответствуют грани с Ω в области от 7 до 19% полного телесного угла, равного 4π стерадиан. Остальные 1398 граней с Ω < 5% отвечают невалентным взаимодействиям Ln/Z. В роли атомов Z чаще всего выступают атомы Ln или Te (соответственно 841 и 163 грани). Кроме того, 394 грани отвечают невалентным контактам Ln···R, где R – внешнесферные катионы, компенсирующие заряд ацидокомплексов [LnnTem]х– (табл. 1). Безразмерный второй момент инерции (G3), характеризующий степень сферичности полиэдров ВД, для 337 атомов Ln в среднем равен 0.0821(16). Смещение ядер атомов Ln из центра тяжести их полиэдров ВД (DA) составляет 0.021(34)Å и в пределах σ равно нулю. Максимальное значение как G3 (0.0838(5)), так и DA (0.14(6)Å) отвечает атомам Ln c КЧ 7.
ПОЛИЭДРЫ ВД АТОМОВ ТЕЛЛУРА
Проведенный анализ показал, что в согласии с [2–5] в структурах рассмотренных соединений встречаются атомы теллура двух типов. Большинство из них (458 из 576) можно рассматривать как ионы Te2–, а остальные 128 – как ионы Te–. Полиэдры ВД ионов Te2– и Te– в среднем имеют соответственно 15(4) и 13(1) граней. Радиусы (Rsd) соответствующих им сферических доменов равны 2.01(7) и 1.94(5) Å и совпадают в пределах 2σ. Поскольку КЧ ионов Te2– и Te– равно 5(1) и 7(1), то на один ион приходится в среднем соответственно 10 и 6 невалентных взаимодействий Te/Z. Cтепень сферичности полиэдров ВД ионов Te2– и Te– принципиально не различается (G3 = 0.0834(20) и 0.0818(13) соответственно). Смещение ядер атомов теллура из центра тяжести их полиэдров ВД для Te2– и Te– равно соответственно 0.15(14) и 0.12(8) Å и в пределах 2σ равно нулю.
Ионы Te- присутствуют в структурах 70 соединений. В 63 случаях они сосуществуют с ионами Te2–, а в семи теллуридах R[Ln(Te2)2] (комплексы 19, табл. 1) содержатся только ионы Te–. В отличие от ионов Te2–, которые связаны только с атомами Ln и R, ионы Te- обязательно образуют от одной до четырех связей Te–Te и, кроме того, связывают от одного до четырех атомов Ln. За счет связей Te–Te атомы Te– образуют в теллуридах Ln разнообразные по топологии олигомерные (0D), цепочечные (1D) или слоистые (2D) группировки, содержащие только атомы Te–. Детальное рассмотрение особенностей их топологии выходит за рамки данной работы. Отметим только, что наиболее часто в теллуридах встречаются квадратные сетки 44 [20] (в структурах LnTe2, Ln2Te5 и LnTe3) или фрагменты таких сеток (структуры комплексов [Ln10Te19] и [Ln3Te8]–).
Принципиальное различие кристаллохимической роли ионов Te2– и Te– четко проявляется на распределениях (Ω, d) для граней полиэдров ВД, которые соответствуют взаимодействиям между атомами теллура (рис. 4). С позиций СМСК в полиэдрах ВД ионов Te2– (рис. 4а) все 3720 граней Te/Te отвечают только внутримолекулярным невалентным взаимодействиям, поскольку во всех случаях ранг граней (РГ) больше 1 (равен 2 или 4 соответственно для 3682 и 38 граней). Отметим, что значения РГ указывают минимальное число химических связей, соединяющих атомы Te, полиэдры ВД которых имеют общую грань. Для всех граней Te2–/Te2– максимальное Ω(Te–Te) < 9%, расстояния d(Te–Te) лежат в диапазоне 3.52–6.65 Å, а среднее межатомное расстояние (4.3(4) Å) превышает удвоенный ван-дер-ваальсов радиус (≈4.1 Å) теллура.
Рис. 4.
Зависимости телесных углов Ω (в % от 4π ср.) граней полиэдров ВД атомов Te от межатомных расстояний d(Te–Te), соответствующих этим граням; а – 3720 граней Te–Te в 458 полиэдрах ВД ионов Te2–, б – 1284 грани Te–Te в 128 полиэдрах ВД ионов Te–.

У полиэдров ВД 128 ионов Te– имеется 1284 грани Te/Te (рис. 4б), ранг которых изменяется от 0 до 4. Как и в случае ионов Te2–, наиболее многочисленны грани c РГ > 1, которые в рамках СМСК характеризуют внутримолекулярные невалентные взаимодействия между ионами Te–. Для 549 таких граней (включая 544, 4 и 1 грань соответственно с РГ = 2, 3 и 4) значения Ω(Te–Te) < < 11.1%, d(Te–Te) лежат в диапазоне 3.33–6.09 Å (в среднем 4.2(4) Å). Межмолекулярным невалентным взаимодействиям Te–/Te– отвечают грани с РГ = 0. Для 272 таких граней максимальное значение Ω(Te–Te) < 5%, d(Te–Te) лежат в диапазоне 4.08–4.32 Å (в среднем 4.21(5) Å). Ранг остальных 463 граней равен 1 и, согласно СМСК, все они соответствуют химическим связям Te––Te–. Для “связевых” граней полиэдров ВД: Ω(Te–Te) > 11.5%, d(Te–Te) лежат в диапазоне 2.78–3.29 Å (среднее 3.09(8) Å).
Отметим, что для 788 граней с d(Te––Te–) < 4.1 Å (рис. 4б), 463 из которых соответствуют химическим связям, а остальные – специфическим или ван-дер-ваальсовым взаимодействиям, с достоверностью аппроксимации R2 = 0.968 выполняется линейная зависимость
(1)
$\Omega ({\text{T}}{{{\text{e}}}^{ - }}{\kern 1pt} - {\kern 1pt} {\text{T}}{{{\text{e}}}^{ - }}) = {\text{5}}0.{\text{2}}({\text{3}}) - {\text{11}}.{\text{66}}({\text{8}})d({\text{T}}{{{\text{e}}}^{ - }}{\kern 1pt} - {\kern 1pt} {\text{T}}{{{\text{e}}}^{ - }}).$В соответствии с (1), телесные углы граней полиэдров ВД, которые отвечают связям Te––Te–, закономерно уменьшаются по мере увеличения межатомного расстояния d(Te––Te–). Грани с максимальной величиной Ω (19.6–20.2%) на рис. 4б соответствуют комплексам [Ln(Te2)2]– (19 в табл. 1). Грани с Ω в диапазоне 16.2–18.4% отвечают связям Te––Te– в комплексах [Ln3Te8]–, а с Ω ≈15.0–11.6% – в структурах [Ln10Te19], [LnTe2], [Ln2Te5] и [LnTe3].
Как показано выше, в пределах 2σ величины Rsd ионов Te2– и Te– совпадают. Учитывая известное правило “октета”, с позиций СМСК можно считать, что примерное постоянство Rsd (или Vvdp) атомов теллура обусловлено тем, что во всех случаях они реализуют однотипную устойчивую восьмиэлектронную валентную оболочку. Принципиальное различие ионов Te2– и Te– состоит в том, что ионы Te2– образуют такую оболочку за счет совокупности только гетероатомных химических связей Te–Ln и Te–R, тогда как ионы Te–, кроме связей Te–Ln, образуют и гомоатомные ковалентные связи Te–Te. Отметим, что Rsd (или Vvdp) ионов Te– понижено по сравнению c Te2– именно из-за того, что связи Te–Te, как правило, короче связей Te–Ln. Судя по имеющимся данным, гомоатомные связи Te–Te возникают только при дефиците электронодонорных атомов Ln и R в составе веществ. Свидетельством может служить тот факт, что связи Te–Te (а как следствие, и ионы Te–) имеются в структурах комплексов [Ln(Te2)2]–, но отсутствуют в аналогичных по составу [LnTe4]5–. Такая же ситуация наблюдается и для трех других обнаруженных пар комплексов ([LnTe2] и [LnTe2]–, [Ln2Te5] и [Ln2Te5]4–, [LnTe3] и [LnTe3]3–, табл. 1), имеющих одинаковый состав, но разный заряд. Во всех случаях первый комплекс обязательно содержит ионы Te– и Te2–, а второй – только Te2–.
КРАТНОСТЬ СВЯЗЕЙ Te–Te В ТЕЛЛУРИДАХ Ln
С позиций СМСК, существование линейной зависимости (1) свидетельствует о возможности количественной оценки кратности (ki) связей Te–Te на основании расстояния между атомами теллура. В качестве характеристики связи с ki = 1 примем среднее значение d(Te––Te–) = 2.782(2) Å для трех кристаллографически разных анионов ${\text{Te}}_{2}^{{2 - }}$ в кристаллах Rb2Te2 {73179} [21] и Cs2Te2 {83351} [22]. Как известно, в рамках метода пересекающихся сфер [13] максимальная теоретически возможная длина связи Te––Te– равна сумме rs(Te) + Rsd(Te–), где rs(Te) – слейтеровский радиус атома Te, а Rsd(Te–) – радиус сферического домена атома Tе–. Поскольку rs(Te) = 1.4 Å [23], а установленное среднее Rsd(Te–) ≈ 1.94 Å, то связи с ki = 0 соответствует d(Te–Te) ≈ 3.34 Å. Постулируя, что кратность связи Te–Te линейно уменьшается при увеличении ее длины, получим, что в общем случае
(2)
${{k}_{i}}({\text{Te}}{\kern 1pt} - {\kern 1pt} {\text{Te}}) = {\text{6}}.0 - {\text{1}}.{\text{8}}d({\text{Te}}{\kern 1pt} - {\kern 1pt} {\text{Te}}).$Рассмотрим несколько примеров, свидетельствующих о пригодности уравнения (2) для оценки кратности связей Te–Te. Так, по данным нейтронографического исследования в структуре кристаллов элементарного теллура {96502} [24] расстояние между соседними атомами в спиральных цепочках –Te–Te–Te– равно 2.789 Å. Согласно (2), для каждой связи Te–Te значение k = = 0.98 ≈ 1, что приемлемо согласуется с классическими представлениями [23]. Учитывая, что среднее d(Te–Te) в семи комплексах [Ln(Te2)2]– (табл. 1), содержащих гантелеподобные анионы (Te2)2–, равно 2.779(3) Å, как и следовало ожидать, в соответствии с (2), получим, что в таких дианионах k = 1.00.
Более сложная ситуация наблюдается в LnTe2, Ln2Te5 и LnTe3, которую подробнее рассмотрим на примере теллуридов Gd. В тетрагональной структуре GdTe2 {636465} [25] и в квазитетрагональных (в обоих случаях параметры a и c ромбических ячеек совпадают) кристаллах Gd2Te5 {636468} [26] и GdTe3 {636467} [26] содержатся однотипные квадратные сетки 44 из атомов Te. В таких сетках каждый атом Te образует по четыре равноценных связи с d(Te–Te) 3.053 (GdTe2), 3.066 (Gd2Te5) и 3.059 Å (GdTe3). Согласно (2), кратность указанных связей равна соответственно 0.50, 0.48 и 0.49. Существенно, что общая кратность связей Te–Te, образованных одним атомом Те (2.02, 1.92 и 1.98 в GdTe2, Gd2Te5 и GdTe3), как и в случае элементарного теллура, близка к 2.
Отметим, что обнаруженное более полувека назад существование идеальных квадратных сеток 44 в кристаллах LnTen при n = 2, 2.5 или 3, вошло в противоречие как с теоретическими представлениями [27], так и с данными ряда электронно-дифракционных и рентгенографических исследований полителлуридов Ln, которые были получены в последние десятилетия [4, 5, 28, 29]. Так, авторы [4] установили существование (3 + + 1)D модулированных сверхструктур в сетках 44 из атомов Te в кристаллах CeTe3, PrTe3 и NdTe3, обусловленных наличием волн зарядовой плотности. На основе результатов суперпространственного кристаллоструктурного анализа они выяснили, что в сетках чередуются короткие и длинные связи Te–Te. Учет наиболее коротких связей позволяет рассматривать “сетки 44” как совокупности олигомеров (V-образных “тримеров”, N-образных “тетрамеров” и одиночных атомов Te). В модулированных сетках расстояния Te–Te изменяются в диапазонах (соответственно для теллуридов Ce, Pr и Nd) 2.9564–3.2407, 2.956–3.144 и 2.9454–3.2104 Å [4]. Согласно (2), значения кратности указанных связей лежат в диапазоне от 0.70 до 0.17. Если считать, что каждый атом Te образует по две самых коротких и самых длинных связи, то суммарная кратность четырех таких связей в трителлуридах Ce, Pr и Nd составит соответственно 1.69, 2.04 и 1.84, т.е. как и в случае идеальных квадратных сеток, окажется близка к 2.
Похожая картина наблюдается и в структуре Sm2Te5 [5], особенностью которой является наличие двух независимых разнонаправленных волн зарядовой плотности, обусловливающих появление модулированных несоразмерных сверхструктур в обеих кристаллографически разных сетках 44. Из-за наличия упорядоченных вакансий в сетках этот теллурид имеет состав Sm2Te4.9. По данным суперпространственного (3 + 2)D кристаллоструктурного анализа, выполненного при 100 и 500 К [5], модулированные сетки из атомов Те характеризуются богатым разнообразием чередующихся олигомеров [Te]n (n изменяется от 1 до 8), форма, размеры и последовательность которых зависят как от выбранного авторами предельного значения d(Te–Te), так и от температуры и направления вектора модуляции q. Несмотря на указанные особенности, средняя длина связей Te–Te в обеих модулированных сетках в пределах σ(d) cовпадает (при 100 К – 3.089 и 3.083 Å, а при 500 К – 3.095 и 3.085 Å [5]). Согласно (2), общая кратность четырех таких связей равна соответственно 1.78 и 1.75 при 100 и 500 К.
Поскольку суммарная кратность связей Te–Te у атомов Te в квазиквадратных сетках (в том числе и модулированных) в кристаллах LnTe2, Ln2Te5 и LnTe3, как и в элементарном теллуре близка к 2, с кристаллохимической точки зрения, такие сетки можно считать электронейтральными. Поэтому, учитывая, что структурно родственные LnTe2, Ln2Te5 и LnTe3 обладают металлической проводимостью [4, 5, 30], следуя Уэллсу [6], эти полителлуриды можно упрощенно охарактеризовать единой формулой (LnIIITe)+(Ten)(1–Δ)–(Δē), где соответственно n = 1, 1.5 или 2, а параметр Δ (0 ≤ Δ ≤ 1) учитывает возможность локализации электронной плотности в сетках из атомов теллура. Например, в предельном случае при n = 1 и Δ = 1 для LnTe2 получим (LnIIITe)+(Te)(ē), а при n = 1 и Δ = = 0 – (LnIIITe)+(Te)–.
ЗАКЛЮЧЕНИЕ
В процессе подготовки данной работы для сравнения нами был проведен анализ характеристик полиэдров ВД атомов в теллуридах таллия. Выяснилось, что в кристаллах охарактеризованных к настоящему времени соединений таллия [10] содержится более 40 атомов Tе*, которые по склонности к образованию ковалентных связей Te–Te аналогичны атомам Te– в рассмотренных соединениях Ln. Отметим, что для полиэдров ВД атомов Tе* величина Rsd (1.94(2) Å) совпала с установленной для Te– (1.94(5) Å) , а коэффициенты зависимости Ω = f[d(Te*–Te*)] в пределах стандартных отклонений совпали с найденными для уравнения (1). Поскольку установленная зависимость кратности связи Te–Te от ее длины в конечном итоге опирается на (1), указанные факты дают основание предполагать, что уравнение (2) может быть использовано для оценки кратности ковалентных связей Te–Te в структурах кристаллов любых теллурсодержащих соединений.
Список литературы
Pell M.A., Ibers J.A. // Chem. Mater. 1996. V. 8. № 7. P. 1386. DOI: 10.1021/cm9505761
Böttcher P., Doert Th., Arnold H., Tamazyan R. // Z. Kristallogr. 2000. V. 215. № 4. P. 246. DOI: https://doi.org/.10.1524/zkri.2000.215.4.246
Yin W., Wang W., Bai L. et al. // Inorg. Chem. 2012. V. 51. P. 117. doi: dx.doi.org/10.1021/ic301655e
Malliakas C., Billinge S.J.L., Kim H.J., Kanatzidis M.G. // J. Am. Chem. Soc. 2005. V. 127. № 18. P. 651. doi: 10.1021/ja0505292
Malliakas C.D., Iavarone M., Fedor J., Kanatzidis M.G. // J. Am. Chem. Soc. 2008. V. 130. № 11. P. 3310. doi: 10.1021/ja7111405
Уэллс А. Структурная неорганическая химия. В 3-х т. Т. 3. М.: Мир. 1988. С. 407.
Singh A.K., Jayaraman A., Chatterjee A. // Solid State. Commun. 1971. V. 9. № 17. P.1459. https:// doi.org/.10.1016/0038-1098(71)90156-6
Chatterjee A., Singh A.K. // Physical Rewiev. B. 1972. V. 6. № 6. P. 228. DOI:https://doi.org/ doi 10.1103/PhysRevB.6.2285
Vologzhanina A.V., Pushkin D.V., Serezhkin V.N. // Acta Cryst. 2006. V. B62. N 5. P. 754. doi: 10.1107/S0108768106018726
Inorganic Crystal Structure database. Gmelin-institut fur Anoranische Chemie & FIC Karlsruhe. 2017.
Cambridge Structural Database System. Cambridge Crystallographic Data Centre. 2017.
Современная кристаллография (в четырех томах). Том 1. Симметрия кристаллов. Методы структурной кристаллографии / Под ред. Б.К. Вайнштейна. М.: Наука, 1979. 384 с.
Cережкин В.Н., Михайлов Ю.Н., Буслаев Ю.А. // Журн. неорган. химии. 1997. Т. 42. № 12. С. 2036.
Serezhkin V.N. // Structural Chemistry of Inorganic Actinide Compounds / Ed. by S.V. Krivovichev, P.C. Burns, I.G. Tananaev. Amsterdam: Elsevier, 2007. P. 31–65.
Сережкин В.Н., Медведков Я.А., Сережкина Л.Б. Пушкин Д.В. // Журн. физ. химии. 2015. Т. 89. № 6. С. 978. DOI: 10.7868/S0044453715060254
Duczmal M., Pawlak L. // J. Magnetism and Magnetic Materials. 1988. V. 76–77. № 1. P. 195. https://doi.org/10.1016/0304-8853(88)90365-4
Словянских В.К., Кузнецов Н.Т., Грачева Н.В. // Журн. неорган. химии. 1985. Т. 30. № 7. С. 1895.
Ярембаш Е.И., Вигилева Е.С., Елисеев А.А и др. // Неорган. материалы. 1974. Т. 10. № 8 . С. 1212.
Елисеев А.А., Зинченко К.А., Землянухина В.М. // Журн. неорган. химии. 1976. V. 21. № 10 P. 1431.
Пирсон У. Кристаллохимия и физика металлов и сплавов. Часть 1. М.: Мир, 1977. 429 с.
Boettcher P., Getzschmann J., Keller R. // Z. Anorg. Allg. Chem. 1993. V. 619. № 3. P. 476. doi.org/10.1002/zaac.19936190309
Getzschmann J., Boettcher P., Kaluza W. // Z. Kristallogr. 1996. V. 211. № 2. P. 90. doi.org/ 10.1524/zkri.1996.211.2.90
Современная кристаллография (в четырех томах). Т. 2. Структура кристаллов / Под ред. Б.К. Вайнштейна, В.М. Фридкина, В.Л. Инденбома. М.: Наука, 1979. С. 83.
Bouad N., Chapon L., Marin-Ayral R.M. et al. // J. Solid State Chem. 2003. V. 173. № 1. P. 189. doi: 10.1016/S0022–4596(03)00017-3
Niihara K., Shishido T., Yajima S. // Bull. Chem. Soc. Japan. 1972. V. 45. № 4. P. 1239. https://doi.org/10.1246/bcsj.45.1239
Pardo M.P., Flahaut J. // Bull. Soc. Chim. 1967. V. 10. P. 3658.
Tremel W., Hoffmann R. // J. Am. Chem. Soc. 1987. V. 109. № 1. P. 124. DOI: 10.1021/ja00235a021
DiMasi E., Aronson M.C., Mansfield J.F. et al. // Phys. Rev. B. 1995. V. 52. № 20. 14516. doi:https:// doi.org/.10.1103/PhysRevB.52.14516
Ijjaali I., Ibers J.A. // J. Solid State Chem. 2006. V. 179. № 11. P. 3456. doi: 10.1016/j.jssc.2006.07.010
Stöwe K. // Ibid. 2000. V. 149. № 1. P. 155. https://doi.org/.10.1006/jssc.1999.8514
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии



