Журнал физической химии, 2019, T. 93, № 2, стр. 253-257
О допировании аэрогеля оксида графена азотом в ходе восстановления парами гидразина и низкотемпературного отжига на воздухе
Ю. М. Шульга a, b, *, Е. Н. Кабачков a, c, **, С. А. Баскаков a, Ю. В. Баскакова a
a Российская академия наук, Институт проблем химической физики
Московская обл., г. Черноголовка, Россия
b Национальный исследовательский технологический университет “МИСиС”
Москва, Россия
c Российская академия наук, Научный центр в Черноголовке, Московская обл.
г. Черноголовка, Россия
* E-mail: yshulga@icp.ac.ru
** E-mail: 9610151344@mail.ru
Поступила в редакцию 22.03.2018
Аннотация
Методами элементного анализа и рентгеновской фотоэлектронной спектроскопии в аэрогеле оксида графена, который отжигали на воздухе, зафиксировали присутствие азота. Установлено, что азот в заметных количествах появляется в образцах при температуре отжига 125°С. Концентрация азота в аэрогеле достигает максимума (0.17 мас. %) при температуре отжига 225°С. В случае восстановления аэрогеля в парах гидразина концентрация азота в нем достигает 3 мас. %. Для восстановленного гидразином аэрогеля спектр N1s аппроксимируется тремя пиками (399.5, 401.3 и 403.6 эВ). В аэрогеле, отожженном на воздухе, азот присутствует только в двух состояниях, которые соответствуют фотоэлектронным пикам N1s с энергиями связей 399.7 и 401.2 эВ.
Известно, что восстановление оксида графена аммиаком или гидразином приводит к тому, что на поверхности нанолистов из атомов углерода появляются азотсодержащие функциональные группы и/или атомы азота, встроенные в углеродную решетку [1–6]. Модифицирование азотом восстановленного оксида графена имеет положительный аспект, поскольку такие образцы в принципе можно использовать в качестве катализаторов реакции восстановления кислорода [7–10] или носителя для металлсодержащих катализаторов. В последнем случае координация металлической частицы с атомом азота подложки будет препятствовать агрегации металлических частиц в ходе катализа (смотри, например, работу [11] и ссылки к ней).
В нашей работе [12] установлено, что гранулированный аэрогель оксида графена в результате отжига на воздухе при умеренных температурах (до 300°С) восстанавливается (карбонизируется) с потерей веса (до 40%), но с сохранением как внешней формы, так и внутренней пористой структуры. Как следствие карбонизации цвет аэрогеля меняется с коричневого до черного. При температуре отжига 175°С и выше аэрогель теряет способность впитывать большие объемы воды. Контактный угол смачивания для капли воды на поверхности аэрогеля растет с увеличением температуры отжига То, при 175°С ≤ То ≤ 300°С.
Удивительным образом оказалось, что после отжига на воздухе в некоторых образцах методом элементного анализа обнаруживается азот. В настоящей работе мы поставили своей целью рассмотреть закономерности допирования аэрогеля оксида графена азотом в ходе его отжига на воздухе и изучить состояние атомов азота в допированных образцах методом рентгеновской фотоэлектронной спектроскопии. Для сравнения исследовали также аэрогель оксида графена, который был восстановлен парами гидразина и в котором заведомо, как известно из литературы, присутствуют азотсодержащие функциональные группы.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез ОГ. Оксид графита был получен модифицированным методом Хаммерса [13]. Суспензия оксида графена была получена путем микромеханической эксфолиации оксида графита в ультразвуковом поле в воде.
Получение аэрогеля оксида графена (АОГ). Методика получения гранулированного АОГ состояла в следующем: гелеобразную суспензию оксида графена с концентрацией 15 мг/мл медленно прикапывали с помощью шприца-дозатора в стеклянный сосуд Дьюара, заполненный жидким азотом. После замерзания, капли в виде гранул опускаются на дно сосуда. Замороженные гранулы сушили при температуре жидкого азота в течение 3-х суток на установке Martin Christ ALPHA 1–2 LD plus Laboratory Freeze-Dryer. Удельная масса сухих гранул составляла 20 мг/см3.
Отжиг. Отжиг гранул аэрогеля проводили в печи СШ-80-01 СПУ на воздухе при температурах в диапазоне 25–300°С с шагом 25 градусов. Время отжига составляло 2 часа.
Восстановление. Восстановление гранул проводили в парах гидразина. Для этого на дно герметично закрывающейся емкости из полипропилена объемом 1 л помещали две чашки Петри. В первую чашку помещали навеску АОГ (0.5 г), а во вторую наливали гидразин гидрат (1 мл). Емкость закрывали и помещали в сушильный шкаф на 24 ч при температуре 60°С. При восстановлении гранулы меняют цвет с серо-коричневого на черный. Через сутки гранулы изымали из емкости и сушили на воздухе 3–4 ч при 60–70°С.
Экспериментальное оборудование. Элементный анализ образцов проводили на CHNS/O анализаторе “Vario Micro cube” Elementar GmbH. Спектры РФЭС получены, используя электронный спектрометр Specs PHOIBOS 150 MCD, рентгеновская трубка с магниевым анодом (hν = 1253.6 эВ). При съемке спектров вакуум в камере спектрометра не превышал 3 × 10–10 torr. Спектры регистрировались в режиме постоянной энергии пропускания (40 эВ для обзорного спектра и 10 эВ для отдельных линий). Обзорный спектр записывался с шагом 1 эВ, спектры отдельных линий – с шагом 0.03 эВ.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Прежде всего обсудим результаты, полученные при исследовании образца АОГ, восстановленного гидразином. Данные об элементном составе этого образца до и после восстановления представлены в табл. 1. Видно, что восстановление АОГ гидразином сопровождается увеличением содержания углерода и уменьшением содержания кислорода. В восстановленном образце также появляется азот, концентрация которого достаточно высокая – около 3 мас. %.
Таблица 1.
Элементный состав аэрогеля оксида графена до и после восстановления гидразином
| Образец | [С], мас. % | [Н], мас. % | [N], мас. % | [S], мас. % | [О]*, мас. % |
|---|---|---|---|---|---|
| Исходный | 47.53 | 3.101 | 0.00 | 1.156 | 48.21 |
| Восстановленный | 63.10 | 2.243 | 2.96 | 1.538 | 30.16 |
Обзорный РФЭС спектр восстановленного образца можно видеть на рис. 1. Помимо интенсивных пиков, обусловленных атомами углерода и кислорода, в спектре присутствуют малоинтенсивные пики азота и серы. Состав образца в зоне анализа методом РФС, рассчитанный из интегральных интенсивностей аналитических линий с учетом сечений ионизации, соответствует брутто формуле С0.80O0.16N0.03S0.01. Достаточно хорошее соответствие данных о составе образца, полученных поверхностно-чувствительным методом РФС и объемным методом элементного анализа, указывают близкое к гомогенному распределение элементов в образце.
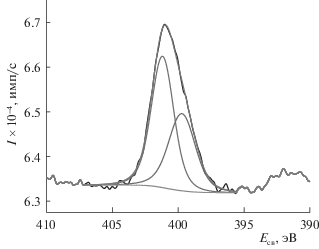
Сразу возникает вопрос, в каком состоянии азот присутствует в аэрогеле. На рентгеновском фотоэлектронном спектре линия N1s (рис. 2) аппроксимируется тремя пиками с энергиями связей (Есв) 399.5, 401.3 и 403.6 эВ. Согласно имеющимся в литературе данным [2, 4, 6] пики с Есв = = 399.5 и 401.3 эВ обусловлены азотом пиридиновых и пиррольных групп, соответственно. Третий пик многие авторы (см., например, [4, 6, 14–18]) относят к азоту в графеновом слое.
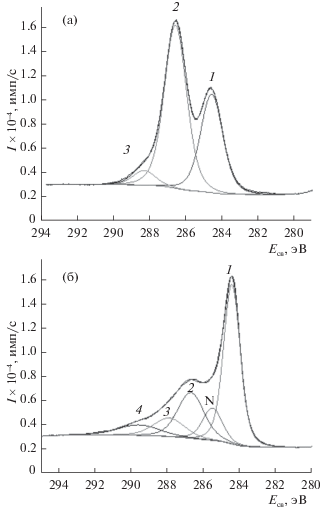
Рентгеновские фотоэлектронные спектры C1s оксида графена (рис. 3) хорошо известны [19–23]. Он состоит из трех четко выраженных пиков. Пик 1 (284.6 эВ) обусловлен атомами углерода, в ближайшем окружении которого находятся только атомы углерода (С–С). Это пик графеновых кластеров, которые присутствуют в оксиде графена. Пик 2 (286.6 эВ), приписывают атомам углерода, имеющим одну одинарную связь с атомом кислорода, т.е. гидроксильным и эпоксидным функциональными группам на поверхности графенового листа. Пик 3 (288.3 эВ) связывают с атомами углерода, имеющими двойную связь с атомом кислорода (С=О).
После восстановления гидразином форма C1s спектра меняется (рис. 3). Пик 1 (284.5 эВ) становится более узким и несколько сдвигается в сторону более низких энергий связи. Пик 2 (286.7 эВ), наоборот, становится более широким. Между пиком 1 и 2 появляется дополнительный пик N (285.5 эВ), который можно было бы приписать атомам углерода, связанным с атомом азота. Такое отнесение соответствует литературным данным (см., например, [4, 15, 24–26]). Однако, относительная интенсивность этого пика в спектре (IN(отн) = IN/$\sum\nolimits_i^{} {[{{I}_{i}}]} $, где [Ii] – интенсивность i‑пика) заметно превышает содержание азота в образце. Следовательно, вклад в интенсивность этого пика могут давать также атомы углерода, связанные с атомами кислорода, которые по энергии связи оказались близки к энергии связи пика N. Это не удивительно, поскольку расстояние между пиками 1 и 2 в оксиде графена меняется и, видимо, зависит от концентрации кислорода в образце. Пики 3 (287.9 эВ) и 4 (289.5 эВ) по их положению можно отнести к карбонильным и карбоксильным группам.
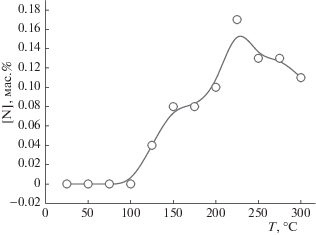
Как уже сообщалось, данные об изменении элементного состава образцов АОГ при их отжиге на воздухе, были описаны и обсуждены с точки зрения карбонизации образца в ходе отжига в работе [12]. Приведем здесь только табличные данные о составе исследованных образцов (табл. 2) и график изменения содержания азота в зависимости от температуры отжига (рис. 4). Как можно видеть из графика, содержание азота достигает максимума при температуре отжига 225°С. Именно этот образец был выбран для исследования методом РФЭС.
Таблица 2.
Элементный состав исследуемых образцов (Т – температура отжига)
| Т, °С | [С], мас. % | [Н], мас. % | [N], мас. % | [S], мас. % |
|---|---|---|---|---|
| 25 | 47.42 | 3.129 | 0.00 | 1.183 |
| 50 | 47.53 | 3.101 | 0.00 | 1.156 |
| 75 | 48.17 | 2.904 | 0.01 | 1.292 |
| 100 | 51.74 | 3.194 | 0.00 | 1.270 |
| 125 | 51.08 | 2.474 | 0.04 | 1.267 |
| 150 | 53.73 | 2.278 | 0.08 | 1.326 |
| 175 | 66.87 | 1.382 | 0.08 | 1.911 |
| 200 | 68.73 | 1.192 | 0.10 | 1.747 |
| 225 | 71.97 | 0.941 | 0.17 | 0.955 |
| 250 | 74.27 | 0.912 | 0.13 | 0.909 |
| 275 | 73.94 | 0.805 | 0.13 | 0.445 |
| 300 | 74.52 | 0.744 | 0.11 | 0.412 |
Рис. 4.
Зависимость содержания азота в АОГ от температуры нагрева в атмосфере воздуха (согласно данным элементного анализа).
Линия N1s (рис. 5) этого образца аппроксимируется двумя пиками с энергиями связей 399.7 и 401.2 эВ. От линии N1s АОС, восстановленного гидразином, линия N1s образца, отожженного на воздухе при 225°С, отличается меньшей интенсивностью и отсутствием третьего пика с Есв = = 403.6 эВ. Соотношением пиков, обусловленных пиридиновыми и пиррольными группами, также изменилось в пользу последних.
Если связывать появление в составе отожженных на воздухе образцов АОГ азотсодержащих функциональных групп с азотом воздуха, то сразу возникает вопрос об активационном центре, поскольку молекулярный азот принято считать инертным газом, который при комнатной температуре реагирует только с металлическим литием. С другой стороны, известно, что биологические объекты могут фиксировать азот при нормальных условиях. В настоящее время полагают, что в ферментативной фиксации молекулярного азота участвуют соединения молибдена и железа (железо-молибденовый кофактор). Понятно, что в нашем случае присутствие молибдена исключено. Но проведенные методом рентгеновской флюоресценции анализы разных образцов АОГ показали присутствие в них небольшого количества марганца (0.01–0.17 мас. %). Причина присутствия марганца в АОГ обусловлена использованием KMnO4 в синтезе оксида графита по методу Наммерса [13]. Другие переходные элементы, если и присутствуют в АОГ, то их содержание меньше порога чувствительности метода РФА. Таким образом, установленное нами образование пиридиновых и пиррольных групп в аэрогелях из оксида графена при отжиге на воздухе является примером небиологической фиксации молекулярного азота из воздуха при умеренных температурах.
Таким образом, в результате проделанной работы было установлено, что гранулированный аэрогель оксида графена можно допировать азотсодержащими функциональными группами в ходе отжига на воздухе при умеренных температурах. Методом элементного анализа показано, что азот в заметных количествах появляется в образцах АОГ при температуре отжига 125°С. Концентрация азота в аэрогеле достигает максимума (0.17 мас. %) при температуре отжига 225°С. В случае восстановления аэрогеля в парах гидразина концентрация азота в нем достигает 3 мас. %. Для восстановленного гидразином аэрогеля спектр N1s аппроксимируется 3-мя пиками (399.5, 401.3 и 403.6 эВ). В АОГ, отожженном на воздухе, азот присутствует только в двух состояниях, которые соответствуют фотоэлектронным пикам N1s с энергиями связей 399.7 и 401.2 эВ.
Работа выполнена при финансовой поддержке Российского фонда фундаментальных исследований (код проекта № 17-43-500093 р_а).
Список литературы
Lee S.H., Kim H.W., Hwang J.O. et al. // Angew. Chem. 2010. V. 122. P. 10282.
Xue Y., Liu J., Chen H. et al. // Angew. Chem. Int. Ed. 2012. V. 51. P. 12124.
Kondo T., Casolo S., Suzuki T. et al. // Phys. Rev. 2012. V. B86. P. 035436.
Wang R., Xu C., Sun J. et al. // ACS Appl. Mater. Interfaces. 2014. V. 6. P. 3427.
Qin Y., Yuan J., Li J. et al. // Adv Mater. 2015. V. 27. P. 5171.
Iamprasertkun P., Krittayavathananon A., Sawangphruk M. et al. // Carbon. 2016. V. 102. P. 455.
Liu R.L., Wu D.Q., Feng X.L. et al. // Angew. Chem. Int. Ed. 2010. V. 49. P. 2565.
Wang S.Y., Yu D.S., Dai L.M. et al. //ACS Nano. 2011. V. 5. P. 6202.
Li Y., Zhao Y., Cheng H. et al. // J. Am. Chem. Soc. 2012. P. 15, 134.
Wang S., Iyyamperumal E., Roy A. et al. // Angew. Chem. Int. Ed. 2011. V. 50. P. 11756.
Wu Z.S., Yang S., Sun Y. et al. // J. Amer. Chem. Soc. 2012. V. 134. V. 9082.
Баскаков С.А., Баскакова Ю.В., Блинова Л.Н. и др. // ХВЭ. 2018. Т. 52. (в печати).
Hummers W.S., Offman R.E. // J. Am. Chem. Soc. 1958. V. 80. P. 1339.
Yang S., Zhi L., Tang K. et al. // Adv. Funct. Mater. 2012. V. 22. P. 3634.
Hu H., Zhao Z., Wan W. et al. // Adv. Mater. 2013. V. 25. P. 2219.
Jeong H.M., Lee J.W., Shin W.H. et al. // Nano Lett. 2011. V. 11. P. 2472.
Sui Z., Wang C., Shu K. et al. // J. Mater. Chem. 2015. V. A3. P. 10403.
Wang H., Wu Z., Meng F. et al. // Chem. Sus. Chem. 2013. V. 6. P. 56.
Yang D., Velamakanni A., Bozoklub G. et al. // Carbon. 2009. V. 47. P. 145.
Stankovich S., Dikin D.A., Piner R.D. et al. // Carbon. 2007. V. 45. P. 1558.
Park S., An J., Potts J.R. et al. // Carbon. 2011. V. 49. P. 3019.
Shulga Y.M., Baskakov S.A., Knerelman E.I. et al. // RSC Adv. 2014. V. 4. P. 587.
Voylov D.N., Agapov A.L., Shulga Y.M. et al. // Carbon. 2014. V. 69. P. 563.
Reddy A.L.M., Srivastava A., Gowda S.R. et al. // ACS Nano. 2010. V. 4. P. 6337.
Wang X., Cao X.Q., Bourgeois L. et al. // Adv. Funct. Mater. 2012. V. 22. P. 2682.
Wohlgemuth S.-A., White R.J., Willinger M.-G. et al. // Green Chem. 2012. V. 14. P. 1515.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии