Журнал физической химии, 2019, T. 93, № 2, стр. 188-194
Термодинамические функции смешения метилметакрилата с органическими растворителями
В. В. Сергеев a, *, С. И. Герасимчук a, Ю. П. Павловский a
a Национальный университет “Львовская политехника”
Львов, Украина
* E-mail: vsergeev14@gmail.com
Поступила в редакцию 15.03.2018
Аннотация
Тензиметрическим методом измерено давление насыщенного пара над растворами метилметакрилата в ацетонитриле, бензоле, гексане, 1,2-дихлорэтане и уксусной кислоте в температурном интервале 295–350 К. По данным температурной зависимости общего давления насыщенного пара рассчитаны: состав равновесных фаз, коэффициенты активности компонентов и термодинамические функции смешения (HE, GE) исследованных растворов.
Метакриловая кислота и ее эфиры являются важными исходными веществами, как для существующих, так и для перспективных технологий производства различных полимеров с широким спектром свойств. Метилметакрилат (ММК) – один из самых широко используемых в химической технологии эфиров метакриловой кислоты. Ацетонитрил, бензол, гексан, 1,2-дихлорэтан и уксусная кислота – растворители, которые часто используют в технологии для проведения полимеризации и других химических процессов.
Поэтому неудивительно, что изучению термодинамических свойств растворов метилметакрилата посвящено большое количество опубликованных статей. Но, несмотря на это большинство опубликованных исследований избыточных свойств его растворов посвящены в основном определению избыточных мольных объемов [1–6], и только две найденные нами публикации [7, 8] посвящены определению избыточных энтальпий смешения метилметакрилата с органическими растворителями. Вместе с тем, публикации, посвященные определению давления насыщенного пара над растворами метилметакрилата в органических растворителях, в доступной нам литературе не были найдены.
Эта статья является продолжением серии наших публикаций [9–15] посвященных определению характеристик молекулярных взаимодействий между растворителями и мономерами акрилового ряда, в частности, определения влияния свойств растворителя на термодинамические параметры растворов.
В данной работе измерено давление насыщенного пара над растворами метилметакрилата в ацетонитриле, бензоле, гексане, 1,2-дихлорэтане и уксусной кислоте в диапазоне температур 295–350 К. По данным температурной зависимости общего давления насыщенного пара согласно рекомендациям [16], рассчитаны парциальные давления компонентов, состав равновесных фаз, коэффициенты активности компонентов и термодинамические функции смешения исследованных растворов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Исходные вещества произведены MERCK (Германия) и дополнительно очищены многократной перегонкой, а бензол и уксусная кислота, кроме того – перекристаллизацией. Чистота веществ определена хроматографически, а также подтверждена по величинам показателей преломления и плотности. Физико-химические характеристики использованных веществ и их чистота приведены в табл. 1.
Таблица 1.
Физико-химические характеристики компонентов (C – содержание основного вещества)
| Вещество | ρ, г/см3 | $n_{{20}}^{D}$ | μ, D | С, мас. % |
|---|---|---|---|---|
| Ацетонитрил | 0.7821 | 1.3445 | 3.94 | 99.8 |
| Бензол | 0.8787 | 1.5011 | 0.0 | 99.9 |
| Гексан | 0.6593 | 1.3751 | 0.0 | 99.9 |
| 1,2-Дихлорэтан | 1.2538 | 1.4445 | 1.27 | 99.9 |
| Уксусная кислота | 1.0493 | 1.3716 | 1.70 | 99.9 |
| Метилметакрилат | 0.9434 | 1.4145 | 2.31 | 99.9 |
Давление насыщенного пара определяли статическим тензиметрическим методом [17, 18]. В экспериментальной установке использован датчик давления Sensor Technics СТЕ8N01 с кремниевой мембраной и чувствительностью 0.3 Па. Экспериментальная установка сконструирована таким образом, что объем паровой фазы не превышал объема жидкой фазы; в этих условиях можно считать, что состав жидкой фазы во время проведения эксперимента изменялся не более чем на 0.2 мол. %, за счет преимущественного испарения более легколетучего компонента. Во время проведения опыта экспериментальную установку погружали в водяной термостат, температуру в котором поддерживали с точностью 0.1 К.
Надежность работы экспериментальной установки проверена в серии опытов по испарению бензола и гексана. Значения давления пара, полученные экспериментально, отличались от литературных данных [19] не более чем на ошибку эксперимента. Концентрацию растворов определяли хроматографически после окончания эксперимента, предварительно охладив экспериментальную установку до комнатной температуры. Для предотвращения возможной полимеризации метилметакрилата в растворы добавляли ингибитор – гидрохинон в количестве не более 0.1 мол. %, что не могло существенно повлиять на результаты измерений.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Температурные зависимости общего давления насыщенного пара над растворами аппроксимировали уравнением Антуана методом наименьших квадратов
Коэффициенты уравнения и значения среднеквадратичного отклонения экспериментальных точек от полученных зависимостей представлены в табл. 2. На температурных зависимостях давления насыщенного пара над растворами разного состава и чистыми веществами делали изотермические сечения с шагом десять градусов. Полученные изотермические концентрационные зависимости давления пара над растворами аппроксимировали степенными полиномами. Степень полиномов выбирали исходя из значения среднеквадратического отклонения между экспериментальными точками и значениями, рассчитанными с помощью полинома.Таблица 2.
Коэффициенты уравнения Антуана температурной зависимости давления насыщенного пара над растворами метилметакрилата
| х, мол. % | А | В | С | Т инт., К | Sn, кПа |
|---|---|---|---|---|---|
| Ацетонитрил–метилметакрилат | |||||
| 0.0 | 10.38355 | 1945.56 | –7.569 | 312–362 | [1] |
| 10.2 | 8.56039 | 994.026 | –87.60 | 295–350 | 0.05 |
| 27.7 | 8.98247 | 1203.46 | –59.12 | 295–350 | 0.05 |
| 48.4 | 8.82193 | 1104.35 | –68.94 | 295–350 | 0.07 |
| 70.0 | 8.97498 | 1176.87 | –59.45 | 295–350 | 0.10 |
| 89.9 | 9.21203 | 1314.42 | –42.40 | 295–350 | 0.12 |
| 100.0 | 9.28443 | 1355.37 | –37.85 | 288–362 | [19] |
| Бензол–метилметакрилат | |||||
| 0.0 | 10.38355 | 1945.56 | –7.569 | 312–362 | [1] |
| 10.7 | 9.10618 | 1262.42 | –61.16 | 293–350 | 0.07 |
| 30.2 | 8.87239 | 1157.21 | –65.88 | 293–350 | 0.05 |
| 46.4 | 8.88793 | 1159.57 | –63.04 | 293–350 | 0.08 |
| 70.1 | 8.67599 | 1044.66 | –73.04 | 293–350 | 0.10 |
| 89.9 | 8.83115 | 1113.66 | –63.38 | 293–350 | 0.16 |
| 100.0 | 9.02384 | 1203.84 | –53.23 | 287–354 | [19] |
| Гексан–метилметакрилат | |||||
| 0.0 | 10.38355 | 1945.56 | –7.569 | 312–362 | [1] |
| 10.9 | 8.27540 | 889.053 | –91.73 | 293–350 | 0.11 |
| 29.9 | 9.23211 | 1385.20 | –25.56 | 293–350 | 0.08 |
| 41.6 | 9.63878 | 1629.83 | 1.632 | 293–350 | 0.11 |
| 58.8 | 8.37339 | 870.57 | –88.07 | 293–350 | 0.10 |
| 88.6 | 9.07140 | 1210.24 | –44.90 | 293–350 | 0.10 |
| 100.0 | 9.00836 | 1171.53 | –48.78 | 286–342 | [19] |
| 1,2–Дихлорэтан–метилметакрилат | |||||
| 0.0 | 10.38355 | 1945.56 | –7.569 | 312–362 | [1] |
| 10.0 | 9.74605 | 1592.96 | –33.20 | 293–350 | 0.13 |
| 29.2 | 9.10841 | 1259.50 | –60.46 | 293–348 | 0.08 |
| 46.6 | 9.51175 | 1489.81 | –33.81 | 288–350 | 0.09 |
| 74.5 | 9.62508 | 1551.90 | –24.24 | 290–350 | 0.10 |
| 94.3 | 9.69741 | 1588.53 | –18.74 | 293–350 | 0.01 |
| 100.0 | 9.59088 | 1521.79 | –24.67 | 242–372 | [19] |
| Метилметакрилат–уксусная кислота | |||||
| 0.0 | 9.68767 | 1642.54 | –39.76 | 290–391 | [1] |
| 8.1 | 9.07956 | 1306.70 | –67.58 | 294–351 | 0.04 |
| 30.5 | 9.07665 | 1289.20 | –65.25 | 293–351 | 0.11 |
| 48.9 | 9.58415 | 1544.30 | –39.99 | 293–351 | 0.13 |
| 65.5 | 9.00270 | 1212.04 | –72.22 | 293–351 | 0.03 |
| 92.2 | 10.13280 | 1818.98 | –16.07 | 294–351 | 0.06 |
| 100.0 | 10.38355 | 1945.56 | –7.569 | 312–362 | [19] |
Последующие расчеты производили, допуская, что паровая фаза близка к идеальной. Используя концентрационную изотермическую зависимость давления пара над растворами рассчитывали значения парциальных давлений компонентов, с помощью преобразованного уравнения Дюгема–Маргулеса [17, 18]. Полученные значения парциальных давлений компонентов позволили рассчитать состав равновесных фаз и значения коэффициентов активности компонентов в температурном интервале 300–340 К. Зависимости коэффициентов активности компонентов от состава раствора для граничных значений температурного интервала приведены в табл. 3.
Таблица 3.
Состав равновесных фаз и коэффициенты активности растворов метилметакрилата
| x, мол. % | y, мол. % | p, кПа | γ1 | γ2 | x, мол. % | y, мол. % | p, кПа | γ1 | γ2 |
|---|---|---|---|---|---|---|---|---|---|
| Ацетонитрил–метилметакрилат | |||||||||
| 300 К | 340 К | ||||||||
| 0.0 | 0.00 | 5.38 | – | 1.0000 | 0.0 | 0.00 | 33.96 | – | 1.0000 |
| 10.0 | 35.08 | 7.53 | 2.0367 | 1.0090 | 10.0 | 25.7 | 41.53 | 1.7015 | 1.0067 |
| 20.0 | 49.99 | 8.96 | 1.7235 | 1.0392 | 20.0 | 40.27 | 46.93 | 1.5057 | 1.0287 |
| 30.0 | 58.38 | 9.90 | 1.4826 | 1.0927 | 30.0 | 50.03 | 50.88 | 1.3512 | 1.0664 |
| 40.0 | 64.21 | 10.57 | 1.3054 | 1.1701 | 40.0 | 57.52 | 53.88 | 1.2336 | 1.1199 |
| 50.0 | 69.25 | 11.10 | 1.1834 | 1.2674 | 50.0 | 64.08 | 56.28 | 1.1488 | 1.1868 |
| 60.0 | 74.49 | 11.60 | 1.1079 | 1.3727 | 60.0 | 70.51 | 58.33 | 1.0916 | 1.2627 |
| 70.0 | 80.31 | 12.08 | 1.0667 | 1.4713 | 70.0 | 77.15 | 60.13 | 1.0554 | 1.3439 |
| 80.0 | 86.45 | 12.54 | 1.0425 | 1.5766 | 80.0 | 84.03 | 61.60 | 1.0305 | 1.4441 |
| 90.0 | 92.38 | 12.88 | 1.0178 | 1.8220 | 90.0 | 91.13 | 62.60 | 1.0096 | 1.6285 |
| 100.0 | 100.00 | 13.00 | 1.0000 | – | 100.0 | 100.00 | 62.88 | 1.0000 | – |
| Бензол–метилметакрилат | |||||||||
| 300 К | 340 К | ||||||||
| 0.0 | 0.00 | 14.33 | – | 1.0000 | 0.0 | 0.00 | 33.96 | – | 1.0000 |
| 10.0 | 25.83 | 16.76 | 1.1767 | 1.0028 | 10.0 | 18.71 | 37.62 | 1.0527 | 1.0000 |
| 20.0 | 42.42 | 18.87 | 1.1221 | 1.0111 | 20.0 | 33.98 | 41.21 | 1.0463 | 1.0010 |
| 30.0 | 54.5 | 20.81 | 1.0832 | 1.0229 | 30.0 | 46.65 | 44.73 | 1.0390 | 1.0033 |
| 40.0 | 64.06 | 22.63 | 1.057 | 1.0363 | 40.0 | 57.35 | 48.15 | 1.0311 | 1.0074 |
| 50.0 | 72.07 | 24.40 | 1.0403 | 1.0496 | 50.0 | 66.53 | 51.46 | 1.0230 | 1.0139 |
| 60.0 | 79.01 | 26.13 | 1.0301 | 1.0622 | 60.0 | 74.58 | 54.69 | 1.0154 | 1.0231 |
| 70.0 | 85.08 | 27.85 | 1.0230 | 1.0758 | 70.0 | 81.74 | 57.83 | 1.0088 | 1.0355 |
| 80.0 | 90.43 | 29.51 | 1.0162 | 1.0979 | 80.0 | 88.27 | 60.90 | 1.0038 | 1.051 |
| 90.0 | 95.2 | 31.07 | 1.0077 | 1.1546 | 90.0 | 94.32 | 63.93 | 1.0008 | 1.0681 |
| 100.0 | 100.00 | 32.45 | 1.0000 | – | 100.0 | 100.00 | 66.97 | 1.0000 | – |
| Гексан–метилметакрилат | |||||||||
| 300 К | 340 К | ||||||||
| 0.0 | 0.00 | 5.38 | – | 1.0000 | 0.0 | 0.00 | 33.96 | – | 1.0000 |
| 10.0 | 51.45 | 9.95 | 2.3106 | 1.0078 | 10.0 | 36.23 | 48.31 | 1.8136 | 1.0064 |
| 20.0 | 66.41 | 13.15 | 1.9701 | 1.0368 | 20.0 | 52.57 | 59.00 | 1.6059 | 1.0283 |
| 30.0 | 73.47 | 15.33 | 1.6925 | 1.0908 | 30.0 | 62.12 | 67.06 | 1.4375 | 1.0670 |
| 40.0 | 77.63 | 16.81 | 1.4710 | 1.1766 | 40.0 | 68.71 | 73.34 | 1.3040 | 1.1245 |
| 50.0 | 80.59 | 17.87 | 1.2992 | 1.3026 | 50.0 | 73.93 | 78.47 | 1.2011 | 1.2026 |
| 60.0 | 83.19 | 18.73 | 1.1715 | 1.4783 | 60.0 | 78.62 | 82.92 | 1.1246 | 1.3032 |
| 70.0 | 86.02 | 19.54 | 1.0830 | 1.7097 | 70.0 | 83.24 | 86.96 | 1.0704 | 1.4280 |
| 80.0 | 89.60 | 20.38 | 1.0294 | 1.9883 | 80.0 | 88.11 | 90.69 | 1.0338 | 1.5850 |
| 90.0 | 94.33 | 21.27 | 1.0053 | 2.2644 | 90.0 | 93.45 | 94.00 | 1.0103 | 1.8088 |
| 100.0 | 100.00 | 22.12 | 1.0000 | – | 100.0 | 100.00 | 96.69 | 1.0000 | – |
| 1,2-Дихлорэтан–метилметакрилат | |||||||||
| 300 К | 340 К | ||||||||
| 0.0 | 0.00 | 5.38 | – | 1.0000 | 0.0 | 0.00 | 33.96 | – | 1.0000 |
| 10.0 | 18.61 | 5.95 | 0.9561 | 0.9983 | 10.0 | 14.86 | 35.8 | 0.9155 | 0.9975 |
| 20.0 | 34.50 | 6.54 | 0.9747 | 0.9949 | 20.0 | 28.95 | 37.93 | 0.9441 | 0.9921 |
| 30.0 | 47.87 | 7.16 | 0.9866 | 0.9908 | 30.0 | 41.81 | 40.24 | 0.9637 | 0.9853 |
| 40.0 | 59.07 | 7.79 | 0.9934 | 0.9872 | 40.0 | 53.28 | 42.66 | 0.9765 | 0.9784 |
| 50.0 | 68.53 | 8.42 | 0.9965 | 0.9847 | 50.0 | 63.44 | 45.13 | 0.9843 | 0.9720 |
| 60.0 | 76.59 | 9.05 | 0.9973 | 0.9837 | 60.0 | 72.45 | 47.64 | 0.9889 | 0.9664 |
| 70.0 | 83.57 | 9.67 | 0.9971 | 0.9840 | 70.0 | 80.49 | 50.18 | 0.9919 | 0.9609 |
| 80.0 | 89.71 | 10.3 | 0.9971 | 0.9838 | 80.0 | 87.73 | 52.76 | 0.9945 | 0.9530 |
| 90.0 | 95.19 | 10.93 | 0.9981 | 0.9763 | 90.0 | 94.27 | 55.41 | 0.9975 | 0.9354 |
| 100.0 | 100.00 | 11.58 | 1.0000 | – | 100.0 | 100.00 | 58.18 | 1.0000 | – |
| Метилметакрилат–уксусная кислота | |||||||||
| 300 К | 340 К | ||||||||
| 0.0 | 0.00 | 2.38 | – | 1.0000 | 0.0 | 0.00 | 16.48 | – | 1.0000 |
| 10.0 | 27.81 | 2.98 | 1.5381 | 1.0052 | 10.0 | 23.72 | 19.60 | 1.3730 | 1.0040 |
| 20.0 | 43.70 | 3.45 | 1.3996 | 1.0220 | 20.0 | 39.10 | 22.10 | 1.2761 | 1.0170 |
| 30.0 | 54.45 | 3.82 | 1.2908 | 1.0499 | 30.0 | 50.30 | 24.19 | 1.1976 | 1.0387 |
| 40.0 | 62.67 | 4.15 | 1.2077 | 1.0881 | 40.0 | 59.20 | 26.00 | 1.1356 | 1.0687 |
| 50.0 | 69.59 | 4.43 | 1.1458 | 1.1357 | 50.0 | 66.83 | 27.58 | 1.0884 | 1.1064 |
| 60.0 | 75.84 | 4.68 | 1.1006 | 1.1929 | 60.0 | 73.78 | 29.03 | 1.0540 | 1.1505 |
| 70.0 | 81.70 | 4.92 | 1.0667 | 1.2643 | 70.0 | 80.40 | 30.39 | 1.0302 | 1.2000 |
| 80.0 | 87.30 | 5.12 | 1.0388 | 1.3702 | 80.0 | 86.86 | 31.65 | 1.0145 | 1.2562 |
| 90.0 | 92.88 | 5.29 | 1.0135 | 1.5840 | 90.0 | 93.30 | 32.82 | 1.0045 | 1.3290 |
| 100.0 | 100.00 | 5.38 | 1.0000 | – | 100.0 | 100.00 | 33.96 | 1.0000 | – |
По концентрационным зависимостям коэффициентов активности рассчитали термодинамические функции растворов. Энергию Гиббса ΔmixG, избыточные энергию Гиббса GE и энтальпию смешения HE исследованных систем рассчитывали по уравнениям:
Рис. 1.
Концентрационные зависимости термодинамических функций смешения системы ацетонитрил–метилметакрилат при 300 и 340 К.
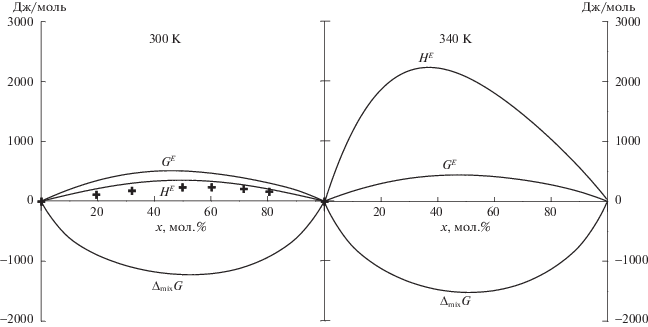
Рис. 2.
Концентрационные зависимости термодинамических функций смешения системы бензол–метилметакрилат при 300 и 340 К.

Рис. 3.
Концентрационные зависимости термодинамических функций смешения системы гексан–метилметакрилат при 300 и 340 К.

Рис. 4.
Концентрационные зависимости термодинамических функций смешения системы 1,2-дихлорэтан–метилметакрилат при 300 и 340 К.

Рис. 5.
Концентрационные зависимости термодинамических функций смешения системы метилметакрилат–уксусная кислота при 300 и 340 К.

Для всех систем энергия Гиббса смешения ΔmixG принимает отрицательные значения во всем исследованном диапазоне температур и концентраций, что характерно при образовании гомогенных, не склонных к расслаиванию растворов.
Растворы метилметакрилата в ацетонитриле, бензоле, гексане и уксусной кислоте характеризуются большими единицы значениями коэффициентов активности компонентов, положительными значениями избыточной энергии Гиббса GE > 0, и соответственно позитивным отклонением от закона Рауля. Система 1,2-дихлорэтан – метилметакрилат характеризуется значениями коэффициентов активности компонентов меньшими единицы, отрицательным значением избыточной энергии Гиббса GE < 0, и соответственно отрицательным отклонением от закона Рауля.
Энтальпии смешения растворов метилметакрилата в ацетонитриле, бензоле, гексане и уксусной кислоте имеют положительные значения во всем исследованном диапазоне концентраций, то есть энергетическая ценность связей между разнородными молекулами в растворе меньше чем у чистых компонентов. Энтальпия смешения системы 1,2-дихлорэтан – метилметакрилат при 300 К отрицательна почти во всем диапазоне концентраций, что свидетельствует об образовании в растворе междумолекулярных связей более сильных, чем в индивидуальных веществах.
По увеличению значения энтальпии смешения растворов метилметакрилата, исследованные растворители можно расположить в следующий ряд:
1,2-дихлорэтан < бензол < уксусная кислота < < ацетонитрил < гексан.
Для неполярных растворителей, таких как бензол и гексан, величина энтальпии смешения преимущественно зависит от дисперсионных взаимодействий между молекулами. Для растворителей полярных, таких как 1,2-дихлорэтан, уксусная кислота и ацетонитрил, величина энтальпии смешения в значительной мере зависит от ориентационных и дипольных взаимодействий, которые определяются величиной дипольного момента молекул растворителей. Для исследованных систем, содержащих полярные растворители, величина энтальпии смешения возрастает с ростом дипольного момента молекул растворителя. Этот факт может быть следствием того, что энергия межмолекулярных взаимодействий между разнородными молекулами в растворе не способна компенсировать энергию разрыва межмолекулярных связей между молекулами растворителя, которая возрастает с увеличением их дипольного момента.
Для всех исследованных систем с повышением температуры избыточная энтальпия увеличивается, что свидетельствует о положительном значении изменения теплоемкости образования этих растворов.
Рассчитанные нами значения теплоты смешения для исследованных растворов удовлетворительно совпадают со значениями, полученными прямым калориметрическим определением теплот смешения указанных растворов [15], которые на графиках обозначены отдельными точками. Это свидетельствует о возможности применения данного метода для расчета термодинамических функций смешения растворов, на основании данных о температурной зависимости общего давления пара над бинарными растворами.
Список литературы
René D Peralta, Ramiro Infante, Gladis Cortez et al. // Thermochimica Acta. V. 390. I. 1–2. 2002. P. 47.
René D. Peralta, Ramiro Infante, Gladis Cortez et al. // Ibid. V. 398. I. 1–2. 2003. P. 39.
René D. Peralta, Ramiro Infante, Gladis Cortez et al. // Ibid. V. 402. I. 1–2. P. 247.
René D. Peralta, Ramiro Infante, Gladis Cortez et al. // Ibid. V. 421. I. 1–2. P. 59.
Jaime Wisniak, René D. Peralta, Ramiro Infante et al. // Ibid. V. 437. I. 1–2. 2005. P. 1.
Jaime Wisniak, Isabel Villarreal, René D. Peralta et al. // The Journal of Chemical Thermodynamics. V. 39. I. 1. 2007. P. 88.
John George, Sastry N.V., Prasad D.H.L. // Fluid Phase Equilibria. V. 214. 2003. P. 39.
John George, Sastry Nandhibatla V., Sunil R. Patel, Mahendra K. Valand // Journal of Chemical & Engineering Data. 2002. V. 47. № 2. P. 262.
Сергеев В.В., Дибривний В.Н., Ван-Чин-Сян Ю.Я. // Журн. прикл. химии. 2011. Т. 84. № 5. С. 869.
Сергеев В.В., Дибривний В.Н., Ван-Чин-Сян Ю.Я. // Журн. общ. химии. 2012. Т. 82. № 2. С. 205.
Сергеев В.В., Ван-Чин-Сян Ю.Я. // Журн. прикл. химии. 2012. Т. 85. № 4. С. 684.
Serheyev V. // Chemistry & Chemical Technology. 2012. V. 6. № 1. P. 15.
Serheyev V. // Ibid. 2015. V. 9. № 1. P. 1.
Сергеев В.В., Ван-Чин-Сян Ю.Я. // Журн. физ. химии. 2015. Т. 89. № 3. С. 409.
Сергеев В.В. // Там же. 2016. Т. 90. № 3. С. 370.
Белоусов В.П., Морачевский А.Г. Теплоты смешения жидкостей. Л.: Химия, 1970. 256 с.
Сергеев В.В., Кос Ю.В., Ван-Чин-Сян Ю.Я. // Журн. физ. химии. 2011. Т. 85. № 2. С. 280.
Serheyev V., Kos Yu., Van-Chin-Sayn Yu. // Chemistry & Chemical Technology. 2011. V. 5. № 2. P. 123.
Boublik T., Fried V., Hala E. The Vapour pressure of pure substances. Amsterdam etc.: Elsevier, 1973. 626 p.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии


