Журнал физической химии, 2019, T. 93, № 2, стр. 195-198
Кинетическая модель ферментативного катализа окислительно-восстановительных реакций
Ю. А. Ершов a, М. А. Хачатурян b, Т. К. Слонская b, *
a Московский государственный технический университет им. Н.Э. Баумана
Москва, Россия
b Первый Московский государственный медицинский университет им. И.М. Сеченова (Сеченовский Университет)
Москва, Россия
* E-mail: tslonskaya@mail.ru
Поступила в редакцию 17.04.2018
Аннотация
По данным спектрофотометрии определены характеристики равновесия мономерной и димерной форм тиазинового красителя метиленового голубого (МГ) в водно-солевых растворах. Установлено, что повышение концентрации соли смещает равновесие в сторону образования димера. На основании исследования реакции восстановления МГ аскорбиновой кислотой в присутствии альбумина в различных ионных средах показано, что действие белка на скорость реакции переноса водорода зависит от ионного состава раствора. Действие альбумина сходно с действием аминосоединений на данную реакцию. Предположено, что стадией процесса восстановления, на которую влияют аминосоединения и белки, является протонирование нейтральной формы красителя.
Перенос водорода в окислительно-восстановительных реакциях клеточного метаболизма идет по схеме [1, 2]
где D – донор водорода Н (редуктант), СоЕ – кофермент, переносчик водорода, А – акцептор водорода (оксидант).Тиазиновые красители, в частности метиленовый голубой (МГ), представляют собой соединения, электронные и структурные характеристики которых близки к характеристикам активных групп флавиновых ферментов. Поэтому эти красители могут служить для моделирования функций активных групп ферментов.
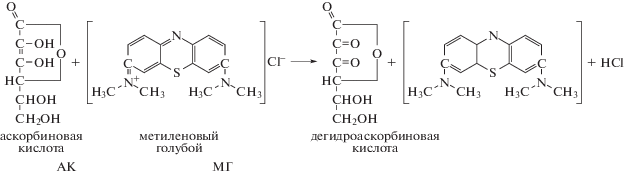
В данной работе перенос водорода моделируется реакцией между аскорбиновой кислотой (редуктант) – АК и красителем – МГ (оксидант): аскорбиновая кислота (АК) + метиленовый голубой (МГ).
Молекулы тиазиновых соединений проявляют склонность к образованию ассоциатов, из которых наиболее изучены димеры. Процесс димеризации определяется различными факторами. В частности, этот процесс зависит от солевого состава среды [3].
В данной работе изучены условия образования димерной формы (ридимера) МГ и сопоставление реакционной способности мономерной и димерной форм МГ в реакции переноса водорода.
В работе [4] показано, что многие амины способны катализировать реакции переноса водорода (рис. 1). В связи с этим можно предположить, что белки – полимеры аминокислот, например альбумин, будут проявлять в реакции переноса водорода аналогичные каталитические свойства. Кинетика восстановления МГ аскорбиновой кислотой была прослежена в данной работе в присутствии альбумина.
Рис. 1.
Перенос водорода в окислительно-восстановительной реакции аскорбиновая кислота (АК) (редуктант – донор) + краситель МГ (оксидант – акцептор).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Исследования процессов в растворах проводили спектрофотометрически на максимуме поглощения красителя λmax = 666 нм. Метиленовый голубой C16H17N3S · HCl · 3Н2О марки “Sigma” очищали перекристаллизацией и сушили при 105°С в течение 30 мин. Соли: хлорид, бромид, иодид, роданид, нитрат и сульфат калия марки “х. ч.” очищали перекристаллизацией. МГ – катионный краситель, поэтому для изучения влияния солей выбраны соли с общим катионом – калием.
По степени уменьшения поглощения анионы солей располагаются в ряд: NO$_{3}^{ - }$ < SO$_{4}^{{2 - }}$ < Cl– < Br–.
Иодид- и роданид-ионы образуют с катионом МГ мало растворимые соли, выпадающие частично в осадок. Влияние концентрации аниона на спектр поглощения красителя было проведено с растворами хлорида калия следующих концентраций: 1.0, 1.5, 2.1 моль/л.
Концентрация красителя составляла 3.76 × × 10–5 моль/л.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Влияние среды на кинетику восстановления красителя
Скорость реакции МГ + АК существенно зависит от pH раствора (рис. 2). Для нейтральной и щелочной областей характерно наличие индукционного периода. Величина индукционного периода достигает 30 мин и максимальна при нейтральных pH.
Рис. 2.
Кинетические кривые восстановления красителя в буферных растворах при различных pH: 1 – 3.3, 2 – 4.71, 3 – 6.01, 4 – 6.96, 5 – 7.96.
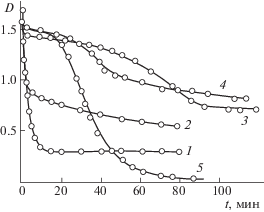
Ход кинетических кривых в реакции восстановления МГ существенно зависит от pH среды и применяемого катализатора (аминосоединения).
В работе [4] показано, что восстановление МГ начинается с образования комплекса между катионом М+ и анионом АК, имеющим характер ионной пары, и в дальнейшем следует по схеме:
где М+ – катион МГ, М0 – незаряженная полувосстановленная форма МГ, МН+ – протонированный катион МГ, МН – восстановленная форма МГ.В слабощелочной среде основным продуктом восстановления красителя является незаряженная полувосстановленная форма М0. Наличие индукционного периода связано с образованием нестойкого соединения МГ, а также гидроксида, присоединяющегося по типу комплексов переноса заряда к диметиламиновой группе красителя. Возникающая конкуренция между анионом аскорбиновой кислоты и гидроксидом обусловливает торможение реакции.
При значениях pH, близких к нейтральным значениям, восстановление МГ практически заканчивается образованием протонированного катиона МН+, весьма устойчивой структуры, которая накапливается в растворе.
Индукционный период, наблюдаемый при этом, соответствует медленной стадии протонирования нейтральной формы М0, а зелено-синяя окраска катиона МН+ обусловливает незначительное понижение оптической плотности раствора. Присоединение еще одного электрона переводит катион-радикал МН+ в незаряженную восстановленную форму МН. В кислой среде эта форма присоединяет протон МН$_{2}^{ + }$ и становится бесцветной.
Для определения влияния на кинетику изучаемой реакции мономерной и димерной форм красителя при различном солевом составе раствора необходимо иметь значение константы димеризации: K = сдимера/$c_{{{\text{м о н о м е р а }}}}^{2}$
Эта величина определяется на основе спектрофотометрических данных по формуле
где ${{D}_{{\mathbf{\lambda }}}}$ – оптическая плотность раствора при λ = = 666 нм; с0, см, сд – концентрации (моль/л) МГ, мономера МГ, димера МГ соответственно; εм; εд – коэффициенты экстинции мономера и димера соответственно.Зная K, εм и εд, находят концентрации мономера и димера МГ для заданного значения с0.
Расчеты по формуле (1) были выполнены для растворов красителя при концентрациях KCl, моль/л: 1; 1,5; 2,1.
Значения K для растворов красителя в хлориде калия приведены в табл. 1.
Таблица 1.
Значения K для растворов красителя в хлориде калия
| CKCl, M | 0.00 | 1.00 | 1.50 | 2.10 |
|---|---|---|---|---|
| K × 10–4, л/моль | 0.47 | 1.01 | 13.0 | 2.85 |
Добавление электролита к раствору метиленового голубого вызывает смещение равновесия в сторону образования димера. Фактором, способствующим образованию димера, следует считать связывание двух катионов красителя общим анионом по схеме:
Аналогичное предположение было сделано в работе, посвященной ридимерному строению азокрасителей [3].
В том случае, когда связывающим анионом является I– или CNS–, димеризация ведет к образованию осадка солеобразного соединения. В отсутствие солей металлов МГ проявляет также тенденцию к полимеризации.
Природа сил, действующих при димеризации, рассмотрена в работе [3].
Реакционная способность мономеров и димеров изучена на реакции восстановления МГ + АК с превращением МГ его в бесцветную лейкоформу. Концентрация растворов АК составляла 6 × × 10–2 моль/л. Концентрацию красителя Ск в ходе реакции определяли спектрофотометрическим методом.
Ниже представлены значения начальной скорости реакции ${{\text{v}}_{{{\text{н а ч }}}}}$ × 107, моль/(л с), полученные на основе кинетических кривых изменения концентрации красителя в растворах различного солевого состава.
Из данных табл. 2 следует, что повышение концентрации KCl приводит к снижению скорости образования лейкоформы красителя. Поскольку и димер, и мономер способны реагировать с аскорбиновой кислотой, то скорость $\text{v}$ образования лейкоформы МГ может быть выражена суммой:
где K1 и K2 — константы скоростей восстановления мономера и димера.Таблица 2.
Значения начальной скорости ${{\text{v}}_{{{\text{н а ч }}}}}$ × 107 моль/(л с) реакции восстановления МГ при заданных концентрациях KCl
| Ск × 105, моль/л | 3.76 | 2.82 | 1.88 | 0.94 |
|---|---|---|---|---|
| 0.0 М KCl | 5.65 | 3.60 | 2.10 | 0.94 |
| 1.0 М KCl | 3.45 | 2.45 | 1.45 | 0.60 |
| 1.5 М KCl | 2.10 | 1.40 | 0.85 | 0.40 |
| 2.1 М KCl | 0.90 | 0.85 | 0.75 | 0.60 |
Равновесие 2М+ ↔ Д2+ устанавливается быстро. Это дает возможность подставить в уравнение (3) вместо Сд произведение С$_{{\text{м }}}^{2}$K, где K – константа димеризации. В результате имеем:
Отсюда: Экспериментальные данные по зависимости концентраций мономера и димера от исходной концентрации С0 красителя при различных концентрациях КСl в пределах погрешности согласуются с модельными расчетами.Влияние альбумина на кинетику восстановления красителя
Введение альбумина в реакционную систему при нейтральных и щелочных pH приводит к росту скорости реакции, сокращению индукционного периода, тем более значительному, чем выше концентрация белка (рис. 3, 4). Длина волны максимума поглощения красителя остается при этом постоянной.
Рис. 3.
Кинетические кривые восстановления МГ в водных растворах альбумина Са = 2% масс при рН: 1 – 3.4, 2 – 4.7, 3 – 6.3, 4 – 7.0, 5 – 7.9; D – оптическая плотность раствора.

Рис. 4.
Кинетические кривые восстановления МГ в водных растворах (рН 7.96) при концентрациях альбумина Са, мас. %: 1 – 0.0, 2 – 1.0, 3 – 2.0; D – оптическая плотность раствора.

Полученные кинетические кривые аналогичны кривым восстановления МГ в присутствии аминов [4, 5]. Отсюда следует, что аминогруппы белка способны катализировать перенос водорода в исследованной области pH.
В результате индукционный период отсутствует.
При восстановлении МГ в кислых средах (рис. 3, кривые 1, 2) альбумин тормозит протекание реакции и тем сильнее, чем выше его концентрация.
При низких pH аминогруппы белка блокированы, и эффект торможения реакции, по-видимому, обусловлен стерическими факторами. Возможно также, что в этом случае перенос водорода осуществляется другим путем, через иные функциональные группы.
Таким образом, рассмотренный выше материал свидетельствует о влиянии равновесия мономерной и димерной форм тиазинового красителя метиленового голубого в водно-солевых растворах и присутствия альбумина на скорость окислительно-восстановительной реакции аскорбиновая кислота + метиленовый голубой. Исследованные процессы могут служить моделями ферментативного катализа окислительно-восстановительных реакций.
Список литературы
Марри Р. Биохимия человека. Т. 1, 2. М.: Мир, 1993. 799 с.
Ершов Ю. Биохимия человека. М.: Юрайт. 2017. 372 с.
Михеев Ю.А., Ершов Ю.А. // Журн. физ. химии. 2018. Т. 92. № 9. С. 672.
Юшина В.В., Фадеев Г.Н., Николаев Л.А. // Докл. АН СССР. 1971. Т. 201. С. 1163.
Денисов Е.Т. Кинетика гомогенных химических реакций. М.: Высш. школа, 1988. 391 с.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии




