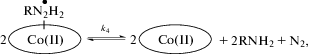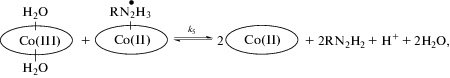Журнал физической химии, 2019, T. 93, № 2, стр. 230-236
Кинетика реакции кобинамида с изониазидом в водных растворах
С. О. Тумаков a, И. А. Деревеньков a, Д. С. Сальников a, *, С. В. Макаров a
a Ивановский государственный химико-технологический университет
Иваново, Россия
* E-mail: densal@isuct.ru
Поступила в редакцию 18.04.2018
Аннотация
Изучена кинетика и механизм реакции диаквакобинамида (Cbi(III)) с изониазидом (гидразидом изоникотиновой кислоты, ГИК). Установлено, что состав продуктов зависит от соотношения концентраций реагентов. Добавление избытка ГИК к кобинамиду приводит к быстрому образованию стабильного комплекса Cbi(III) с двумя молекулами изониазида. Если концентрации изониазида и кобинамида близки или кобинамид находится в избытке, сначала образуется комплекс Cbi(III) с одной молекулой изониазида. Затем происходит быстрый внутрисферный перенос электрона, приводящий к образованию нестабильного комплекса восстановленного Cbi(II) с гидразильным радикалом ((RN2H2)(Cbi(II))), распадающимся с образованием восстановленного кобинамида и продуктов окисления изониазида: изоникотинамида, пиридин-4-карбоксальдегида, изоникотиновой кислоты (ИНК). Сделан вывод, что при десятикратном избытке кобинамида главным продуктом окисления ГИК является ИНК.
Отравление токсичным алкоголем, цианидом, сероводородом, оксидом углерода, а также преднамеренные или непреднамеренные передозировки медицинских препаратов стоят на втором месте по числу случаев вредного воздействия на здоровье человека [1, 2]. Одним из способов противодействия отравлению является применение веществ (антидотов), способных препятствовать или ослаблять действие ядов на организм человека. Выделяют несколько механизмов действия антидотов: 1) взаимодействие с ядами с образованием нетоксичных соединений; 2) усиление выведения ядов из организма; 3) уменьшение скорости превращения яда в более токсичные вещества; 4) конкуренция с ядом за активные центры рецепторов; 5) блокирование активных центров рецепторов усиливающих токсическое влияние яда [1, 3].
Изониазид (рис. 1а) является высокоэффективным антитуберкулезным препаратом [4, 5], включенным в список жизненно необходимых и важнейших лекарственных средств. Одной из клинических проблем связанных с применением ГИК(гидразид изоникотиновой кислоты) является его нейро- и гепатотоксичность [4, 5]. Передозировка изониазида оказывает негативное воздействие на организм человека [6]. Для снижения токсического эффекта в данном случае рекомендуется применять пиридоксаль (витамин B6) [7]. Однако в литературе опубликованы данные, свидетельствующие о недостаточной эффективности его применения при передозировке изониазида [8].
Кобинамид (рис. 1б) является предшественником витамина B12 (кобаламина, Cbl) при его биосинтезе [9]. Отличием кобинамида от витамина B12 является отсутствие в его структуре рибонуклеотидного фрагмента. Установлено, что диаквакобинамид является более эффективным антидотом на цианид [10, 11] и сероводород [12–15], чем аквакобаламин, а также может быть использован как регулятор активности NO [16].
Ранее было изучено взаимодействие витамина B12 с изониазидом. Показано, что в ходе реакции происходит обратимое связывание кобаламином нейтральной молекулы ГИК [17]. Однако информация о взаимодействии изониазида с кобинамидом отсутствует.
Целью настоящей работы является определение кинетических параметров и механизма реакции изониазида с кобинамидом.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовали изониазид (>98%), изоникотиновую кислоту (99%) и изоникотинамид (99%) фирмы Alfa Aesar. Диаквакобинамид был синтезирован согласно методике [18]. Другие реагенты имели марку “х.ч.”.
Определение продуктов реакции изониазида с кобинамидом в нейтральной среде проводили следующим образом. К водному раствору кобинамида добавляли водный раствор изониазида в анаэробных условиях. Соотношение реагентов Cbi(III)/ГИК в полученном растворе составляло: 1/2 и 1/4. Полученный раствор оставляли на несколько часов для полного завершения реакции. Раствор пропускали через колонку с силикагелем (1 гр) и промывали ее 100 мл дистиллированной воды. Кобинамид сорбируется и удерживается силикагелем, а изониазид и продукты его окисления вымываются из колонки. Водный раствор после хроматографической колонки упаривали под вакуумом при температуре 40°С до образования сухого осадка. Осадок растворяли в этаноле (95 об. %) и анализировали методом ГХ/МС с помощью газового хроматомасс-спектрометра GCMS-QP2010Ultra, снабженного капиллярной колонкой Zebron ZB-5ms. В качестве подвижной фазы использовался гелий (30 мл/мин). Температура колонки (120°С) поддерживалась постоянной с помощью термостата.
Кинетические исследования проведены в анаэробных условиях на приборе Cary 50 с использованием герметичной кварцевой кюветы толщиной 1 см. Для исследования быстрых реакций использовали приставку быстрого смешения RX 2000.
Для создания анаэробных условий использовали аргон.
Скорость реакции кобинамида с изониазидом контролировали по изменению оптической плотности при длинах волн 412, 460, 520 и 537 нм.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Установлено, что добавление избытка изониазида к водному раствору кобинамида приводит к изменению цвета раствора с красного на желтый в диапазоне рН 4–13.
Анализ электронных спектров поглощения, наблюдаемых в ходе реакции кобинамида с изониазидом при рН ≥ 7.5, показал два последовательных изменения (рис. 2).
Рис. 2.
Электронные спектры поглощения, записанные в ходе реакции кобинамида с изониазидом при рН 7.5: исходный кобинамид (1), промежуточные продукты (2, 3) и конечный продукт (4); [Cbi(III)]0 = = 5 × 10–5 M; [ГИК]0 = 1 (2), 50 (3) мM; 25°C, анаэробные условия.

Первое изменение происходит очень быстро и зависит от концентрации изониазида. При концентрации ГИК < 1 мM наблюдается исчезновение пиков при 348, 495 и 517 нм (исходного кобинамида, рис. 2, спектр 1) и появление новых при 350 и 497 нм (рис. 2, спектр 2). При высокой концентрации изониазида (> 5 мM) появляются пики при 355, 507 и 532 нм (рис. 2, спектр 3). Такие изменения характерны для реакций комплексообразования кобинамида с различными лигандами (L): тиоцианатом [19], цианамидом [20], сероводородом [13], цианидом [21]. В указанных реакциях происходит последовательное замещение координированных молекул воды c образованием LCbi(III) и (L)2Cbi(III).
Второе изменение сопровождается исчезновением пиков первого интермедиата и появлением новых при 315 и 469 нм (рис. 2, спектр 4). Конечный спектр продукта реакции соответствует восстановленной форме кобинамида Co2+ (Cbi(II)) [13, 22].
При уменьшении значения рН до 4.5 реакция изониазида с кобинамидом протекает в одну стадию и сопровождается исчезновением пиков исходного кобинамида (349 и 520 нм) и появлением новых (315 и 469 нм), соответствующих Cbi(II).
Это показывает, что кобинамид выступает в качестве окислителя изониазида в широком диапазоне рН.
Общая стехиометрия реакции
Результаты спектрофотометрического титрования кобинамида изониазидом в анаэробных условиях представлены на рис. 3.
Установлено, что полное восстановление Cbi(III) достигается при соотношении [ГИК] : : [Cbi(III)] = 1 : 4.
Отметим, что изониазид в редокс реакциях выступает в качестве одно- или четырехэлектронного восстановителя [23, 24].
Определение продуктов реакции изониазида с кобинамидом в нейтральной среде
Методом ГХ-МС определены продукты реакции изониазида с кобинамидом в нейтральной среде: изоникотиновая кислота, изоникотинамид и пиридин-4-карбоксальдегид (табл. 1). Исходный изониазид не был найден в исследуемом образце, что указывало на его полное окисление.
Таблица 1.
Характеристика продуктов реакции
| Наименование вещества | Rt, мин | m/z | Выход, % | |
|---|---|---|---|---|
| Cbi(III) : ГИК 1 : 2 | Cbi(III) : ГИК 4 : 1 | |||
| Пиридин-4-карбоксальдегид | 2.170 | 107 | 16 | – |
| Изоникотинамид | 3.537 | 122 | 68 | 10 |
| Изоникотиновая кислота | 4.346 | 123 | 16 | 90 |
| Изониазид | 16.257 | 137 | – | – |
По значениям площадей пиков найдено, что главным продуктом при соотношении Cbi(III) : ГИК 1 : 2 является изоникотинамид (68%, табл. 1), а при Cbi(III) : ГИК 1 : 4 – изоникотиновая кислота (90%, табл. 1).
Аналогичные изменения наблюдаются при окислении изониазида каталазой-пероксидазой, выделенной из палочки Коха (Catalase Peroxidase from Mycobacterium tuberculosis) [25].
Таким образом, общая схема окисления изониазида кобинамидом в водных растворах в анаэробных условиях при рН 7.5 может быть представлена следующим образом:
Кинетические исследования
Кинетику реакции комплексообразования кобинамида с изониазидом изучить не удалось, так как она протекает очень быстро и заканчивается за время смешивания реагентов во всем изученном диапазоне рН.
Типичные кинетические кривые, соответствующие восстановлению кобинамида, представлены на рис. 4.
Рис. 4.
Кинетические кривые восстановления кобинамида избытком изониазида [Cbi(III)]0 = 5 × 10–5 M; [ГИК]0 = 0.25 (1), 1 (2), 5 (3), 50 (4) мM; 25°C, pH 7.5; анаэробные условия.

Из рис. 4 видно, что начальная оптическая плотность возрастает с увеличением концентрации изониазида. Это объясняется образованием комплекса кобинамида с двумя молекулами ГИК (рис. 2). Установлено также, что падение оптической плотности (соответствует накоплению восстановленной формы кобинамида (Cbi(II))) уменьшается с ростом избытка изониазида по отношению к кобинамиду.
Кинетические кривые линеаризуются в координатах (A0 – At)/(Af – At) от времени и хорошо описываются уравнением
(2)
${{A}_{t}} = \frac{{{{A}_{0}} + kt{{A}_{f}}{{{[{\text{Cbi(III)}}]}}_{0}}}}{{1 + kt{{{[{\text{Cbi(III)}}]}}_{0}}}},$Зависимость kнабл2 от концентрации изониазида при рН 7.5 нелинейна и уменьшается с увеличением его концентрации (табл. 2).
Таблица 2.
Зависимость kнабл2 от концентрации изониазида (рН 7.5, 25°С, анаэробные условия)
| [ГИК], мM | kнабл2, M–1 c–1 |
|---|---|
| 0.25 | 659 |
| 1 | 546 |
| 5 | 119 |
| 50 | 7.8 |
Уменьшение скорости реакции восстановления кобинамида с одновременным ростом концентрации комплекса кобинамида (III) с двумя молекулами изониазида показывает, что присоединение двух молекул ГИК к Cbi(III) стабилизирует степень окисления Co(III) и препятствует восстановлению. Отметим, что аналогичные результаты получены при взаимодействии Cbi(III) c сероводородом [13].
Типичная кинетическая кривая процесса окисления ГИК избытком Cbi(III) представлена на рис. 5. Обработкой кинетических данных в полулогарифмических координатах показано, что частный порядок реакции первый ($k_{{{\text{н а б л 2}}}}^{'}$, с–1).
Рис. 5.
Типичная кинетическая кривая восстановления кобинамида изониазидом при недостатке последнего (вторая стадия) [Cbi(III)]0 = 1.5 × 10–4 M; [ГИК]0 = 1.25 × 10–5 M; 25°C, pH 7.5; анаэробные условия.

Зависимость наблюдаемой константы скорости реакции окисления ГИК от концентрации Cbi(III) нелинейна, но линеаризуется в координатах $k_{{{\text{н а б л 2}}}}^{'}$ – [Cbi(III)]2. Это указывает на второй порядок реакции по кобинамиду. Линейная обработка указанной зависимости позволила рассчитать константу третьего порядка k' = (4.55 ± 0.2) × 105 M–2 c–1 при рН 7.5 и 25°С в анаэробных условиях.
Таким образом, кинетические исследования показывают, что для образования восстановленного кобинамида требуется две молекулы Cbi(III), и реакция подчиняется кинетическому уравнению
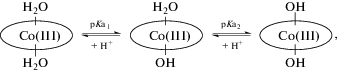
Таким образом, в водном растворе кобинамид находится в виде диаквакобинамида ((H2O)2Cbi(III)), аквагидроксокобинамида ((H2O)(OH–)Cbi(III)) и дигидроксоформах ((HO–)2Cbi(III)) с pKa1 = 5.9 и pKa2 = 10.2 (4) [13]. Отметим, что в реакциях комплексообразования участвуют только диаквакобинамид и аквагидроксокобинамид, поскольку гидроксид ион инертен к замещению во внутренней сфере комплекса.
ГИК также обладает кислотно-основными свойствами и существует в растворе в четырех формах (5) с pKa3 = 1.99, pKa4 = 3.67, pKa5 = 10.89 [23]. При физиологическом значении рН изониазид находится преимущественно в нейтральной форме (RN2H3, где R = ацил изоникотиновой кислоты).
На основании данных о продуктах и стехиометрии реакции, кинетических исследований может быть предложен следующий механизм взаимодействия изониазида с кобинамидом в нейтральной среде.
Он включает обратимые стадии последовательного связывания кобинамидом двух молекул изониазида (RN2H3), реакции (6), (7). В первом случае комплекс нестабилен, происходит перенос электрона с образованием комплекса восстановленного Cbi(II) с гидразильным радикалом (8). Связывание второй молекулы изониазида (7) препятствует протеканию реакции 8 и стабилизирует степень окисления кобальта 3+ в кобинамиде. Образование комплекса кобинамида с двумя молекулами изониазида показывает, что главной формой, генерируемой после присоединения первой молекулы ГИК, является (RN2H3)(H2O)Cbi(III), поскольку OH- инертен к замещению.
Комплекс восстановленного Cbi(II) с гидразильным радикалом ((RN2H2)(Cbi(II))) нестабилен и разрушается. Различие в продуктах реакции показывает, что данный процесс протекает по двум механизмам. Первый заключается в диспропорционировании данного комплекса с образованием двух молекул Cbi(II), изоникотинамида (RNH2) и азота (9). Второй – окисление комплекса (RN2H2)(Cbi(II)) второй молекулой Cbi(III) с образованием двух молекул Cbi(II) и продукта двухэлектронного окисления изониазида (10). В обоих случаях порядок реакции по кобинамиду равен двум, т.к. в скоростьлимитирующей стадии участвуют две молекулы кобинамида.
Продукт двухэлектронного окисления изониазида (RN2H2) нестабилен и быстро окисляется избытком кобинамида до изоникотиновой кислоты (ROH) и азота (11).
Таким образом, в настоящей работе показано, что при рН, близких к физиологическим, кобинамид способен с высокими скоростями образовывать комплекс с одной или двумя молекулами изониазида. Связывание изониазида кобинамидом в одинаковых условиях (pH 7.5, 25°C) протекает примерно в 300 раз быстрее, чем аквакобаламином (витамин B12) [17]. Комплекс Cbi(III) с одной молекулой изониазида (он образуется преимущественно в условиях, когда концентрации изониазида и кобинамида близки или кобинамид находится в избытке) не стабилен и образует восстановленный кобинамид и продукты окисления изониазида: изоникотиновую кислоту, изоникотинамид, пиридин-4-карбоксальдегид. Основным продуктом окисления ГИК избытком кобинамида является изоникотиновая кислота, которая является менее токсичной, чем ГИК. Образование ИНК указывает также на способность кобинамида окислять активные метаболиты (радикальные формы) ГИК, образующиеся при его окислении и ответственных за инактивацию биологических веществ [27–29].
В противоположность кобинамиду, аквакобаламин не способен окислять ГИК [17].
Комплекс кобинамида с двумя молекулами ГИК (он образуется при большом избытке изониазида) стабилен при рН 7.5 и 25°С, окисления изониазида не происходит.
Работа выполнена при поддержке Российского научного фонда (Соглашение № 14-23-00204 П). Авторы работы выражают благодарность сотруднику лаборатории газовой хроматомасс- и ЭПР спектрометрии Центра коллективного обслуживания научных исследований Ивановского государственного химико-технологического университета Н. Печниковой за помощь в выполнении анализа продуктов окисления изониазида методом ГХ/МС.
Список литературы
Справочное руководство для врача скорой медицинской помощи / Под ред. А.Л. Верткина. М.: ГЭОТАР-МЕД, 2001. 285 с.
Marraffa J.M., Cohen V., Howland M.A. // Am. J. Health Syst. Pharm. 2012. V. 69. № 3. P. 199.
Bradberry S., Vale A. // Medicine. 2007. V. 35. № 10. P. 562.
Preziosi P. // Curr. Drug. Metab. 2007. V. 8. № 8. P. 839.
Wang P. // Acta Pharm Sin B. 2016. V. 6. № 5. P. 384.
Watkins R.C., Hambrick E.L., Benjamin G., Chavda S.N. // J. Natl. Med. Assoc. 1990. V. 82. № 1. P. 57.
Sievers M.L., Herrier R.N. // Am. J. Hosp. Pharm. 1975. V. 32. № 2. P. 202.
Tai W.P., Yue H., Hu P.J. // Adv. Therapy. 2008. V. 25. № 10. P. 1085.
Scott A.I., Roessner C.A. // Biochem. Soc. Trans. 2002. V. 30. № 4. P. 613.
Broderick K.E. et al. // Exp. Biol. Med. 2006. V. 231. № 5. P. 641.
Chan A. et al. // Clin. Toxicol. 2010. V.48. № 7. P. 709.
Salnikov D.S., Kucherenko P.N., Dereven’kov I.A. et al. // Eur. J. Inorg. Chem. 2014. P. 852.
Salnikov D.S., Makarov S.V., van Eldik R. et al. // Eur. J. Inorg. Chem. 2014. P. 4123.
Brenner M., Benavides S., Mahon S.B. et al. // Clin. Toxicol. 2014. V. 52. № 5. P. 490.
Jiang J., Chan A., Ali S. et al. // Sci. Rep. 2016. V. 6. P. 20831.
Broderick K.E., Singh V., Zhuang S. et al. // J. Biol. Chem. 2005. V. 280. № 10. P. 8678.
Tumakov S.O., Dereven’kov I.A., Salnikov D.S. et al. // Russ. J. Phys. Chem. 2017. V. 91. № 10. P. 1839.
Blackledge W.C., Griesel A., Mahon S.B. et al. // Anal. Chem. 2010. V. 82. № 11. P. 4216.
Dereven’kov I.A., Salnikov D.S., Makarov S.V. et al. // J. Inorg. Biochem. 2013. V. 125. P. 32.
Kucherenko P.N., Salnikov D.S., Thu Thuy Bui et al. // Macroheterocycles. 2013. V. 6. № 3. P. 262.
Blackledge W.C., Blackledge C.W., Griesel A. et al. // Anal. Chem. 2010. V. 82. № 10. P. 4216.
Dereven'kov I.A., Salnikov D.S., Silaghi-Dumitrescu R. et al. // Coord. Chem. Rev. 2016. V. 309. P. 68.
Dong J., Ren Y., Sun S. et al. // Dalton Trans. 2017. V. 46. № 26. P. 8377.
Bogdándi V., Lente G., Fábián I. // RSC Adv. 2015. V. 5. № 83. P. 67500.
Johnsson K., Schultz P.G. // J. Am. Chem. Soc. 1994. V. 116. № 16. P. 7425.
Hynes M.J. // Proceedings of the Royal Irish Academy. Section B: Biological, Geological, and Chemical Science. 1989. V. 89B. P. 435.
Sinha B.K., Mason R.P. // J. Drug. Metab. Toxicol. 2014. V. 5. № 3. P. 168.
Metushi I., Uetrecht J., Phillips E. // Br. J. Clin. Pharmacol. 2016. V. 81. № 6. P. 1030.
Forbes L.V. et al. // Biochem. Pharmacol. 2012. V. 84. № 7. P. 949.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии