Журнал физической химии, 2019, T. 93, № 2, стр. 278-283
Сорбционные свойства алюмосиликатов натрия и калия из щелочных гидролизатов соломы риса
С. Б. Ярусова a, b, П. С. Гордиенко a, А. Е. Панасенко a, c, *, Н. Н. Баринов d, Л. А. Земнухова a, c
a Российская академия наук, Дальневосточное отделение, Институт химии
Владивосток, Россия
b Владивостокский государственный университет экономики и сервиса
Владивосток, Россия
c Дальневосточный федеральный университет
Владивосток, Россия
d Российская академия наук, Дальневосточное отделение, Дальневосточный геологический институт
Владивосток, Россия
* E-mail: panasenko@ich.dvo.ru
Поступила в редакцию 28.02.2018
Аннотация
Получены образцы алюмосиликатов натрия и калия из растворов, образующихся при щелочном гидролизе соломы риса. Полученные образцы охарактеризованы методами рентгенофазового анализа, ИК-спектроскопии, определен их элементный состав, морфология частиц, удельная поверхность и термические свойства. Сорбционные свойства синтезированных алюмосиликатов исследованы по отношению к ионам Cs+ в статических условиях. Приведены кинетические кривые и изотермы сорбции, описана кинетическая модель сорбции.
Комплексная переработка возобновляемого растительного сырья является важнейшим фактором повышения эффективности сельскохозяйственного производства и получения широкого спектра ценных материалов для различных отраслей промышленности.
Запасы возобновляемых растительных источников сырья, к которым относятся и побочные продукты урожая однолетних злаковых растений (солома и плодовые оболочки зерна, называемые также половой, лузгой или шелухой), исчисляются в России ежегодно миллионами тонн. Однако коэффициент использования такого сырья чрезвычайно низок. Отходы однолетних культур в основном применяются при получении грубого малоценного корма для жвачных животных; в качестве подстилочного или упаковочного материала и как топливо. В то же время растительная биомасса, которая постоянно возобновляется в процессе фотосинтеза и превышает суммарную добычу угля, нефти и газа, является перспективным сырьем для производства ряда полезных веществ и материалов. Основным достоинством такого сырья является его ежегодная воспроизводимость, а также невысокая стоимость. Для создания эффективных технологий переработки растительного сырья необходимы полные и достоверные сведения о химическом составе веществ, входящих в состав растения, их свойствах, оптимальных условиях получения, которые зачастую отсутствуют. Все это относится, в частности, и к соломе риса. Сведений об использовании рисовой соломы в качестве сырья для химической промышленности сравнительно с шелухой (плодовыми оболочками) риса немного [1, 2]. Видимо, это связано с тем, что основная масса соломы, если и находит применение, то в сельском хозяйстве, и лишь незначительная ее часть используется в гидролизной промышленности [3]. В литературе имеется только одна монография, посвященная переработке соломы злаковых культур [4], в которой, есть сведения и о соломе риса.
Солома риса сортов приморской селекции содержит от 4 до 16% диоксида кремния [5], поэтому может быть использована в качестве сырья для получения аморфного кремнезема, выход и свойства которого зависят от сорта риса и способа переработки (кислотный или щелочной гидролиз).
Следует отметить, что свойства аморфного кремнезема из рисовой соломы мало изучены. Сведения, полученные в [6], по сорбции ионов Mn(II) из водных растворов образцами диоксида кремния, выделенными по одной схеме из рисовой шелухи и соломы, указывают на разные характеристики поверхности образцов.
При переработке растительных отходов однолетних культур могут образовываться сточные воды (гидролизаты, экстракты), как кислые, так и щелочные, в зависимости от схемы получения конечных продуктов, которые необходимо утилизировать в соответствии с современными нормативными требованиями по охране окружающей среды [7, 8]. Щелочные гидролизаты могут быть утилизированы разными способами с выделением ценных компонентов, таких как полисахариды [9], ингибиторы коррозии [10] или аморфный диоксид кремния [11]. Однако готовых к внедрению технологий по извлечению ценных веществ из отходов производства риса в настоящее время нет.
В Институте химии ДВО РАН показано [12], что одним из возможных путей утилизации гидролизатов соломы риса является получение наноструктурированных алюмосиликатов щелочных металлов. Указанная работа является продолжением ранее проводимых исследований по получению наноструктурированных алюмосиликатов с их дальнейшим использованием в качестве сорбентов для извлечения ионов Cs+ из водных растворов, в том числе сложного солевого состава [13–16].
Следует отметить, что в зарубежной литературе большое количество работ посвящено автоклавному синтезу цеолитов, где в качестве кремнийсодержащего компонента полностью или частично используют золу рисовой шелухи [17–21]. Работ, связанных с синтезом и исследованием свойств алюмосиликатов из рисовой соломы, сравнительно немного [22, 23].
Настоящая работа посвящена исследованию сорбционных свойств алюмосиликатов натрия и калия, полученных из щелочных гидролизатов соломы риса.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для исследования в п. Тимирязевский Приморского края в 2010 г. были отобраны два образца соломы риса (РС) сортов “Дарий-23” и “Луговой”. Солому измельчали на части длиной 10–50 мм, промывали водой и сушили на воздухе. Затем навеску сырья обрабатывали 1 M раствором гидроксида калия (“Дарий-23”) или натрия (“Луговой”) при 90°С в течение 1 ч. Остаток соломы (который далее может быть использован как сырье для получения целлюлозных материалов) отделяли от раствора, к которому затем добавляли насыщенный раствор Al2(SO4)3 · 18Н2О до достижения рН 7. Образовавшийся осадок отфильтровывали, промывали водой до полного удаления ионов ${\text{SO}}_{4}^{{2 - }}$, сушили на воздухе при 60°С (образцы I и II соответственно).
Рентгеновские дифрактограммы записывали на дифрактометре Bruker D8 Advance (Германия) в СuКα-излучении. Элементный анализ выполняли методом энергодисперсионной рентгенофлуоресцентной спектроскопии на спектрометре Shimadzu EDX 800 HS (Япония). Анализ проводили без учета легких элементов с использованием программного обеспечения спектрометра. Относительная погрешность определения не превышала ±2%. ИК-спектры поглощения образцов записывали в области 400–4000 см–1 на спектрофотометре с фурье-преобразованием Spectrum-1000 (Perkin-Elmer, США). Морфологию образцов изучали на сканирующем электронном микроскопе (СЭМ) EV0-50XVP, оснащенном рентгеновской энергодисперсионной системой INCA Energy-350 (“LEO”, Германия). Удельную поверхность образцов определяли методом низкотемпературной адсорбции азота с использованием прибора “Сорбтометр-М” (Россия).
Опыты по сорбции проводили в статических условиях при соотношении твердой и жидкой фаз, равном 1 : 40 и температуре 20°С из водных растворов карбоната цезия с различными начальными концентрациями ионов Cs+ в диапазоне от 0.1 до 26.6 ммоль ⋅ л–1 при перемешивании на магнитной мешалке в течение 3 ч. В качестве контрольного опыта навеску сорбента помещали в пробирку с дистиллированной водой и перемешивали параллельно с исследуемыми пробами. Затем растворы отделяли от сорбента фильтрованием (бумажный фильтр “синяя лента”) и определяли концентрации ионов Cs+, K+ и Na+.
Для получения кинетических кривых сорбции при аналогичных условиях в серию пробирок помещали навески сорбента (образец I или II), заливали их водным раствором Cs2CO3 с начальной концентрацией Cs+ 7.2 ммоль л–1 и встряхивали от 1 до 60 мин.
Содержание ионов цезия, калия и натрия в растворах определяли методом атомно-абсорбционной спектрометрии (ААС) на двулучевом спектрометре Solaar M6 (Thermo Scientific, США) по аналитическим линиям 852.1; 766.5 и 586.6 нм соответственно. Предел обнаружения ионов цезия в водных растворах составляет 0.01 мкг мл–1, калия – 0.002 мкг мл–1, натрия – 0.0002 мкг мл–1. Относительная ошибка определения указанных ионов методом ААС составляет 15%.
Сорбционную емкость (Ас, ммоль г–1) образцов рассчитывали по формуле:
где Сисх – исходная концентрация ионов Cs+ в растворе, ммоль л–1; Ср – равновесная концентрация ионов Cs+ в растворе, ммоль л–1; V – объем раствора, л; m – масса сорбента, г.Степень извлечения ионов Cs+ (α, %) рассчитывали по формуле:
В линейной интегральной форме при начальных условиях (At = 0 при t = 0 и At = At в момент времени t = t) уравнение имеет вид:
Кинетическая модель псевдовторого порядка выражается уравнением: где k2 – константа скорости сорбции модели псевдовторого порядка. Это выражение может быть преобразовано следующим образом:ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Характеристика синтезированных алюмосиликатов калия и натрия
Согласно данным рентгенофазового анализа, полученные образцы рентгеноаморфны. На дифрактограммах наблюдается гало с максимумом, соответствующим межплоскостному расстоянию 3.20 Å для образца I и 3.22 Å для образца II.
На рентгенограммах обоих образцов после их отжига при 1000°С в течение 1 ч наблюдается аморфный пик в диапазоне углов 15–35 град. Для образца II на фоне аморфного пика зарегистрированы пики, относящиеся к алюмосиликату натрия NaAlSiO4 триклинной модификации (PDF-2, 00-033-1203) с параметрами кристаллической ячейки: а – 5.03470, b – 5.08220, с – 16.91000, α = = 99.000, ß = 81.500, γ = 119.090. Образец I остается рентгеноаморфным, межслоевое расстояние увеличивается до 3.41 Å.
Количественное определение элементного состава полученных образцов показало следующие содержания элементов в полученных образцах (мас. %) – образец I: K – 16.7, Al – 10.6,Si – 19.2; образец II: Si – 19.6; Al – 13.5; Na – 11.2. Такой состав отвечает молярному соотношению основных элементов M : Al : Si для образца I – 1.09 : 1 : 1.74, для образца II – 0.97 : 1 : 1.39.
Выход алюмосиликатов калия и натрия из гидролизатов соломы риса составляет 9.7% относительно массы исходной соломы для образца I и 14.5% для образца II. Потери при прокаливании для исследованных образцов составляют 26–27%.
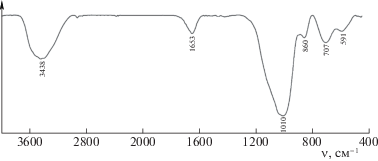
В ИК-спектрах полученных алюмосиликатов (рис. 1) наблюдаются интенсивные полосы поглощения в области валентных асимметричных колебаний силоксановых связей Si–O–Si (1018 см–1 для образца I и 1010 см–1 для образца II) и специфическая полоса связей Al–O–Si при ~860 см–1. Низкочастотные полосы в области 450–600 см–1 – к деформационным колебаниям связей Si–O–Si и Al–O–Si. Наличие полос в области 3438 см–1 ν(O–H) и 1653 см–1 δ(O–H) свидетельствует о наличии связанной воды в образце [26].
Согласно данным сканирующей электронной микроскопии (рис. 2), образцы состоят преимущественно из агломератов частиц с развитым рельефом поверхности, встречаются крупные частицы пластинчатой формы размером до 500 мкм. Также наблюдаются более мелкие агломераты сложной формы с размерами от нескольких единиц до нескольких десятков микрометров. Поверхность агломератов состоит из частиц разнообразной формы, среди которых имеются более плотные частицы с гладкой поверхностью и рыхлые частицы, представляющие собой скопления более мелких зерен (до 1 мкм). На поверхности массивных пластинчатых частиц визуально определяются многочисленные макропоры с максимальными размерами до нескольких десятков мкм.
Удельная поверхность, определенная методом БЭТ, составляет для образца I – 84.8 м2 г–1, для образца II – 32.7 м2 г–1.
Сорбция ионов цезия
На основании полученных экспериментальных данных по сорбции ионов Cs+ исследуемыми сорбентами построены изотермы сорбции (рис. 3). Как видно из приведенного рисунка, сорбционная способность образца II по отношению к ионам цезия выше, чем у образца I.
Для оценки сорбционных свойств образцов I и II полученные изотермы сорбции анализировали в соответствующих координатах уравнения Ленгмюра:
где Ср – равновесная концентрация ионов Cs+ в растворе, Am – максимальная сорбционная емкость, k – константа Ленгмюра. Найденные параметры уравнения Ленгмюра представлены в табл. 1.Таблица 1.
Параметры уравнения Ленгмюра при сорбции ионов Cs+ сорбентами I и II
| Сорбент | k, л ммоль–1 | Am, ммоль г–1 | R2 |
|---|---|---|---|
| I | 1.53 | 0.822 | 0.9682 |
| II | 2.61 | 0.93 | 0.9693 |
Оценка кинетики сорбции ионов Cs+ в интервале времени сорбции от 1 до 60 мин показала, что кинетическая кривая выходит на плато уже в течение 5 минут и в дальнейшем величина сорбции не изменяется (рис. 4). При этом уже через 1 минуту степень извлечения ионов Cs+ составляет 90.3% для сорбента I и 96.9% для сорбента II.
Кажущиеся псевдоскоростные константы, k1 и k2, соответствующие квадраты коэффициентов корреляции R2, показывающие правильность соотнесения с кинетическими моделями псевдо-первого и псевдовторого порядков, приведены в табл. 2. Видно, что процесс сорбции ионов Cs+ в анализируемом временном интервале исследуемыми материалами наилучшим образом описывается моделью псевдовторого порядка, о чем свидетельствуют соответствующие коэффициенты корреляции.
Таблица 2.
Результаты обработки кинетических кривых сорбции ионов Cs+ алюмосиликатами калия (I) и натрия (II)
| Образец | Кинетическая модель | |||
|---|---|---|---|---|
| Псевдопервого порядка | Псевдовторого порядка | |||
| k1, мин–1 | R2 | k2, г ммоль–1 мин–1 | R2 | |
| I | 0.096 | 0.6926 | 68.0 | 0.9999 |
| II | 0.025 | 0.6926 | 48.5 | 0.9999 |
Анализ содержания ионов K+ и Na+ в фильтратах после сорбции показывает, что при увеличении концентрации ионов Cs+ в растворе возрастает концентрация ионов K+ от 2.0 до 17.3 ммоль л–1 (в опытах с сорбентом I) и Na+ от 1.9 до 22.1 ммоль л–1 (в опытах с сорбентом II) в фильтратах после сорбции относительно контрольного опыта. Эти данные подтверждаются результатами элементного анализа твердых осадков после сорбции, которые показывают увеличение содержания цезия в образцах и уменьшение содержания соответствующего щелочного металла. Это свидетельствует о том, что основным механизмом сорбции в исследованных материалах является катионный обмен ионов K+ и Na+ на ионы Cs+ в полученных алюмосиликатных сорбентах.
Таким образом, полученные образцы алюмосиликатов калия и натрия имеют соотношение Al : Si равное 1 : 1.74 и 1 : 1.39 соответственно, удельная поверхность составляет 84.8 м2/г и 32.7 м2/г. Материалы рентгеноаморфны, после обжига при 1000°С происходит частичная кристаллизация алюмосиликата натрия с образованием фазы NaAlSiO4. Сорбционная способность по отношению к ионам цезия у алюмосиликата калия выше, чем у алюмосиликата натрия, изотермы сорбции соответствуют уравнению Ленгмюра. Кинетическая кривая выходит на плато в течение 5 мин, кинетика сорбции описывается моделью псевдо-второго порядка. Ионы цезия сорбируются преимущественно по механизму катионного обмена.
Работа выполнена при финансовой поддержке гранта Президента РФ для государственной поддержки молодых российских ученых – кандидатов наук МК-2884.2017.3 и проекта 4.5913.2017/8.9 в рамках базовой части государственного задания образовательных организаций высшего образования, находящихся в ведении Министерства образования и науки Российской Федерации.
Список литературы
Сергиенко В.И., Земнухова Л.А., Егоров А.Г. и др. // Рос. хим. журн. 2004. Т. 68. № 3. С. 116.
Sun R.C. Cereal Straw as a Resource for Sustainable Biomaterials and Biofuels. Amsterdam: Elsevier, 2010. 292 p.
Савиных А.Г., Глазман Б.А., Николаева Н.С., Исайкина Н.И. // Тр. ВНИИгидролиз. 1980. Вып. 30. С. 36.
Стейнифорт А.Р. Солома злаковых культур. М.: Колос, 1983. 191 с.
Ладатко А.Г., Земнухова Л.А., Федорищева Г.А., Ковалевская В.А. // Рисоводство. 2005. № 7. С. 100.
Николенко Ю.М., Холомейдик А.Н., Земнухова Л.А. и др. // Вестн. ДВО РАН. 2012. № 5. С. 70.
Земнухова Л.А., Арефьева О.Д., Федорищева Г.А., Ковшун А.А. // Экология и промышленность России. 2011. Вып. 2. С. 49.
Земнухова Л.А., Арефьева О.Д., Ковшун А.А. // Химия в интересах устойчивого развития. 2011. Т. 19. № 5. С. 509.
Земнухова Л.А., Томшич С.В., Мамонтова В.А. и др. // Журн. прикл. химии. 2004. Т. 77. Вып. 11. С. 1901.
Щетинина Г.П., Чернов Б.Б., Земнухова Л.А., Харченко У.В. // Трансп. дело России. 2005. Спец. вып. № 3. С. 135.
Земнухова Л.А., Колзунова Л.Г., Арефьева О.Д. и др. // Вода: химия и экология. 2014. № 9. С. 86.
Земнухова Л.А., Федорищева Г.А., Цой Е.А., Арефьева О.Д. Способ получения алюмосиликатов натрия или калия из кремнийсодержащего растительного сырья: Пат. 2557607 РФ // Опубл. 27.07.15, Бюл. № 21.
Гордиенко П.С., Шабалин И.А., Ярусова С.Б. Способ получения сорбента цезия: Пат. 2516639 РФ // Опубл. 20.05.14. Бюл. № 14.
Гордиенко П.С., Шабалин И.А., Ярусова С.Б. Способ получения сорбента цезия: Пат. 2510292 РФ // Опубл. 27.03.14, Бюл. № 9.
Гордиенко П.С., Ярусова С.Б., Буланова С.Б. и др. // Хим. технология. 2013. Т. 14. № 3. С. 185.
Гордиенко П.С., Ярусова С.Б., Шабалин И.А. и др. // Радиохимия. 2014. Т. 56. № 6. С. 518.
Tan W.-C., Yap S.-Y., Matsumoto A. et al. // Adsorption. 2011. V. 17. P. 863.
Thuadaij P., Nuntiya A. // Proc. Eng. 2012. V. 32. P. 1026.
Bohra S., Kundu D., Naskar M.K. // Ceram. Int. 2014. V. 40. P. 1229.
Mohamed R.M., Mkhalid I.A., Barakat M.A. // Arabian J. Chem. 2015. V. 8. Is. 1. P. 48.
Ng E.-P., Awala H., Tan K.-H. et al. // Microporous and Mesoporous Mat. 2015. V. 204. P. 204.
Ali I.O., Thabet M.S., El-Nasser K.S. et al. // Ibid. 2012. V. 160. P. 97.
Ali I.O., Salama T.M., Thabet M.S. et al. // Mat. Chem. Phys. 2013. V. 140. P. 81.
Coleman N.J., Brassington D.S., Raza A., Mendham A.P. // Waste Management. 2006. V. 26. P. 260.
Ho Y.S., McKay G. // Process Biochem. 1999. V. 34. P. 451.
Плюснина И.И. Инфракрасные спектры минералов. М.: Изд-во Моск. ун-та, 1976. 175 с.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии