Журнал физической химии, 2019, T. 93, № 2, стр. 269-277
Влияние природы наночастицы и биосовместимого полимерного стабилизатора на размерные и спектральные характеристики гибридных наносистем
С. В. Валуева a, *, Л. Н. Боровикова a, А. А. Кутин a, А. В. Плющенко a, b
a Российская академия наук, Институт высокомолекулярных соединений
Санкт-Петербург, Россия
b Санкт-Петербургский политехнический университет Петра Великого
Санкт-Петербург, Россия
* E-mail: svalu67@mail.ru
Поступила в редакцию 07.05.2018
Аннотация
Методами динамического светорассеяния, УФ-спектроскопиии просвечивающей электронной микроскопии (ПЭМ) определены размерные и спектральные характеристики гибридных наносистем (ГНС) на основе наночастиц (НЧ) нуль-валентного серебра или нуль-валентного селена, стабилизированных биосовместимыми полимерными стабилизаторами (БПС) различной природы: катионным полиэлектролитом – поли-N,N,N,N-триметилметакрилоилоксиэтиламмоний метилсульфатом, метилцеллюлозой, Зостерином и поливинилпирролидоном. Показана возможность регулирования размерных и спектральных характеристик НС путем варьирования природы НЧ и БПС. Установлен факт формирования сферических наноструктур.
Металлические наночастицы (НЧ) – превосходный материал для создания электронных, оптических, сенсорных устройств нового поколения. Кроме того, они весьма перспективны в биоаналитической электрохимии [1, 2], биомедицине [3, 4], при синтезе заменителей крови [5] и т.д. Так, например, для НЧ нуль-валентного серебра (Ag0) характерны сильно выраженные антимикробные свойства, причем степень антибактериального эффекта в значительной мере определяется размерами НЧ [6–8].
Известно, что биогенный элемент – селен, входящий в состав пищевых продуктов, оказывает антибластическое действие, а между содержанием селена во внешней среде и частотой поражения населения злокачественными опухолями существует обратно пропорциональная зависимость [9]. Известно также, что в условиях дефицита селена наблюдается развитие миокардиодистрофии, атеросклероза, ишемической болезни сердца, инфаркта миокарда и хронического гепатита различной этимологии [10]. В клинической медицине показана эффективность использования НЧ селена в нуль-валентной форме (Se0) в комбинации с известными противоопухолевыми веществами [11].
Так как НЧ обладают избытком поверхностной энергии, вследствие чего термодинамически неустойчивы, они нуждаются в стабилизации. Для повышения их агрегативной устойчивости применяют самые разнообразные вещества, из которых наибольшее значение имеют высокомолекулярные соединения. При такой стабилизации, получившей название стерической (для неионогенных полимерных матриц) или электростерической (если в качестве стабилизаторов выступают полиэлектролиты) [12], металлические НЧ окружены предохраняющим барьером, представляющим собой сплошной слой сольватированных полимерных цепей, в результате чего коллоидная система становится неограниченно устойчивой до тех пор, пока защитный слой остается неповрежденным. Очевидно, что в формировании ГНС ключевую роль играют силы дальнодействия между НЧ и макромолекулами, а также между образующимися наноструктурами, которые определяются, в первую очередь, природой НЧ и полимерного стабилизатора.
Один из наиболее перспективных способов получения стабильных НЧ – восстановление их ионных форм в растворах полимеров. Адсорбция макромолекул на НЧ сопровождается формированием органической оболочки на неорганическом ядре и приводит к снижению поверхностного натяжения, стабилизации образующихся НЧ от их агрегации, торможению роста, а также повышению их устойчивости к окружающей среде [13]. Кроме того, в таких процессах часто образуются НЧ с достаточно узким распределением по размерам. Следует также заметить, что средний размер НЧ, образующихся в присутствии органических соединений, существенно меньше, чем в их отсутствие. Эти факты свидетельствуют о влиянии адсорбции и природы взаимодействий полимеров с поверхностью НЧ металлов и неметаллов на процесс формирования НЧ [14].
Ввиду того, что гибридные наносистемы (ГНС) обладают синергизмом свойств исходных компонентов, были синтезированы и изучены ГНС на основе биосовместимых полимерных стабилизаторов (БПС), используемых для получения лекарственных препаратов и БАД [6, 15–21], и НЧ Ag0 или Se0.
В настоящей работе в качестве БПС использовали: катионный полиэлектролит – поли-N,N,N,N-триметилметакрилоилоксиэтиламмоний метилсульфата (ПТМАЭМ), метилцеллюлозу (МЦ), Зостерин и поливинилпирролидон (ПВП). Структурные формулы, состав и молекулярные массы БПС представлены в табл. 1.
Таблица 1.
Структурные формулы, состав и ММ БПС
| Название | Структурная формула, состав |
|---|---|
| ПТМАЭМ Mw = 170000 |
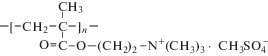 |
| МЦ Mw = 40000 |
[C6H7O2(OH)3 – x(OCH3)x]n (х = 1, 2 или 3) |
| Зостерин Mw = 60000 |
Зостерин имеет линейный остов из рамногалактурана и разветвленную область. К ней присоединен ксилогалактуронан (цепи, состоящие из колец галактуроновой кислоты и моносахара ксилозы). В Зостерине мало метильных групп (не более 5% от общего числа гидроксильных остатков), поэтому он эффективно связывает кислотными группами галактуроновых колец и водородными связями катионы тяжелых металлов. |
| ПВП Mw = 55000 |
 |
Катионный полиэлектролит – ПТМАЭМ – хорошо растворяется в воде в любых соотношениях, обладает хорошей биосовместимостью и сравнительно невысокой токсичностью, в водных растворах ПТМАЭМ подавляет рост многих бактерий и грибов при концентрации 0.1–1 мас. %, обладает иммуногенностью [6]. МЦ обладает хорошей растворимостью в воде, что позволяет использовать ее для получения композиций биомедицинского назначения с требуемым комплексом физико-химических и биологических свойств [15]. Зостерин, относящийся к классу пектинов, обладает уникальным комплексом биоактивных свойств: высокой антиоксидантной, иммуномодулирующей, противовирусной, репаративной, противоопухолевой, геропротекторной, гипохолестеринемической, радиозащитной и сорбционной, активностью, поэтому широко применяется в медицине, ветеринарии, медицинской косметологии и др. [16–19]. Поливинилпирролидон – водорастворимый нетоксичный полимер, который широко используется в производстве лекарственных средств [20, 21].
Цель данной работы – определение размерных и спектральных характеристик серебро- и селенсодержащих ГНС на основе ПТМАЭМ, МЦ, Зостерина и ПВП широким спектром методов при массовом соотношении (ν) Ag0:БПС и Se0:БПС, равном 0.1 (ν = 0.1 – точка насыщения адсорбционной емкости наночастиц селена [22]).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Получение наночастиц нуль-валентного серебра и селена
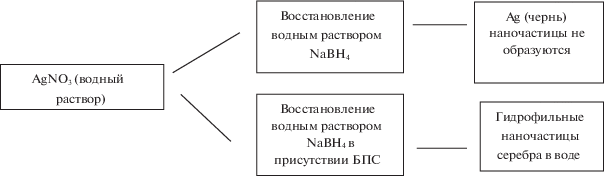
Наночастицы серебра получали в результате реакции между нитратом серебра (AgNO3) и боргидридом натрия (NaBH4):
(1)
$\begin{gathered} {\text{AgN}}{{{\text{О }}}_{{\text{3}}}} + {\text{NaB}}{{{\text{H}}}_{{\text{4}}}} + {{{\text{H}}}_{{\text{2}}}}{\text{O}} \to \\ \to {\text{A}}{{{\text{g}}}^{0}} + {\text{NaN}}{{{\text{O}}}_{{\text{3}}}} + {\text{B}}{{({\text{OH}})}_{{\text{3}}}} + {{{\text{H}}}_{{\text{2}}}}{\kern 1pt} \uparrow . \\ \end{gathered} $Общая схема синтеза гидрофильных НЧ серебра приведена ниже:
При смешении растворов AgNO3 и NaBH4 в отсутствие веществ, препятствующих агрегации частиц, происходит быстрая, необратимая реакция с выпадением черного осадка металлического серебра, т.е. рост частиц не останавливается в области нанометровых размеров. В присутствии БПС в растворе образуются гидрофильные НЧ Ag0, стабильные во времени. Варьируя природу БПС, в ходе реакции (1) можно изменять размеры наноструктур/НЧ.
Синтез НЧ селена осуществлялся в результате реакции между селенистой (H2SeO3) и аскорбиновой (C6H8O6) кислотами в присутствии БПС:
(2)
${{{\text{H}}}_{{\text{2}}}}{\text{Se}}{{{\text{O}}}_{{\text{3}}}}\, + \,{\text{2}}{{{\text{C}}}_{{\text{6}}}}{{{\text{H}}}_{{\text{8}}}}{{{\text{O}}}_{{\text{6}}}}\, \to \,{\text{S}}{{{\text{e}}}^{0}}\, + \,{\text{3}}{{{\text{H}}}_{{\text{2}}}}{\text{O}}\, + \,{\text{2}}{{{\text{C}}}_{{\text{6}}}}{{{\text{H}}}_{{\text{6}}}}{{{\text{O}}}_{{\text{6}}}}{\text{.}}$В результате реакции (2) в отсутствие БПС происходило образование золя нуль-валентного красного аморфного селена (Se0) и дегидроаскорбиновой кислоты. Образование нуль-валентного селена показано ранее [23]. Золь не устойчив в растворе и выпадал в осадок через ~24 ч. Кроме того, через 7–10 суток Se0 из аморфной красной формы переходил в другую модификацию – серый металлический селен. Таким образом, в отсутствие БПС наночастицы Se0 были лиофобными коллоидами с низкой агрегативной устойчивостью. Введение в реакцию (2) БПС приводило к получению стабильных растворов красновато-оранжевого цвета, НЧ Se0 сохраняли стабильное состояние в растворе в течение 3 месяцев, при этом после выпадения в осадок селен не менял модификацию (рис. 2).
В результате реакций (1) и (2) были получены относительно гидрофильные НЧ металла (Ag0) и гидрофобные НЧ металлоида (Se0). Величина рН серебросодержащих растворов составляла 10.4–10.8, селенсодержащих растворов – 3.2–3.5. Для измерения рН среды использовали милливольтметр И-160МИ.
Регистрация спектров поглощения
Спектры поглощения в УФ- и видимой областях измеряли с помощью спектрофотометра “Specord M-40” (Карл Цейс Йена, Германия) в рабочем диапазоне от 220 до 900 нм в кварцевых кюветах с толщиной фотометрического слоя 1 см. Относительная суммарная погрешность при регистрации спектров не превышала 2%.
Измерения динамического светорассеяния
Гидродинамические радиусы наноструктур ($R_{{\text{h}}}^{*}$) определяли методом динамического светорассеяния на корреляционном спектрометре PhotoCorComplex (источник света – гелий-неоновый лазер фирмы Сoherent мощности 20 мВт с длиной волны λ = 632.8 нм) с программируемым коррелятором Photocor-FC (число каналов 288, ЗАО “Антекс”, Россия). Обработку корреляционной функции осуществляли с помощью программы DynaLS (“Гелиос”, Россия). Величины гидродинамических радиусов $R_{{\text{h}}}^{*}$ (табл. 2 и 3) рассчитывали из значений коэффицентов диффузии (D*) по уравнению Эйнштейна – Стокса: $R_{h}^{*}$ = = kT/6πη0D* (η0 – вязкость растворителя, k – константа Больцмана, T – температура) [24]. Корреляционную функцию интенсивности рассеянного света получали с помощью коррелятора PhotoCor-FC с числом каналов 288 (изготовитель – ЗАО “Антекс”, Россия). Анализ корреляционной функции осуществляли с помощью программы обработки данных динамического светорассеяния Dynals (фирма “Гелиос”, Россия).
Исследования методом просвечивающей электронной микроскопии
Исследования методом просвечивающей электронной микроскопии (ПЭМ) проводили на электронном микроскопе BS-500 (фирмы Tesla, Чехия) при ускоряющем напряжении U = 60 кВ, в диапазоне увеличений 9000–30000. Перед исследованием водный раствор ГНС наносили на медную сетку, покрытую формваровой пленкой, и сушили на воздухе.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Для синтезированных ГНС исследованы спектры оптического поглощения в УФ- и видимой областях. Из всех использованных БПС только Зостерин имеет пик поглощения в УФ-области при λ = 280 нм (рис. 3в), остальные БПС не имеют характеристических максимумов поглощения (рис. 3а,б,г). На рис. 3а–3г приведены оптические спектры поглощения для наносистем БПС/Ag0. Максимум полосы поверхностного плазмонного резонанса (ППР) для всех исследованных серебросодержащих ГНС наблюдается при λ = 400 нм, что свидетельствует об образовании в водном растворе НЧ серебра в нуль-валентном состоянии [25]. Известно, что на форму и интенсивность ППР для серебросодержащих ГНС влияет несколько факторов: размер и форма НЧ Ag0, их диэлектрическое окружение и особенности взаимодействия со стабилизатором [26]. Сравнение величин оптической плотности поглощения D показывает увеличение величины параметра D в ряду БПС: МЦ < ПТМАЭМ < ПВП (табл. 2) (Зостерин не принимаем во внимание, так как он поглощает в данной области рис. 3в). В случае ППР серебросодержащих ГНС изменение величины оптической плотности можно объяснить межмолекулярными взаимодействиями поверхностного плазмона НЧ с функциональными группами молекул БПС. В щелочной области (рН 10.4–10.8) ПТМАЭМ и ПВП не заряжены [20], т.е. ГНС ПТМАЭМ/Ag0и ПВП/Ag0 формируются по стерическому механизму стабилизации [12]. Напротив, Зостерин и МС в этой области рН заряжены, т.е. в этих случаях реализуется электростерический тип стабилизации [12]. При электростерической стабилизации заряженные функциональные группы полимерного стабилизатора вызывают изменение электронной плотности поверхностных электронов НЧ:
что, в свою очередь, приводит к изменению величины оптической плотности ППР. Форму ППР для изученных серебросодержащих ГНС оценивали на основании критерия, называемого Q-фактором, рассчитанным как отношение величины оптической плотности (D) к ее ширине на полувысоте (W1/2), эта величина характеризует также степень полидисперсности частиц золей металлов: Приведенные в табл. 2 факторы Q для различных БПС возрастают в следующем ряду: ПВП < < МЦ < ПТМАЭМ, причем этот ряд отличается от приведенного выше ряда БПС, “привязанного” к величине оптической плотности поглощения D. Таким образом, не удается выделить один фактор, который определил бы характер изменения и формы, и интенсивности ППР для серебросодержащих ГНС. По-видимому, их спектральные характеристики определяются совокупностью особенностей БПС, таких как плотность и распределение заряда по цепи, молекулярная масса, топология основных полимерных групп и пр.Рис. 3.
УФ-спектры для свободных БПС (а – ПТМАЭМ, б – МЦ, в – Зостерин, г – ПВП) в воде при сБПС = 0.1 мас. % (1) и для соответствующих серебросодержащих ГНС (2).

На рис. 4а–4г представлены оптические спектры поглощения для ГНС БПС/Se0. Максимум на спектрах поглощения для исследованных селенсодержащих ГНС наблюдается при λ = 250–265 нм, что свидетельствует об образовании в водном растворе НЧ селена в нуль-валентном состоянии (согласно литературным данным, пик поглощения для свободных НЧ Se0 наблюдается при λ = 256 нм, что мало отличается от наших ГНС БПС/Se0 [27]). Однако, различия в форме пиков существенны. Так, для наносистемы ПТМАЭМ/Se0 (рис. 4а) наблюдается локальный пик при λ = 260 нм, плавно переходящий в ярко выраженное “крыло”. В случае ГНС МЦ/Se0 и Зостерин/Se0 (рис. 4б и 4в) на оптических спектрах поглощения наблюдается четко выраженный узкий пик при λ = 250–253 нм, а при использовании в качестве БПС ПВП – сильно “размытый” максимум оптической плотности при λ ~ 265 нм (рис. 4г). Сравнение величин оптической плотности поглощения D для селенсодержащих ГНС показывает увеличение параметра D в ряду БПС: ПТМАЭМ < ПВП < МЦ (табл. 3) (Зостерин так же, как и в случае серебросодержащих ГНС, не принимаем во внимание, так как он поглощает в данной области длин волн (рис. 4 в)). В кислой области (рН 3.2–3.5) ПТМАЭМ и ПВП заряжены [20], а МЦ – не заряжена. Так как селен представляет собой гидрофобный неорганический полимер, то стабилизация НЧ Se0 происходит преимущественно за счет их взаимодействий с гидрофобными фрагментами БПС. При этом заряженные группы БПС будут обращены в раствор, и именно в этих случаях не наблюдается выраженных пиков на оптических спектрах поглощения ГНС. Итак, ГНС БПС/Se0 формируются по стерическому механизму стабилизации [12] во всех изученных случаях, однако наличие заряда на БПС оказывает влияние на форму спектра оптического поглощения.
Рис. 4.
УФ-спектры для свободных БПС (а – ПТМАЭМ, б – МЦ, в – Зостерин, г – ПВП) в воде при сБПС = 0.1 мас. % (1) и для соответствующих селенсодержащих ГНС (2).

Оценка гидродинамического радиуса Rh наночастиц селена методом ДСР показала, что в отсутствие полимера образуются крупные частицы селена с радиусом ~100 нм (первые сутки), ~180 нм (вторые сутки), с первоначально узким унимодальным распределением по размерам. Однако, через ~50 ч распределение по размерам становится бимодальным и широким. По истечении двух суток происходит уже видимая агрегация селена. При использовании в качестве БПС для НЧ селена – ПТМАЭМ, МЦ, Зостерина или ПВП, в водных растворах при ν = 0.1, формируются наноструктуры с гидродинамическим радиусом $R_{{\text{h}}}^{*}$ < < 100 нм (табл. 3), без тенденции к агрегации в течение нескольких месяцев. Важно отметить, что минимальные размеры для селенсодержащих ГНС получаются в случае использования в качестве БПС гидрофильного БПС – ПВП, а максимальные – для МЦ, характеризующейся в исследованном ряду БПС максимальной степенью гидрофобности.
Аналогичная ситуация наблюдается для серебросодержащих ГНС: при использовании в качестве БПС для НЧ серебра – ПТМАЭМ, МЦ, Зостерина или ПВП формируются наноструктуры с гидродинамическим радиусом $R_{{\text{h}}}^{*}$ < 100 нм (табл. 2). Максимальные размеры для серебросодержащих ГНС так же, как и в случае селенсодержащих ГНС, наблюдаются при стабилизации НЧ серебра МЦ – БПС с максимальной степенью гидрофобности в исследованном ряду БПС.
Так как чем сильнее взаимодействие поверхностных атомов с адсорбированными на НЧ макромолекулами, тем меньше размер частиц, при котором образуется устойчивая в растворе система [28], то были сопоставлены величины гидродинамических радиусов $R_{{\text{h}}}^{*}$ для серебро- и селенсодержащих ГНС при одних и тех же БПС. Анализ данных по размерным параметрам (табл. 2 и 3) показал, что серебросодержащие ГНС для всех изученных БПС имеют меньшие значения $R_{{\text{h}}}^{*}$, чем селенсодержащих ГНС, что, по-видимому, обусловлено большей степенью гидрофобности НЧ селена по сравнению с НЧ серебра.
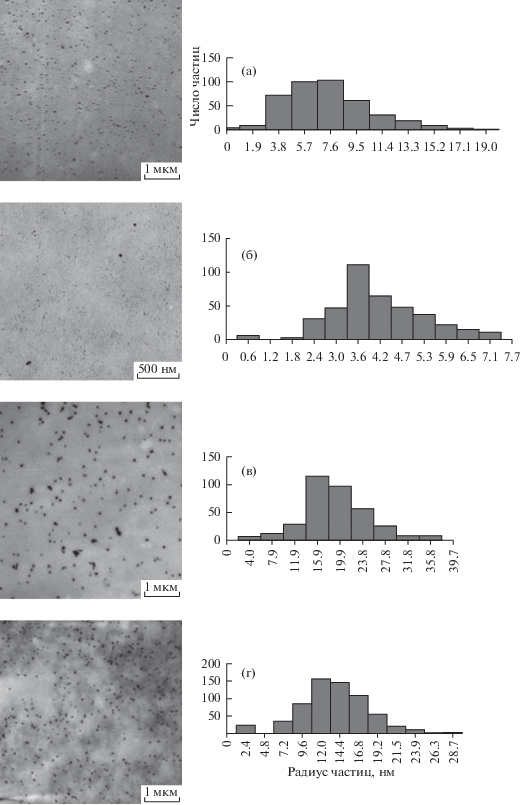
На ПЭМ-изображениях, полученных для ГНС МЦ/Ag0, Зостерин/Ag0, МЦ/Se0 и Зостерин/Se0 (рис. 5а–5г) хорошо видно, что основная популяция НЧ имеет форму, близкую к сферической. Обработка электронно-микроскопических изображений, полученных методом ПЭМ для ГНС на основе МЦ и Зостерина, с целью получения информации о распределении по размерам нанокластеров серебра и селена в соответствующих ГНС, проводилась по программе “MatLab” по оригинальной методике. Анализ распределений НЧ серебра по размерам, по данным ПЭМ, для серебросодержащих ГНС МЦ/Ag0 и Зостерин/Ag0 показал, что распределения довольно широкие: от 2 до 17 нм, в первом случае, наиболее вероятный размер (радиус) при этом составляет ~7.6 нм (рис. 5а, табл. 2), и от 2 до 7 нм (во втором случае), наиболее вероятный размер при этом составляет ~3.6 нм (рис. 5б, табл. 2). Наиболее вероятные размеры нанокластеров селена превосходят размеры нанокластеров серебра и составляют, по данным ПЭМ для ГНС МЦ/Se0 и Зостерин/Se0 (рис. 5в, 5г, табл. 3), соответственно 15.9 и 12.0 нм. Кроме того, обращает на себя внимание тот факт, что независимо от природы НЧ, более крупные нанокластеры наблюдаются при использовании в качестве БПС МЦ, которая в исследованном ряду БПС, как уже отмечалось выше, имеет максимальную степень гидрофобности.
Рис. 5.
ПЭМ-изображения и соответствующие гистограммы распределения по размерам нанокластеров для серебро (а, б) и селенсодержащих (в, г) ГНС на основе МЦ (а, в) и Зостерина (б, г).
Полученные результаты составляют физико-химическую основу для модификации полимерных материалов с выраженной физиологической активностью биогенными элементами в нуль-валентной форме.
ЗАКЛЮЧЕНИЕ
Таким образом, для всех исследованных серебро- и селенсодержащих ГНС методом УФ-спектроскопии установлен факт образования в водном растворе НЧ в нуль-валентном состоянии. Показано, что селенсодержащие ГНС на основе всех изученных БПС формируются по стерическому механизму стабилизации, однако наличие заряда на БПС оказывает влияние на форму кривой спектра оптического поглощения. Напротив, для серебросодержащих ГНС в зависимости от природы БПС может реализоваться как стерический механизм стабилизации (для систем ПТМАЭМ/Ag0 и ПВП/Ag0), так и – электростерический (для ГНС Зостерин/Ag0 и МС/Ag0).
Методом динамического светорассеяния установлено, что при использовании в качестве БПС для НЧ серебра и селена – ПТМАЭМ, МЦ, Зостерина или ПВП, в водных растворах при ν = 0.1, формируются наноструктуры с гидродинамическим радиусом $R_{{\text{h}}}^{*}$ < 100 нм. Обнаружено, что максимальные размеры наноструктур (нанокластеров) наблюдаются при использовании в качестве БПС МЦ (с максимальной степенью гидрофобности в исследованном ряду БПС). Обнаружено, что серебросодержащие ГНС имеют меньшие значения $R_{{\text{h}}}^{*}$ и $R_{{{\text{П Э М }}}}^{*}$, чем селенсодержащих ГНС, что, по-видимому, обусловлено большей степенью гидрофобности НЧ селена по сравнению с НЧ серебра.
Список литературы
Wang J. // Anal. Chim. Acta. 2003. V. 500. № 1–2. P. 247.
Вертелов Г.К., Оленин А.Ю., Лисичкин Г.В. // Журн. аналит. химии. 2007. Т. 62. № 9. С. 903.
Rosi N.L., Mirkin C.A. // Chem. Rev. 2005. V. 105. № 4. P. 1547.
De la Fuente J.M., Renades S. // Biochim. Biophys. Acta. 2006. V. 1760. № 4. P. 636.
Takeoka S. // Organ Microcirculation. V. 13 / Ed. by H. Ishii, M. Suematsu, K. Tanishita, H. Suzuki. Tokyo: Springer, 2006. P. 35.
Афиногенов Г.Е., Панарин Е.Ф. Антимикробные полимеры. СПб.: Гиппократ, 1993. 264 с.
Копейкин В.В., Афиногенов Г.Е., Панарин Е.Ф., Сантурян Ю.Г. Водорастворимые полимерсодержащие коллоидные дисперсии серебра и их антимикробные свойства // Химия и физика высокомолекулярных соединений. Тез. докл. XX науч. конф. ИВС АН СССР. Л., 1983. С. 86.
Водорастворимая серебросодержащая бактерицидная композиция и способ ее получения: Пат. 2128047 РФ, МПК 51А 61 К 31/79, А 61 К 33/38 / Афиногенов Г.Е., Копейкин В.В., Панарин Е.Ф.; заявитель и патентообладатель Афиногенов Геннадий Евгеньевич. № 95119636/14; заявл. 21.06.1995; опубл. 27.03.1999. 4 с.
Yoshizawa K., Willett W.C., Morris S.J. // J. Natl. CancerInst. 1998. V. 90. № 16. P. 1219.
Yu S.Y., Zhu Y.J., Li W.G. // Biol. Trace Element Res. 1997. V. 51. № 1. P. 117.
Wang Y., Hang H., Yan L. // Colloids and Surfaces B: Biointerfaces. 2016. V. 140. P. 297.
Mayer A.B.R. // Polym. Adv. Technol. 2001. V. 12. P. 96.
Тальрозе Р.В., Шандрюк Г.А., Мерекалов А.С., Шаталова А.М., Отмахова О.А. // Высокомолек. соед. А. 2009. Т. 51. № 11. С. 1930.
Литманович О.Е. // Высоколомолек. соед. С. 2008. Т. 50. № 7. С. 1370.
Суханова Т.Е., Вылегжанина М.Э., Гофман И.В и др. // Поверхность. Рентгеновские, синхротронные и нейтронные исследования. 2014. № 9. С. 47.
Лоенко Ю.Н., Артюхов А.А., Козловская Э.П. и др. Зостерин. Владивосток: Дальнаука, 1997. 88 с.
Вехов В.Н. Зостера морская Белого моря. М.: Изд-во МГУ, 1992. 144 с.
Лазарева Е.Б., Меньшиков Д.Д. // Антибиотики и химиотерапия. 1999. № 2. С. 37.
Колесова В.Г., Додали В.А., Лойко В.И., Марченко В.А. // Эфферентная терапия. 1995. Т. 1. № 1. С. 65.
Кирш Ю.Э. Поли-N-винилпирролидон и другие поли-N-виниламиды. М.: Наука, 1998. 252 с.
Валуева С.В., Азизбекян С.Г., Кучинский М.П. и др. // Нанотехника, 2012. № 4(32). P. 53.
Валуева С.В., Титова А.В., Боровикова Л.Н. // Журн. физ. химии. 2015. Т. 89. № 9. С. 1420.
Shaker A.M. // J. Colloid and Interfase Science. 1996. V. 180. P. 225.
Brown W. Dynamic Light Scattering: the Method and Some Application. Oxford: Clarondon Press, 1993. 305 p.
Низамов Т.Р., Евстафьев И.В., Оленин А.Ю., Лисичкин Г.В. // Коллоидн. журн. 2014. Т. 76. № 4. С. 513.
Moores A., Goettmann F. // New J. Chem. 2006. V. 30. № 8. P. 1121.
Бусев А.И. Колориметрические (фотометрические) методы определения неметаллов. М.: Изд-во иностр. лит., 1963. 467 с.
Kamat P.V. // J. Phys.Chem. B. 2002. V. 106. P. 7729.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии