Журнал физической химии, 2019, T. 93, № 3, стр. 459-463
Хроматографическое поведение петанина в обращенно-фазовой ВЭЖХ в подвижных фазах с широким диапазоном pH
В. И. Дейнека a, *, Я. Ю. Кульченко a, Л. А. Дейнека a
a Белгородский государственный национальный исследовательский университет
Белгород, Россия
* E-mail: deineka@bsu.edu.ru
Поступила в редакцию 04.06.2018
Аннотация
Впервые исследовано хроматографическое поведение петанина – петунидин-3-O-[6-O-(4-O-(E)-пара-кумароил-O-α-рамнопиранозил)-β-глюкопиранозида]-5-O-β-глюкопиранозида в условиях обращенно-фазовой высокоэффективной жидкостной хроматографии в подвижных фазах с различным значением рН. Обсуждена взаимосвязь между хроматографическим поведением (удерживанием и эффективностью пика) и переходами между различными формами антоцианов. На основе анализа данных, полученных в диапазоне рН подвижных фаз от 2 до 6.5, а также анализа спектров поглощения петанина и результатов исследования влияния добавок тетрабутиламмония бромида в подвижную фазу сделан вывод, что повышение рН приводит к образованию кроме формы псевдооснования халконных незаряженных и анионной форм.
Антоцианы представляют большой интерес как природные пищевые красители, оказывающие благоприятное действие на здоровье человека [1]. Относясь к классу флавоноидов, они отличаются от остальных представителей класса существованием в водных растворах большого числа рН-зависимых форм [2]. Это свойство вместе со склонностью к нескольким типам копигментации и комплексообразования [3, 4] позволяет получать множество окрасок, обнаруживаемых в природных объектах (в плодах, цветках и листьях), содержащих антоцианы, и в красителях, приготовленных на их основе [5, 6]. Исследованию равновесия и взаимных переходов между формами антоцианов посвящено значительное число опубликованных работ. При этом большое разнообразие природных видов антоцианов по химическому строению служит причиной различий в их поведении в растворах при изменении рН. В целом, в кислой среде (до рН 1 и ниже) антоцианы существуют в окрашенной в красные цвета с оттенками, зависящими от строения, флавилиевой форме (I) (рис. 1). При повышении рН они подвергаются двум типам превращений. Первое из них – гидратация – начинается с нуклеофильной атаки молекулой воды и заканчивается образованием бесцветного псевдооснования – циклического полукеталя (II) (рис. 1). Продукт II быстро и обратимо раскрывается, образуя слабо окрашенную (в желто-зеленые тона) цис-халконную форму (IIIа), которая медленно [7, 8] превращается в транс-халконную форму (IIIб). С данным направлением конкурирует быстрое элиминирование протона с образованием также интенсивно окрашенных (в более “синие” тона) хиноидных (quinonoidal bases) форм (IVа и IVб), количество которых зависит от числа заместителей в структуре. Наконец, при дальнейшем повышении рН могут образоваться также интенсивно окрашенные c батохромным сдвигом максимумов абсорбции заряженные хиноидные структуры (V), число которых также зависит от строения антоциана. Для ряда видов антоцианов возможно образование даже дианионных (на базе хиноидных) структур [8].
Обращенно-фазовая хроматография широко и успешно используется для разделения антоцианов [9], но только во флавилиевой форме, т.е. в сильнокислых подвижных фазах. Поэтому цель настоящей работы – определение особенностей хроматографического поведения антоцианов в условиях обращенно-фазовой хроматографии в подвижных фазах в приемлемом для традиционных октадецил-модифицированных силикагелей диапазоне рН – от 2 до 7.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовали экстракт плодов паслена садового (Solanum retroflexum) настаиванием в 0.1 М водном растворе соляной кислоты с последующей очисткой методом твердофазной экстракции на концентрирующих патронах Диапак С18 (Биохиммак СТ, Москва).
Хроматографические исследования проводили на хроматографе Agilent 1200 Infinity с диодно-матричным детектором. Использовали хроматографическую колонку 4.6 × 100 мм Kromasil 100-5C18. Подвижная фаза А содержала 36 об. % ацетонитрила (“ч.д.а.”, Компонент-Реактив) в дистиллированной воде; фаза Б – 0.01 М раствор фосфатного буфера, рН которого доводили до необходимого значения добавлением раствора гидроксида натрия. Для хроматографирования использовали режим смешивания растворов 50% Б (и, следовательно, 50% А), чем обеспечивали постоянную концентрацию ацетонитрила в подвижных фазах. Скорость подвижной фазы 0.8 мл мин–1, температура термостата колонок 40°С. Спектры записывали в кювете детектора в диапазоне 450–800 нм.
Значения рН растворов контролировали на приборе Эксперт-рН, используя комбинированный стеклянный электрод ЭСК-10614. Хроматограммы записывали, хранили и обрабатывали в программе Agilent Chem Station. Для дополнительной обработки спектры и хроматограммы импортировали и обрабатывали в программе MSExcel. Параметр липофильности (CLogP) рассчитывали в программе ChemSketch 12.0 (ACD Labs).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Хроматограммы антоцианов плодов паслена садового (Solanum retroflexum), записанные в подвижных фазах, содержащих 18 об. % ацетонитрила в 0.01 М фосфатных буферах с различными значениями рН, представлены на рис. 2. При рН 2 (наименее низком значении рН из диапазона устойчивости обычных обращенных фаз) на хроматограмме детектируется пик основного компонента [10] – петанина (петунидин-3-O-[6-O-(4-O-(E)-пара-кумароил-O-α-рамнопиранозил)-β-глюкопиранозида]-5-O-β-глюкопиранозида). Эффективность пика относительно невысока (лишь 2000 теоретических тарелок), что связано с сосуществованием двух форм антоцианов-I и II [7, 8].
Рис. 2.
Разделение антоцианов экстракта плодов паслена при различных рН подвижных фаз. Колонка: 4.6 × 100 мм Kromasil 100-5C18. Подвижные фазы: 16 об. % ацетонитрила в 0.01 М фосфатных буферах с заданным рН (1 – 2, 2 – 3, 3 – 4, 4 – 5, 5 – 6, 6 – 6.5), 0.8 мл/мин.
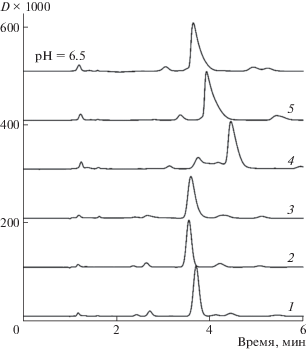
Форма пика и эффективность, выраженная числом теоретических тарелок в данном случае принципиально важны. Уширение пиков (при рассмотрении по методу теоретических тарелок) связано с дисперсией кратности актов сорбции–десорбции. Но кроме этой дисперсии в случае антоцианов возможна еще одна (ортогональная) дисперсия, связанная с сорбцией различных форм. Она обнаруживается в том случае, когда каждой из форм соответствуют различные предельные факторы удерживания. Подобные эффекты хорошо известны в практике спектральных методов [11]. Очевидно, что два пика для каждой из форм могут быть получены одновременно на одной хроматограмме только при очень медленном взаимопревращении – при времени жизни каждой из форм, большим чем время хроматографирования. Примером такого разделения может служить разделение цис- и транс-халконных форм антоцианов [12]. При быстром установлении равновесия получается один “усредненный” по сорбированным состояниям пик. Именно поэтому при дальнейшем росте рН эффективность продолжает снижаться (уменьшается доля флавилиевой формы, и растут доли других форм).
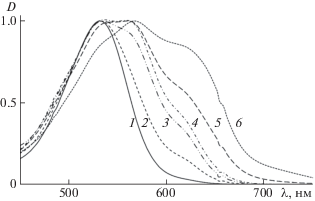
Важным критерием сосуществования нескольких форм могут служить параметры спектров поглощения пиков, записанных в кювете детектора. Нормированные спектры петанина для различных рН подвижных фаз представлены на рис. 3. Если предположить, что спектры поглощения остальных форм антоцианов будут, как и флавилиевая форма, иметь одну доминирующую полосу, то, сопоставляя спектры поглощения на рис. 3, записанные при различных рН, можно считать, что кроме флавилиевой формы появляется минимум две другие формы – одна с максимумом абсорбции в диапазоне 560–580 нм, и другая – в диапазоне 620–650 нм. Это согласуется с литературными данными об образовании незаряженных хиноидных структур и анионной формы таких структур при повышении рН [7, 8].
Рис. 3.
Электронные спектры поглощения петанина в подвижных фазах с различным значением рН: 1 – 2, 2 – 3, 3 – 4, 4 – 5, 5 – 6, 6 – 6.5; D – нормированная оптическая плотность.
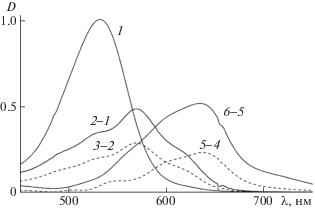
Отметим, что особенно важен в данном случае анализ разностных спектров, получаемых для двух последовательных спектров вычитанием из второго первого, умноженного на понижающий коэффициент. И хотя однозначного критерия для подбора такого коэффициента нет (кроме очевидного запрета на появление пиков с отрицательной оптической плотностью), нетрудно убедиться, что разности для спектров 2 и 1 на рис. 3 аналогичны разности спектров 3 и 2 на рис. 4. Максимум абсорбции в этом случае находится при 569 нм, поэтому такой спектр может быть принят за образ спектра незаряженной хиноидной формы. Следует обратить внимание на то, что на этих спектрах просматривается и полоса с более длинноволновым максимумом. Следовательно, незаряженной форме может сопутствовать и анионная форма, что является обычной ситуацией для систем с множественными равновесиями. Разности спектров пары 6 и 5 (рис. 4) и следующей пары 7 и 6 также похожи друг на друга и могут считаться образом спектра анионной заряженной формы.
Рис. 4.
Спектр флавилиевой формы и разностные спектры спектров на рис. 3, D – относительная оптическая плотность.
Полученные при анализе электронных спектров поглощения пиков, отделенных от примесей в условиях ОФ ВЭЖХ, выводы согласуются с результатами исследований подвижности антоцианов при различных рН методом электрофореза на бумаге [13]. По данным цитируемой работы, мальвидин-3-глюкозид существует при низких рН во флавилиевой форме, превращается в незаряженные формы при рН от 3.5 до 4.5 (рKа = 1.76 ± ± 0.07), затем появляется отрицательно заряженная форма (рKа = 5.36 ± 0.04), концентрация которой постепенно возрастает до рН 8.0. Наконец образуется двухзарядная анионная форма (рKа = = 8.39 ± 0.07), образование которой в условиях обращенно-фазовой ВЭЖХ невозможно из-за быстрого разрушения стационарных фаз на основе модифицированного силикагеля в таких условиях.
Возвращаясь к анализу хроматографического поведения антоцианов отметим, что повышение рН от 2 до 3 приводит к некоторому уменьшению удерживания антоцианов, что может указывать на более слабое удерживание формы псевдооснования (II) по сравнению с флавилиевой формой (I). Это необычно, поскольку удерживание в обращенно-фазовой хроматографии повышается с ростом липофильности, но указанный параметр для незаряженной формы должен быть выше, чем для заряженной. Но, с другой стороны, поплавочный механизм удерживания антоцианов [14] предполагает проникновение плоской флавилиевой структуры между углеводородными радикалами привитой фазы, в то время как форма II не является плоской, что снижает удерживание. Другим примером того же порядка – удерживание неплоского дигидрокверцетина оказывается меньшим по сравнению с удерживанием плоского кверцетина [15], несмотря на замену С=С-связи на две метиленовые группы – процесс, приводящий к существенному росту удерживания жирных кислот и триацилглицеринов [16].
При дальнейшем росте рН от 3 до 4 удерживание немного возрастает, несмотря на рост доли, приходящейся на структуру II. Это может быть следствием только более высокого удерживания плоских хиноидных структур IVа и/или IVб, находящихся в равновесии с другими формами антоцианов. Но хроматограмма антоцианов при рН 5 оказывается наиболее сложной – пик пространственно разделен (с практически идентичными спектрами поглощения во всех точках пика). Более того, форма пика быстро изменяется (для последовательных вводов в хроматограф). Такое поведение было обнаружено ранее в нашей лаборатории при анализе удерживания бетацианинов [17] – соединений, подверженных реакции дециклизации. Возникновение артефактов, которые также могут привести к искажению хроматограмм [18] в настоящей работе было исключено приготовлением растворов петанина в растворителях, идентичных составу подвижной фазы. Анализ изменений площади пика петанина от времени ввода пробы, начиная с момента ее приготовления (рис. 5), позволяет предположить, что изначально образуется преимущественно более липофильная (СLogP = 2.06 ± 0.78) незаряженная хиноидная форма IVа, термодинамически менее устойчивая [19] по сравнению с формой IVб (СLogP = 1.21 ± 0.82). При этом характеристическое время сорбции меньше среднего времени существования частиц IVа и IVб, связанных друг с другом не напрямую, а через флавилиевую форму I, что и служит причиной наблюдаемых изменений при рН 5.0.
Рис. 5.
Относительное изменение площадей пика петанина от времени ввода в хроматограф после приготовления раствора пробы; изменения при рН 5 (1), 6 (2) и 6.5 (3).
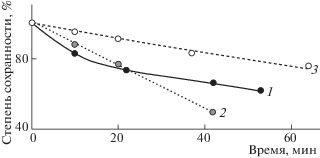
Для антоцианов при рН 6.0 и 6.5 изменение концентрации веществ происходит по иному механизму – характер падения концентрации соответствует нулевому порядку. При этом при повышении рН устойчивость структур несколько возрастает, что может быть следствием стабилизации отрицательно заряженной халконной формы V при полной делокализации заряда по структуре иона [2], отделенной от направления, отвечающего за потерю окраски (I → II → III) двумя равновесиями (рис. 1).
Наконец, существует еще одна специфическая для обращенно-фазовой ВЭЖХ возможность оценки зарядового состояния вещества – исследование изменения его удерживания при добавках ион-парных реагентов. При использовании добавки тетрабутиламмония бромида (0.0025 М) в подвижную фазу было найдено, что удерживание антоцианов при рН 6 увеличивается. Это указывает на присутствие в равновесии анионной хиноидной формы. Примерно вдвое большее увеличение удерживания антоцианов при рН 6.5 указывает на увеличение вклада таких форм при снижении рН. Это полностью подтвердило сделанные выше выводы о формах антоцианов при различных рН.
Список литературы
Fossen T., Cabrita L., Andersen Ø.M. // Food Chem. 1998. V. 63. P. 435.
Welch C.R., Wu Q., Simon J.E. // Curr. Anal. Chem. 2008. V. 4. P. 75.
Boulton R. // Am. J. Enol. Vitic. 2001. V. 52. P. 67.
Trouillas P., Sancho-García J.C., De Freitas V. et al. // Chem. Rev. 2016. V. 116. P. 4937.
Кульченко Я.Ю., Дейнека В.И., Дейнека Л.А., Блинова И.П. // Тонкие химические технологии. 2017. Т. 12. № 6. С. 32.
Дейнека В.И., Кульченко Я.Ю., Блинова И.П. и др. // Химия растительного сырья. 2018. № 1. С. 129.
Brouillard R., Lang J. // Can. J. Chem. 1990. V. 68. P. 755.
Macanita A.L., Moreira P.F.Jr., Lima J.C. et al. // J. Phys. Chem. A. 2002. V. 106. P. 1248.
Deineka V.I., Deineka L.A., Saenko I.I. // J. Anal. Methods Chem. 2015. V. 2015. D 732918.
Sidorov A., Deineka V., Kostenko M. et al. // Res. J. Pharm. Biol. Chem. Sci. 2016. V. 7. P. 2318.
Минкин В.И., Симкин Б.Я., Миняев Р.М. Теория строения молекул. Ростов-на-Дону: Феникс, 1997. С. 440–441.
Preston N.W., Timberlake C.F. // J. Chromat. 1981. V. 214. P. 222.
Asenstofer R.A., Iland P.G., Tate M.E., Jones G.P. // Anal. Biochem. 2003. V. 318. P. 291.
Дейнека В.И., Дейнека Л.А., Саенко И.И., Чулков А.Н. // Журн. физ. химии. 2015. Т. 89. С. 1172.
Дейнека В.И., Дейнека Л.А., Блинова И.П. и др. // Сорбционные и хроматографические процессы. 2016. Т. 16. Вып. 3. С. 377.
Podlaha O., Töregård B. // J. Sep. Sci. 1982. V. 5. P. 553.
Саенко И.И., Дейнека В.И., Дейнека Л.А. // Журн. аналит. химии. 2015. Т. 70. С. 777.
Дейнека В.И., Сидоров А.Н., Дейнека Л.А., Тыняная И.И. // Сорбционные и хроматографические процессы. 2016. Т. 16. Вып. 3. С. 384.
Brouillard R., Chassaing S., Isorez G. et al. //Recent advances in polyphenol research”. V. 2. Ed. by C. Santos-Buelga, M.T. Escribano-Bailon, V. Lattancio. Willey-Blackwell, 2010. P. 8.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии