Журнал физической химии, 2019, T. 93, № 3, стр. 464-470
Характеристики удерживания и энтальпии сорбции сложных эфиров природных гидроксикарбоновых кислот на неподвижной фазе DB-1
С. В. Портнова a, *, Ю. Ф. Ямщикова a, Е. Л. Красных a
a Самарский государственный технический университет
Самара, Россия
* E-mail: kinterm@samgtu.ru
Поступила в редакцию 19.04.2018
Аннотация
Методом газожидкостной хроматографии в интервале температур 90–260°С на неполярной фазе DB-1 изучены характеристики сорбции и удерживания сложных эфиров гликолевой, молочной, яблочной и винной кислот со спиртами С1–С8 линейного строения. Получены величины индексов удерживания исследованных соединений. На основе экспериментально определенных времен удерживания оценены термодинамические характеристики сорбции в условиях предельного разбавления. Установлены зависимости изменения энтальпий сорбции от длины линейного алкильного заместителя и от значения логарифмического индекса удерживания. Показана возможность оценки энергии межмолекулярных взаимодействий эфиров молочной кислоты в жидкой фазе на основе полученных величин энтальпий сорбции и энтальпий испарения.
В настоящее время большой интерес вызывают гидроксикарбоновые кислоты, содержащие одну или две карбоксильные группы (гликолевая, молочная, яблочная, винная) и их сложные эфиры. Он обусловлен возможностью получения на их основе биоразлагаемых полимеров [1–3], обширным применением в пищевой и косметической промышленности [1, 3], а также особенностями структуры данных соединений. Для производства гидроксикарбоновых кислот используются природные возобновляемые сырьевые источники, при этом, как правило, образуются смеси сложного состава [3–5]. Один из способов разделения таких смесей – этерификация кислот спиртами с последующей ректификацией полученной реакционной массы [3]. Для разработки подобной технологии и методов идентификации полученных смесей необходима обширная база данных по величинам энтальпий испарения и характеристикам удерживания в условиях газожидкостной хроматографии сложных эфиров гидроксикарбоновых кислот.
Определение энтальпий испарения, как правило, сопряжено с проведением сложных и трудоемких экспериментов и с необходимостью получения значительных количеств высокочистых образцов исследуемых соединений. В работе [6] было показано, что энтальпии испарения линейно зависят от энтальпии сорбции на неполярной неподвижной фазе в условиях газожидкостной хроматографии (ГЖХ) для разных классов органических соединений, и полученные зависимости могут быть использованы для расчета энтальпий испарения соединений похожего строения. Подобный принцип нами опробован на сложных эфирах гидроксикарбоновых кислот.
Цель данной работы – определение методом ГЖХ характеристик удерживания, их температурных зависимостей и термодинамических характеристик сорбции сложных эфиров гликолевой, молочной, яблочной и винной кислот со спиртами С1–С8 линейного строения, а также выявление закономерностей в изменении исследуемых параметров в зависимости от строения.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез эфиров осуществляли этерификацией гидроксикарбоновых кислот соответствующими спиртами. В случае одноосновных гидроксикарбоновых кислот (гликолевой и молочной) реакцию проводили без катализатора. Для этерификации двухосновных гидроксикарбоновых кислот (яблочной и винной) использовали гетерогенный катализатор – катионит Amberlist 36 DRY.
При проведении реакции этерификации метиловым и этиловым (С1–С2) спиртом мольное соотношение кислота : спирт составляло 1 : 5. Удаление образующейся воды из реакционной массы проводили с помощью процесса перегонки. При этерификации кислот тяжелыми спиртами (С3–С8) мольное соотношение кислота : спирт составляло 1 : 3. Для удаления реакционной воды применяли азеотропообразующий агент – бензол и насадку Дина–Старка.
Очистку полученных соединений осуществляли фракционной перегонкой под вакуумом. Анализ реакционной массы и полученных эфиров гидроксикарбоновых кислот проводили методом ГЖХ с использованием программно-аппаратного комплекса Хроматек–Аналитик на базе газового хроматографа “Кристалл-2000М” с пламенно-ионизационным детектором и капиллярной колонкой размером 100 м × 0.2 мм × 0.5 мкм с привитой неподвижной жидкой фазой (НЖФ) – диметилполисилоксаном – DB-1. Температура испарителя 250°С, температура детектора – 280°С, газ-носитель – гелий, деление потока 1/80, объем пробы 0.2 мкл. Для анализа использовали следующий температурный режим колонки: начальную температуру поддерживали в течение 20 мин (100°С или 150°С – при анализе эфиров молочной кислоты спиртов С3–С5), далее проводили нагрев термостата до 260°С со скоростью нагрева 5 К/мин. Чистота полученных образцов составила 98–99 мас. %.
Определение характеристик сорбции осуществляли на том же приборе в изотермическом режиме с использованием методик, описанных в работах [7, 8]. Температура испарителя составляла 250°С, температура детектора – 280°С, газ-носитель – гелий, деление потока 1/80, объем пробы 0.2 мкл, температура термостата 90–260°С. При подготовке пробы в 1 мл метанола растворяли 1 мкл исследуемого соединения и по 1 мкл н-алканов с числом атомов углерода z и z + 1, подобранных таким образом, чтобы время удерживания исследуемого соединения находилось между временами удерживания алканов.
Расчет индексов удерживания проводили по формуле Ковача [9]:
(1)
${{I}_{x}} = \frac{{\ln (t_{x}^{'}) - \ln (t_{z}^{'})}}{{\ln (t_{{z + 1}}^{'}) - \ln (t_{z}^{'})}}100 + 100z,$Величины изменения внутренней энергии ${{\Delta }_{{{\text{с о р б }}}}}\bar {U}$ (кДж/моль) и энтальпии ${{\Delta }_{{{\text{с о р б }}}}}\bar {H}$ сорбции (кДж/моль) при средней температуре эксперимента определяли из зависимостей [8, 10, 11]:
(2)
$\ln \left( {\frac{k}{T}} \right) = C - \frac{{{{\Delta }_{{{\text{с о р б }}}}}\bar {U}}}{{RT}},$(5)
$\begin{gathered} {{\Delta }_{{{\text{с о р б }}}}}H(T) = {{\Delta }_{{{\text{с о р б }}}}}\bar {H}({{T}_{{{\text{с р }}}}}) + \mathop \smallint \limits_{{{T}_{{{\text{с р }}}}}}^T ( - \Delta _{{\text{ж }}}^{n}C_{p}^{{^{ \circ }}})dT = \\ = \;{{\Delta }_{{{\text{с о р б }}}}}\bar {H}({{T}_{{{\text{с р }}}}}) + ( - \Delta _{{\text{ж }}}^{n}C_{p}^{{^{ \circ }}})\Delta (T - {{T}_{{{\text{с р }}}}}), \\ \end{gathered} $ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Индексы удерживания
В табл. 1 представлены экспериментальные значения индексов удерживания и коэффициенты их температурных зависимостей для всех исследованных соединений. Погрешность измерения величин I составляла менее 1.2 е.и. К сожалению, сравнить полученные величины с литературными не представляется возможным, поскольку имеющиеся данные [13, 14] определены на неполярной фазе при программировании температуры.
Таблица 1.
Экспериментальные значения индексов удерживания и коэффициенты температурных зависимостей сложных эфиров гидроксикарбоновых кислот (I = aTс+ b, Tс– температура колонки)
| nС | I, ед. | ΔI/ΔT | a | b | R2 | |||
|---|---|---|---|---|---|---|---|---|
| Сложные эфиры гликолевой кислоты | ||||||||
| 363.15 K | 373.15 K | 383.15 K | 393.15 K | – | – | – | – | |
| 1 | 675.4 ± 0.1 | 675.6 ± 0.1 | 675.9 ± 0.2 | 676.2 ± 0.2 | 0.2 | 0.025 | 673.0 | 0.970 |
| 2 | 757.1 ± 0.1 | 757.1 ± 0.1 | 757.3 ± 0.3 | 757.3 ± 0.1 | 0.1 | 0.009 | 756.2 | 0.655 |
| 3 | 855.8 ± 0.1 | 856.0 ± 0.1 | 856.3 ± 0.1 | 856.6 ± 0.1 | 0.3 | 0.027 | 853.2 | 0.965 |
| 4 | 956.4 ± 0.1 | 956.7 ± 0.1 | 957.1 ± 0.1 | 957.9 ± 0.1 | 0.5 | 0.046 | 952.1 | 0.951 |
| 373.15 K | 383.15 K | 393.15 K | 403.15 K | – | – | – | – | |
| 5 | 1056.8 ± 0.3 | 1057.5 ± 0.2 | 1058.2 ± 0.1 | 1058.9 ± 0.1 | 0.7 | 0.068 | 1050 | 0.999 |
| Сложные эфиры молочной кислоты | ||||||||
| 1 | 717.6 ± 0.7 | 717.9 ± 0.1 | 718.1 ± 0.1 | 718.4 ± 0.1 | 0.3 | 0.026 | 715.2 | 0.988 |
| 2 | 794.6 ± 0.1 | 794.6 ± 0.1 | 794.7 ± 0.1 | 795.1 ± 0.1 | 0.2 | 0.016 | 793.0 | 0.784 |
| 3 | 889.9 ± 0.4 | 890.3 ± 0.1 | 890.6 ± 0.1 | 891.2 ± 0.1 | 0.4 | 0.040 | 886.1 | 0.962 |
| 4 | 987.8 ± 0.1 | 988.1 ± 0.1 | 988.5 ± 0.1 | 989.3 ± 0.1 | 0.5 | 0.051 | 983.0 | 0.942 |
| 5 | 1086.1 ± 0.1 | 1086.5 ± 0.1 | 1087.1 ± 0.1 | 1088.0 ± 0.1 | 0.6 | 0.061 | 1080 | 0.968 |
| 393.15 K | 403.15 K | 413.15 K | 423.15 K | – | – | – | – | |
| 6 | 1187.6 ± 0.1 | 1188.3 ± 0.1 | 1189.2 ± 0.1 | 1190.3 ± 0.1 | 0.9 | 0.096 | 1374 | 0.991 |
| 7 | 1287.4 ± 0.1 | 1288.2 ± 0.1 | 1289.0 ± 0.1 | 1290.3 ± 0.1 | 1.0 | 0.096 | 1275 | 0.984 |
| 8 | 1386.6 ± 0.1 | 1387.4 ± 0.1 | 1388.4 ± 0.1 | 1389.5 ± 0.1 | 1.0 | 0.090 | 1176 | 0.991 |
| Сложные эфиры яблочной кислоты | ||||||||
| 503.15 K | 513.15 K | 523.15 K | 533.15 K | – | – | – | – | |
| 1 | 1101.7 ± 0.2 | 1104.9 ± 0.9 | 1108.2 ± 0.8 | 1110.9 ± 1.2 | 3.1 | 0.31 | 1030.9 | 0.999 |
| 2 | 1240.6 ± 0.1 | 1242.4 ± 0.3 | 1244.0 ± 0.4 | 1245.6 ± 0.2 | 1.7 | 0.17 | 1202.4 | 0.999 |
| 3 | 1431.4 ± 0.1 | 1433.5 ± 0.2 | 1435.6 ± 0.3 | 1437.7 ± 0.1 | 2.1 | 0.21 | 1383.6 | 0.999 |
| 4 | 1620.8 ± 0.1 | 1623.2 ± 0.2 | 1625.8 ± 0.4 | 1627.9 ± 0.1 | 2.4 | 0.24 | 1565.8 | 0.999 |
| 5 | 1811.0 ± 0.2 | 1813.9 ± 0.5 | 1817.5 ± 1.2 | 1819.2 ± 0.1 | 2.7 | 0.28 | 1746.5 | 0.980 |
| Сложные эфиры винной кислоты | ||||||||
| – | – | – | – | |||||
| 1 | 1188.3 ± 0.1 | 1192.1 ± 0.3 | 1196.2 ± 0.1 | 1201.4 ± 0.3 | 4.0 | 0.397 | 1097.0 | 0.988 |
| 2 | 1332.9 ± 0.2 | 1336.0 ± 0.1 | 1339.3 ± 0.2 | 1343.6 ± 0.2 | 3.3 | 0.328 | 1257.0 | 0.991 |
| 3 | 1521.3 ± 0.1 | 1524.2 ± 0.1 | 1526.9 ± 0.1 | 1530.2 ± 0.1 | 2.8 | 0.280 | 1457.0 | 0.996 |
| 4 | 1714.3 ± 0.1 | 1717.6 ± 0.1 | 1720.8 ± 0.1 | 1724.4 ± 0.1 | 3.2 | 0.323 | 1640.0 | 0.998 |
Необходимо отметить, что для эфиров молочной кислоты приращение индексов при увеличении температуры на 10°С не превышало 1 е.и., в случае яблочной кислоты – 2–3 е.и., а для винной кислоты – 3–4 е.и. Таким образом, каждая следующая гидроксильная или эфирная группа дает приращение ~1 е.и. на каждые 10°С. Полученные результаты согласуются с данными по изменению величин индексов удерживания для сложных эфиров дикарбоновых кислот и моно- и диалкиловых эфиров глицерина, изученных ранее [7, 8].
Температурные зависимости индексов удерживания для всех исследованных соединений имеют линейный характер, что свидетельствует об отсутствии взаимодействия между молекулами вещества в сорбенте [15]. Коэффициенты полученных уравнений приведены в таблице 1. Они позволяют провести расчет индексов и идентифицировать рассмотренные в работе эфиры при других температурах вблизи исследованного интервала.
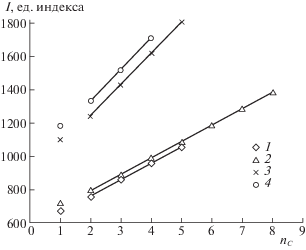
Были получены зависимости величин индексов удерживания от длины линейного алкильного заместителя (nC) при температурах 120°С для гликолевой и молочной кислот и 230°С для яблочной и винной кислот (рисунок 1). Уравнения зависимостей:
Рис. 1.
Зависимости индексов удерживания от длины линейного алкильного заместителя (nC) при 393.15 К для сложных эфиров гликолевой (1) и молочной (2) кислот и при 503.15 К для эфиров яблочной (3) и винной кислот (4).
для эфиров гликолевой кислоты
для эфиров молочной кислоты
для эфиров яблочной кислоты
для эфиров винной кислоты
Из рисунка 1 видно, что полученные зависимости линейны. Изменение индекса удерживания ΔI, приходящееся на одну СН2-группу в спиртовой части молекул сложных эфиров, составляет 100.3 ед. для эфиров гликолевой кислоты, 98.75 ед. – для эфиров молочной кислоты, 95 и 95.3 ед. – для эфиров яблочной и винной кислот соответственно. Исключением являются метиловые эфиры гидроксикарбоновых кислот, для них изменение индекса удерживания значительно ниже: 81.1, 76.7, 69.5 и 72.3 ед. – для гликолевой, молочной, яблочной и винной кислоты соответственно. Подобные отклонения характерны для первых представителей гомологических рядов и могут быть объяснены эффектом альтернирования, который был отмечен для сложных эфиров карбоновых и дикарбоновых кислот [16].
Для сложных эфиров молочной кислоты линейная зависимость индексов удерживания сохраняется при увеличении длины алкильного фрагмента до С8. Следовательно, ввиду схожести строения можно предположить, что для сложных эфиров других гидроксикарбоновых кислот величины индексов удерживания также линейно будут увеличиваться при изменении длины алкильного фрагмента. Таким образом, уравнения (6)–(9) могут быть использованы для расчета индексов удерживания линейных эфиров гликолевой, яблочной и винной кислот и спиртов от С6 до С8.
Энтальпии сорбции
Результаты расчета величин ${{\Delta }_{{{\text{с о р б }}}}}\bar {H}$ и ${{\Delta }_{{{\text{с о р б }}}}}H^\circ $ (298.2 К), полученных на основе времен удерживания, представлены в табл. 2. Погрешность определения в среднем не превышает 0.7 кДж/моль. Анализ данных показывает, что зависимости величин ${{\Delta }_{{{\text{с о р б }}}}}\bar {H}$ от длины алкильного заместителя (nC) линейны (рис. 1) и приращение на метиленовый фрагмент для всех эфиров находится в интервале от –3.9 до –4.8 кДж/моль, что в пределах погрешности совпадает с вкладом метиленового фрагмента для ранее исследованных сложных эфиров триметилолпропана [17], а также простых эфиров глицерина и ацеталей [6]. По разности значений ${{\Delta }_{{{\text{с о р б }}}}}H^\circ $(298.2 К) эфиров яблочной и винной кислот, которые отличаются на гидроксильную группу, можно определить вклад второй вицинальной гидроксильной группы. Полученное значение составило в среднем 9.5 кДж/моль.
Таблица 2.
Результаты расчета энтальпии сорбции (кДж/моль)
| nС | $ - \Delta _{{\text{ж }}}^{п }C_{p}^{{^{ \circ }}}$, Дж/(моль К) | Тср, К | $ - {{\Delta }_{{{\text{с о р б }}}}}\bar {H}$ (Тср) | $ - {{\Delta }_{{{\text{с о р б }}}}}H^\circ $ (298.2 K) |
|---|---|---|---|---|
| Сложные эфиры гликолевой кислоты | ||||
| 1 | 88.1 | 378.2 | 34.7 ± 0.4 | 41.7 |
| 2 | 95.2 | 378.2 | 38.0 ± 0.4 | 45.6 |
| 3 | 102.4 | 378.2 | 41.6 ± 0.4 | 49.8 |
| 4 | 109.5 | 378.2 | 45.4 ± 0.4 | 54.2 |
| 5 | 116.6 | 378.2 | 49.1 ± 0.3 | 59.6 |
| Сложные эфиры молочной кислоты | ||||
| 1 | 92.3 | 378.2 | 37.5 ± 0.7 | 44.9 |
| 2 | 99.4 | 378.2 | 39.6 ± 0.4 | 47.6 |
| 3 | 106.6 | 378.2 | 43.1 ± 0.4 | 51.6 |
| 4 | 113.7 | 378.2 | 46.8 ± 0.4 | 55.9 |
| 5 | 120.8 | 378.2 | 50.6 ± 0.4 | 60.2 |
| 6 | 127.9 | 408.2 | 52.4 ± 0.4 | 66.4 |
| 7 | 135.1 | 408.2 | 56.2 ± 0.4 | 71.1 |
| 8 | 142.2 | 408.2 | 60.0 ± 0.4 | 75.7 |
| Сложные эфиры яблочной кислоты | ||||
| 1 | 135.9 | 518.2 | 44.1 ± 0.5 | 74.0 |
| 2 | 141.6 | 518.2 | 48.4 ± 0.5 | 79.6 |
| 3 | 151.0 | 518.2 | 53.7 ± 0.4 | 87.0 |
| 4 | 161.5 | 518.2 | 59.3 ± 0.4 | 94.8 |
| 5 | 172.8 | 518.2 | 65.0 ± 0.4 | 103.0 |
| Сложные эфиры винной кислоты | ||||
| 1 | 175.1 | 518.2 | 45.6 ± 0.3 | 83.2 |
| 2 | 180.7 | 518.2 | 49.9 ± 0.3 | 88.8 |
| 3 | 190.1 | 518.2 | 55.7 ± 0.3 | 96.6 |
| 4 | 200.6 | 518.2 | 61.6 ± 0.3 | 104.7 |
Рассмотрены зависимости величин ${{\Delta }_{{{\text{с о р б }}}}}H^\circ $(298.2 К) от значений логарифмических индексов удерживания. Для эфиров гликолевой и молочной кислот имеется общая линейная зависимость, что достаточно логично, поскольку структуры эфиров подобны и содержат в своем составе одну гидроксильную, одну карбоксильную группы и отличаются суммарно на метиленовый фрагмент. Эта зависимость описывается уравнением
(10)
$\begin{gathered} {{\Delta }_{{{\text{с о р б }}}}}H^\circ (298.2\;{\text{К }}) = - 0.048{{I}_{{393}}}{\;} - {\;}8.6, \\ {{R}^{2}} = 0.997, \\ \end{gathered} $В случае эфиров яблочной и винной кислот зависимости величин ${{\Delta }_{{{\text{с о р б }}}}}H^\circ $(298.2 К) от I503 линейны и описываются уравнениями:
(11)
$\begin{gathered} {{\Delta }_{{{\text{с о р б }}}}}H^\circ (298.2\;{\text{К }}) = - 0.041{{I}_{{503}}}{\;} - {\;}28.3, \\ {{R}^{2}} = 0.999, \\ \end{gathered} $(12)
$\begin{gathered} {{\Delta }_{{{\text{с о р б }}}}}H^\circ (298.2\;{\text{К }}) = - 0.041{{I}_{{503}}}{\;} - {\;}34.3, \\ {{R}^{2}} = {\text{ }}0.999. \\ \end{gathered} $Данные зависимости параллельны. Это связано с отличием структуры эфиров яблочной и винной кислот на гидроксильную группу, вклад которой постоянен. Таким образом, полученные уравнения могут быть использованы для прогнозирования значения ${{\Delta }_{{{\text{с о р б }}}}}H^\circ $(298.2 К) сложных эфиров яблочной и винной кислот, при известном значении логарифмического индекса удерживания, определенном на неполярной неподвижной фазе при температуре 393 К.
Взаимосвязь энтальпий сорбции и энтальпий испарения
Как известно, энтальпии сорбции и испарения связаны между собой следующим уравнением [11]:
(13)
$\Delta {{H}^{{E,\infty }}}(T) = {{\Delta }_{{{\text{и с п }}}}}H^\circ (T) + {{\Delta }_{{{\text{с о р б }}}}}H^\circ (T),$В работе [18] было показано, что для соединений, содержащих ОН-группу, в жидкой фазе реализуются межмолекулярные взаимодействия (ММВ, водородные связи). В газовой фазе и в сорбированном состоянии на неполярной фазе таких взаимодействий нет. При определении характеристик удерживания были использованы разбавленные растворы и деление потока 1 к 80. Следовательно, можно принять, что хроматографирование проходило в условиях предельного разбавления, и исключить возможность межмолекулярного взаимодействия сорбат–сорбат. Таким образом, в первом приближении $\Delta {{H}^{{E,\infty }}}(T)$ можно рассматривать как величину, показывающую уровень энергии водородной связи между молекулами сложных эфиров гидроксикарбоновых кислот в жидкой фазе.
В литературе представлены данные по ${{\Delta }_{{{\text{и с п }}}}}H^\circ (298.2\;{\text{К }})$ для эфиров молочной кислоты (табл. 3) [19–23]. В табл. 3 также представлены результаты расчета избыточной энтальпии смешения $\Delta {{H}^{{E,\infty }}}(298.2\;{\text{К }})$ по уравнению (13). Видно, что $\Delta {{H}^{{E,\infty }}}(298.2\;{\text{К }})$ практически для всех эфиров находится на уровне 2.9–6.6 кДж/моль, и среднее значение составляет 4.9 кДж/моль, за исключением данных для бутилового эфира [19, 21, 23], которые не были включены в обработку.
Таблица 3.
Результаты расчета избыточной энтальпии сорбции $\Delta {{H}^{{E,\infty }}}\left( {298.2} \right)$ для сложных эфиров молочной кислоты (кДж/моль)
| Соединение | ${{\Delta }_{{{\text{и с п }}}}}H^\circ \left( {298.2} \right)$, эксп. | Лит. | $ - {{\Delta }_{{{\text{с о р б }}}}}H^\circ $ (298.2 K) | $\Delta {{H}^{{E,\infty }}}\left( {298.2} \right)$ | ${{\Delta }_{{{\text{и с п }}}}}H^\circ \left( {298.2} \right)$, расч.a | ΔΔb |
|---|---|---|---|---|---|---|
| Метиллактат | 49.8 ± 1.1 | [19] | 44.9 | 4.9 | 49.8 | –0.7 |
| 50.3 ± 1.1 | [20] | 5.4 | –0.2 | |||
| Этиллактат | 53.8 ± 1.6 | [20] | 47.6 | 6.2 | 52.5 | 0.7 |
| 54.2 ± 1.1 | [21] | 6.6 | 1.1 | |||
| 52.0 ± 0.4 | [19] | 4.4 | –1.1 | |||
| 53.1 ± 0.8 | [22] | 5.5 | 0 | |||
| н-Пропиллактат | 56.3 ± 0.5 | [20] | 51.6 | 4.7 | 56.5 | –0.9 |
| н-Бутиллактат | 61.1 ± 0.6 | [20] | 55.9 | 5.2 | 60.8 | –0.4 |
| 63.8 ± 1.1 | [23] | 7.9c | – | |||
| 59.2 ± 1.2 | [21] | 3.3c | – | |||
| 57.9 ± 0.5 | [19] | 2.0c | – | |||
| н-Пентиллактат | 65.1 ± 0.5 | [20] | 60.2 | 4.9 | 65.1 | –0.7 |
| н-Гексиллактат | 69.7 ± 0.6 | [20] | 66.4 | 3.3 | 71.3 | –1.7 |
| н-Гептиллактат | – | – | 71.1e | 4.9d | 76.0 | – |
| н-Октиллактат | 78.6 ± 0.8 | [20] | 75.7 | 2.9 | 80.6 | –2 |
a - расчет по уравнению (14).
b – разность ${{\Delta }_{{{\text{и с п }}}}}H^\circ \left( {298.2} \right)$эксп. – ${{\Delta }_{{{\text{и с п }}}}}H^\circ \left( {298.2} \right)$расч.
e – получено по уравнению (7).
Расчет величин энтальпий испарения при 298.2 К был проведен по уравнению:
(14)
${{\Delta }_{{{\text{и с п }}}}}H^\circ (298.2\;{\text{К }}) = - {{\Delta }_{{{\text{с о р б }}}}}H^\circ (298.2\;{\text{К }}) + 4.9.$Полученные значения энтальпий испарения при 298.2 К хорошо согласуются с экспериментальными данными и различие рассчитанных и литературных величин не превышает 2 кДж/моль (табл. 3).
ЗАКЛЮЧЕНИЕ
Методом газожидкостной хроматографии в интервале температур 90–260°С на неполярной фазе DB-1 изучены характеристики удерживания и сорбции сложных эфиров гликолевой, молочной, яблочной и винной кислот со спиртами С1–С8 линейного строения. Получены зависимости изменения логарифмических индексов от температуры, а также зависимости изменения энтальпий сорбции от значения логарифмического индекса удерживания. Показано, что полученные уравнения могут быть использованы для прогнозирования величин ${{\Delta }_{{{\text{с о р б }}}}}H^\circ $(298.2 К) веществ, имеющих сходное строение при известном значении логарифмического индекса удерживания. По полученным величинам энтальпии сорбции и известным значениям энтальпии испарения при 298.2 К оценена энергия водородной связи между молекулами эфиров молочной кислоты в жидкой фазе (4.9 кДж/моль).
Данная работа выполнена при финансовой поддержке Российского фонда фундаментальных исследований (код проекта № 17-08-00967 а).
Список литературы
Wolf O., Patel V., Marscheider-Weidemann F. et al. Techno-Economic Feasibility of Large-Scale Production of Bio-Based Polymers in Europe. Technical Report EUR 22103EN. European Communities, 2005. 260 p.
Keramatnia F., Jouybanc A., Valizadehd H. et al. // Fluid Phase Equilibria. 2016. V. 425. P. 108.
Vijayakumar J., Aravindan R., Viruthagiri T. // Chem. Biochem. Eng. Q. 2008. V. 22. P. 245–264.
Özcelika S., Kuleyb E., Özogulb F. // LWT – Food Science and Technology. 2016. V. 73. P. 536.
Zou X., Yanga J., Tiana X. et al. // Process Biochemistry. 2016. V. 51. Is. 1. P. 16.
Chickos J.S., Hosseini S., Hesse D.G. // Thermochimica Acta. 1995. V. 249. P. 41.
Липп (Портнова) С.В., Красных Е.Л., Леванова С.В. // Журн. аналит. химии. 2008. Т. 63. № 4. С. 383.
Жабина А.А., Красных Е.Л. // Журн. физ. химии. 2017. Т. 91. № 12. С. 2132–2136.
Яшин Я.И., Яшин Е.Я., Яшин А.Я. Газовая хроматография / М.: Изд-во “ТрансЛит”, 2009. 528 с.
Kovats E., Foty G., Dallos A. // J. Chromatogr. A. 2004. V. 1046. P. 185.
Görgényi M., Héberger K. // J. Chromatogr. Sci. 1999. V. 37. P. 11.
Портнова С.В., Красных Е.Л. // Журн. структур. химии. 2017. Т. 58. № 4. С. 739.
Fan, W., Qian, M.C. // Flavour Fragr. J. 2006. V. 21. Is. 2. P. 333.
da Fonseca, A.M., Bizerra, A.M.C., de Souza et al. // Braz. J. Pharmacognosy. 2009. V. 19. Is. 1B. P. 193.
Pavlovskii A.A., Hérberger K., Zenkevich I.G. // J. Chromatogr. A. 2016. V. 1445. P. 126.
Портнова С.В. Термодинамические характеристики равновесия жидкость–пар сложных эфиров дикарбоновых кислот: Автореф. дис…. канд. хим наук. Самара: СамГТУ, 2010. 24 с.
Красных Е.Л., Александров А.Ю., Соколова А.А. и др. // Журн. физ. химии. 2017. Т. 91. № 2. С. 372.
Красных Е.Л. // Журн. структур. химии. 2009. Т. 50. № 4. С. 577.
Lomba L., Ginera B., Zuriaga E. et al.// Thermochimica Acta. 2014. V. 575. P. 305.
Rechberg C.E., Dixon M.B. // J. Am. Chem. Soc. 1950. V. 72. P. 1918.
Pena-Tejedor S., Murga R., Sanz M.T. et al. // Fluid Phase Equilib. 2005. V. 230. P. 197.
Matsuda H., Inaba K., Sumida H. et al. // Ibid. 2016. V. 420. P. 50.
Stephenson R.M., Malanowski S. Handbook of the Thermodynamics of Organic Compounds. New York: Elsevier, 1987. 234 p.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии