Журнал физической химии, 2019, T. 93, № 3, стр. 448-453
ТЕОРЕТИЧЕСКИЙ АНАЛИЗ ИЗМЕНЕНИЯ СЕЛЕКТИВНОСТИ ИОННОГО ОБМЕНА ДЛЯ СИСТЕМ ВЫТЕСНИТЕЛЬНОЙ КОМПЛЕКСООБРАЗОВАТЕЛЬНОЙ ХРОМАТОГРАФИИ
О. В. Харитонов a, Л. А. Фирсова a, *, Е. А. Козлитин a
a Российская академия наук, Институт физической химии и электрохимии им. А.Н. Фрумкина
Москва, Россия
* E-mail: Lubovfirsova@mail.ru
Поступила в редакцию 16.05.2018
Аннотация
Проведен теоретический анализ селективности ионного обмена вытеснительной комплексообразовательной хроматографии (ВКХ). Установлено, что коффициенты разделения, определенными другими методами комплексообразовательной хроматографии, фронтальной и элютивной, не всегда взаимозаменяемы с ВКХ. Предложена методика определения коэффициентов разделения применительно к ВКХ. Предложен способ построения изотерм ионного обмена разделяемых компонентов при одновременном присутствии в системе ионов вытеснителя, водорода и сорбированного комплексона. Рассмотрено изменение селективности разновалентных элементов. Для протонированных комплексов полное обращение селективности соответствует переходу изотермы разделения из выпуклой в вогнутую через S-образную. При одновременном присутствии в системе протонированных и биядерных комплексов М2А обращение селективности сопровождается появлением смешанных изотерм переменного типа, имеющих две точки пересечения с диагональю. Определено размытие фронтов вытеснения методом Мак–Кэба и Тиле. При выпуклой изотерме, имеющей S-образный вид, наблюдается размытие нижней части фронта вытеснения второго компонента. Для сложных изотерм, имеющих два максимума, при достаточно острых нижних и верхних частях фронта размывается середина фронта.
Для всех видов катионообменной комплексообразовательной хроматографии – фронтальной (ФКХ), элютивной (ЭКХ) и вытеснительной (ВКХ) – коэффициент разделения для равновалентных элементов определяется следующим уравнением:
(1)
${{\alpha }_{{{{{\text{M}}}_{b}} - {{{\text{M}}}_{a}}}}} = \frac{{{{P}_{{{{{\text{M}}}_{a}}}}}}}{{{{P}_{{{{{\text{M}}}_{b}}}}}}}{{K}_{{{{{\text{M}}}_{b}} - {{{\text{M}}}_{a}}}}},$ $\sum {[{{{\text{M}}}_{i}}{{{\text{A}}}_{j}}{{{\text{H}}}_{k}}]} $ – сумма концентраций комплексов, образующихся в системе, моль/л.
$\sum {[{{{\text{M}}}_{i}}{{{\text{A}}}_{j}}{{{\text{H}}}_{k}}]} $ – сумма концентраций комплексов, образующихся в системе, моль/л.
Поскольку экспериментальное определение коэффициентов разделения методом ВКХ весьма затруднительно, то в ВКХ используют коэффициенты разделения, определяемыми другими методами комплексообразовательной хроматографии – ФКХ и ЭКХ. Возникает принципиальный вопрос о применимости коэффициентов разделения, экспериментально определяемых с помощью ФКХ и ЭКХ, для ВКХ.
Для комплексов состава МА и МНА при сохранении условия ${{P}_{{\text{M}}}}$ $ \gg $ 1 коэффициент разделения зависит только от концентрации ионов водорода [H] в соответствии с уравнением:
(2)
${{\alpha }_{{{{{\text{M}}}_{b}} - {{{\text{M}}}_{a}}}}} = {{K}_{{{{{\text{M}}}_{b}} - {{{\text{M}}}_{a}}}}}\frac{{{{K}_{{{{{\text{M}}}_{a}}{\text{A}}}}}(1 + {\text{[H]}}{{K}_{{{{{\text{M}}}_{a}}{\text{HA}}}}})}}{{{{K}_{{{{{\text{M}}}_{b}}{\text{A}}}}}(1 + {\text{[H]}}{{K}_{{{{{\text{M}}}_{b}}{\text{HA}}}}})}},$Если значение pH элюирующих растворов ФКХ и ЭКХ соответствует значению pH элюатов ВКХ, то коэффициенты разделения могут быть взаимозаменяемо использованы для всех видов комплексообразовательной хроматографии практически без ограничений.
При образовании биядерных комплексов для ФКХ, если создать искусственную смесь, где соотношение между комплексообразователем и комплексоном будет соответствовать составу элюатов ВКХ [1], коэффициенты разделения также могут быть использованы. В элютивной хроматографии, где разделяемые элементы используются обычно в микроконцентрациях, биядерные комплексы не образуются, поэтому коэффициенты разделения, определяемые методом ЭКХ, для ВКХ не применимы.
При использовании нитрилотриацетата (НТА) в качестве комплексообразующего реагента справедливо выражение:
(3)
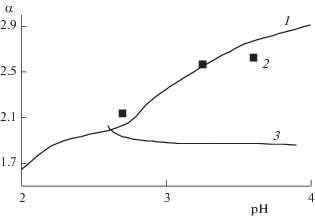
${{\alpha }_{{{{{\text{M}}}_{b}} - {{{\text{M}}}_{a}}}}} = {{K}_{{{{{\text{M}}}_{b}} - {{{\text{M}}}_{a}}}}}\frac{{{{K}_{{{{{\text{M}}}_{a}}{\text{A}}}}}(1 + {\text{[A]}}{{K}_{{{{{\text{M}}}_{a}}{{{\text{A}}}_{2}}}}})}}{{{{K}_{{{{{\text{M}}}_{b}}{\text{A}}}}}(1 + {\text{[A]}}{{K}_{{{{{\text{M}}}_{b}}{{{\text{A}}}_{2}}}}})}}.$При образовании моно- и бикомплексов в системах ВКХ концентрация лиганда с увеличением концентрации иона вытеснителя уменьшается и, следовательно, уменьшается доля бикомплексов, возрастает доля монокомплексов. Для большинства РЗЭ и ТПЭ различие в константах комплексообразования бикомплексов превышает различие в константах для монокомплексов [2–4]. Следовательно, любое увеличение концентрации иона-вытеснителя должно приводить к уменьшению коэффициентов разделения РЗЭ и ТПЭ (рис. 1, кривая 3). Увеличение значения рН исходного раствора в ЭКХ и ФКХ приводит к увеличению полноты диссоциации комплексона, возрастанию концентрации лиганда и, следовательно, к увеличению коэффициентов разделения (рис. 1, кривая 1). Таким образом, как показано на рис. 1, изменение значения рН оказывает диаметрально противоположное влияние на изменение коэффициентов разделения в ВКХ и определяемых ЭКХ и ФКХ при разделении РЗЭ и ТПЭ с помощью НТА.
Рис. 1.
Изменение коэффициентов разделения Nd и Pr для 0.0523 моль/л НТА при t = 25°С, определяемых фронтальным методом, в зависимости от рН, кривая 1 – расчет, точки 2 – эксперимент [1]. Кривая 3 – расчет для ВКХ.
Из всего вышеизложенного следует, что определение коэффициентов разделения в ВКХ должно проводиться в две стадии. На первой стадии – вытеснительной – проводится элюирование смеси разделяемых элементов элюентом определенного состава. Далее отбираются фракции чистых компонентов. На второй стадии, фронтальной, смешиваются фракции чистых компонентов с содержанием их в смеси от 0 до 100%. Полученная смесь пропускается через колонку до полного насыщения, дальше проводится десорбция. По составу десорбатов определяется состав твердой фазы. Далее, зная состав твердой и жидкой фаз, рассчитывается коэффициент разделения как отношение коэффициентов распределения [5].
Для разновалентных элементов, если выразить коэффициент разделения через константы обмена с вытеснителем, получается относительно простое уравнение, отличающееся от уравнения для равновалентных элементов наличием члена, характеризующего режим параллельного переноса $(Q{\text{/}}[{{{\tilde {D}}}_{P}}])$:
(4)
$\begin{gathered} {{\alpha }_{{{{{\text{M}}}_{b}} - {{{\text{M}}}_{a}}}}} = \frac{{{{P}_{{{{{\text{M}}}_{a}}}}}}}{{{{P}_{{{{{\text{M}}}_{b}}}}}}}\frac{{{{K}_{{{{{\text{M}}}_{b}} - {\text{D}}}}}}}{{{{K}_{{{{{\text{M}}}_{a}} - {\text{D}}}}}}}{{\left( {\frac{Q}{{[{{{{\tilde {D}}}}_{P}}]}}} \right)}^{{{{n}_{{{{{\text{M}}}_{b}}}}} - {{n}_{{{{{\text{M}}}_{a}}}}}}}} = \\ = \;\frac{{{{P}_{{{{{\text{M}}}_{a}}}}}}}{{{{P}_{{{{{\text{M}}}_{b}}}}}}}\frac{{K_{{{{{\text{M}}}_{b}} - {\text{D}}}}^{{\text{*}}}}}{{K_{{{{{\text{M}}}_{a}} - {\text{D}}}}^{{\text{*}}}}}{{\left( {\frac{1}{{[{{{{\tilde {D}}}}_{p}}]}}} \right)}^{{{{n}_{{{{{\text{M}}}_{b}}}}} - {{n}_{{{{{\text{M}}}_{a}}}}}}}}, \\ \end{gathered} $Для определения порядка вымывания разделяемых элементов необходимо рассмотреть и построить парциальную изотерму ионного обмена. В первом приближении тип изотермы можно определить, исходя из значений предельных коэффициентов разделения ${{\alpha }_{{{{{\text{M}}}_{b}} - {{{\text{M}}}_{a}}}}}(0)$ и ${{\alpha }_{{{{{\text{M}}}_{b}} - {{{\text{M}}}_{a}}}}}(\max )$ в верхней и нижней точках изотермы [6]:
| α(о) > 1 и α(max) > 1 – выпуклая | α(о) < 1 и α(max) > 1 – s-образная |
| α(о) < 1 и α(max) < 1 – вогнутая | α(о) > 1 и α(max) < 1 – σ-образная. |
Исходными параметрами для расчета предельных коэффициентов разделения служат соответствующие концентрации, полученные из расчета индивидуальных зон разделяемых элементов [7]. В зоне каждого элемента действуют рекуррентные соотношения, характеризующие режим параллельного переноса:
(5)
$\begin{gathered} \frac{{[\overline {{{{\text{M}}}_{a}}} ]}}{{[{{{\text{M}}}_{a}}_{{_{p}}}]}} = \frac{{[{{{{\bar {M}}}}_{b}}]}}{{[{{{\text{M}}}_{{{{b}_{p}}}}}]}} = \frac{{[{\bar {D}}] - [{{{{\bar {D}}}}_{0}}]}}{{[{{{\text{D}}}_{P}}] - [{{{{\tilde {D}}}}_{P}}]}} = \\ = \;\frac{{[{\bar {H}}] - [\overline {{{{\text{H}}}_{0}}} ]}}{{[{{{\text{H}}}_{P}}] - [{{{{\tilde {H}}}}_{P}}]}} = \frac{{[{\bar {A}}] - [{{{{\bar {A}}}}_{0}}]}}{{[{{{\text{A}}}_{P}}] - [{{{{\tilde {A}}}}_{P}}]}} = \frac{{[{{{{\bar {D}}}}_{0}}]}}{{[{{{{\tilde {D}}}}_{p}}]}}, \\ \end{gathered} $Используя также уравнения электронейтральности, материального баланса, уравнение функциональных связей комплексообразования и ионного обмена рассчитываются концентрации всех разновидностей ионов в обеих фазах.
Основным уравнением ВКХ, связывающим комплексообразование и ионный обмен, является
(6)
${{P}_{{\text{M}}}} = K_{{{\text{M}} - {\text{D}}}}^{{\text{*}}}{{\left( {\frac{1}{{[{{{{\tilde {D}}}}_{P}}]}}} \right)}^{{{{n}_{{\text{M}}}} - 1}}}.$(7)
${{\alpha }_{{{{{\text{M}}}_{b}} - {{{\text{M}}}_{a}}}}}(0) = \frac{{K_{{{{{\text{M}}}_{b}} - {\text{D}}}}^{*}}}{{{{P}_{{{{{\text{M}}}_{b}}}}}({{{\text{M}}}_{a}})}}{{\left( {\frac{1}{{[{{{{\tilde {D}}}}_{p}}]}}} \right)}^{{{{n}_{{{{{\text{M}}}_{b}}}}} - 1}}}.$(8)
${{\alpha }_{{{{{\text{M}}}_{b}} - {{{\text{M}}}_{a}}}}}(\max ) = \frac{{{{P}_{{{{{\text{M}}}_{a}}}}}({{{\text{M}}}_{b}})}}{{K_{{{{{\text{M}}}_{а }} - {\text{D}}}}^{*}}}{{\left( {\frac{1}{{[{{{{\tilde {D}}}}_{p}}]}}} \right)}^{{{{n}_{{{{{\text{M}}}_{a}}}}} - 1}}}.$Для изотерм переменного типа соотношения концентраций $[{{{\text{M}}}_{{{{a}_{p}}}}}]$ и $[{{{\text{M}}}_{{{{b}_{p}}}}}]$ в точке пересечения с диагональю будут соответствовать композиционному барьеру, определяющему порядок вымывания Mа и Mb [6, 8]. Концентрации в критических точках обращения селективности α = 1 рассчитываются с помощью рекуррентных соотношений при равенстве коэффициентов распределения разделяемых элементов:
(9)
$\frac{{[{{{{\bar {M}}}}_{a}}]}}{{[{{{\text{M}}}_{{{{a}_{p}}}}}]}} = \frac{{[{{{{\bar {M}}}}_{b}}]}}{{[{{{\text{M}}}_{{{{b}_{p}}}}}]}}.$Условие, которое позволяет построить парциальную изотерму ионного обмена разделяемых элементов при одновременном присутствии в системе ионов вытеснителя, водорода и сорбированного комплексона, как проекцию многомерной изотермы, также является режим параллельного переноса, но для сумм концентраций разделяемых элементов в обеих фазах:
(10)
$\frac{{[{\bar {M}*}]}}{{[{\text{M}}_{p}^{*}]}} = \frac{{{{n}_{{{{{\text{M}}}_{a}}}}}[{{{{\bar {M}}}}_{a}}] + {{n}_{{{{{\text{M}}}_{b}}}}}[{{{{\bar {M}}}}_{b}}]}}{{{{n}_{{\text{M}}}}_{{_{a}}}[{{{\text{M}}}_{a}}_{{_{p}}}] + {{n}_{{\text{M}}}}_{{_{b}}}[{{{\text{M}}}_{{{{b}_{p}}}}}]}} = ..... = \frac{{[{{{{\bar {D}}}}_{0}}]}}{{[{{{{\tilde {D}}}}_{p}}]}}.$Если задаться мольными долями свободных ионов металлов ${{x}_{{{{{\text{M}}}_{a}}}}}$ и ${{x}_{{{{{\text{M}}}_{b}}}}}$ в растворе:
(11)
${{x}_{{\text{M}}}}_{a} = \frac{{[{{{\text{M}}}_{a}}]}}{{[{{{\text{M}}}_{a}}] + [{{{\text{M}}}_{b}}]}},\quad {{x}_{{{{{\text{M}}}_{b}}}}} = \frac{{[{{{\text{M}}}_{b}}]}}{{[{{{\text{M}}}_{a}}] + [{{{\text{M}}}_{b}}]}},$(12)
$\begin{gathered} \frac{{[{\text{M}}_{P}^{*}]}}{{[{\text{M*}}]}} = {{P}_{{{\text{M*}}}}} = \\ = \;K_{{{{{\text{M}}}_{a}}}}^{*}{{\left( {\frac{1}{{[{{{{\tilde {D}}}}_{P}}]}}} \right)}^{{{{n}_{{\text{M}}}}_{a} - 1}}}{{x}_{{\text{M}}}}_{a} + K_{{{{{\text{M}}}_{b}}}}^{*}{{\left( {\frac{1}{{[{{{{\tilde {D}}}}_{P}}]}}} \right)}^{{{{n}_{{{{{\text{M}}}_{b}}}}} - 1}}}{{x}_{{\text{M}}}}_{{_{b}}}. \\ \end{gathered} $Константы комплексообразования моно- и биядерных комплексов элемента ${\text{M*}}$ определяются, как ${{\beta }_{{{\text{M*}}{{{\text{H}}}_{i}}{{{\text{A}}}_{j}}}}}$ = ${{\beta }_{{\text{M}}}}{{_{{_{a}}}}_{{{\text{M}}{{{\text{H}}}_{i}}{{{\text{A}}}_{j}}}}}{{x}_{{\text{M}}}}_{{_{a}}}$ + ${{\beta }_{{\text{M}}}}{{_{{_{b}}}}_{{{\text{M}}{{{\text{H}}}_{i}}{{{\text{A}}}_{j}}}}}{{x}_{{\text{M}}}}_{{_{b}}}$ и ${{\beta }_{{{\text{M}}_{2}^{ * }{\text{A}}}}}$ = ${{\beta }_{{\text{M}}}}{{_{{_{a}}}}_{{{{{\text{M}}}_{2}}{\text{A}}}}}x_{{{{{\text{M}}}_{a}}}}^{2}$ + ${{\beta }_{{\text{M}}}}{{_{{_{b}}}}_{{{{{\text{M}}}_{2}}{\text{A}}}}}x_{{{{{\text{M}}}_{b}}}}^{2}$ (β – общие константы устойчивости комплексов).
Для решения новой системы используется тот же математический аппарат, как и для зон индивидуальных элементов.
Основные факторы, определяющие изменение селективности разновалентных элементов:
1. Увеличение концентрации вытеснителя, как и в простом ионном обмене (без комплексообразования), приводит при разделении разновалентных элементов к возрастанию сродства к катиониту иона меньшего заряда и, наоборот, к уменьшению ${{\alpha }_{{{{{\text{M}}}_{b}} - {{{\text{M}}}_{a}}}}}(0)$ и ${{\alpha }_{{{{{\text{M}}}_{b}} - {{{\text{M}}}_{a}}}}}(\max )$ при ${{n}_{{{{{\text{M}}}_{b}}}}}$ > ${{n}_{{{{{\text{M}}}_{a}}}}}$.
2. Важным ионообменным фактором является отношение констант обмена $\frac{{{{K}_{{{{{\text{M}}}_{b}} - {\text{D}}}}}}}{{{{K}_{{{{{\text{M}}}_{a}} - {\text{D}}}}}}}$. Константы обмена могут зависеть и от емкости, и от набухания, и даже от изомерного состава сшивающего агента [9]. Поэтому даже при использовании разных партий катионита с одинаковой степенью сшивки возможен различный порядок вымывания при прочих одинаковых условиях проведения процесса.
3. Однако решающим фактором, определяющим порядок вымывания, является различие в константах комплексообразования.
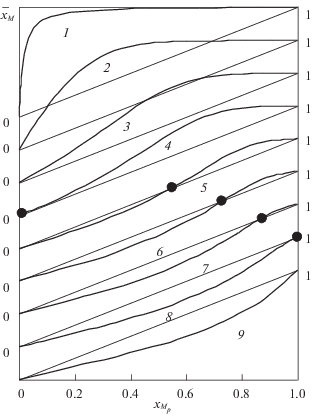
Для протонированных комплексов диэтилентриаминпентауксусной кислоты (ДТПА) с двухвалентными цветными металлами KMHA на 2–3 порядка выше, чем с ТПЭ и РЗЭ. Кроме того цветные металлы образуют с ДТПА биядерные комплексы состава M2A [2]. При увеличении рН элюента или введении буферных добавок цитрата происходит изменение селективности ТПЭ и РЗЭ по отношению к цинку. При этом одновременно происходит и увеличение рН элюатов и, следовательно, уменьшение доли протонированных комплексов и возрастание доли биядерных комплексов. Для тяжелых РЗЭ и ТПЭ, имеющих большие константы устойчивости, решающим фактором является увеличение рН. Парциальная изотерма ионного обмена переходит из выпуклой в S-образную и далее в вогнутую (рис. 2).
Рис. 2.
Изменение изотерм ионного обмена Ho–Zn при элюировании 0.02545 моль/л раствором ДТПА в зависимости от содержания лимонной кислоты (H3Cit) в элюенте, содержащим 0 (изотерма 1), 0.005 (2), 0.01 (3), 0.0123 (4), 0.016 (5), 0.018 (6), 0.02 (7), 0.022 (8) и 0.025 моль/л H3Cit (9); ${{\bar {x}}_{{\text{M}}}}$ и ${{x}_{{{{{\text{M}}}_{p}}}}}$ – эквивалентные доли гольмия в твердой и жидкой фазах, соответственно.
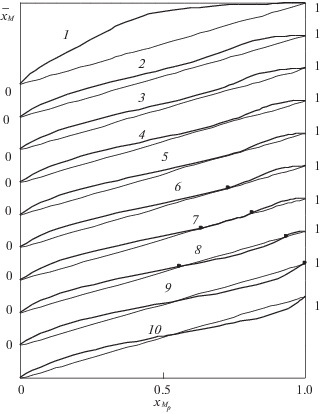
Для европия и более легких РЗЭ при одновременном присутствии в системе протонированных и биядерных комплексов, как показано на рис 3, изменение селективности носит сложный характер и сопровождается появлением смешанных изотерм переменного типа, имеющих две точки пересечения с диагональю. То есть появляется два композиционных барьера, каждый из которых характеризуется различным распределением концентраций в обеих фазах.
Рис. 3.
Изменение изотерм ионного обмена Eu–Zn при элюировании 0.05089 моль/л растворами ДТПА c повышенным значением рН в зависимости от рН элюента: рН 10 (1), 10.7 (2), 10.8 (3), 10.9 (4), 10.95 (5), 10.952(6), 11.0 (7), 11.2 (8), 11.407 (9), 11.5 (10); ${{\bar {x}}_{{\text{M}}}}$ и ${{x}_{{{{{\text{M}}}_{p}}}}}$ – эквивалентные доли Eu в твердой и жидкой фазах, соответственно.
Если известна изотерма ионного обмена, то для определения фронтов вытеснения существует графический метод Мак-Кэба и Тиле [10]. Особый интерес представляет изменение фронтов вытеснения для промежуточных состояний, пока изотерма остается выпуклой, но меняется ее кривизна (рис. 2, изотермы с 1 по 4). Однако для сложных изотерм с переменной кривизной строить графически фронты вытеснения по точкам очень трудоемко. Поэтому целесообразно аппроксимировать изотерму математическим уравнением.
В уравнение изотермы ионного обмена
(13)
${{\bar {x}}_{{\text{M}}}} = \frac{{\alpha ({{x}_{{{{{\text{M}}}_{p}}}}}){{x}_{{{{{\text{M}}}_{p}}}}}}}{{\alpha ({{x}_{{{{{\text{M}}}_{p}}}}}){{x}_{{{{{\text{M}}}_{p}}}}} + 1 - {{x}_{{{{{\text{M}}}_{p}}}}}}}$Рис. 4.
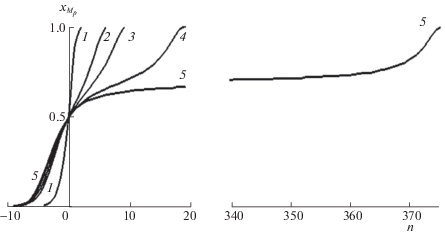
Зависимости коэффициента разделения αНо–Zn от эквивалентной доли гольмия в растворе (соответствует изотерме 1 на рис. 2 и описывается полиномом, α(х) = –144.73х6 + 796.26х5 – 1622.6х4 + 1621.4х3 – ‒ 863.31х2 + 244.59х + 62.227, где $x \equiv {{x}_{{{{{\text{M}}}_{p}}}}}$).
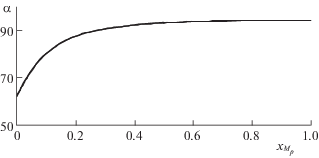
Для средне- и слабовыпуклых изотерм можно аппроксимировать непосредственно саму изотерму ионного обмена простым полиномом:
На рис. 5 представлены фронты вытеснения для изотерм 1–4, представленных на рис. 2, рассчитанные с использованием уравнений аппроксимации по методу Мак-Кэба и Тиле, считая за нулевую тарелку середину зоны смешивания, т.е. когда ${{x}_{{{{{\text{M}}}_{{pа }}}}}}$ = ${{х }_{{{{{\text{M}}}_{{pb}}}}}}$ = 0.5.
Рис. 5.
Размытие фронта вытеснения гольмия для элюента 0.02545 моль/л ДТПА, содержащего 0 (1), 0.005 (2), 0.01 (3) и 0.0123 моль/л H3Cit (4) .
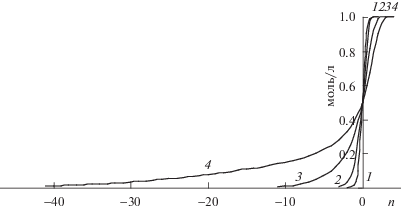
Когда изотерма, оставаясь выпуклой, имеет S-образный вид (изотермы 3, 4 на рис. 2), наблюдается значительное размытие нижней части фронта вытеснения второго компонента (гольмия), напоминающее размытие фронтов при внешней диффузии.
Для сложных изотерм, имеющих два максимума (рис. 3 изотермы 2–5), при достаточно острых нижних и верхних частях фронта начинает размываться середина фронта. Как показано на рис. 6, в наибольшей степени это проявляется для изотермы 5, при этом предельные коэффициенты разделения достаточно высоки α(0) = 2.45 и α(max) = 4.45, минимальный коэффициент разделения составляет величину 1.003, и фронт вытеснения размывается на 370 тарелок. А внешне кривые элюирования напоминают разделение элементов при недостаточном числе полос разделения.
Список литературы
Шептунов В.Н., Маслова Г.Б., Назаров П.П. и др. // Журн. физ. химии. 1972. Т. 46. № 5. С. 1168.
Martell A.E., Smith R.M. Critical Stability Constants. V. 1: Amino Acid. Cпpaвoчник. New York and London: Plenum Press. 1974.
Martell A.E., Smith R.M. Critical Stability Constants. V. 5. First Supplement. New York and London: Plenum Press. 1982.
Martell A.E., Smith R.M. Critical Stability Constants. V. 6. Second Supplement. New York and London: Plenum Press. 1989.
Чувелева Э.А., Харитонов О.В., Фирсова Л.А. // Радиохимия. 1994. Т. 36. № 2. С. 167.
Белов В.В., Назаров П.П. Тезисы доклада. Всесоюзная конференция по применению экстракционных и сорбционных методов для выделения и разделения актинидов и лантанидов. М.: Наука, 1984. С. 51.
Харитонов О.В., Фирсова Л.А., Козлитин Е.А. и др. // Сорбционные и хроматографические процессы. 2016. Т. 16. № 3. С. 291.
James D.B., Powell J.E., Spedding F.N. // J. Inorg. Nucl. Chem. 1961. V. 19. № 1–2. P. 1583.
Гельферих Ф. Иониты. Основы ионного обмена: монография / пер. с нем. М.: Издательство иностранной литературы, 1962. 490 с.
Тремийон Б. Разделение на ионообменных cмолах: монография / пер. с франц. М.: Мир, 1967. 432 с.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии