Журнал физической химии, 2019, T. 93, № 3, стр. 325-331
Образование смешанных комплексов ртути(II) с моно- и диаминными комплексонами в водном растворе
Д. Ф. Пырэу a, *, М. С. Груздев b, Р. С. Кумеев b
a Ивановский государственный университет
Иваново, Россия
b Российская академия наук, Институт химии растворов им. Г.А. Крестова
Иваново, Россия
* E-mail: pyreu@mail.ru
Поступила в редакцию 23.03.2018
Аннотация
Методами калориметрии, pH-метрии и ЯМР-спектроскопии изучено образование смешаннолигандных комплексов в системах HgEdta2– – L (L = Asp2–, Glu2–, Ida2–, Nta3–, Edta4–). Определены термодинамические параметры (lgK, ΔrG°, ΔrH, ΔrS) реакций комплексообразования при 298.15 K и ионной силе I = 0.5(KNO3). Рассмотрен наиболее вероятный способ координации лигандов в составе смешанного комплекса.
Интерес к изучению смешанного комплексообразования в системах, включающих комплексонаты металлов и аминокислоты, продиктован активным использованием комплексонов (Edta, Nta, Dtpa и др.) в биомедицинских целях. В частности, для удаления токсического избытка катиона металла в организме человека посредством хелатотерапии. Несмотря на то, что S-содержащие соединения, такие как димеркаптоянтарная (DMSA), димеркаптопропансульфоновая (DMPS) кислоты, N-ацетилцистеин (NAC), чаще используются при выведении из организма катионов ртути, комплексоны в настоящее время не потеряли своего значения в качестве агентов хелатотерапии. При этом учет образования смешанных комплексонатов металлов с аминокислотами и олигопептидами позволяет сделать существующие приемы хелатотерапии более эффективными, а предлагаемые модели поведения и связывания катиона металла в организме человека более корректными [1].
Ранее была изучена устойчивость смешаннолигандных комплексов этилендиаминтетраацетата Hg(II) с различными моно- и диаминными лигандами, аминокислотами [2–6]. Полученные данные свидетельствуют о том, что координационное число катиона Hg(II) в комплексе с Edta превышает 6, следствием чего является вытеснение внутрисферной молекулы воды из HgEdta(H2O)2– при координации дополнительного лиганда. Анализ термодинамических характеристик и данных ЯМР уже изученных реакций смешанного комплексообразования позволяет говорить о дентатности лигандов в составе смешанных комплексов. Использование более высокодентатных лигандов, таких как Ida и Nta, дает возможность создать ситуацию, когда ни один из комплексонов не реализует полностью свою дентатность. В этом отношении представляет интерес сопоставление данных двух методов, позволяющее указать на наиболее вероятный способ координации комплексонов в смешанном комплексе.
Смешанное комплексообразование с участием комплексонатов Hg(II) и аминокислот изучалось ранее в ряде работ [7, 8]. Однако авторы этих работ, как правило, ограничивались расчетом констант, не прибегая к получению полных термодинамических характеристик изучаемых процессов. В работах часто отсутствуют как критический выбор адекватной эксперименту модели комплексообразования, так и указание на наиболее вероятное строение этих комплексов. Это, в свою очередь, требует детального изучения указанных систем с использованием современных компьютерных программ, предназначенных для обработки экспериментальных данных различных методов. Диамагнитный характер комплексов ртути(II), а также значительные тепловые эффекты при координации аминокарбоксилатных лигандов делают ЯМР-спектроскопию и калориметрию эффективным инструментом при изучении указанных процессов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Использованную в работе дикалиевую соль этилендиаминтетраацетата ртути(II) K2HgEdta · 2H2O получали согласно приведенной ранее методике [2]. Рабочий раствор комплексоната готовили по точной навеске реактива. Нитрилотриуксусную H3Nta и иминодиуксусную H2Ida кислоты марки “ч.д.а.” перекристаллизовывали из водного раствора. L-глутаминовую H2Glu и L-аспарагиновую H2Asp кислоты марки “ч.д.а.” (Reanal) использовали без дополнительной очистки. Используемый для создания ионной силы нитрат калия марки “ч.д.а.” дважды перекристаллизовывали.
Состав и устойчивость смешанных комплексов определяли потенциометрически. Была проведена серия pH-метрических титрований растворов (K2HgEdta + HnL) раствором NaOH при 25°С и ионной силе 0.5, создаваемой KNO3, при соотношениях HgEdta:L = 1:1 и 1:2. ЭДС цепи с переносом, включающей стеклянный и хлорсеребряный электроды, измеряли компенсационным методом. Обработку экспериментальных данных рН-метрических измерений проводили по программе PHMETR [9], основанной на минимизации функции правдоподобия F = Σ(рсНэксп – – рсНрассч)2, где рсН = –lg[H+] – экспериментальные и рассчитанные по модели величины соответственно. При этом учитывалась возможность образования как гомо-, так и гетеролигандных комплексов. Согласие между рассчитанной кривой и экспериментом достигалось только в том случае, когда наряду с HgEdtaL учитывалось образование смешанного комплекса состава HgEdtaHL, образующихся по реакциям:
(1)
${\text{HgEdt}}{{{\text{a}}}^{{2--}}} + {{{\text{L}}}^{n}}^{--} = {\text{HgEdta}}{{{\text{L}}}^{{--(n + 2)}}},$(2)
${\text{HgEdt}}{{{\text{a}}}^{{2--}}} + {{{\text{L}}}^{n}}^{--} + {{{\text{H}}}^{ + }} = {\text{HgEdtaH}}{{{\text{L}}}^{{--(n + 1)}}}.$Рекомендованные значения констант диссоциации этилендиаминтетрауксусной, нитрилотриуксуной, иминодиуксусной, аспарагиновой и глутаминовой кислот были взяты по данным обзоров [10, 11]. Учет образования HgHEdta– и HgEdtaOH3– проводился по данным ранее выполненных нами работ [2]. Рассчитанные константы устойчивости смешанных комплексов приведены в табл. 2. Диаграммы долевого распределения в изученных системах, построенные по результатам настоящей работы, представлены на рис. 1, 2. Расчеты показали, что в условиях эксперимента вклад процессов замещения вида
(3)
$\begin{gathered} {\text{HgEdt}}{{{\text{a}}}^{{2--}}} + i{\text{H}}{{{\text{L}}}^{{1--n}}} = {\text{HgL}}_{i}^{{2 - in}} + {{{\text{H}}}_{i}}{\text{Edt}}{{{\text{a}}}^{i}}^{{--4}}, \\ i = 1,2\quad ({\text{L}} = {\text{Ida(}}n = {\text{2)}},{\text{Nta}}(n = 3)) \\ \end{gathered} $Рис. 1.
Диаграмма долевого распределения частиц в системе HgEdta2– – Ida2– – H+ при соотношении HgEdta:Ida = 1:1 (СHgEdta = 0.01 моль/л).
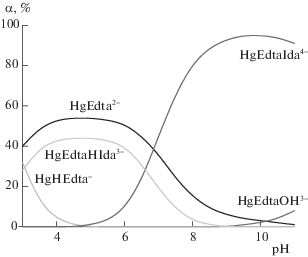
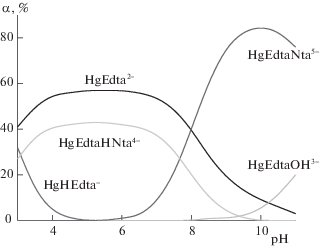
Рис. 2.
Диаграмма долевого распределения частиц в системе HgEdta2––Nta3– – H+ при соотношении HgEdta:Nta = 1:1 (СHgEdta = 0.01 моль/л).
Измерения тепловых эффектов проводили на ампульном калориметре смешения с изотермической оболочкой. Техника измерений была аналогичной [2]. Были измерены тепловые эффекты смешения ΔmixH раствора этилендиаминтетраацетата Hg(II) с растворами полностью нейтрализованных моноаминного комплексона или аминокислоты, содержащих фоновый электролит. Тепловые эффекты смешения в системах HgEdta2––Ln––H+ приведены в табл. 1. Обработку данных калориметрических измерений проводили по программе HEAT [9] с учетом вкладов процессов ионизации воды, протонирования дополнительного лиганда по первой ступени, образования гидроксокомплексоната состава HgEdtaOH3– и смешанного комплекса состава HgEdtaL в суммарный тепловой эффект. Вклад остальных реакций в данных условиях не превышал погрешности эксперимента. Результаты расчета представлены в табл. 2, 3.
Таблица 1.
Тепловые эффекты смешения растворов K2HgEdta (0.5031 моль/кг р-ра) cо щелочными растворами аспарагиновой, иминодиуксусной и нитрилотриуксусной кислот при 298.15 K и I = 0.5 (KNO3)
| ${{m}_{{{{{\text{K}}}_{{\text{2}}}}{\text{HgEdta}}}}}$, г | ${{С }_{{{\text{HgEdt}}{{{\text{a}}}^{{2 - }}}}}}$ × 103, моль/л | ΔmixH, кДж/моль HgEdta2– | ΔmixH – ΔdilH, кДж/моль HgEdta2– |
|---|---|---|---|
| СAsp = 0.006034 моль/л; ${{C}_{{{{{\text{H}}}^{ + }}}}}$ = –0.0000453 моль/л | |||
| 0.54505 | 5.465 | –31.06 | –39.08 |
| 0.44045 | 4.416 | –32.67 | –40.69 |
| 0.52550 | 5.269 | –31.39 | –39.41 |
| 0.55005 | 5.515 | –30.73 | –38.75 |
| 0.41040 | 4.121 | –33.19 | –41.20 |
| СIda = 0.005148 моль/л; ${{C}_{{{{{\text{H}}}^{ + }}}}}$ = 0.000145 моль/л | |||
| 0.50880 | 5.111 | –18.51 | –26.53 |
| 0.46540 | 4.675 | –19.76 | –27.77 |
| 0.45400 | 4.561 | –20.30 | –28.32 |
| 0.50070 | 5.030 | –18.50 | –26.52 |
| 0.49300 | 4.953 | –18.58 | –26.60 |
| СNta = 0.005378 моль/л; ${{C}_{{{{{\text{H}}}^{ + }}}}}$ = –0.000150 моль/л | |||
| 0.47165 | 4.738 | 10.14 | 2.12 |
| 0.51725 | 5.196 | 9.89 | 1.87 |
| 0.53275 | 5.352 | 9.95 | 1.93 |
| 0.57120 | 5.738 | 10.09 | 2.07 |
| 0.46325 | 4.654 | 10.16 | 2.14 |
Таблица 2.
Константы устойчивости смешаннолигандных комплексов в системах HgEdta2––Ln– (L = Glu2–, Asp2–, Ida2–, Nta3–, Edta4–) при 298.15 K и I = 0.5 (KNO3)
| Равновесие | Glu | Asp | Ida | Nta | Edta |
|---|---|---|---|---|---|
| HgEdta2– + Ln– = HgEdtaL–(n+2) | 4.99 ± 0.03 | 5.30 ± 0.03 | 4.91 ± 0.08 | 3.99 ± 0.06 | 4.31 ± 0.07 |
| HgEdta2– + Ln– + H+ = HgEdtaHL–(n+1) | 10.93 ± 0.12 | 11.27 ± 0.10 | 11.54 ± 0.14 | 11.69 ± 0.11 | 12.16 ± 0.10 |
| HgEdta2– + HL1–n = HgEdtaHL–(n+1) | 1.37 ± 0.12 | 1.69 ± 0.10 | 2.18 ± 0.14 | 2.12 ± 0.11 | 2.23 ± 0.10 |
Таблица 3.
Термодинамические параметры реакций образования смешаннолигандных комплексов в системах HgEdta2––Ln– (L = Asp2–, Ida2–, Nta3–) при 298.15 K и I = 0.5 (KNO3)
| Равновесие | lg K | –ΔrG°, кДж/моль | ΔrH, кДж/моль | ΔrS, Дж/(моль K) |
|---|---|---|---|---|
| HgEdta2– + Gly– ↔ HgEdtaGly3– | 6.04 ± 0.12 [2] | 34.48 ± 0.68 | –47.44 ± 0.54 | –43.5 ± 2.9 |
| HgEdta2– + Glu2– ↔ HgEdtaGlu4– | 4.99 ± 0.03 | 28.48 ± 0.17 | –36.97 ± 0.62 | –28.5 ± 2.2 |
| HgEdta2– + Asp2– ↔ HgEdtaAsp4– | 5.30 ± 0.03 | 30.25 ± 0.17 | –38.15 ± 0.33 | –26.5 ± 1.2 |
| HgEdta2– + Ida2– ↔ HgEdtaIda4– | 4.91 ± 0.08 | 28.03 ± 0.46 | –28.42 ± 0.21 | –1.3 ± 1.7 |
| HgEdta2– + Nta3– ↔ HgEdtaNta5– | 3.99 ± 0.06 | 22.77 ± 0.34 | 6.03 ± 0.15 | 96.6 ± 1.2 |
| HgEdta2– + Edta4– ↔ HgEdta$_{2}^{{6 - }}$ | 4.31 ± 0.07 | 24.60 ± 0.40 | 8.30 ± 0.28 | 110.3 ± 1.6 |
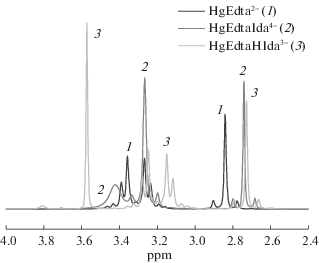
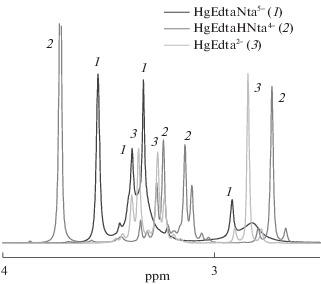
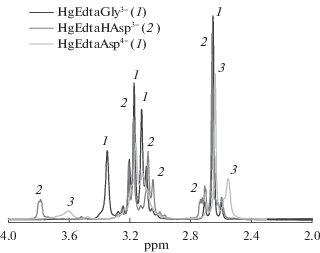
Спектры ЯМР на ядрах 1Н и 13С регистрировали на приборе Bruker AVANCE III – 500 с частотами 500.17 МГц на ядрах протона и 125.76 МГц на ядрах углерода при температуре 298 K. Использование температурной приставки Bruker BVT 3000 позволяло поддерживать температуру с точностью 0.1 K. В качестве внешнего стандарта использовали циклогексан (δэксп = 1.77 м.д. для 1Н и δэксп = 27.6 м.д. для 13С). Была приготовлена серия растворов (растворитель – D2O) с соотношением HgEdta:L = 1:1 при величине pH, отвечающей максимальному выходу смешаннолигандной формы. Нужная величина pH (pD) достигалась введением наряду с кристаллическими K2HgEdta и HnL рассчитанного количества кристаллического KOH марки “х.ч.”. Концентрация комплексоната Hg(II) в растворе составляла 0.250 моль/кг D2O. Спектры растворов ЯМР на ядрах 1Н изученных комплексов представлены на рис. 3–5.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Изучаемые реакции в большинстве случаев сопровождаются отрицательными изменениями энтальпии и энтропии. Близость тепловых эффектов данных реакций и изученных ранее с участием NH3, Gly–, HEn+ [2], прежде всего, свидетельствует о координации аминокислотного остатка через донорный атом азота. Обращает на себя внимание резкое различие в величинах тепловых эффектов и изменения энтропии при присоединении иминодиацетата и нитрилотриацетата к HgEdta (табл. 3), а также отличие параметров этих реакций от параметров модельного процесса присоединения глицина к комплексонату Hg(II). При переходе от Gly к Nta отмечается как снижение устойчивости смешанного комплекса, так и экзотермичности присоединения дополнительного лиганда к комплексонату (присединение Nta носит уже эндотермический характер). Изменение энтропии при этом меняет знак. Все это свидетельствует о том, что координация высокодентатных Ida и Nta, по сравнению с глицином, затруднена. Согласно имеющимся в литературе структурным данным [12, 13], координационное число катиона Hg(II) достигает 7, а его координационная ненасыщенность создает возможность дополнительной координации донорного атома. Поскольку при переходе из твердой фазы в раствор координационный полиэдр и ближайшее окружение комплексонатов в большинстве случаев сохраняются, то в растворах комплексонатов Hg(II) возможно присутствие 7- и даже 8-вершинных комплексов. Таким образом, снижение устойчивости смешанных с Ida и Nta комплексов может быть вызвано насыщением координационной сферы комплексоната и тем, что эти лиганды не могут полностью реализовать свою дентатность.
Анализ спектров ЯМР позволил выявить некоторые детали строения изучаемых комплексов. В структуре ПМР спектра этилендиаминтетраацетата Hg(II) присутствует характерный AB квадруплет, свидетельствующий о наличии долгоживущих связей N → Hg. Наличие этого квартета в спектре ПМР выступает критерием сохранения структуры этилендиаминтетраацетата Hg(II) и долгоживущих связей N → Hg. АВ квадруплет присутствует в спектрах смешанных комплексов HgEdtaGly3– и комплексов вида HgEdtaHL (L = Asp, Ida, Nta), что говорит о минимальных структурных изменениях, связанных с координацией дополнительного лиганда. В последнем случае, по всей видимости, можно говорить об однотипной координации цвиттер-ионной формы моноаминного комплексона посредством ацетатной группы без реализации его хелатной структуры. На это также указывает близость констант устойчивости (табл. 2). ПМР спектры растворов, содержащих HgEdta и моноаминный комплексон (Ida, Nta), характеризуются тем, что AB квадруплет вырождается в уширенный синглет, что, вероятно, связано с лабилизацией связей N → Hg при координации высокодентатного дополнительного лиганда катионом ртути(II). Такая же картина наблюдалась ранее при координации S-содержащих лигандов (цистеина, тиомочевины) [6] и алифатических (En) [3] и гетероциклических (Dipy, Phen) [4] аминов.
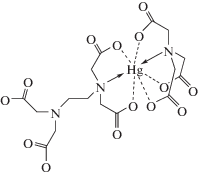
Особенностью спектра ПМР раствора HgEdtaNta является расщепление сигнала, обусловленного этилендиаминным фрагментом Edta, на две линии, одна из которых сильно уширена. Соотношение площадей под тремя другими пиками, обусловленными метиленовыми фрагментами ацетатных групп Edta и Nta, составляет 2 : 2 : 3, что указывает на возможное раскрытие металлоцикла этилендиаминного типа и координацию Edta посредством одного иминодиацетатного фрагмента. Расщепление соответствующих сигналов, доказывающее неэквивалентность иминодиацетатных фрагментов Edta, присутствует и в спектре ЯМР на ядрах 13С. Таким образом, в структуре образующегося тройного комплекса присутствует тетрадентатно координированный нитрилотриацетат и тридентатно координированный этилендиаминтетраацетат (рис. 6). Это объясняет слабый эндоэффект присоединения нитрилотриацетат-иона, сопровождающегося раскрытием этилендиаминного цикла, когда число координированных атомов азота не меняется. В противном случае (Gly, Asp, Ida) наблюдается значительный экзоэффект.
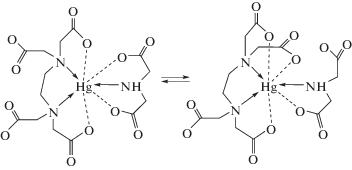
На рис. 7 приведена температурная зависимость 1Н ЯМР спектра раствора, содержащего смешанный комплекс HgEdtaIda4– в дейтерированной воде. Неразрешенный пик в составе уширенной синглетной линии, обусловленной метиленовыми фрагментами ацетатных групп Edta, присутствует в спектре лишь при низких температурах. Можно предположить, что его возникновение связано с процессами обмена между координированной и некоординированной ацетатными группами Edta и Ida, как это показано на рис. 8. То есть в растворе устанавливается равновесие между двумя формами комплекса HgEdtaIda4–, в которых дентатность комплексонов не достигает максимального значения. С ростом температуры, очевидно, вследствие усиления обменного взаимодействия наблюдается лишь одна уширенная синглетная линия.
Рис. 7.
Температурные зависимости 1Н ЯМР спектра раствора, содержащего смешанный комплекс HgEdtaIda4– в D2O (СHgEdta = 0.25 моль/кг D2O). Температурный шаг 10°С.
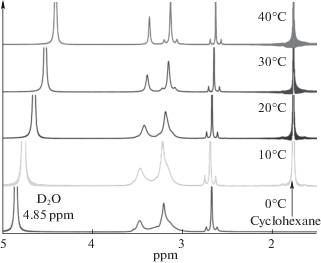
Рис. 8.
Вероятные способы координации комплексонов в смешанном комплексе HgEdtaIda4– и равновесие между формами этого комплекса.
Способность этилендиаминтетраацетатного комплекса ртути(II) эффективно связывать аминокислотные остатки и иминодиацетат предполагает возможность образования дикомплексов Hg(II) с ЭДТА. При этом второй этилендиаминтетраацетатный остаток заведомо полностью не реализует свою дентатность, тридентатно координируясь посредством одного иминодиацетатного фрагмента. Была проведена серия pH-метрических титрований растворов (K2HgEdta + + Na2H2Edta) при соотношениях K2HgEdta : : Na2H2Edta = 1:1 и 2:1 раствором NaOH. Согласие между рассчитанной и экспериментальной кривыми титрования достигалось только при учете образования дикомплексов состава HgEdta$_{2}^{{6 - }}$ и HgHEdta$_{2}^{{5 - }}$. Рассчитанные значения констант устойчивости приведены в табл. 2. Значения LgK присоединения этилендиаминтетраацетат-иона и иминодиацетата оказываются весьма близкими. В то же время константа присоединения монопротонированной частицы HEdta к HgEdta значительно меньше. Такое различие можно объяснить возникновением в структуре HEdta3– внутримолекулярного H-цикла: его разрушение предшествует координации монопротонированной частицы посредством непротонированного иминодиацетатного фрагмента. В спектре ПМР раствора, содержащих K2HgEdta и полностью нейтрализованную динатриевую соль Na2H2Edta в соотношении 1:1, присутствуют четыре синглетные линии, две из которых сильно уширены. При этом характерный АВ квартет, обусловленный метиленовыми звеньями ацетатных групп Edta, вырождается в уширенный синглет, что также связано с лабилизацией связей N → Hg. Другой причиной уширения линий, очевидно, является обмен между шести- и тридентатно координированными этилендиаминтетраацетат-ионами, т.е. образующиеся дикомплексы Hg(II) с ЭДТА являются лабильными в шкале времени ЯМР. Соотношение площадей под пиками 2:6:1:3 указывает на координированный характер только одного иминодиацетатного фрагмента Edta. В спектре 13С ЯМР того же раствора наблюдается расщепление линий, обусловленных карбоксильными группами и метиленовыми звеньями этилендиаминного фрагмента Edta, что также подтверждает участие в координации одного иминодиацетатного фрагмента второго остатка Edta. Обработка pH-метрических кривых титрования растворов (K2HgEdta + Na2H2Edta) при соотношении K2HgEdta:Na2H2Edta = 3:1 выявила образование биядерной частицы состава (HgEdta)2Edta8–, где один из остатков Edta, вероятно, выполняет мостиковую функцию, связывая координационные сферы двух этилендиаминтетраацетатных комплексов Hg(II). Однако доля накопления этого комплекса в условиях эксперимента оказалась невелика и рассчитанное значение его константы образования можно рассматривать как оценочное.
Опыты по смешению растворов K2HgEdta со щелочными растворами Edta выявили близкие к нулю тепловые эффекты. Это может быть следствием того, что число координированных атомов азота при образовании смешанного комплекса HgEdta$_{2}^{{6 - }}$ не меняется, что, в свою очередь, предполагает координацию этилендиаминтетраацетат-ионов по иминодиацетатному типу. То есть для комплекса состава HgEdta$_{2}^{{6 - }}$ можно предложить структуру аналогичную комплексу HgEdtaNta5– (рис. 6). Из данных табл. 3 видно, что в реакциях присоединения остатков Nta и Edta основной вклад в изменение энергии Гиббса дает энтропийное слагаемое. Как было показано ранее [14], сольватационный эффект не играет определяющей роли при образовании смешанных комплексов “развернутого” типа строения. Увеличение энтропии в подобного рода реакциях связано, главным образом, с изменением способа координации этилендиаминтетраацетат-иона, а именно, с раскрытием этилендиаминного цикла в MEdta2–, что приводит к росту внутренней энтропии смешанного комплекса.
Таким образом, на примере смешанного комплексообразования этилендиаминтетраацетата ртути(II) с целым рядом аминокарбоксилатных лигандов удалось показать эффективность термодинамического подхода к оценке вероятного строения смешанных комплексов и способов координации лигандов в их составе. Согласие данных калориметрии и ЯМР-спектроскопии, с одной стороны, убеждает в справедливости выводов по структуре комплексов на основе сравнительного анализа термодинамических данных, а с другой − повышает их надежность.
Список литературы
Дятлова Н.М., Темкина В.Я., Попов К.И. Комплексоны и комплексонаты металлов. М.: Химия, 1988.
Пырэу Д.Ф., Титова Е.С., Козловский Е.В. // Журн. неорган. химии. 2005. Т. 50. № 10. С. 1758.
Пырэу Д.Ф., Титова Е.С., Козловский Е.В. // Там же. 2008. Т. 53. № 2. С. 377.
Пырэу Д.Ф., Козловский Е.В. // Там же. 2008. Т. 53. № 3. С. 377.
Рыжаков А.М., Пырэу Д.Ф., Козловский Е.В. и др. // Координац. химия. 2010. Т. 36. № 8. С. 569.
Pyreu D.F., Ryzhakov A.M., Kozlovskii E.V. et al. // Inorganica Chimica Acta. 2011. V. 371. P. 53.
Корнев В.И., Кардапольцев А.А. // Журн. неорган. химии. 2008. Т. 53. № 11. С. 1875.
Корнев В.И., Кардапольцев А.А. // Координац. химия. 2008. Т. 34. № 8. С. 571.
Бородин В.А., Васильев В.П., Козловский Е.В. Математические задачи химической термодинамики. Новосибирск: Наука, 1985. С. 219.
Anderegg G. // Pure Appl. Chem. 1982. V. 54. № 12. P. 2693.
Anderegg G., Arnaud-Neu F., Delgado R. et al. // Pure Appl. Chem. 2005. V. 77. № 8. P. 1445.
Иванов С.А., Мартыненко Л.И., Илюхин А.Б. // Журн. неорган. химии. 1998. Т. 43. № 3. С. 413.
Albinati A., Gramlich V., Anderegg G. et al. // Inorg. Chim. Acta. 1998. V. 274. № 2. P. 219.
Козловский Е.В. Дис. … док. хим. наук. Иваново: ИГХТА, 1995.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии