Журнал физической химии, 2019, T. 93, № 3, стр. 332-342
Теплоемкость и термодинамические свойства слоистых перовскитоподобных оксидов K2La2Ti3O10 и K2Nd2Ti3O10
А. М. Санкович a, *, А. В. Маркин b, Н. Н. Смирнова b, И. А. Зверева a
a Санкт-Петербургский государственный университет
Санкт-Петербург, Россия
b Национальный исследовательский Нижегородский государственный университет им. Н.И. Лобачевского
Нижний Новгород, Россия
* E-mail: annasankovich@yandex.ru
Поступила в редакцию 25.05.2018
Аннотация
Теплоемкость перовскитоподобных слоистых титанатов K2La2Ti3O10 и K2Nd2Ti3O10 исследована методами прецизионной адиабатической вакуумной калориметрии в температурном интервале 7–350 K и дифференциальной сканирующей калориметрии в интервале 350–670 K. По экспериментальным данным о теплоемкости в температурном интервале 9–670 K рассчитаны стандартные термодинамические функции: энтальпия H(T) – H(9), энтропия S(T) – S(9) и функция Гиббса – [G(T) – G(9)].
Соединения с перовскитоподобной структурой являются объектом пристального внимания, поскольку представляют один из наиболее перспективных классов керамических материалов. В силу особенностей кристаллической структуры эти соединения обладают уникальными свойствами (электрическими, магнитными, каталитическими) [1–5] и находят применение в новейших областях науки и техники. Слоистые титанаты на основе щелочных и редкоземельных металлов служат перспективными катализаторами, в том числе для реакций фотоиндуцируемого разложения воды с целью получения водорода как альтернативного вида топлива [6–8]. Более того, слоистые оксиды могут рассматриваться как принципиально новые каталитические системы, в которых межслоевое пространство увеличивает эффективную площадь поверхности [9]. Еще одна важная особенность данного класса оксидов – их способность к ионному обмену [10, 11], в связи с чем соединения могут быть использованы как прекурсоры для получения других перовскитоподобных фаз [12, 13].
Изучение теплофизических свойств материалов на основе перовскитоподобных оксидов важно для их практического применения в различных областях химической инженерии и электроники. Кроме того, эти данные могут быть полезны и с теоретической точки зрения. Вместе с тем, результаты термодинамического исследования данного класса соединений в литературе встречаются редко.
Данная работа продолжает исследования теплоемкости и термодинамических свойств перовскитоподобных слоистых оксидов из класса перспективных фотокатализаторов [14–17]: представлены результаты калориметрического исследования перовскитоподобных слоистых титанатов K2Ln2Ti3O10 (Ln = La, Nd) в области температур 7–670 K.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Характеристика изученных образцов. Исследуемые перовскитоподобные слоистые титанаты K2Ln2Ti3O10 (Ln = La, Nd) построены по блочному принципу из слоев со структурой перовскита, разделенных слоями со структурой каменной соли. Эти соединения являются представителями класса фаз Раддлесдена–Поппера [18] и имеют кристаллическую структуру, близкую структуре сложного оксида Sr4Ti3O10. Строение K2Ln2Ti3O10 (рис. 1) отвечает той же пространственной группе симметрии, что и титанаты стронция, I4/mmm [19]. Однако вследствие большого различия зарядов катионов K и Ln в изучаемых соединениях наблюдается полное упорядочение этих катионов по неэквивалентным структурным позициям. В результате катионы K заселяют девятикоординированные позиции, расположенные между блоками структурного типа перовскита, и вместе с ближайшими атомами кислорода образуют фрагменты структуры каменной соли. При этом катионы лантаноида, находящиеся в 12-координированном состоянии, заселяют позиции внутри блока со структурой перовскита.
Сложные оксиды K2La2Ti3O10 и K2Nd2Ti3O10 синтезировали керамическим способом при атмосферном давлении на воздухе. В качестве исходных веществ использовали реактивы марки Johnson Mattey высокой степени чистоты: оксиды лантана La2O3 (99.99 мас. %) и неодима Nd2O3 (99.99 мас. %), предварительно прокаленные при Т = 1173 K в течение 3 ч непосредственно перед синтезом с целью удаления влаги, тонкодисперсный диоксид титана TiO2 (99.9 мас. %) в модификации анатаза, карбонат калия K2CO3 (Merck, 99.5 мас. %). Реагенты смешивали в стехиометрических количествах согласно уравнению реакции:
(1)
$\begin{gathered} {\text{L}}{{{\text{n}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}} + {\text{3Ti}}{{{\text{O}}}_{{\text{2}}}} + {{{\text{K}}}_{{\text{2}}}}{\text{C}}{{{\text{O}}}_{{\text{3}}}} \to {{{\text{K}}}_{{\text{2}}}}{\text{L}}{{{\text{n}}}_{{\text{2}}}}{\text{T}}{{{\text{i}}}_{{\text{3}}}}{{{\text{O}}}_{{{\text{10}}}}} + {\text{C}}{{{\text{O}}}_{2}} \\ ({\text{Ln}} = {\text{La}},{\text{Nd}}). \\ \end{gathered} $Обжиг образцов проводили в силитовой печи в корундовых тиглях, температурный режим контролировали платино-платино-родиевой термопарой и обеспечивали с точностью ±1 K с помощью программного терморегулятора ТП 403. Оксид K2Nd2Ti3O10 получали при Т = 1273 K в течение 3 ч, K2La2Ti3O10 – при Т = 1373 K в течение 5 ч.
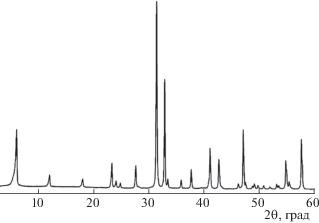
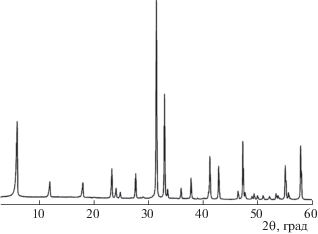
Качественный рентгенофазовый анализ полученных образцов осуществляли методом порошков с использованием дифрактометра Rigaku MiniFlex II, излучение CuKα. Съемку дифрактограмм (рис. 2 и 3) вели с шагом 0.02° в диапазоне углов 2θ = 5°−70°, время съемки – 4 с/точка. Фазовый состав образцов определяли с помощью базы данных ICDD PDF. Для определения количественного состава образцов проводили комплексную фотоэлектронную и растровую оже-электронную спектрометрию на установке Thermo Fisher Scientific Escalab 250Xi.
Аппаратура и методики измерений. Теплоемкость образцов K2La2Ti3O10 и K2Nd2Ti3O10 в температурном интервале 7–350 K измеряли в прецизионном адиабатическом вакуумном калориметре БКТ-3 (АОЗТ “Термис”, Московская обл.) [20, 21], в интервале 350–670 K в дифференциальном сканирующем калориметре DSC 204 F1 Phoenix (Netzsch Gerätebau, Германия) с использованием µ-сенсора [22, 23]. Для проведения измерений в адиабатическом калориметре образец помещали в титановый контейнер объемом 1.5 см3. Перед герметизацией контейнер выдерживали в вакууме (∼5 Па) и затем заполняли газообразным гелием особой чистоты до давления 4 кПа при комнатной температуре. Температуру измеряли железо-родиевым термометром сопротивления (100 Ом). Адиабатические условия поддерживали в пределах ±1 мK. В качестве хладагентов использовали жидкие гелий и азот. Средняя скорость нагрева ампулы с веществом в опыте – 0.2 K/мин. Отношение теплоемкости образца к суммарной теплоемкости (образец + контейнер) составляло 0.4–0.7.
Надежность работы калориметра проверяли на образцах бензойной кислоты и α-Al2O3 (2 × × 10−3Cp, m в температурном интервале 40–350 K, 5 × 10−3Cp, m при T = (20–40) K и 2 × 10−2Cp, m при T < 20 K). Поверку надежности работы ДСК калориметра осуществляли посредством стандартных калибровочных экспериментов по определению термодинамических характеристик плавления индия, олова, висмута, цинка, ртути, калия, хлорида цезия и бифенила. Установлено, что аппаратура и методика измерений позволяют определить теплоемкости веществ с относительной погрешностью 2 × 10−2Cp, m. Проведенные исследования выполняли в атмосфере аргона. Жидкий азот использовали как хладагент.
Термогравиметрический анализ образцов в температурном интервале 300–850 K производили на термомикровесах TG 209 F3 Iris (Netzsch Gerätebau, Германия). Термомикровесы позволяют фиксировать потерю массы с погрешностью ±10−7 г. Измерения выполняли со скоростью нагрева 10 K мин−1 в атмосфере аргона. Техника измерения и в ТГ-анализе, и в ДСК стандартная, согласно ПО Netzsch Software Proteus. В указанном диапазоне температур для изученных образцов потери массы невыявлено, что согласуется с термической устойчивостью изучаемых титанатов в исследуемом температурном интервале [24].
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
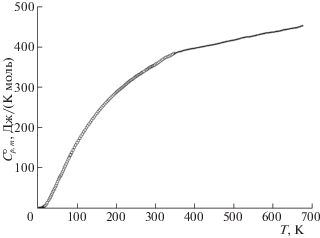
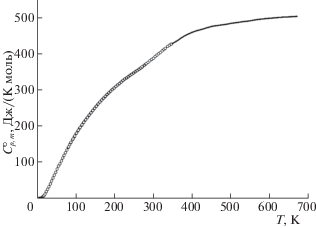
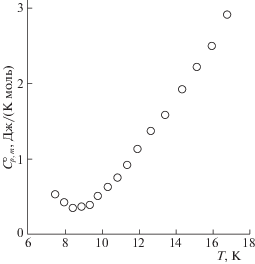
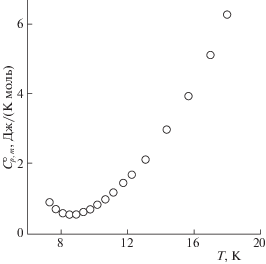
Теплоемкость. Экспериментальные данные по теплоемкости образцов K2La2Ti3O10 и K2Nd2Ti3O10 в интервале температур 7–670 K представлены на рис. 4 и 5 и приведены в табл. 1 и 2 соответственно. Установлено, что изученные титанаты в указанной области температур не проявляют фазовых превращений. Их теплоемкость плавно увеличивается с ростом температуры и не имеет каких-либо особенностей, за исключением области сверхнизких (Т < 9 K) температур (рис. 6 и 7), где для обоих соединений наблюдается аномалия. На кривых температурной зависимости теплоемкости ниже температуры 9 K происходит рост теплоемкости c уменьшением температуры. Такое аномальное увеличение теплоемкости может быть вызвано фазовым переходом второго рода [25]: при определенной температуре, ниже температуры опыта, на кривой теплоемкости должен наблюдаться скачок. По всей вероятности, такое поведение обусловлено незначительными изменениями структуры слоистых соединений.
Таблица 1.
Экспериментальные данные по теплоемкости (Дж/(K моль)) кристаллического K2La2Ti3O10; M = = 659.64 г/моль
| T, K | Cp, m | T, K | Cp, m | T, K | Cp, m | T, K | Cp, m | T, K | Cp, m | T, K | Cp, m |
|---|---|---|---|---|---|---|---|---|---|---|---|
| Серия 1 (АВК) | 66.59 | 91.10 | 192.10 | 277.0 | 51.65 | 61.55 | 165.81 | 249.8 | 280.62 | 342.9 | |
| 7.47 | 0.520 | 68.43 | 95.45 | 195.37 | 279.7 | 53.51 | 66.23 | 169.11 | 253.4 | 282.95 | 344.9 |
| 7.95 | 0.420 | 70.29 | 100.1 | 198.63 | 282.8 | 55.37 | 70.71 | 172.40 | 257.1 | 285.29 | 346.2 |
| 8.42 | 0.342 | 72.46 | 104.1 | 201.42 | 285.6 | 57.23 | 74.63 | 175.69 | 260.3 | 287.62 | 347.3 |
| 8.87 | 0.362 | 74.93 | 109.3 | 203.75 | 287.5 | 59.10 | 77.79 | 178.98 | 264.0 | 289.95 | 348.8 |
| 9.33 | 0.381 | 77.38 | 114.5 | 206.08 | 289.5 | 60.99 | 80.25 | 182.27 | 267.2 | 292.27 | 349.6 |
| 9.80 | 0.502 | 79.84 | 119.6 | 208.41 | 291.4 | 62.86 | 82.98 | 185.55 | 270.3 | 294.59 | 350.8 |
| 10.29 | 0.624 | 82.30 | 124.6 | 210.75 | 292.9 | 64.73 | 86.94 | 188.82 | 273.8 | 296.91 | 352.2 |
| 10.81 | 0.750 | 84.76 | 129.4 | 213.08 | 295.5 | 299.22 | 353.1 | 408.2 | 396 | 543.2 | 423 |
| 11.35 | 0.911 | 87.22 | 133.6 | 215.42 | 296.6 | 302.11 | 355.5 | 413.2 | 397 | 548.2 | 424 |
| 11.92 | 1.13 | 82.17 | 123.9 | 217.75 | 298.7 | 305.59 | 357.5 | 418.2 | 398 | 553.2 | 426 |
| 12.63 | 1.37 | 85.81 | 131.6 | 220.08 | 300.5 | 309.07 | 359.7 | 423.2 | 399 | 558.2 | 427 |
| 13.42 | 1.58 | 89.17 | 137.7 | 222.42 | 302.5 | 312.56 | 362.1 | 428.2 | 400 | 563.2 | 428 |
| 14.33 | 1.93 | 92.52 | 143.7 | 224.75 | 304.6 | 316.04 | 364.8 | 433.2 | 401 | 568.2 | 429 |
| 15.12 | 2.219 | Серия 2 (АВК) | 227.08 | 306.5 | 319.51 | 366.8 | 438.2 | 401 | 573.2 | 430 | |
| 15.94 | 2.496 | 95.88 | 150.1 | 229.41 | 308.6 | 323.00 | 369.4 | 443.2 | 402 | 578.2 | 431 |
| 16.76 | 2.923 | 99.23 | 155.7 | 231.76 | 310.1 | 326.49 | 371.4 | 448.2 | 403 | 583.2 | 432 |
| 17.58 | 3.444 | 102.58 | 161.5 | 234.09 | 312.4 | 329.98 | 372.7 | 453.2 | 404 | 588.2 | 433 |
| 18.40 | 4.093 | 105.93 | 166.8 | 236.43 | 314.2 | 333.48 | 374.0 | 458.2 | 405 | 593.2 | 434 |
| 19.24 | 4.940 | 109.28 | 172.5 | 238.77 | 315.7 | 336.98 | 375.3 | 463.2 | 406 | 598.2 | 434 |
| 20.08 | 5.719 | 112.63 | 178.1 | 241.12 | 317.3 | 340.48 | 377.3 | 468.2 | 408 | 603.2 | 435 |
| 21.71 | 6.598 | 115.97 | 183.0 | 243.46 | 318.7 | 343.98 | 379.2 | 473.2 | 409 | 608.2 | 435 |
| 23.59 | 9.064 | 119.32 | 188.2 | 245.81 | 320.4 | 347.48 | 381.2 | 478.2 | 410 | 613.2 | 436 |
| 25.43 | 11.79 | 122.65 | 193.0 | 248.15 | 322.4 | Серия 3 (ДСК) | 483.2 | 411 | 618.2 | 438 | |
| 27.26 | 14.67 | 125.99 | 198.2 | 250.50 | 323.9 | 348.2 | 381 | 488.2 | 412 | 623.2 | 439 |
| 31.09 | 20.54 | 129.33 | 202.9 | 252.85 | 325.7 | 353.2 | 383 | 493.2 | 413 | 628.2 | 440 |
| 33.09 | 23.83 | 132.67 | 207.7 | 255.19 | 327.1 | 358.2 | 385 | 498.2 | 414 | 633.2 | 441 |
| 34.94 | 27.20 | 136.00 | 212.4 | 257.54 | 328.9 | 363.2 | 386 | 503.2 | 415 | 638.2 | 442 |
| 36.79 | 31.03 | 139.33 | 216.9 | 259.89 | 329.9 | 368.2 | 387 | 508.2 | 416 | 643.2 | 443 |
| 38.64 | 34.84 | 142.65 | 221.1 | 262.24 | 331.2 | 373.2 | 389 | 513.2 | 418 | 648.2 | 443 |
| 40.50 | 38.60 | 145.97 | 225.6 | 264.59 | 332.9 | 378.2 | 390 | 518.2 | 419 | 653.2 | 444 |
| 42.35 | 42.45 | 149.28 | 229.8 | 266.94 | 334.5 | 383.2 | 391 | 523.2 | 420 | 658.2 | 445 |
| 44.21 | 46.14 | 152.59 | 234.0 | 269.29 | 335.9 | 388.2 | 392 | 528.2 | 421 | 663.2 | 447 |
| 46.07 | 49.65 | 155.90 | 238.2 | 271.64 | 337.0 | 393.2 | 393 | 533.2 | 422 | 668.2 | 449 |
| 47.93 | 53.34 | 159.21 | 241.9 | 275.83 | 339.8 | 398.2 | 394 | 538.2 | 423 | 672.2 | 449 |
| 49.79 | 57.22 | 162.51 | 245.7 | 278.29 | 341.4 | 403.2 | 395 | ||||
Таблица 2.
Экспериментальные данные по теплоемкости (Дж/(K моль)) кристаллического K2Nd2Ti3O10; M = = 670.31 г/моль
| T, K | Cp, m | T, K | Cp, m | T, K | Cp, m | T, K | Cp, m | T, K | Cp, m | T, K | Cp, m |
|---|---|---|---|---|---|---|---|---|---|---|---|
| Серия 1 (АВК) | 97.52 | 170.5 | 199.82 | 305.2 | 78.68 | 134.0 | 177.88 | 283.2 | 278.78 | 369.0 | |
| 7.32 | 0.905 | 98.80 | 172.8 | 200.85 | 305.7 | 82.31 | 141.1 | 181.44 | 286.7 | 281.99 | 371.6 |
| 7.68 | 0.690 | 102.21 | 179.0 | 204.39 | 309.7 | 83.13 | 142.8 | 182.49 | 288.2 | 283.36 | 372.9 |
| 8.09 | 0.581 | 103.48 | 180.9 | 205.42 | 310.2 | 85.94 | 148.9 | 186.05 | 291.6 | 287.94 | 376.6 |
| 8.51 | 0.546 | 106.90 | 186.8 | 208.96 | 313.8 | 88.13 | 153.6 | 187.09 | 292.9 | 292.51 | 380.9 |
| 8.93 | 0.542 | 108.15 | 189.0 | 209.99 | 314.4 | 89.15 | 155.4 | 190.65 | 296.2 | 297.07 | 384.5 |
| 9.34 | 0.603 | 111.60 | 194.6 | 213.53 | 317.4 | 92.82 | 162.4 | 191.68 | 297.4 | 301.62 | 388.0 |
| 9.76 | 0.690 | 112.83 | 196.3 | 214.57 | 318.6 | Серия 2 (АВК) | 195.24 | 301.1 | 306.15 | 392.9 | |
| 10.20 | 0.824 | 116.29 | 201.8 | 218.11 | 321.6 | 94.13 | 164.7 | 196.27 | 301.8 | 310.67 | 396.5 |
| 10.65 | 0.979 | 117.50 | 204.0 | 219.15 | 322.5 | 315.22 | 400.7 | 429.2 | 469 | 554.2 | 492 |
| 11.12 | 1.166 | 120.98 | 209.2 | 222.68 | 325.9 | 319.70 | 403.9 | 434.2 | 470 | 559.2 | 493 |
| 11.74 | 1.434 | 122.17 | 211.0 | 223.72 | 326.9 | 324.35 | 408.4 | 439.2 | 472 | 564.2 | 494 |
| 12.25 | 1.682 | 125.66 | 216.4 | 227.25 | 330.1 | 328.94 | 412.4 | 444.2 | 474 | 569.2 | 495 |
| 13.07 | 2.122 | 126.84 | 217.9 | 228.30 | 330.9 | 332.30 | 415.6 | 449.2 | 475 | 574.2 | 496 |
| 14.36 | 2.967 | 130.34 | 223.0 | 231.79 | 333.1 | 338.13 | 420.5 | 454.2 | 477 | 579.2 | 496 |
| 15.67 | 3.941 | 131.51 | 224.2 | 232.88 | 334.1 | 342.74 | 423.9 | 459.2 | 478 | 584.2 | 497 |
| 16.98 | 5.113 | 135.02 | 229.6 | 236.36 | 336.4 | 347.15 | 426.7 | 464.2 | 478 | 589.2 | 497 |
| 18.33 | 6.620 | 136.17 | 231.0 | 237.45 | 337.7 | 348.00 | 427.1 | 469.2 | 479 | 594.2 | 498 |
| 19.69 | 8.574 | 139.69 | 235.9 | 240.93 | 340.2 | Серия 3 (ДСК) | 474.2 | 480 | 599.2 | 498 | |
| 22.24 | 12.51 | 140.83 | 237.3 | 242.05 | 341.0 | 350.3 | 429 | 479.2 | 480 | 604.2 | 499 |
| 25.52 | 18.91 | 144.35 | 242.2 | 245.50 | 343.6 | 354.2 | 431 | 484.2 | 481 | 609.2 | 499 |
| 28.84 | 25.66 | 145.48 | 243.7 | 246.64 | 344.0 | 359.2 | 434 | 489.2 | 482 | 614.2 | 500 |
| 32.24 | 32.65 | 149.01 | 248.5 | 250.08 | 347.0 | 364.2 | 437 | 494.2 | 483 | 619.2 | 500 |
| 35.69 | 40.43 | 150.12 | 249.8 | 251.23 | 347.8 | 369.2 | 441 | 499.2 | 484 | 624.2 | 501 |
| 39.18 | 48.69 | 153.66 | 254.5 | 254.64 | 350.3 | 374.3 | 445 | 504.2 | 485 | 629.2 | 501 |
| 42.69 | 56.87 | 154.75 | 255.5 | 255.82 | 351.4 | 379.2 | 448 | 509.2 | 486 | 634.2 | 502 |
| 46.24 | 64.54 | 158.30 | 260.4 | 259.20 | 353.5 | 384.2 | 451 | 514.2 | 486 | 639.2 | 502 |
| 49.81 | 72.44 | 159.39 | 261.6 | 260.41 | 354.1 | 389.2 | 454 | 519.2 | 487 | 644.2 | 502 |
| 53.38 | 81.44 | 162.95 | 266.3 | 263.76 | 357.0 | 394.2 | 456 | 524.2 | 488 | 649.2 | 502 |
| 56.97 | 89.91 | 164.02 | 267.2 | 265.00 | 357.6 | 399.3 | 459 | 529.2 | 489 | 654.2 | 503 |
| 60.57 | 95.83 | 167.58 | 271.6 | 268.32 | 360.5 | 404.2 | 461 | 534.2 | 489 | 659.2 | 503 |
| 64.19 | 103.8 | 168.64 | 272.6 | 269.59 | 361.1 | 409.2 | 463 | 539.2 | 490 | 664.2 | 503 |
| 67.78 | 111.9 | 172.21 | 276.8 | 272.88 | 363.6 | 414.2 | 465 | 544.2 | 491 | 669.2 | 504 |
| 71.38 | 119.4 | 173.26 | 277.8 | 272.80 | 364.4 | 419.2 | 466 | 549.2 | 491 | 672.2 | 504 |
| 75.02 | 126.6 | 176.82 | 281.6 | 277.44 | 368.2 | 424.2 | 467 | ||||
Экспериментальные значения Cp, m сглаживали с помощью метода наименьших квадратов в интервале 9–670 К. Полиномиальное уравнение температурной зависимости теплоемкости имеет следующий вид:
(2)
${{C}_{{p,{\text{m}}}}} = \sum\limits_{n = 0}^k {{{a}_{i}}} {{\left( {\frac{T}{{30}}} \right)}^{n}},$Экспериментальные значения низкотемпературной теплоемкости (20–50 K) кристаллических титанатов использовали для оценки их фрактальной размерности D [26, 27] и соответственно типа топологии их структур. (В фрактальной модели обработки низкотемпературной теплоемкости показатель степени при Т в функции теплоемкости обозначается как D и называется фрактальной размерностью.) Согласно теории теплоемкости твердых тел Тарасова, для тел цепочечной структуры зависимость $C_{p}^{0}$ от Т в области пониженных температур пропорциональна ${{T}^{1}}$, для твердых тел слоистой структуры – ${{T}^{2}}$, пространственной – ${{T}^{3}}$, т.е. для них значения D соответственно равны 1, 2, 3. Значения D представляется возможным оценить по экспериментальным данным о низкотемпературной зависимости теплоемкости, по наклону соответствующих прямолинейных участков графика ln${{C}_{V}}$ от ln T. Это следует, в частности, из уравнения:
(3)
${{C}_{V}} = 3D(D + 1)kN\gamma (D + 1)\xi (D + 1){{\left( {\frac{T}{{{{\Theta }_{{\max }}}}}} \right)}^{D}},$Фрактальная размерность для изученных титанатов D = 2.5, и характеристические температуры ${{\Theta }_{{\max }}}$ равны 358.4 и 263.5 K для K2La2Ti3O10 и K2Nd2Ti3O10 соответственно. В расчетах принимали, что Cp, m = ${{C}_{V}}$ при Т < 50 K. Полученное значение D указывает на слоисто-пространственную топологию структуры сложных оксидов; значения фрактальных размерностей хорошо согласуются с результатами структурных исследований соединений, показывающих, что перовскитовые блоки состоят из трех слоев октаэдров TiO6, существующих в трехмерной структуре перовскита.
Термодинамические функции. По полученным экспериментальным данным рассчитывали стандартные термодинамические функции изученных титанатов (табл. 3 и 4). Функции рассчитывали от Т = 9 K ввиду проявления описанных выше аномалий и, как следствие, не подчинения низкотемпературных теплоемкостей изученных титанатов теориям Дебая и Эйнштейна. По этой причине мы не можем ссылаться на постулат Планка о нулевой остаточной энтропии при 0 K. Расчет энтальпии H(T) – H(9) и энтропии S(T) – – S(9) выполняли путем интегрирования температурных зависимостей теплоемкости по T и ln T соответственно. Функцию Гиббса –[G(T) – G(9)] рассчитывали из соответствующих значений энтальпии и энтропии. Методика расчета функций опубликована, например, в работе [28].
Таблица 3.
Стандартные термодинамические функции кристаллического K2La2Ti3O10; M = 659.64 г/моль
| T, K | Cp, m, Дж/(K моль) | [H°(T) – H°(9)], кДж/моль | [S°(T) – S°(9)], Дж/(K моль) | –[G°(T) – G°(9)], кДж/моль |
|---|---|---|---|---|
| 9 | 0.360 | 0 | 0 | 0 |
| 10 | 0.531 | 0.000600 | 0.0546 | 0.00000600 |
| 15 | 2.173 | 0.00700 | 0.557 | 0.00134 |
| 20 | 5.273 | 0.02560 | 1.582 | 0.006080 |
| 25 | 11.36 | 0.06720 | 3.389 | 0.01756 |
| 30 | 18.77 | 0.1401 | 6.045 | 0.04124 |
| 40 | 36.89 | 0.4193 | 13.89 | 0.1363 |
| 50 | 57.46 | 0.8860 | 24.25 | 0.3267 |
| 60 | 78.70 | 1.571 | 36.63 | 0.6270 |
| 70 | 99.68 | 2.459 | 50.32 | 1.063 |
| 80 | 119.9 | 3.562 | 64.97 | 1.636 |
| 90 | 139.0 | 4.853 | 80.19 | 2.365 |
| 100 | 156.9 | 6.337 | 95.77 | 3.241 |
| 110 | 173.6 | 7.987 | 111.5 | 4.280 |
| 120 | 189.3 | 9.805 | 127.3 | 5.471 |
| 130 | 204.0 | 11.77 | 143.0 | 6.826 |
| 140 | 217.8 | 13.88 | 158.7 | 8.332 |
| 150 | 230.7 | 16.12 | 174.1 | 9.999 |
| 160 | 242.9 | 18.49 | 189.4 | 11.81 |
| 170 | 254.3 | 20.98 | 204.5 | 13.79 |
| 180 | 265.0 | 23.58 | 219.3 | 15.90 |
| 190 | 274.9 | 26.27 | 233.9 | 18.17 |
| 200 | 284.0 | 29.07 | 248.3 | 20.58 |
| 210 | 292.5 | 31.95 | 262.3 | 23.14 |
| 220 | 300.9 | 34.92 | 276.1 | 25.83 |
| 230 | 308.9 | 37.97 | 289.7 | 28.66 |
| 240 | 316.4 | 41.10 | 303.0 | 31.62 |
| 250 | 323.5 | 44.29 | 316.1 | 34.72 |
| 260 | 330.1 | 47.56 | 328.9 | 37.94 |
| 270 | 336.4 | 50.90 | 341.4 | 41.29 |
| 280 | 342.4 | 54.29 | 353.8 | 44.77 |
| 290 | 348.4 | 57.74 | 365.9 | 48.37 |
| 298.15 | 353.3 | 60.60 | 375.6 | 51.39 |
| 300 | 354.5 | 61.26 | 377.8 | 52.09 |
| 310 | 360.5 | 64.83 | 389.5 | 55.93 |
| 320 | 366.6 | 68.47 | 401.1 | 59.88 |
| 330 | 372.4 | 72.16 | 412.5 | 63.95 |
| 340 | 377.7 | 75.92 | 423.7 | 68.12 |
| 350 | 382.0 | 79.72 | 434.7 | 72.42 |
| 360 | 385 | 83.6 | 446 | 76.8 |
| 370 | 388 | 87.4 | 456 | 81.3 |
| 380 | 390 | 91.3 | 466 | 85.9 |
| 390 | 393 | 95.2 | 477 | 90.7 |
| 400 | 394 | 99.2 | 487 | 95.5 |
| 410 | 396 | 103 | 496 | 100 |
| 420 | 398 | 107 | 506 | 105 |
| 430 | 400 | 111 | 515 | 111 |
| 440 | 402 | 115 | 525 | 116 |
| 450 | 404 | 119 | 534 | 121 |
| 460 | 406 | 123 | 543 | 126 |
| 470 | 408 | 127 | 551 | 132 |
| 480 | 410 | 131 | 560 | 137 |
| 490 | 413 | 135 | 568 | 143 |
| 500 | 415 | 140 | 577 | 149 |
| 510 | 417 | 144 | 585 | 155 |
| 520 | 419 | 148 | 593 | 161 |
| 530 | 421 | 152 | 601 | 166 |
| 540 | 423 | 156 | 609 | 173 |
| 550 | 425 | 161 | 617 | 179 |
| 560 | 427 | 165 | 624 | 185 |
| 570 | 429 | 169 | 632 | 191 |
| 580 | 431 | 173 | 639 | 198 |
| 590 | 433 | 178 | 647 | 204 |
| 600 | 435 | 182 | 654 | 210 |
| 610 | 436 | 186 | 661 | 217 |
| 620 | 438 | 191 | 668 | 224 |
| 630 | 440 | 195 | 675 | 230 |
| 640 | 442 | 200 | 682 | 237 |
| 650 | 444 | 204 | 689 | 244 |
| 660 | 446 | 209 | 696 | 251 |
| 670 | 449 | 213 | 703 | 258 |
Таблица 4.
Стандартные термодинамические функции кристаллического K2Nd2Ti3O10; M = 670.31 г/моль
| T, K | Cp, m, Дж/(K моль) | [H°(T) – H°(9)] кДж/моль | [S°(T) – S°(9)], Дж/(K моль) | –[G°(T) – G°(9)], кДж/моль |
|---|---|---|---|---|
| 9 | 0.554 | 0 | 0 | 0 |
| 10 | 0.761 | 0.000800 | 0.0779 | 0.00000700 |
| 15 | 3.42 | 0.0102 | 0.805 | 0.00189 |
| 20 | 9.038 | 0.0409 | 2.501 | 0.009081 |
| 25 | 17.84 | 0.1080 | 5.424 | 0.02755 |
| 30 | 27.99 | 0.2202 | 9.511 | 0.06518 |
| 40 | 50.70 | 0.6149 | 20.63 | 0.2103 |
| 50 | 72.96 | 1.229 | 34.28 | 0.4856 |
| 60 | 94.67 | 2.080 | 49.69 | 0.9012 |
| 70 | 116.6 | 3.132 | 65.91 | 1.482 |
| 80 | 136.5 | 4.402 | 82.79 | 2.221 |
| 90 | 157.1 | 5.867 | 100.1 | 3.139 |
| 100 | 174.9 | 7.532 | 117.5 | 4.223 |
| 110 | 192.0 | 9.364 | 135.0 | 5.489 |
| 120 | 207.7 | 11.37 | 152.4 | 6.923 |
| 130 | 222.4 | 13.51 | 169.6 | 8.537 |
| 140 | 236.4 | 15.81 | 186.6 | 10.32 |
| 150 | 249.7 | 18.24 | 203.4 | 12.27 |
| 160 | 262.3 | 20.80 | 219.9 | 14.38 |
| 170 | 274.2 | 23.48 | 236.2 | 16.67 |
| 180 | 285.4 | 26.28 | 252.2 | 19.11 |
| 190 | 295.7 | 29.19 | 267.9 | 21.71 |
| 200 | 305.2 | 32.20 | 283.3 | 24.46 |
| 210 | 314.6 | 35.29 | 298.4 | 27.37 |
| 220 | 323.5 | 38.49 | 313.3 | 30.43 |
| 230 | 331.7 | 41.76 | 327.8 | 33.64 |
| 240 | 339.5 | 45.12 | 342.1 | 36.99 |
| 250 | 346.9 | 48.55 | 356.1 | 40.48 |
| 260 | 354.3 | 52.06 | 369.9 | 44.11 |
| 270 | 361.9 | 55.63 | 383.4 | 47.88 |
| 280 | 369.8 | 59.29 | 396.7 | 51.77 |
| 290 | 378.2 | 63.03 | 409.8 | 55.81 |
| 298.15 | 385.4 | 66.14 | 420.4 | 59.19 |
| 300 | 387.0 | 66.86 | 422.8 | 59.97 |
| 310 | 396.0 | 70.77 | 435.6 | 64.26 |
| 320 | 404.9 | 74.78 | 448.3 | 68.68 |
| 330 | 413.5 | 78.87 | 460.9 | 73.23 |
| 340 | 421.5 | 83.05 | 473.4 | 77.90 |
| 350 | 428.5 | 87.30 | 485.7 | 82.70 |
| 360 | 435 | 91.6 | 497.8 | 87.6 |
| 370 | 442 | 96.0 | 510 | 92.7 |
| 380 | 448 | 100 | 522 | 97.8 |
| 390 | 454 | 105 | 533 | 103 |
| 400 | 459 | 110 | 545 | 109 |
| 410 | 463 | 114 | 556 | 114 |
| 420 | 466 | 119 | 568 | 120 |
| 430 | 469 | 124 | 579 | 125 |
| 440 | 472 | 128 | 589 | 131 |
| 450 | 476 | 133 | 600 | 137 |
| 460 | 477 | 138 | 611 | 143 |
| 470 | 479 | 142 | 621 | 149 |
| 480 | 481 | 147 | 631 | 156 |
| 490 | 482 | 152 | 641 | 162 |
| 500 | 484 | 157 | 651 | 168 |
| 510 | 486 | 162 | 660 | 175 |
| 520 | 487 | 167 | 670 | 182 |
| 530 | 489 | 172 | 679 | 188 |
| 540 | 490 | 176 | 688 | 195 |
| 550 | 492 | 181 | 697 | 202 |
| 560 | 493 | 186 | 706 | 209 |
| 570 | 495 | 191 | 715 | 216 |
| 580 | 496 | 196 | 723 | 223 |
| 590 | 497 | 201 | 732 | 231 |
| 600 | 499 | 206 | 740 | 238 |
| 610 | 500 | 211 | 748 | 246 |
| 620 | 500 | 216 | 757 | 253 |
| 630 | 501 | 221 | 765 | 261 |
| 640 | 502 | 226 | 773 | 268 |
| 650 | 502 | 231 | 780 | 276 |
| 660 | 503 | 236 | 788 | 284 |
| 670 | 504 | 241 | 796 | 292 |
Таким образом, результаты исследования теплоемкостей слоистых перовскитоподобных оксидов K2La2Ti3O10 и K2Nd2Ti3O10 в температурном интервале 7–670 K свидетельствуют о выполнении закона Дюлонга–Пти в области повышенных температур и об отклонениях от закона Дебая в области сверхнизких температур. Подобная аномалия теплоемкости, наблюдаемая ниже 9 K для обоих соединений, может быть вызвана небольшими изменениями в структуре перовскитоподобных слоистых соединений.
Работа выполнена при финансовой поддержке РФФИ (грант № 18-03-00915), Министерства образования и науки РФ по теме “Ведущие исследователи на постоянной основе” (Задание № 4.6138.2017/ВУ). ТГ-измерения проведены в РЦ “Термогравиметрические и калориметрические исследования”, исследование фазового и элементного состава выполнены в РЦ “Рентгенодифракционные методы исследования” и РЦ “Физических методов исследования поверхности” Научного парка СПбГУ.
Список литературы
Toda K., Kameo Y., Kurita S. et al. // J. Alloys and Compounds. 1996. V. 234. P. 19.
Pradhan D.K., Samantaray B.K., Choudhary R.N.P. et al. // Materials Science and Engineering. 2005. V. B 116. P. 7.
Moritomo Y., Asamitsu A., Kuwahara H. et al. // Nature. 1996. V. 380. P. 141.
Machida M., Miyazaki K., Matsushima S. et al. // Chemistry of Materials. 2003. V. 13. P. 1433.
Tai Y.-W., Chen J.-S., Yang Ch.-C. et al. // Catalysis Today. 2004. V. 97. P. 95.
Родионов И.А., Зверева И.А. // Успехи химии. 2016. Т. 85. P. 248.
Родионов И.А., Силюков О.И., Уткина Т.Д. и др. // Журн. общ. химии. 2012. Т. 82. № 7. С. 1064.
Rodionov I.A., Mechtaeva E.V., Burovikhina A.A. et al. Monatshefte für Chemie – Chemical Monthly. 2018. V. 149. P. 475.
Sato M., Toda K., Shimizu K. et al. // Chemistry of Materials. 2005. V. 17. P. 5161.
Schaak R.E., Mallouk T.E. // J. Solid State Chem. 2001. V. 161. P. 225.
Gopalakrishnan J., Sivakumar T., Ramesha K. et al. // J. Am. Chem. Soc. 2000. V. 122. P. 6237.
Shaak R.E., Mallouk T.E. // Ibid. 2000. V. 122. P. 2798.
Silyukov O.I., Kulish L.D., Trofimova D.V. et al. // J. Solid State Chem. 2018. V. 259. P. 28.
Kohut S.V., Sankovich A.M., Blokhin A.V. et al. // J. Therm. Anal. Calorim. 2014. V. 115. P. 119.
Markin A.V., Sankovich A.M., Smirnova N.N. et al. // J. Chem. Eng. Data. 2015. V. 60. P. 3069.
Sankovich A.M., Chislova I.V., Blokhin A.V. et al. // J. Therm. Anal. Calorim. 2016. V. 126. P. 601.
Sankovich A.M., Markin A.V., Smirnova N.N. et al. // Journal of Thermal Analysis and Calorimetry. 2018. V. 131. P. 1107.
Ruddlesden S.N., Popper P. // Acta Crystallographica. 1957. V. 10. P. 538.
Richard M., Brohan L., Tournoux M. // J. Solid State Chemistry. 1994. V. 112. P. 345.
Varushchenko R.M., Druzhinina A.I., Sorkin E.L. // J. Chem. Thermodyn. 1997. V. 29. P. 623.
Малышев В.М., Мильнер Г.А., Соркин Е.Л. и др. // Приборы и техника эксперимента. 1985. Т. 6. С. 195.
Höhne G.W.H., Hemminger W.F., Flammersheim H.-J. Differential Scanning Calorimetry. Berlin: Springer-Verlag Berlin and Heidelberg GmbH, 2003. 310 p.
Drebushchak V.A. // J. Therm. Anal. Calorim. 2005. V. 79. № 1. P. 213.
Санкович А.М., Зверева И.А. // Журн. cтруктур. химии. 2014. Т. 55. С. 805.
Физика и химия твердого состояния органических соединений / Под ред. Ю.А. Пентина. М.: Мир, 1967. 740 с.
Якубов Т.С. // Докл. АН СССР. 1990. Т. 310. № 1. С. 145.
Lazarev V.B., Izotov A.D., Gavrichev K.S. et al. // Thermochim. Acta. 1995. V. 269–270. P. 109.
McCullough J.P., Scott D.W. Calorimetry of Non-Reacting Systems. London: Butterworth, 1968.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии