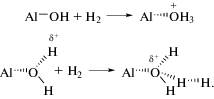Журнал физической химии, 2019, T. 93, № 3, стр. 398-404
МЕХАНИЗМ АДСОРБЦИИ ВОДОРОДА В ГРАФЕНОВЫХ НАНОСТРУКТУРАХ, СИНТЕЗИРОВАННЫХ В ПОРАХ МЕМБРАН И НА ЦЕОЛИТАХ
А. П. Солдатов *
Российская академия наук, Институт нефтехимического синтеза им. А.В. Топчиева
Москва, Россия
* E-mail: Soldatov@ips.ac.ru
Поступила в редакцию 18.05.2018
Аннотация
Изучен механизм адсорбции водорода в моно- и многослойных ориентированных углеродных нанотрубках из графенов (ОУНТГ), синтезированных в порах мембран “TRUMEM”. Проведено сравнительное исследование этих результатов и полученных ранее данных по адсорбции водорода в цилиндрических и планарных графеновых наноструктурах (ЦПГНС), сформированных на цеолитах ЦВМ и ЦВН. Синтезированы ОУНТГ и ЦПГНС при температуре 800°C, с использованием метана в качестве пиролизуемого реагента, а насыщение водородом проведено при давлении 9.0–12.0 МПа. С использованием термогравиметрического анализа (ТГА), совмещенного с масс-спектрометрическим анализом, установлено, что температура десорбции водорода из ОУНТГ составляет 175°С, а из ЦПГНС она происходит при 250 и 450°C, что свидетельствует о двух механизмах его адсорбции. С использованием спектроскопии комбинационного рассеяния (КРС) и просвечивающей электронной микроскопии (ПЭМ) показано, что ОУНТГ являются графеновыми структурами. Исследование изменения электрофизических характеристик (ξ-потенциала и заряда поверхности пор) исходных мембран, мембран с ОУНТГ и мембран с ОУНТГ, в которых аккумулирован водород, а также морфологии ОУНТГ, позволяет заключить, что механизм его адсорбции – диссоциативный. При этом, установлено, что способность адсорбировать водород исчезает, когда ОУНТГ перестают быть замкнутой, по периметру поры, цилиндрической структурой. Сделан вывод, что водород диффундирует по поверхности ОУНТГ и, вероятно, исследованные ранее реакции некаталитического гидрирования децена-1 и нафталина, с его участием, протекают по механизму спилловера. Проведен сравнительный анализ механизмов адсорбции водорода в ОУНТГ и ЦПГНС и оценка влияния физико-химических свойств поверхности субстратов на этот процесс.
Интенсивное развитие работ по синтезу и изучению наноструктур углеродного состава является неоспоримым фактом. Причем, при всем многообразии тематик, наибольшее внимание уделяется исследованию нанотрубок, фуллеренов, графенов, графанов, графдинов, графдиновых нанотрубок, обладающих уникальными поверхностно-адсорбционными и электронно-эмиссионными свойствами, которые находят широкое применение в микро- и наноэлектронике, материаловедении и т.д. [1–26]. Однако, круг публикаций, затрагивающих тему влияния подложки, на которой синтезируют наноструктуру, на ее свойства, достаточно ограничен и посвящен, главным образом, присутствию в субстрате примесей, дефектов и т.п. [27, 28]. При этом, исследования, рассматривающие взаимодействие подложки с ГНС, сформированной на ее поверхности, и ее влияние на адсорбцию водорода в ГНС, к настоящему времени отсутствуют.
В работах [29–32] было проведено исследование адсорбции водорода в ОУНТГ и ЦПГНС, которые являются графеновыми структурами [33], синтезированными на различных субстратах и, поскольку, с использованием этого водорода, впервые, проведены реакции гидрирования децена-1 и нафталина [34, 35], сравнительное изучение механизма его адсорбции в этих наноструктурах представляет значительный научный интерес.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
ОУНТГ и ЦПГНС синтезировали по методике, описанной в [30]. ОУНТГ в порах ультрафильтрационных композиционных мембран “TRUMEM” (TiO2 + Cr2O3 и TiO2 + MgO на пористой стали), имевших форму дисков с D = 47 мм, толщину селективного слоя ∼20 мкм и Dпор = 50 и 90 нм, соответственно. Пористость ∼25–35%, площадь поверхности пор ∼1.7 и 1.9 м2. ЦПГНС на цеолитах ЦВМ и ЦВН. Первый имел величину мольного отношения SiO2/Al2O3 – 25 с “оксидной” формулой: l.2Na2O · Аl2О3 · 25SiO2 (4.43% натрия в пересчете на оксид). У цеолита типа ЦВН величина мольного отношения SiO2/Al2O3 составляла 55 с “оксидной” формулой 0.14Na2O · · 0.86Н2O · Аl2О3 · 55SiO2 (0.25 мас. % оксида натрия). Предварительно цеолиты прогревали в вакууме (∼1.0 мм рт. ст.) при температуре формирования ЦПГНС – 800°С.
Насыщение водородом проводили при давлении 9.0–12.5 МПа в течение 20–24 ч.
Определение температуры десорбции Н2 проводили с использованием термогравиметрического анализа (ТГА), совмещенного с масс-спектрометрическим анализом. Для этого использовали дериватограф SETSYS EVOLUTION 16/18 (Setaram), совмещенный с масс-спектрометром OmniStar GSD 301 (Pfeiffer). Исследовали образцы мембран, в порах которых были синтезированы ОУНТГ или цеолита, на поверхности которого наносили ЦПГНС и аккумулировали водород. Ионные токи при m/e = 2, 15, 18, 28, 31, 32, 44 фиксировали в режиме on-line.
Для получения КРС-спектров была использована установка, состоящая из спектрометра TRIAX-552 (Jobin Yvon) с низкотемпературной Spec-10 ССD, зеркальной оптики и фильтров для подавления лазерного излучения, снабженная микроскопической приставкой. Возбуждение спектров осуществлялось лазером Stabilite 2018 с длиной волны 514 нм. Спектральный диапазон – 200–800 нм, спектральное разрешение ∼1 см–1, пространственное разрешение – 1 мкм. В работе использовалась геометрия обратного отражения: лазерный луч фокусировался на объекте той же линзой, которая собирала рассеянное от объекта излучение.
Электронно-микроскопические исследования проводили на приборе JEM-2010 просвечивающего типа с EDS приставкой (элементный анализ).
Электроповерхностные свойства мембран исследовали методом потенциала течения с использованием хлор-серебряных (Ag–AgCl) электродов [36]. В работе снимали зависимость между разностью потенциала $\Delta E$ и давления $\Delta P$ на мембране при пропускании через нее 0.01 М раствора KCl. Потенциал течения (ΔЕ/ΔР) использовали для определения $\xi $-потенциала по уравнению Смолуховского, значение которого применяли в уравнении Гуи для расчета плотности заряда на поверхности пор. По тангенсу угла наклона ΔЕ/ΔР определяли знак заряда поверхности.
Течение через мембраны жидкостей изучали на установках двух типов, обеспечивающих градиент давления за счет вакуумирования приемника и при создании избыточного давления на мембране. Вакуумную фильтрацию проводили при температуре 20–22°С и перепаде давления на мембране Δр = 1 атм. Изучение проницаемости на установке с избыточным давлением проводили на мембранах с D = 47 мм, что обусловлено конструкцией ее измерительной ячейки. Проницаемость рассчитывали по формуле: Q = J/SмембрΔp, где J – поток жидкости через мембрану за единицу времени, cм3/с; Sмембр – рабочая площадь мембраны, cм2; Δp – перепад давления на мембране, см рт.ст.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Для исследования механизма адсорбции водорода в ОУНТГ и ЦПГНС были определены, с использованием ТГА, совмещенного с масс-спектрометрическим анализом, температуры десорбции Н2 из этих структур (рис. 1). При десорбции водорода из ОУНТГ наблюдается пик изменения ионного тока (2) для m/e = 2 при температуре ∼175°С (рис. 1а), что свидетельствует об одном механизме его адсорбции. В спектре, описывающем десорбцию водорода из ЦПГНС, присутствуют два пика для m/e = 2, при температурах 250 и 450°С (рис. 1б). Это свидетельствует о существовании двух различных механизмов адсорбции водорода в ЦПГНС.
Рис. 1.
Изменение массы (1) и ионного тока (2) при m/e = 2 для мембраны, в порах которой синтезированы ОУНТГ и адсорбирован Н2 (а) и изменение массы (1) и ионного тока при m/e = 2 (2), 15 (3) и 31 (4) для образца ЦВМ, на поверхности которого синтезированы ЦПГНС и аккумулирован H2 (б).
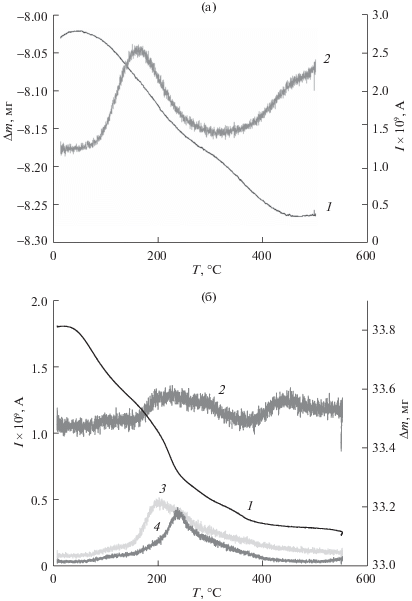
Как следует из рис. 1а температура десорбции водорода из ОУНТГ равна 175°С, т.е. она существенно превосходит энергию водородных связей. Известно [36, 37], что энергия водородной связи молекул воды, которая при 0°С образует четырехмолекулярные ассоциаты, является весьма сильной и составляет 25 кДж/моль. Однако при температуре кипения и атмосферном давлении вода содержит менее 1% димеров [38], т.е. происходит практически полное разрушение водородных связей. В то же время, в ОУНТГ водород сохраняется до существенно более высокой температуры – 175°С.
Морфология ОУНТГ и механизма адсорбции водорода были исследованы методами КРС и ПЭМ, а также измерением электрофизических свойств поровой поверхности исходных мембран, мембран, в порах которых синтезировали ОУНТГ и мембран с ОУНТГ, в которых был аккумулирован Н2. На рис. 2а приведен рамановский спектр синтезированных углеродных наноструктур. Вид спектра в области 2400–3200 см–1 (узкая полоса 2Д в области 2700 см–1, а так же справа и слева от нее широкие полосы) соответствует спектру графена с числом слоев ≥5. В то же время, в образце, по-видимому, присутствует, как примесь, наноразмерный графит с размером кластера около 5 нм. Сравнительный анализ спектров образцов, подвергавшихся и не подвергавшихся насыщению водородом, показал их практическую идентичность, т.е. адсорбированный водород не образовал химических связей со структурами ОУНТГ.
Рис. 2.
Рамановский спектр (а) и фотография ПЭМ (б) графеновой наноструктуры, синтезированной на мембране “TRUMEM”.
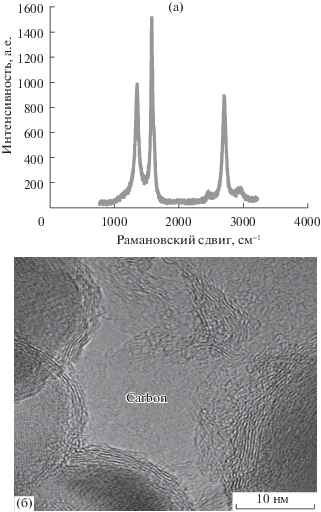
Электронно-микроскопическое изображение с высоким разрешением углеродной пленки, нанесенной на мембрану (рис. 2б), показывает, что на оксидах, в виде шаров, из которых сформирован селективный слой мембраны, присутствуют структуры, состоящие из нескольких графеновых слоев.
При измерении электрофизических свойств поровой поверхности установлено, что после нанесения ОУНТГ, ξ-потенциал и заряд их поверхности уменьшаются ∼ на порядок, по сравнению с исходной мембраной (таблица 1). Это связано с тем, что наноуглеродное покрытие экранирует поровую поверхность, уменьшая как заряд ее поверхности, так и ξ-потенциал, характеризующий разность потенциалов дисперсионной среды и неподвижного слоя жидкости, окружающего частицу. Однако, после насыщения ОУНТГ водородом происходит увеличение ∼ в 3–4 раза как ξ-потенциала, так и заряда их поверхности. Это подтверждает, что водород в двухмерной углеродной структуре весьма активен и вступает в обменные или координационные взаимодействия, которые, вероятно, обусловлены механизмом диссоциативной адсорбции.
Таблица 1.
Влияние адсорбции водорода (${{A}_{{{{{\text{H}}}_{{\text{2}}}}}}}$) в ОУНТГ на электрофизические характеристики поровой поверхности и производительность мембран
| № обр. | –ζ × 103, В | –σ × 104, Кл/м2 | ${{A}_{{{{{\text{H}}}_{{\text{2}}}}}}}$, мас. % от ОУНТГ | Q × 105, мл/c см2 cм Hg | ||
|---|---|---|---|---|---|---|
| Н2О | этанол | додекан | ||||
| Исх. 50 нм | 20.0 | 47.5 | – | 4.4 | 2.9 | 2.9 |
| 1* | 2.6 | 6.1 | – | 7.9 | 6.8 | 5.3 |
| Исх. 90 нм | 27.4 | 66.5 | – | 14.2 | 9.2 | 6.5 |
| 2* | 2.2 | 5.1 | – | 18.5 | 13.6 | 9.2 |
| 3** | 8.3 | 17.2 | 0.2 | 2.2 | 2.4 | 2.8 |
| 4** | 8.1 | 18.9 | 0.5 | 1.7 | 2.1 | 2.3 |
| 5** | 7.3 | 17.0 | 0.7 | 1.1 | 2.0 | 2.1 |
| 6** | 7.0 | 16.1 | 1.0 | 0.59 | 0.76 | 0.43 |
Высокая реакционная способность водорода, адсорбированного в ОУНТГ, подтверждается результатами работ [33, 34], в которых установлено, что энергии активации, для некаталитического гидрирования децена-1 и нафталина, составляют 94.5 и 123.5 кДж/моль соответственно. Для сравнения, энергия активации реакций некаталитического гидрирования олефинов, в частности этилена, молекулярным водородом составляет ∼180 кДж/моль, при этом на платиновом катализаторе, одном из лучших для этого процесса, – 40 кДж/моль [39], а в нашем случае – 94.5 кДж/моль. Это показывает, что ОУНТГ проявляют свойства катализатора в реакциях гидрирования.
Учитывая приведенные выше результаты, можно полагать, что реакция гидрирования протекает по механизму спилловера, реализующегося при каталитических процессах:
(1)
$\begin{gathered} {{{\text{Н }}}_{2}}\;\xrightarrow{{{\text{г р а ф е н }}}}\;{\text{2Н }}\;\overset {{\text{г р а ф е н }}} \leftrightarrows \;{\text{2}}{{{\text{H}}}^{ + }} + 2{\text{e}}, \\ {\text{2H}} + {\text{C}}{{{\text{H}}}_{3}}{{({\text{C}}{{{\text{H}}}_{{\text{2}}}})}_{7}}{\text{CH = C}}{{{\text{H}}}_{2}} \to \\ \to {\text{C}}{{{\text{H}}}_{3}}{{({\text{C}}{{{\text{H}}}_{{\text{2}}}})}_{7}}{\text{C}}{{{\text{H}}}_{2}}{\kern 1pt} - {\kern 1pt} {\text{C}}{{{\text{H}}}_{3}}, \\ 4{\text{Н }} + {{{\text{С }}}_{{{\text{10}}}}}{{{\text{Н }}}_{8}} \to {{{\text{С }}}_{{{\text{10}}}}}{{{\text{Н }}}_{{{\text{12}}}}}, \\ {\text{H}} + {\text{H}} \to {{{\text{H}}}_{2}}. \\ \end{gathered} $Действительно, после адсорбции водорода в ОУНТГ ξ-потенциал и заряд поровой поверхности возрастают (таблица 1). Это, вероятно, связано с появлением электронов (схема 1), причем, ξ‑потенциал и заряд поровой поверхности имеют практически одинаковые значения независимо от количества адсорбированного водорода (табл. 1). Можно полагать, что в обратимом процессе образования электронов и H+ (схема 1), достигается равновесная концентрация.
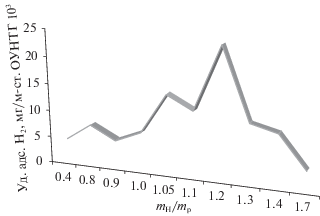
Механизм спилловера предполагает адсорбцию водорода на катализаторе, миграцию к молекуле гидрируемого реагента и собственно реакцию. В нашем случае, диффузия молекул водорода и продуктов их диссоциативного разложения по поверхности ОУНТГ подтверждается результатами работы [33], в которой, в частности, проведено исследование зависимости адсорбции водорода в ОУНТГ от их морфологии. Был введен численный фактор Ψ = mн/mр, где mн – реально нанесенная масса углерода при формировании ОУНТГ, а mр – расчетная масса углерода, необходимого для образования монослойных ОУНТГ, и установлено, что способность ОУНТГ адсорбировать и сохранять водород выполняется при соотношение: 0.4–0.6 < Ψ < 1.5–1.7, причем, зависимость удельной адсорбции водорода от Ψ имеет максимум при значении фактора 1.2 (рис. 3). Это означает, при 0.4–0.6 < Ψ < 1.2 масса наносимого углерода недостаточна для формирования сплошных монослойных ОУНТГ, т.е. на поверхности пор появляются участки, на которых углеродное покрытие отсутствует, оно становится фрагментарным, однако его водород-адсорбционная способность сохраняется. При Ψ < 0.4–0.6 углеродный монослой вырождается в совокупность не связанных между собой “островов”, и его способность адсорбировать водород пропадает.
Причина этого, вероятно, связана с тем, что когда ОУНТГ является замкнутой цилиндрической структурой, молекулы водорода и продукты их диссоциативного разложения диффундируют по ее поверхности, оставаясь адсорбированными в углеродной наноструктуре. Однако, при Ψ < < 0.4–0.6 цилиндрическая структура ОУНТГ сменяется фрагментарной и водород, адсорбирующийся на этих участках, диффундирует на оксидную поверхность поры и десорбируется.
Говоря о высокой реакционной способности адсорбированного в ОУНТГ водорода, необходимо отметить его влияние на производительность мембран. В табл. 1 приведены результаты, показывающие, что при формировании в порах мембран с D = 50 и 90 нм однослойных ОУНТГ (без Н2), их производительность увеличивается (обр. 1* и 2*). После адсорбции водорода в количестве от 0.2 до 1.0% производительность уменьшается по всем жидкостям в 4–26 раз. При этом, снижение проницаемости при увеличении количества адсорбированного водорода имеет, практически, линейный характер (табл. 1). Из приведенных данных видно, что производительность мембран с адсорбированным Н2, имеющих Dпор = 90 нм, становится сопоставимой, а в некоторых случаях почти на порядок меньшей, чем у мембран с Dпор = 50 нм, не содержащих аккумулированного водорода.
После адсорбции водорода в ОУНТГ, возникает весьма необычный феномен: производительность мембран по всем жидкостям (вода, этанол, додекан) становится, практически, одинаковой при равном количестве адсорбированного водорода (табл. 1). Можно полагать, что такие важные, для проницаемости мембран, факторы как дипольный момент молекул транспортируемого флюида, который для воды и спирта равен $\mu = 6.1$ и 5.7 Кл м, соответственно, а для додекана имеет нулевое значение, его вязкость, молекулярный вес нивелируются за счет взаимодействий с адсорбированным водородом. Несомненно, что механизм влияния водорода на проницаемость мембран, обусловленный его взаимодействием с молекулами транспортируемых жидкостей, весьма интересен и требует специального исследования.
Таким образом, можно считать, что механизм адсорбции является диссоциативным, при этом, водород и продукты его диссоциативного разложения, диффундируют по поверхности ОУНТГ. Некаталитическое гидрирование децена-1 и нафталина протекает по механизму спилловера, который реализуется в реакциях с использованием катализаторов. Вместе с этим, приведенные выше энергии активации для отмеченных реакций, показывают, что ОУНТГ, т.е. углеродная наноструктура обладает каталитическим эффектом.
Проведем сравнение этих результатов с данными [32], описывающими механизм адсорбции водорода в ЦПГНС. Было показано, что, в этом случае, адсорбция протекает по двум механизмам: ассоциативному (температура десорбции 250°С) и хемосорбционному (температура десорбции 450°С). Первый обусловлен взаимодействием водорода с гидроксильными группами, что приводит к изменению их структуры и образованию новой структуры близкой к супер-кислотному центру по схемам:
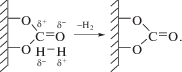
Второй механизм связан с координацией Н–Н по двойной связи С=О в карбонат-ионе. Это приводит к поляризации как связи Н+δ–Н–δ , так и С+δ=О–δ, причем реакция является обратимой. После нагрева образца до 450°С происходит десорбция водорода и снятие его координации с С=О-связи, что приводит к перераспределению электронной плотности в карбонат-ионах по схеме:
Видно, что активность водорода, адсорбированного в ЦПГНС, настолько высока, что он взаимодействует с подложкой, а именно, с реакционно-способными структурами цеолитов с образованием сильных химических связей. Активность водорода, адсорбированного в ОУНТГ, не менее высока, что подтверждается некаталитическим гидрированием децена-1 и нафталина, но данная углеродная наноструктура синтезирована на поверхности оксидов, реакционная способность которых несравнимо ниже. Поэтому мы не наблюдаем каких-либо взаимодействий между ними, что подтверждается результатами рамановской спектроскопии.
Полученные результаты показывают, что механизм адсорбции водорода в ОУНТГ, сформированных в порах мембран, является диссоциативным. При этом, водород и продукты его диссоциации диффундируют по поверхности ОУНТГ, оставаясь адсорбированными в углеродной наноструктуре до тех пор, пока ее морфология не превратится в совокупность не связанных между собой “островов”.
Некаталитическое гидрирование децена-1 и нафталина водородом, адсорбированным в ОУНТГ, протекает по механизму спилловера, который типичен для реакций с использованием катализаторов. Учитывая, что энергии активации для этих реакций, существенно ниже, чем для реакций некаталитического гидрирования молекулярным водородом и, в то же время, сопоставима с энергией активации при гидрировании с использованием катализатора, можно полагать, что ОУНТГ, т.е. углеродная наноструктура обладает значительным каталитическим эффектом.
Сравнение адсорбции водорода в ОУНТГ и ЦПГНС, показывает, что подложка чрезвычайно сильно влияет на механизм и энергетику этого процесса. Водород, адсорбированный в ОУНТГ, синтезированных на оксидной поверхности мембран, не взаимодействует с подложкой. В то же время, водород, аккумулированный в ЦПГНС, взаимодействует с различными химическими соединениями цеолитов, что приводит к реализации ассоциативного механизма адсорбции и хемосорбции. Таким образом, влияние подложки весьма важный фактор, определяющий целевое использование аккумулируемого водорода (накопительная адсорбция, адсорбция для гидрирования и т.д.).
Работа выполнена в рамках Государственного задания ИНХС РАН.
Список литературы
Zhang W., Lu W-C., Zhang H-X. et al. // Carbon. 2018. V. 131. P. 137.
Dasgupta A., Rajukumar L.P., Rotella C. et al. // Nano Today. 2017. V. 12. P. 116.
Shekar S.C., Swathi R.S. // Carbon. 2018. V. 126. P. 489.
Algara-Siller G., Lehtinen O., Kaiser U. et al. // Nature. 2015. V. 519. № 7544. P. 443.
Guoxing Li, Yuliang Li, Huibiao Liu et al. // Chem. Commun. 2010. V. 46. P. 3256.
Kar R., Patel N.N., Chand N., Shilpa R.K. et al. // Carbon. 2016. V. 106. P. 233.
Shi J.-L., Wang H.-F., Zhu X., Chen C.-M. et al. // Ibid. 2016. V. 103. P. 36.
Sun X., Li R., Stansfield B., Dodelet J.-P. et al. // Ibid. 2007. V. 45. № 4. P. 732.
Elias D.C., Nair R.R., Mohiuddin T.M.G. et al. // Science. 2009. V. 323. № 5914. P. 610.
Savchenco A. Materials science: transforming graphene // Science. 2009. V. 323. № 5914. P. 589.
Gao L., Zhou X., Ding Y. // Chem. Phys. Lett. 2007. V. 434. № 4–6. P. 297.
Klimov N.N., Jung S., Zhitenev N.B. et al. // Science. 2012. V. 336. № 6088. P. 1557.
Yang H., Heo J., Park S. et al. // Ibid. 2012. V. 336. № 6085. P. 1140.
Britnell L., Mishchenko A., Georgiou T. et al. // Ibid. 2012. V. 335. № 6071. P. 947.
Simon J., Greiner M. // Nature. 2012. V. 483. № 7389. P. 282.
Chen C.F., Park C.H., Horng J. et al. // Ibid. 2011. V. 471. № 7340. P. 617.
Ray A.K., Sahu R.K., Rajinikanth V. et al. // Carbon. 2012. V. 50. № 11. P. 4123.
Hao H., Liu P., Tang J. et al. // Ibid. 2012. V. 50. № 11. P. 4103.
Britnell L., Mishchenko A., Georgiou T. et al. // Science. 2012. V. 335. № 6071. P. 947.
Zhang C., Li J., Liu E. et al. // Carbon. 2012. V. 50. № 10. P. 3513.
Wu C., Li F., Zhang Y. et al. // Ibid. 2012. V. 50. № 10. P. 3622.
Hagen A., Moos G., Talalaev V. et al. // Appl. Phys. A. 2004. V. 78. P. 1137.
Haley M.M. // Pure Appl. Chem. 2008. V. 80. № 3. P. 519. 21. Granford S.W., Buehler M.J. // Nanoscale. 2012. V. 4. P. 4587.
Malko D., Neiss C., Viñes F. et al. // Phys. Rev. Lett. 2012. V. 108. P. 086804.
Li G.X., Li Y.L., Liu H.B. et al. // Chem. Commun. 2010. V. 46. P. 3256.
Li G., Li Y., Qian X. et al. // J. Phys. Chem. C. 2011. V. 115. P. 2611.
Çelik Y., Escoffier W., Yang M. et al. // Carbon. 2016. V. 109. P. 529.
Roy S.S., Jacobberger R.M., Wan C. et al. // Ibid. 2016. V. 100. P. 1.
Солдатов А.П., Паренаго О.П. // Докл. АН. 2008. Т. 421. № 3. С. 364.
Soldatov A.P., Tsodikov M.V., Bichkov V.Yu. et al. // Int. J. Hydrogen Energy. 2011. V. 36. № 1. P. 1264.
Солдатов А.П., Паренаго О.П. // Докл. АН. 2014. Т. 456. № 5. С. 552.
Солдатов А.П., Бондаренко Г.Н., Сорокина Е.Ю. // Журн. физ. химии. 2015. Т. 89. № 2. С. 306.
Солдатов А.П., Кириченко А.Н., Татьянин Е.В. // Там же. 2016. Т. 90. № 7. С. 1038.
Солдатов А.П. // Там же. 2014. Т. 88. № 7–8. С. 1207.
Солдатов А.П. // Там же. 2017. Т. 91. № 5. С. 897.
Березкин В.В., Волков В.И., Киселева О.А. и др. // Коллоидн. журн. 2003. Т. 65. С. 129.
Гороновский И.Т., Назаренко Ю.П., Некряч Е.Ф. Краткий справочник по химии, Киев: Наукова думка, 1974. 991 с.
Синюков В.В. Структура одноатомных жидкостей, воды и водных растворов электролитов. М.: Наука, 1976. 264 с.
Токабе К. Катализаторы и каталитические процессы. М.: Наука, 1993.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии