Журнал физической химии, 2019, T. 93, № 4, стр. 579-583
Энтальпия анионного обмена хлорид−пиридинкарбоксилат на анионите АВ-17-8
Г. Н. Альтшулер a, *, Е. В. Остапова a, О. Г. Альтшулер a, b
a Федеральный исследовательский центр угля и углехимии Сибирского отделения Российской академии наук
Кемерово, Россия
b Кемеровский государственный университет
Кемерово, Россия
* E-mail: altshulerh@gmail.com
Поступила в редакцию 20.04.2018
Аннотация
Выполнены микрокалориметрические измерения теплот обмена анионов Cl– на анионы никотиновой, изоникотиновой, дипиколиновой и цинхомероновой кислот на сильноосновном анионите АВ-17-8 при 298 K. Определены парциальные и стандартные энтальпии сорбции анионов пиридинкарбоновых кислот из водных растворов на Cl-форму анионита АВ-17-8. Значения стандартных энтальпий находятся в интервале 3–14 кДж/моль и увеличиваются в последовательности: никотинат, изоникотинат, анион дипиколиновой кислоты, анион цинхомероновой кислоты.
В последнее время интенсивно исследуются физико-химические свойства пиридинкарбоновых кислот. Наиболее изучена никотиновая (пиридин-3-карбоновая) кислота, так как она играет решающую роль в биологических системах, поскольку выступает в качестве важного предшественника окислительно-восстановительных коферментов – никотинамидадениндинуклеотида и никотинамидадениндинуклеотидфосфата – ключевых компонентов в клеточных метаболических реакциях [1]. Неуклонно растет мировой спрос на никотиновую кислоту и ее производные от 8500 тонн в год в 1980-х годах до 40000 тонн в 2000-х годах [2–4]. Прогноз [5] на 2020 год – 100000 тонн. Изоникотиновую (пиридин-4-карбоновую) кислоту используют в качестве сырья в производстве ряда противотуберкулезных препаратов и антидепрессантов [6, 7]. Дипиколиновая (пиридин-2,6-дикарбоновая) кислота – прекурсор ангиопротекторных препаратов типа пармидина. Описано применение дипиколиновой кислоты для создания протон проводящих материалов [8], для ингибирования коррозии и дезактивации ядерных реакторов [9]. Цинхомероновая (пиридин-3,4-дикарбоновая) кислота – прекурсор никотиновой и изоникотиновой кислот.
Нами показана возможность иммобилизации никотиновой и изоникотиновой кислот в наноконтейнерах на основе сульфированных сетчатых полимеров [10], исследованы механизм и кинетика их сорбции на сильнокислотных катионитах (сульфокатионите КУ-2-8, сульфированном поликаликсарене) [11], на сильноосновном анионообменнике АВ-17-8 [12].
В данной работе выполнены микрокалориметрические измерения теплот ионного обмена хлорид-ионов на анионы никотиновой, изоникотиновой, цинхомероновой и дипиколиновой кислот на сильноосновном анионите АВ-17-8. Определены парциальные и стандартные энтальпии сорбции анионов пиридинкарбоновых кислот на Cl-форму анионита АВ-17-8 из водных растворов.
Процесс анионного обмена хлорид–пиридинкарбоксилат можно представить уравнением
(1)
$\begin{gathered} \overline {{{{[{\text{C}}_{6}^{{}}{{{\text{H}}}_{{\text{5}}}}{\text{C}}{{{\text{H}}}_{2}}{\text{N}}{{{({\text{CH}}_{3}^{{}})}}_{3}}]}}^{ + }}{\text{С }}{{{\text{l}}}^{ - }}} + {\text{Py}}{\kern 1pt} - {\kern 1pt} {\text{С O}}{{{\text{O}}}^{ - }} = \\ = \;\overline {{{{[{\text{C}}_{6}^{{}}{{{\text{H}}}_{5}}{\text{C}}{{{\text{H}}}_{2}}{\text{N}}{{{({\text{CH}}_{3}^{{}})}}_{3}}]}}^{ + }}{\text{Py}}{\kern 1pt} - {\kern 1pt} {\text{С O}}{{{\text{O}}}^{ - }}} + {\text{C}}{{{\text{l}}}^{ - }}, \\ \end{gathered} $Термодинамические характеристики процесса анионного обмена (1) во многом определяются кислотно-основными равновесиями пиридинкарбоновых кислот. На схеме приведены кислотно-основные равновесия в водных растворах никотиновой кислоты
(2)
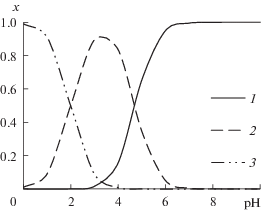
${{K}_{1}} = \frac{{[{\text{HL}}]}}{{[{\text{H}}][{\text{L}}]}},\quad {{K}_{2}} = \frac{{[{{{\text{H}}}_{2}}{\text{L}}]}}{{[{\text{H}}][{\text{HL}}]}},$Молярные доли ионных форм пиридинкарбоновых кислот (${{x}_{{\text{L}}}},$ ${{x}_{{{\text{HL}}}}},$ ${{x}_{{{{{\text{H}}}_{{\text{2}}}}{\text{L}}}}}$) в растворе могут быть рассчитаны из системы уравнений (2) и уравнения материального баланса. На рис. 1 представлены зависимости ${{x}_{{\text{L}}}}({\text{р Н }})$, ${{x}_{{{\text{Н L}}}}}({\text{р Н }}),$ ${{x}_{{{{{\text{Н }}}_{{\text{2}}}}{\text{L}}}}}({\text{р Н }})$ для никотиновой кислоты. Процессы анионного обмена хлорид–пиридинкарбоксилат (1) изучены при концентрации анионов пиридинкарбоновых кислот, превышающей концентрацию катионов и молекул в растворе (рис. 1).
Рис. 1.
Зависимости молярной доли ионных форм никотиновой кислоты от рН раствора: 1 – ${{x}_{{\text{L}}}}$, 2 – ${{x}_{{{\text{HL}}}}}$, 3 – ${{x}_{{{{{\text{H}}}_{2}}{\text{L}}}}}$.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Сильноосновной анионит АВ-17-8 имеет гелевую структуру, содержит бензилтриметиламмониевые ионогенные группы на матрице сополимера стирола и 8% дивинилбензола. Полная динамическая ионообменная емкость анионита АВ-17-8 по 0.1 М КОН составляла 2.7 мг-экв на грамм Cl-формы сухого полимера. Динамическая ионообменная емкость при сорбции анионов пиридинкарбоновых кислот из 0.01 М водных растворов – 2.7 мг-экв/г.
Никотиновая (пиридин-3-карбоновая) кислота соответствовала требованиям Международной фармакопеи [15], содержала не менее 99.0% основного вещества. Изоникотиновая (пиридин-4-карбоновая) кислота фирмы “ВЕКТОН”, содержала 99.0% основного вещества. Дипиколиновая кислота получена по методике [16] (т. пл. 232–233° С, Найдено (%): C, 50.65; H, 3.02; N, 9.35, C7H5NO4. Вычислено (%): C, 50.29; H, 3.02; N, 8.38). Цинхомероновая кислота получена по методике [17] (т. пл. 258–260° С. Найдено (%): C, 50.62; H, 3.15; N, 8.48, C7H5NO4. Вычислено (%): C, 50.29; H, 3.02; N, 8.38).
Тепловые эффекты (Q) ионообменных процессов (1) измеряли с помощью дифференциального микрокалориметра ДАК 1-1А с аналогово-цифровым преобразователем в режиме автоматической компенсации термо-ЭДС за счет эффекта Пельтье при температуре 298 K с использованием стандартных (контрольной и измерительной) ампул из нержавеющей стали емкостью 6 мл.
Поверка калориметра выполнена по измерению энергии тепловыделения в режиме подключения калиброванных встроенных в калориметр мощностей 70 и 233 мкВт. Погрешность измерения тепловыделения составляла 1%. Чувствительность калориметра в режиме автоматической компенсации термо-ЭДС – 0.02 В/Вт. Микрокалориметр градуировали по растворению в воде химически чистого хлористого рубидия, обладающего высокой молекулярной массой. В расчетах использовали справочное [18] значение ${{\Delta }_{{{\text{aq}}}}}H_{{{\text{RbCl}}}}^{0} = 17.01 \pm 0.03$ кДж/моль.
При измерении тепловых эффектов сорбции анионов пиридинкарбоновых кислот в измерительную ампулу помещали 5.3 мл 0.01–0.05 М водного раствора калиевой соли пиридинкарбоновой кислоты (рН 7–7.5), а в контрольную ампулу – 5.3 мл воды. В измерительную ампулу вводили (1–3) × 10–2 г набухшего анионита АВ-17-8 в Cl-форме и регистрировали тепловой поток. При измерении тепловых эффектов десорбции анионов пиридинкарбоновых кислот в измерительную ампулу помещали 5.3 мл 0.01–0.05 М водного раствора NaCl, а в контрольную ампулу – 5.3 мл воды. В измерительную ампулу вводили (1–3) × × 10–2 г набухшего анионита АВ-17-8 в форме пиридинкарбоновой кислоты и регистрировали тепловой поток. Тепловые потоки составляли 10–6–10‒4 Вт. При определении значений теплового эффекта ионообменного процесса выполняли не менее трех измерений.
Количество сорбированной или десорбированной кислоты рассчитывали по изменению ее концентрации в растворе до и после калориметрических измерений. Концентрацию пиридинкарбоновых кислот в растворах определяли с помощью спектрофотометра СФ-46 при λ = 262.7 нм и pH 6.86 (фосфатный буфер).
В табл. 2 приведены основные параметры экспериментов по определению тепловых эффектов ионного обмена ${\text{C}}{{{\text{l}}}^{ - }} \leftrightarrow {\text{Py}}{\kern 1pt} - {\kern 1pt} {\text{С O}}{{{\text{O}}}^{ - }}$ на анионите АВ-17-8 при 298 K.
Таблица 2.
Тепловые эффекты ионного обмена ${\text{C}}{{{\text{l}}}^{ - }} \leftrightarrow {\text{Py}} - {\kern 1pt} {\text{С O}}{{{\text{O}}}^{ - }}$ на анионите АВ-17-8
| ${{C}_{{{\text{Py}}{\kern 1pt} - {\kern 1pt} {\text{С O}}{{{\text{O}}}^{ - }}}}}$, моль/кг | m, г | ${{\bar {x}}_{{{\text{Py}} - {\text{CO}}{{{\text{O}}}^{ - }}}}}$ | Q, Дж | $\Delta H$, кДж/моль | ||
|---|---|---|---|---|---|---|
| исходная | конечная | исходная | конечная | |||
| Обмен Cl– ↔ анион цинхомероновой кислоты | ||||||
| 0 | 1.01 | 0.0078 | 0 | 0.37 | 0.147 | 18.5 |
| 0 | 1.44 | 0.0117 | 0 | 0.53 | 0.27 | 16.0 |
| 0 | 1.80 | 0.0186 | 0 | 0.67 | 0.58 | 17.4 |
| 0 | 2.4 | 0.0095 | 0 | 0.87 | 0.28 | 12.6 |
| 2.7 | 1.31 | 0.0194 | 1 | 0.48 | –0.30 | 11.0 |
| 2.7 | 1.53 | 0.0154 | 1 | 0.57 | –0.159 | 9.7 |
| 2.7 | 2.4 | 0.0671 | 1 | 0.89 | –0.21 | 10.7 |
| Обмен Cl– ↔ анион дипиколиновой кислоты | ||||||
| 0 | 1.47 | 0.0128 | 0 | 0.54 | 0.083 | 4.4 |
| 0 | 2.1 | 0.0116 | 0 | 0.79 | 0.093 | 3.7 |
| 0 | 2.4 | 0.0135 | 0 | 0.90 | 0.175 | 5.3 |
| 2.7 | 1.30 | 0.0150 | 1 | 0.482 | –0.159 | 7.2 |
| 2.7 | 1.33 | 0.0130 | 1 | 0.49 | –0.102 | 5.8 |
| Обмен Cl– ↔ изоникотинат | ||||||
| 0 | 0.62 | 0.0203 | 0 | 0.23 | 0.029 | 2.3 |
| 0 | 0.97 | 0.0180 | 0 | 0.36 | 0.019 | 1.1 |
| 0 | 1.15 | 0.0229 | 0 | 0.42 | 0.046 | 1.75 |
| 2.7 | 1.18 | 0.0096 | 1 | 0.44 | –0.068 | 4.6 |
| 2.7 | 1.28 | 0.0112 | 1 | 0.47 | –0.052 | 3.2 |
| Обмен Cl– ↔ никотинат | ||||||
| 0 | 1.09 | 0.0175 | 0 | 0.40 | 0.025 | 1.3 |
| 0 | 1.33 | 0.0120 | 0 | 0.49 | 0.024 | 1.5 |
| 2.7 | 0.79 | 0.0133 | 1 | 0.29 | –0.105 | 4.1 |
| 2.7 | 0.95 | 0.0091 | 1 | 0.35 | –0.053 | 3.3 |
| 2.7 | 1.69 | 0.0122 | 1 | 0.62 | –0.068 | 5.5 |
| 2.7 | 1.83 | 0.0089 | 1 | 0.68 | –0.032 | 4.1 |
Обозначения: ${{C}_{{{\text{Py}}{\kern 1pt} - {\kern 1pt} {\text{С O}}{{{\text{O}}}^{ - }}}}}$ – концентрация аниона ${\text{Py}}{\kern 1pt} - {\kern 1pt} {\text{С O}}{{{\text{O}}}^{ - }}$ в анионите, m – масса анионита, (${{\bar {x}}_{{{\text{Py}} - {\text{С O}}{{{\text{O}}}^{ - }}}}}$) – молярная доля аниона ${\text{Py}}{\kern 1pt} - {\kern 1pt} {\text{С O}}{{{\text{O}}}^{ - }}$ в анионите, Q – теплота обмена $\overline {{\text{С }}{{{\text{l}}}^{ - }}} \leftrightarrow \overline {{\text{Py}}{\kern 1pt} - {\kern 1pt} {\text{С O}}{{{\text{O}}}^{ - }}} $, $\Delta H$ – дифференциальная энтальпия обмена $\overline {{\text{С }}{{{\text{l}}}^{ - }}} \to \overline {{\text{Py}}{\kern 1pt} - {\kern 1pt} {\text{С O}}{{{\text{O}}}^{ - }}} $.
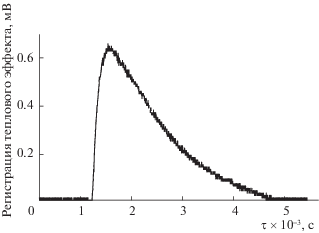
В качестве примера на рис. 2 приведена баллистическая кривая, отражающая мощность теплового потока в ходе процесса обмена анионов Cl– на анионы дипиколиновой кислоты в АВ-17-8 при изменении концентрации аниона в полимере от 0 до 1.47 моль/кг (табл. 2).
Рис. 2.
Мгновенное значение выходной ЭДС калориметра, пропорциональное мгновенной мощности теплового потока в процессе обмена анионов Cl– на анионы дипиколиновой кислоты в АВ-17-8 при изменении концентрации аниона в полимере от 0 до 1.47 моль/кг при 298 K (баллистическая кривая).
Дифференциальные (парциальные) энтальпии анионного обмена хлорид–пиридинкарбоксилат ($\Delta H$) рассчитывали как отношение измеренной теплоты ионного обмена (Q) к числу молей сорбированного аниона. Ошибка определения парциальной энтальпии не превышала 1.6 кДж/моль. Стандартные энтальпии анионного обмена (${{\Delta }_{{\text{r}}}}H_{{298}}^{0}$) хлорид-анионов на анионы пиридинкарбоновых кислот в анионите АВ-17-8 при 298 K получены интегрированием соответствующих дифференциальных энтальпий по составу полимера в пределах от ${{\bar {x}}_{{{\text{Py}} - {\text{CO}}{{{\text{O}}}^{ - }}}}} = 0$ до ${{\bar {x}}_{{{\text{Py}} - {\text{CO}}{{{\text{O}}}^{ - }}}}} = 1$ по уравнению
(3)
${{\Delta }_{{\text{r}}}}H_{{298}}^{0} = \int\limits_0^1 {\Delta H} d{{\bar {x}}_{{{\text{Py}} - {\text{CO}}{{{\text{O}}}^{ - }}}}},$Полученные интегральные величины ${{\Delta }_{{\text{r}}}}H_{{298}}^{0}$ являются стандартными энтальпиями ионного обмена, так как теплоты смешения и различия в теплосодержании между 0.05 М растворами солей пиридинкарбоновых кислот и хлоридов калия, натрия меньше, чем экспериментальные ошибки.
Расчеты энтальпий образования ${{\Delta }_{{\text{f}}}}H_{{298}}^{0}$ возможных структур анионов пиридинкарбоновых кислот, катиона бензилтриметиламмония проведены методом РМ7 в рамках программы МОРАС 2016, полученной с web-узла: www.openmopac.net, на компьютере на базе процессора Intel(R) Core (ТМ) i5-2310 CPU @ 2.9 GHz 2.9 GHz.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
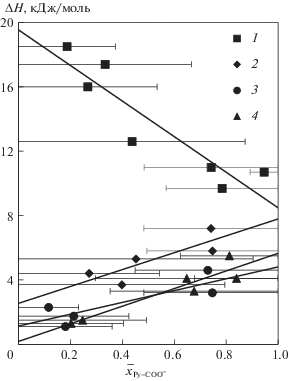
Дифференциальные энтальпии ∆H процессов обмена хлорида на анионы пиридинкарбоновых кислот в анионите АВ-17-8 приведены на рис. 3 в виде точек на серединах отрезков, отражающих изменение молярной доли анионов пиридинкарбоновых кислот в полимере при измерении теплового эффекта. Как видно (табл. 2, рис. 3), сорбция анионов пиридинкарбоновых кислот сопровождается поглощением тепла, десорбция пиридинкарбоксилатов – выделением тепла. Для каждого бинарного обмена $\overline {{\text{С }}{{{\text{l}}}^{ - }}} \to \overline {{\text{Py}}{\kern 1pt} - {\kern 1pt} {\text{С O}}{{{\text{O}}}^{ - }}} $ дифференциальные энтальпии прямого процесса (1), рассчитанные по экспериментальным данным, полученным как при сорбции, так и при десорбции пиридинкарбоксилата, укладываются на единую линейную зависимость ∆H(${{\bar {x}}_{{{\text{Py}} - {\text{CO}}{{{\text{O}}}^{ - }}}}}$) (рис. 3). Все зависимости ∆H(${{\bar {x}}_{{{\text{Py}} - {\text{CO}}{{{\text{O}}}^{ - }}}}}$) описываются уравнениями прямых с хорошими коэффициентами корреляции. Например, для обмена хлорид → анион цинхомероновой кислоты функция ∆H(${{\bar {x}}_{{{\text{Py}} - {\text{CO}}{{{\text{O}}}^{ - }}}}}$) описывается уравнением
с коэффициентом корреляции –0.91; для обмена хлорид → никотинат – уравнением ∆H = 5.48(${{\bar {x}}_{{{\text{Py}} - {\text{CO}}{{{\text{O}}}^{ - }}}}}$) + 0.18 c коэффициентом корреляции 0.93. Прямолинейность функций ∆H(${{\bar {x}}_{{{\text{Py}} - {\text{CO}}{{{\text{O}}}^{ - }}}}}$) отражает аддитивный вклад парциальных мольных энтальпий ионного обмена компонентов системы в общее изменение дифференциальной энтальпии анионного обмена (1).Рис. 3.
Дифференциальные энтальпии ионного обмена хлорид-анионов в анионите АВ-17-8 на анионы цинхомероновой кислоты (1); дипиколиновой кислоты (2); изоникотиновой кислоты (3); никотиновой кислоты (4) из водных растворов при 298 K.
В табл. 3 приведены стандартные энтальпии анионного обмена, рассчитанные по экспериментальным данным микрокалориметрии процесса (1), и стандартные энтальпии модельной реакции
(4)
$\begin{gathered} {{[{\text{C}}_{6}^{{}}{{{\text{H}}}_{5}}{\text{C}}{{{\text{H}}}_{2}}{\text{N}}{{({\text{CH}}_{3}^{{}})}_{3}}]}^{ + }}{\text{С }}{{{\text{l}}}^{ - }} + {\text{Py}}{\kern 1pt} - {\kern 1pt} {\text{С O}}{{{\text{O}}}^{ - }} = \\ = \;{{[{\text{C}}_{6}^{{}}{{{\text{H}}}_{5}}{\text{C}}{{{\text{H}}}_{2}}{\text{N}}{{({\text{CH}}_{3}^{{}})}_{3}}]}^{ + }}{\text{Py}}{\kern 1pt} - {\kern 1pt} {\text{С O}}{{{\text{O}}}^{ - }} + {\text{C}}{{{\text{l}}}^{ - }}, \\ \end{gathered} $Таблица 3.
Стандартные энтальпии анионного обмена хлорид-пиридинкарбоксилата на анионите АВ-17-8 (I – по данным микрокалориметрии процесса (1), II – квантово-химический расчет процесса (4)
| Анион | ${{\Delta }_{{\text{r}}}}H_{{298}}^{0},\;{\text{к Д ж /м о л ь }}$ | |
|---|---|---|
| I | II | |
| Никотинат | 2.9 ± 0.6 | –6.026 |
| Изоникотинат | 3.0 ± 0.8 | –4.469 |
| Анион дипиколиновой кислоты | 5.2 ± 0.9 | –4.311 |
| Анион цинхомероновой кислоты | 14.0 ± 1.6 | 42.055 |
Стандартная энтальпия анионного обмена (1) по данным микрокалориметрических измерений (табл. 3) увеличивается в последовательности: никотинат, изоникотинат, анион дипиколиновой кислоты, анион цинхомероновой кислоты. В этой же последовательности увеличивается ${{\Delta }_{{\text{r}}}}H_{{298}}^{0}$ модельной реакции (4). Вероятно, изменение энергии взаимодействия анионов с ионогенной группой анионита АВ-17-8 вносит определяющий вклад в энтальпию анионного обмена хлорид-пиридинкарбоксилата.
Интересно отметить, что измеренные теплоты анионного обмена хлорид-пиридинкарбоксилат для никотиновой, изоникотиновой, дипиколиновой кислот находятся в интервале 3–5 кДж/моль, что составляет примерно 25 Дж/г. Следовательно, анионный обмен с их участием, например в трансмембранных процессах в биологических системах, не должен оказывать существенную тепловую нагрузку на живой организм. Цинхомероновая кислота, имеющая значительную энтальпию при сорбции из водных растворов Cl-формой анионита, в химиотерапии не используется.
Работа выполнена в рамках государственного задания ИУХМ ФИЦ УУХ СО РАН (проект АААА-А17-117041910146-5).
Список литературы
Smith K.E., Callahan M.P., Gerakines P.A. et al. // Geochim. Cosmochim. Acta. 2014. V. 1. P. 136.
Shimizu S. Vitamins and Related Compounds: Microbial Production, in Biotechnology: 2nd completely rev. ed. / Ed. H.-J. Rehm, G. Reed, A. Puhler, P. J. W. Stadler. Weinheim: VCH, 2001. V. 10. P. 320–327.
Weissermel K., Arpe H.-J. Industrial Organic Chemistry, 4th ed. Weinheim: Wiley-VCH, 2003. 491 p.
Cantarella M., Cantarella L., Gallifuoco A. et al. // Enzyme Microb. Technol. 2008. V. 42. P. 222–229.
Goncalves Elsa M., Bernardes Carlos E.S., Diogo Hermı’nio P. et al. // J. Phys. Chem. B. 2010. V. 114. P. 5475.
Van Loenhout-Rooyackers J.H., Veen J. // Neth. J. Med. 1998. V. 53. P. 7.
Машковский М.Д. Лекарственные средства. 14-е изд., перераб., испр. и доп. М.: ООО “Издательство Новая волна”, 2002. Т. 1. 540 с.
Ramezanipoura F., Aghabozorga H., Shokrollahib A. et al. // J. Mol. Struct. 2005. V. 779. № 1–3. P. 77.
Chatterjee M., Maji M., Ghosh S., Mak T.C.W. // J. Chem. Soc., Dalton Trans. 1998. P. 3641.
Остапова Е.В., Шкуренко Г.Ю., Лырщиков С.Ю., Альтшулер Г.Н. // Бутлеровские сообщения. 2016. Т. 48. № 10. С. 37.
Альтшулер Г.Н., Шкуренко Г.Ю., Остапова Е.В., Альтшулер О.Г. // Изв. АН. Сер. хим. 2017. № 7. С. 1177.
Альтшулер Г Н., Остапова Е.В., Малышенко Н.В., Альтшулер О.Г. // Изв. АН. Сер. хим. 2017. № 10. С. 1854.
The IUPAC Stability Constants Database, http:// www.acadsoft.co.uk/scdbase/scdbase.htm.
Albert A., Sergeant E.P. The determination of ionization constants: a laboratory manual. London; New York: Chapman and Hall, 1984. 218 p.
The International Pharmacopoeia, Fifth Edition, http:// apps.who.int/phint/en/p/docf.
Black G., Depp E., Corson B.B. // J. Org. Chem. 1949. V. 14. P. 14.
Lindenstruth A.F., VanderWerf C.A. // J. Amer. Chem. Soc. 1949. V. 71. P. 3020.
Термодинамические свойства индивидуальных веществ / Под ред. В.П. Глушко. М.: Наука, 1982. Т. 4. Кн. 1. С. 442.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии