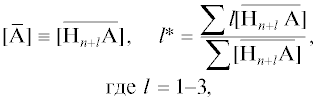Журнал физической химии, 2019, T. 93, № 4, стр. 594-600
Моделирование систем вытеснительной комплексообразовательной хроматографии
О. В. Харитонов a, Л. А. Фирсова a, *, Е. А. Козлитин a
a Российская академия наук, Институт физической химии и электрохимии им. А.Н. Фрумкина
Москва, Россия
* E-mail: Lubovfirsova@mail.ru
Поступила в редакцию 16.05.2018
Аннотация
Разработано математическое описание систем вытеснительной комплексообразовательной хроматографии (ВКХ), представляющее собой совокупность математических моделей стационарного состояния каждой из образующихся зон. Отмечено, что в основе теоретического анализа элюционных систем лежит принцип последовательного рассмотрения равновесий и расчет концентраций всех разновидностей ионов в обеих фазах. Проведены численные эксперименты по элюированию РЗЭ на сульфокатионитах элюентами на основе ДТПА. Показано, что увеличение рН элюента, концентрации элюента, а также введение в элюент буферных добавок обостряет фронты вытеснения. Сделан вывод, что в зоне сорбированного комплексона его концентрация многократно превышает концентрацию в исходном элюенте. Показано, что при увеличении концентрации вытеснителя, за счет увеличения количества вводимой щелочи и введения дополнительных комплексообразующих или буферных добавок, рН и концентрация вымываемого компонента возрастают. Установлено, что на кривой зависимости содержания РЗЭ в твердой фазе имеется максимум, соответствующий минимуму ВЭТТ.
Моделирование и анализ систем вытеснительной комплексообразовательной хроматографии (ВКХ) основываются на принципе последовательного рассмотрения равновесий и расчете концентраций всех разновидностей ионов в обеих фазах в каждой из образующихся зон: зоне вытеснителя, зоне сорбированного комплексона, зонах разделяемых элементов [1–4]. Вследствие ограниченных возможностей вычислительной техники 70–80 гг. прошлого века, ранние модели применялись либо в эмпирическом, либо в очень упрощенном виде и не учитывали всего разнообразия комплексных соединений в хроматографической системе. Однако расширение задач теоретического анализа элюционных систем, связанное с использованием для разделения элюентов, содержащих смесь комплексонов, буферные, солевые добавки, в широком интервале изменения рН, требует более универсальных математических выражений общего вида. При этом необходимо не только рассчитать параметры в каждой из зон, но и определить взаимное расположение зон. Таким образом, параметры, определяемые на каждом этапе теоретического анализа, являются исходными данными для каждого последующего. Рассмотрение ионообменных равновесий в каждой зоне дает информацию не только о распределении концентраций в твердой и жидкой фазах, но и характеризует точку соответствующей парциальной изотермы ионного обмена.
ЗОНА ВЫТЕСНИТЕЛЯ
Расчет состава элюента
На практике элюент готовится следующим образом. Комплексоны, буферные добавки лимонной кислоты (Cit), ацетата натрия (Ac) или уксусную кислоту, а также минеральную кислоту растворяют в воде с одновременной нейтрализацией гидроокисями натрия или аммония до определенного значения рН.
Исходными параметрами для расчета состава элюента являются: значение рН элюента, концентрация комплексообразующего вещества $[{{{\tilde {A}}}_{p}}]$, концентрация второго комплексообразующего вещества $[{{{\tilde {B}}}_{p}}]$ или буферной добавки $[{\tilde {A}}{{{\text{c}}}_{p}}]$ и добавки солей минеральных кислот $[{\tilde {S}}]$. Тогда при использовании щелочных металлов в качестве вытеснителей с учетом их комплексообразования можно записать общее уравнение материального баланса:
(1)
$\begin{gathered} {{n}_{{\text{A}}}}[{{{{\tilde {A}}}}_{p}}] + {{n}_{{\text{B}}}}[{{{{\tilde {B}}}}_{p}}] + [{\tilde {A}}{{{\text{c}}}_{p}}] + [{O\tilde {H}}] + {{n}_{{\text{S}}}}[{\tilde {S}}] = \\ = \;[{{{{\tilde {H}}}}_{p}}] + [{{{{\tilde {D}}}}_{p}}]. \\ \end{gathered} $Далее с использованием уравнений индивидуальных материальных балансов, уравнения электронейтральности, уравнений функциональных связей протонирования комплексонов, рассчитываются концентрации отдельных ионов и общие концентрации водорода $\left[ {{{{{\tilde {H}}}}_{p}}} \right]$ и вытеснителя – щелочного металла или аммония $\left[ {{{{{\tilde {D}}}}_{p}}} \right]$.
Так как элюент готовится при комнатной температуре, а разделение проводится при 70–80°С, то необходима температурная коррекция соответствующих изменений констант, а, следовательно, и изменение некоторых концентраций. В данной работе в качестве элюента рассматривается диэтилентриаминпентауксусная кислота (ДТПА).
В табл. 1 приведены константы протонирования ДТПА при 25°C и 70°C. На рис. 1 приведена зависимость рН и рА элюента на основе ДТПА от количества вводимой щелочи, отнесенной к концентрации комплексона.
Таблица 1.
Константы протонирования ДТПА (lg an) при 25 и 70°C
| n | 25°C | 70°С |
|---|---|---|
| 1 | 10.45 | 9.68 |
| 2 | 8.53 | 8.12 |
| 3 | 4.28 | 4.14 |
| 4 | 2.60 | 2.52 |
| 5 | 2.00 | 2.05 |
| 6 | 1.60 | 1.60 |
| 7 | 0.70 | 0.70 |
| 8 | –0.10 | –0.10 |
Рис. 1.
Изменение концентраций рА (1, 2) и рН (3, 4) в зависимости от концентрации вытеснителя (Na), вводимого в виде щелочи, для 25°C (2, 4) и 70°С (1, 3) для элюента 0.05089 моль/л ДТПА; [А] – концентрация свободного иона комплексона.
Из приведенных данных следует, что при нагревании элюента в связи с уменьшением констант протонирования наблюдается увеличение концентрации свободного лиганда и снижение рН. Однако ввиду того, что наибольшим температурным изменениям подвержены константы протонирования ионов Аn– и НА(n–1)–, доля которых возрастает с ростом рН, указанные изменения рН проявляются для элюентов на основе ДТПА, имеющих рН > 6 при 25°C. Для рА наоборот – изменения проявляются при исходном рН < 6.
Состав твердой фазы
Обычно в ВКХ для разделения РЗЭ и ТПЭ используются сульфокатиониты типа КУ-2, Dowex-50, Chromalite и др. Состав твердой фазы рассчитывается с помощью уравнения материального баланса по сорбенту:
и констант ионного обмена:(4)
${{K}_{{{\text{A}} - {\text{H}}}}} = {{\frac{{[\overline {{{{\text{H}}}_{{n + l}}}{\text{A}}} ]}}{{[{{{\text{H}}}_{{n + l}}}{\text{A}}]}}} \mathord{\left/ {\vphantom {{\frac{{[\overline {{{{\text{H}}}_{{n + l}}}{\text{A}}} ]}}{{[{{{\text{H}}}_{{n + l}}}{\text{A}}]}}} {{{{\left( {\frac{{\overline {[{\text{H}}]} }}{{[{\text{H}}]}}} \right)}}^{l}}}}} \right. \kern-0em} {{{{\left( {\frac{{\overline {[{\text{H}}]} }}{{[{\text{H}}]}}} \right)}}^{l}}}},\quad {{K}_{{{\text{D}} - {\text{H}}}}} = {{\frac{{[{\bar {D}}]}}{{[{\text{D}}]}}} \mathord{\left/ {\vphantom {{\frac{{[{\bar {D}}]}}{{[{\text{D}}]}}} {\frac{{[{\bar {H}}]}}{{[{\text{H}}]}}}}} \right. \kern-0em} {\frac{{[{\bar {H}}]}}{{[{\text{H}}]}}}},$(5)
$[{{{\text{H}}}_{{n + l}}}{\text{A}}] = {{H}^{{n + 1}}}A\prod\limits_{i = 1}^{n + 1} {{{k}_{i}}} ,$В табл. 2 приведен расчет состава твердой фазы в зоне вытеснителя в зависимости от рН элюента.
Таблица 2.
Состав твердой фазы в зоне вытеснителя в зависимости от рН элюента
| рН элюента | ${{\bar {x}}_{{\text{D}}}}$ | ${{\bar {x}}_{{{{{\text{H}}}_{{\text{8}}}}{\text{A}}}}}$ | ${{\bar {x}}_{{{{{\text{H}}}_{{\text{7}}}}{\text{A}}}}}$ | ${{\bar {x}}_{{{{{\text{H}}}_{{\text{6}}}}{\text{A}}}}}$ | ${{\bar {x}}_{{\text{H}}}}$ |
|---|---|---|---|---|---|
| 1.92 | 1.63 × 10–2 | 2.39 × 10–1 | 5.22 × 10–1 | 8.88 × 10–2 | 1.34 × 10–1 |
| 1.95 | 7.60 × 10–2 | 2.18 × 10–1 | 4.89 × 10–1 | 8.51 × 10–2 | 1.31 × 10–1 |
| 2.00 | 1.84 × 10–1 | 1.83 × 10–1 | 4.30 × 10–1 | 7.82 × 10–2 | 1.25 × 10–1 |
| 2.50 | 9.33 × 10–1 | 2.20 × 10–3 | 1.67 × 10–2 | 9.92 × 10–3 | 3.85 × 10–2 |
| 3.00 | 9.90 × 10–1 | 6.82 × 10–6 | 2.11 × 10–4 | 5.08 × 10–4 | 9.48 × 10–3 |
| 3.50 | 9.97 × 10–1 | 2.41 × 10–8 | 2.54 × 10–6 | 2.07 × 10–5 | 2.79 × 10–3 |
| 4.00 | 9.992 × 10–1 | 5.94 × 10–11 | 2.11 × 10–8 | 5.82 × 10–7 | 8.26 × 10–4 |
| 4.50 | 9.998 × 10–1 | 8.36 × 10–14 | 1.05 × 10–10 | 1.01 × 10–8 | 2.35 × 10–4 |
| 5.00 | 9.999 × 10–1 | 9.14 × 10–17 | 3.90 × 10–13 | 1.29 × 10–10 | 6.89 × 10–5 |
Обозначения: ${{\bar {x}}_{{\text{D}}}}$, ${{\bar {x}}_{{{{{\text{H}}}_{{\text{8}}}}{\text{A}}}}}$, ${{\bar {x}}_{{{{{\text{H}}}_{{\text{7}}}}{\text{A}}}}}$, ${{\bar {x}}_{{{{{\text{H}}}_{{\text{6}}}}{\text{A}}}}}$, ${{\bar {x}}_{{\text{H}}}}$ – доли от емкости катионов вытеснителя, катионов комплексона, водорода соответственно.
Из данных, приведенных в табл. 2, видно, что в твердой фазе содержание ионов щелочного металла или аммония возрастает с ростом концентрации этих ионов в жидкой фазе и одновременным уменьшением концентрации ионов Н+ и Нn + lАl+. Для элюентов с рН > 4 в твердой фазе полосы вытеснителя присутствуют практически только ионы щелочного металла или аммония.
Выбор условий вытеснения
Критерием реализации вытеснительного режима элюирования РЗЭ и ТПЭ является условие: ${{\alpha }_{{{\text{M}} - {\text{D}}}}}\left( 0 \right) \leqslant 1$ , где
(6)
${{\alpha }_{{{\text{M}} - {\text{D}}}}}\left( 0 \right) = \frac{{{{P}_{{\text{D}}}}}}{{{{P}_{{\text{M}}}}}}{{K}_{{{\text{M}} - {\text{D}}}}}{{\left( {\frac{{[{\bar {D}}]}}{{[{{{{\tilde {D}}}}_{p}}]}}} \right)}^{{{{n}_{M}} - 1}}},$(7)
${{P}_{{\text{D}}}} = \frac{{[{{{{\tilde {D}}}}_{p}}]}}{{[{\text{D}}]}},\quad {{P}_{{\text{M}}}} = \frac{{[{{{\text{M}}}_{p}}]}}{{[{\text{M}}]}},$Увеличение концентрации свободного лиганда при увеличении рН элюента, увеличение концентрации элюента, а также увеличение концентрации вытеснителя приводят к уменьшению αМ–D(0) и, следовательно, к более острому фронту вытеснения. Вследствие того, что натрий обладает наименьшим сродством к катиониту и наибольшей константой обмена с РЗЭ и ТПЭ по сравнению с другими щелочными металлами и аммонием, а лантан обладает наименьшими комплексообразующими свойствами среди РЗЭ и ТПЭ, при выполнении условия αLn–Na(0) < 1 будет осуществляться вытеснительный режим как для всех РЗЭ и ТПЭ, так и для всех вытеснителей.
Однако при высоком значении рН элюента образуются гидроксокатионы типа ${\text{M}}{{\left( {{\text{OH}}} \right)}^{{\left( {{{n}_{{\text{M}}}} - 1} \right) + }}}$, ${\text{M}}\left( {{\text{OH}}} \right)_{2}^{{({{n}_{{\text{M}}}} - 2) + }}$, имеющие отличные от обычных катионов константы обмена и устойчивости, что может оказывать влияние на условия вытеснения.
Характер изменения предельных значений коэффициентов разделения с учетом и без учета образования гидролизованных ионов приведен на примере лантана на рис. 2.
Рис. 2.
Изменения lg αM–D(0) для лантана при температуре 70°С в зависимости от рН элюента для 0.02545 (1, 1') и 0.05089 моль/л ДТПА (2, 2') с учетом (1, 2) и без учета (1', 2') образования гидролизованных ионов.
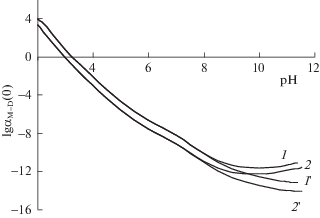
Из приведенных данных следует, что при образовании гидролизованных ионов значение αМ–D(0) увеличивается на три порядка. Однако и в этом случае сохраняется вытеснительный режим, т.е. выполняется условие αLn–Na(0) < 1.
ЗОНА СОРБИРОВАННОГО КОМПЛЕКСОНА
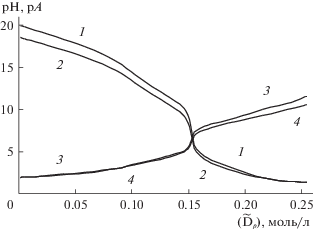
Многие комплексоны, склонные к образованию бетаиновых структур, могут сорбироваться на катионообменных смолах. Для ДТПА, имеющей три аминогруппы, возможно образование катионов с зарядом от +1 до +3 [2, 5, 6]. Закономерности сорбции комплексонов описываются законами фронтальной хроматографии [2, 7]. Скорость движения переднего фронта полосы комплексона выше скорости движения заднего фронта на величину $l{\text{*}}[{{{\tilde {A}}}_{p}}]$. Поэтому длина полосы сорбированного комплексона увеличивается по мере протекания элюирования. Концентрация комплексона в зоне многократно превышает концентрацию в исходном элюенте (рис. 3).
Рис. 3.
Расчетное (линии) и экспериментальное (точки) изменение Ар (1) и рН (2) в зависимости от концентрации вытеснителя (Na) при введении буферной добавки (Cit) от 0.01 до 0.025 моль/л; 3 – концентрация комплексона в исходном элюенте.
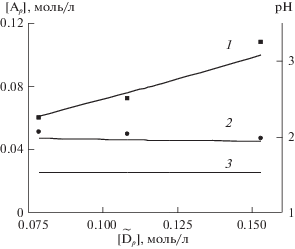
На рис. 3 приведены расчетное и экспериментальное изменение Ар и рН в зависимости от концентрации вытеснителя (натрий) при введении буферной добавки лимонной кислоты (Cit).
Как следует из приведенных данных, концентрация Н+-ионов и концентрация комплексона увеличивается пропорционально концентрации вытеснителя. При введении в состав элюента 0.025 моль/л лимонной кислоты концентрация комплексона превышает концентрацию комплексона в элюенте в 4 раза.
Положение зоны вытесняемого компонента относительно зоны сорбированного комплексона определяется предельным значением коэффициента разделения αМ–А(0) при Мр→ 0. При αМ–А(0) < < 1 зона сорбированного комплексона может являться дополнительной зоной вытеснения, а при αМ–А(0) > 1 – дополнительной удерживающей зоной [7].
ЗОНА РАЗДЕЛЯЕМЫХ КОМПОНЕНТОВ
Модели, описывающие зону разделяемых компонентов [8], включают в себя рекуррентные соотношения, характеризующие режим параллельного переноса:
(8)
$\begin{gathered} \frac{{[{\bar {M}}]}}{{[{{{\text{M}}}_{p}}]}} = \frac{{[{\bar {D}}] - [{{{{\bar {D}}}}_{0}}]}}{{[{{{\text{D}}}_{P}}] - [{{{{\tilde {D}}}}_{P}}]}} = \\ = \;\frac{{[{\bar {H}}] - [{{{{\bar {H}}}}_{0}}]}}{{[{{{\text{H}}}_{P}}] - [{{{{\tilde {H}}}}_{P}}]}} = \frac{{[{\bar {A}}] - [{{{{\bar {A}}}}_{0}}]}}{{[{{{\text{A}}}_{P}}] - [{{{{\tilde {A}}}}_{P}}]}} = \frac{{[{{{{\bar {D}}}}_{{\text{0}}}}]}}{{[{{{{\tilde {D}}}}_{p}}]}}, \\ \end{gathered} $При использовании уравнений электронейтральности, материального баланса в обеих фазах, а также уравнений функциональных связей комплексообразования и ионного обмена, получается система уравнений, при решении которой рассчитываются концентрации всех разновидностей ионов, как в водной фазе, так и в фазе ионита.
С помощью несложных алгебраических преобразований получается уравнение, связывающее комплексообразование и ионный обмен, являющееся основным уравнением ВКХ:
(9)
$P = 1 + \sum {[{{{\text{M}}}_{i}}{{{\text{A}}}_{j}}{{{\text{H}}}_{k}}]} = K_{{{\text{M}} - {\text{D}}}}^{*}{{\left( {\frac{1}{{[{{{{\tilde {D}}}}_{P}}]}}} \right)}^{{{{n}_{M}} - 1}}},$Анализ уравнения позволяет сделать следующие выводы:
1. Закомплексованность металла и концентрация свободного лиганда в ВКХ обратно пропорциональны концентрации вытеснителя. Наличие протонированных или биядерных комплексов ослабляет или усиливает эту зависимость. При наличии только моно- или высших комплексов концентрация свободного лиганда определяется концентрацией вытеснителя независимо от способа его введения: в виде соли минеральной кислоты, щелочи или с буферными добавками.
2. Закомплексованность металла и концентрация свободного лиганда прямо пропорциональны константе ионного обмена выделяемого элемента с вытеснителем. Согласно литературным данным, константы ионного обмена зависят от параметров катионита – емкости, набухания, степени сшивки [9]. Следовательно, при изменении характеристик сорбента соответственно изменяются закомплексованность и концентрация свободного лиганда.
3. Концентрация лиганда обратно пропорциональна константам комплексообразования, т.е. ионы с меньшими константами комплексообразования обладают большим сродством к сорбенту.
Влияние констант ионного обмена
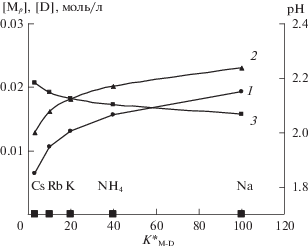
При постоянном составе элюента состав элюатов может меняться в зависимости от используемого вытеснителя за счет изменения соответствующих констант ионного обмена. При возрастании КМ-D в ряду Cs–Rb–K–NH4–Na возрастает рН, а концентрация РЗЭ, наоборот, падает (рис. 4).
Влияние констант комплексообразования
В табл. 3 приведены расчеты состава элюатов и твердой фазы для РЗЭ и ТПЭ при использовании в качестве элюента натриевых солей 0.05089 моль/л ДТПА, рН 7.5.
Таблица 3.
Расчет состава элюатов и твердой фазы для РЗЭ и ТПЭ для 0.05089 моль/л ДТПА, рН 7.5, 70°C
| Элементы | lg KM–A | $K_{{{\text{М }} - {\text{D}}}}^{*}$ | Состав элюатов, моль/л | Состав твердой фазы, % | ||||||
|---|---|---|---|---|---|---|---|---|---|---|
| pH | [Mp] × 102 | [D] × 102 | [Ap] × 102 | ${{\bar {x}}_{{\text{H}}}}$ | ${{\bar {x}}_{{\text{M}}}}$ | ${{\bar {x}}_{{\text{D}}}}$ | ${{\bar {x}}_{{\text{A}}}}$ | |||
| Ho | 22.06 | 100.0 | 1.91 | 3.347 | 3.707 | 5.743 | 5.6 | 64 | 23.6 | 6.8 |
| Cm | 22.13 | 150.1 | 1.98 | 3.315 | 4.522 | 5.577 | 4.8 | 61.4 | 28.8 | 4.9 |
| Am | 22.01 | 158.1 | 2.01 | 3.319 | 4.716 | 5.490 | 4.4 | 61.5 | 30.0 | 4.0 |
| Eu | 21.63 | 139.3 | 2.08 | 3.223 | 5.035 | 5.358 | 3.8 | 61.6 | 32.1 | 2.6 |
| Nd | 20.91 | 165.4 | 2.26 | 3.150 | 5.715 | 5.194 | 2.5 | 60.2 | 36.4 | 0.9 |
| Pr | 20.46 | 173.3 | 2.40 | 2.966 | 6.442 | 5.144 | 1.8 | 56.7 | 41.0 | 0.5 |
| Ce | 19.84 | 186.2 | 2.57 | 2.776 | 7.151 | 5.11 | 1.2 | 53.0 | 45.6 | 0.2 |
| La | 19.00 | 204.3 | 2.82 | 2.500 | 8.067 | 5.094 | 0.07 | 47.9 | 51.4 | 0.04 |
В ряду РЗЭ при переходе от легких к тяжелым константы обмена увеличиваются, а константы комплексообразования уменьшаются. Поэтому в обеих фазах в этом же ряду уменьшается концентрация металла, увеличивается рН и концентрация вытеснителя. За счет более низкого значения рН в элюатах гольмия и ТПЭ, в твердой фазе наблюдается высокое содержание водорода и сорбированного комплексона от 8 до 13%. А в твердой фазе легких РЗЭ (Nd–La) присутствуют практически только катионы металла и вытеснителя.
Влияние состава элюента
На рис. 5 и 6 приведены изменения состава элюатов и заполнения сорбента в зависимости от концентрации вытеснителя при различных способах его введения. При увеличении концентрации вытеснителя, за счет увеличения количества вводимой щелочи (кривые 1, рис. 5), введения дополнительных комплексообразующих (кривая 2) или буферных (кривая 3) добавок, происходит возрастание рН и концентрации вымываемого компонента. Характер изменений параметров при увеличении концентрации цитрата (кривая 3) в элюенте аналогичен изменению параметров при увеличении рН элюента (кривая 1) и введению буферной добавки ацетата (кривая 2) до концентрации вытеснителя в элюенте 0.1 моль/л. Происходит увеличение концентраций РЗЭ и рН в элюатах (рис. 5), заполнение сорбента ионами РЗЭ возрастает (рис. 6).
Рис. 5.
Численный эксперимент. Изменение концентрации гольмия (1–4) и рН (1'–4') в зависимости от концентрации вытеснителя (Na) в элюате: 1, 1'– повышенный рН, 2, 2' – добавки Ac, 3, 3' – добавки Cit, добавки нитрата – 4, 4'.
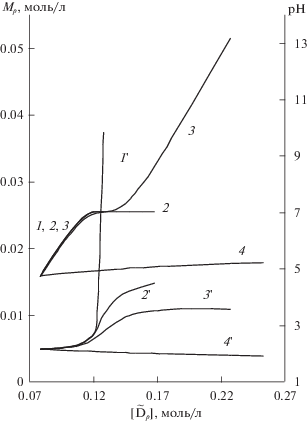
Рис. 6.
Численный эксперимент. Изменение заполнения сорбента по РЗЭ в зависимости от концентрации вытеснителя (Na) в элюате: 1 – повышенный рН, 2 – добавки Ac, 3 – добавки Cit, добавки нитрата – 4.
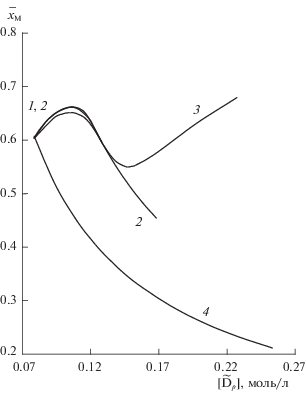
На кривой заполнения (рис. 6) имеется максимум при концентрации вытеснителя 0.11 моль/л, соответствующий 90%-ной полноте комплексообразования ([Мр]/[Ар]). При дальнейшем увеличении концентрации вытеснителя для элюентов, содержащих ацетаты, а также для элюентов с повышенным значением рН, концентрация РЗЭ достигает предельного значения и становится равной концентрации комплексона. Но при этом начинает снижаться содержание РЗЭ в твердой фазе. При содержании в элюенте 0.025 моль/л лимонной кислоты (0.15 моль/л вытеснителя) последняя начинает участвовать в комплексообразовании. Концентрация РЗЭ в элюатах вновь повышается, также возрастает содержание РЗЭ в сорбенте. Рост рН элюата для элюентов, содержащих лимонную кислоту, происходит более плавно, чем для элюентов с повышенным значением рН и содержащих ацетаты.
Как показано в работах [10, 11], максимум заполнения соответствует минимуму высоты, эквивалентной теоретической тарелке (ВЭТТ). Проникающие в зону РЗЭ ионы вытеснителя, водорода и комплексона, являясь конкурирующими ионами, замедляют процессы ионного обмена РЗЭ тем в большей степени, чем больше этих ионов проникает в зону разделяемых элементов. Введение в элюент буферных добавок увеличивает заполнение сорбента ионами РЗЭ и снижает количество конкурирующих ионов в сорбенте, тем самым улучшая кинетику ионного обмена. Кроме того, введение буферных добавок в элюент улучшает кинетику комплексообразования за счет повышения лабильности комплексов ДТПА–РЗЭ вследствие образования короткоживущих смешанных комплексов, включающих ионы ДТПА и цитрата или ацетата [12, 13].
Предлагаемое описание позволяет на основе анализа рассчитываемого состава твердой и жидкой фаз оценить условия вытеснения и удерживания компонентов, оптимальные составы элюентов для разделения смесей. Реализация математического описания позволяет выявлять основные физико-химические закономерности в системах ВКХ, оптимизировать процессы хроматографического разделения многокомпонентных смесей, проводить численные эксперименты для конкретных условий разделения.
Список литературы
James D.B., Powell J.E., Spedding F.N. // J. Inorg. Nucl. Chem. 1961. V. 19. № 1–2. P.1583.
Hagivara Z., Oki H. // J. Inorg. Nucl. Chem. 1970. V. 32. № 1. P. 291.
Назаров П.П., Шептунов В.Н., Маслова Г.Б., Чмутов К.В. // Журн. физ. химии. 1972. Т. 46. № 5. С. 1161.
Шептунов В.Н., Маслова Г.Б., Назаров П.П., Чмутов К.В. // Там же. 1975. Т. 49. № 11. С. 2965.
Маторина Н.Н., Шепетюк Л.В., Чмутов К.В. // Там же. 1967. Т. 41. № 1. С. 112.
Kogan L., Ratner R. // J. Chromatography. 1971. V. 62. № 3. P. 449.
Харитонов О.В., Фирсова Л.А. // Журн. физ. химии. 2009. Т. 83. № 8. С. 1548.
Харитонов О.В., Фирсова Л.А., Козлитин Е.А. и др. // Сорбционные и хроматографические процессы. 2016. Т. 16. № 3. С. 291.
Гельферих Ф. Иониты. Основы ионного обмена: монография / Пер. с нем. М.: Изд-во иностр. литературы. 1962. 490 с.
Гелис В.М., Маслова Г.Б. // Радиохимия. 1999. Т. 41. № 5. С. 436.
Радевич В.С., Чувелева Э.А., Харитонов О.В и др. // Журн. физ. химии. 1976. Т. 50. № 7. С. 1870.
Мартыненко Л.И., Спицын В.И., Артюхина Г.А. // Журн. неорган. химии. 1970. Т. 15. № 4. С. 931.
Balcombe C.I., Wiseall B. // J. Inorg. Nucl. Chem. 1974. V. 36. № 4. P. 881.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии