Журнал физической химии, 2019, T. 93, № 4, стр. 607-610
Определение потенциала хлорсеребряного электрода при различных температурах
А. В. Леванов a, *, О. Я. Исайкина a, В. В. Лунин a
a Московский государственный университет имени М.В. Ломоносова, Химический факультет
Москва, Россия
* E-mail: levanov@kge.msu.ru
Поступила в редакцию 01.09.2018
Аннотация
Предложен простой и надежный метод определения потенциала лабораторного хлорсеребряного электрода (ХСЭ), основанный на измерении ЭДС гальванического элемента, составленного из хлорсеребряного и медносульфатного (медь в насыщенном водном растворе сульфата меди) электродов. С помощью найденных значений потенциала ХСЭ определены стандартные термодинамические характеристики реакции восстановления иона гексацианоферрата (III) до гексацианоферрата (II) в водном растворе.
Потенциометрические методы находят чрезвычайно широкое применение в самых различных отраслях промышленности и в научных исследованиях. При потенциометрических измерениях очень важно иметь надежный и удобный в работе электрод сравнения. Для водных растворов в таком качестве наиболее широко используется хлорсеребряный электрод (ХСЭ). Он представляет собой серебряную проволочку, покрытую хлоридом серебра и погруженную в раствор, содержащий хлорид-ионы (обычно концентрированный или насыщенный раствор KCl). Значения его потенциала можно найти в литературе, и они хорошо воспроизводятся в том случае, если строго придерживаться аналогичных условий эксперимента. Однако при реальных измерениях потенциал ХСЭ может отклоняться от литературных значений из-за влияния таких факторов, как различие способов изготовления, наличие примесей бромид-ионов в хлориде калия, вытекание раствора KCl из околоэлектродного пространства, возможность частичного растворения AgCl в концентрированных растворах хлоридов и других. При измерениях с варьированием температуры значения потенциала сильно зависят от режима нагрева (от глубины погружения электрода в исследуемый раствор и скорости нагрева электрохимической ячейки). Кроме того, при использовании ХСЭ с насыщенным раствором хлорида калия равновесная концентрация соли при повышении температуры не успевает установиться, если время термостатирования небольшое. Часто в ходе рутинных измерений исследователь не располагает временем, достаточным для полного установления термического равновесия в электрохимической ячейке. Таким образом, разработка простого и надежного способа определения потенциала ХСЭ, который используется в повседневной работе, является актуальной задачей. В настоящей статье описывается метод определения потенциала лабораторного ХСЭ путем измерения ЭДС гальванического элемента, составленного из хлорсеребряного и медносульфатного электродов.
В литературе имеются два источника информации о значениях потенциала ХСЭ при различных температурах. Во-первых, эти значения приводятся в работах [1, 2], основанных на экспериментальных данных [3, 4]. В интервале 0–95°С и при различных концентрациях KCl (с, моль/л), потенциал ХСЭ (мВ) может быть представлен выражением
| с | А | В | С |
|---|---|---|---|
| 1 | 236.1 | 0.5777 | 1.4338 |
| 3 | 207.3 | 0.7070 | 1.8458 |
| 3.5 | 203.3 | 0.8057 | 1.0335 |
| снасыщ | 196.6 | 1.0064 | 1.0686 |
Здесь и далее величины потенциалов выражены относительно стандартного водородного электрода. Во-вторых, значения потенциала ХСЭ можно рассчитать по формуле
| с | Т, °С | а | b |
|---|---|---|---|
| 0.1 | 12–38 | 289.9 | 0.3758 |
| 3.0 | 10–40 | 209.9 | 0.7155 |
| 3.5 | 10–40 | 204.2 | 0.7202 |
| 4.0 | 25–40 | 200.2 | 0.7705 |
| снасыщ | 10–50 | 198.6 | 1.0007 |
Следует отметить, что концентрации KCl, выраженные в единицах молярности, относятся к температуре 25°С. Концентрации насыщенного раствора KCl при различных температурах даны в работе [9]; при повышении температуры эта концентрация увеличивается. Различие между результатами [1, 2] и [5–8] достигает 2.5 мВ.
В настоящей работе для определения потенциала ХСЭ, в качестве электрода сравнения использован медносульфатный электрод. Он представляет собой медную проволоку, погруженную в насыщенный водный раствор сульфата меди, подкисленный H2SO4 для предотвращения гидролиза иона Cu2+. Важнейшие преимущества медносульфатного электрода – простота изготовления, доступность исходных материалов, достаточная скорость установления равновесия на границе металл–раствор и воспроизводимость значений потенциала. Потенциал подобного электрода при различных температурах надежно установлен [10] и определяется выражением:
(1)
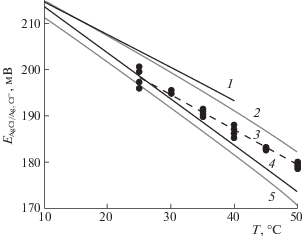
${\text{Cu}}\,\left| {\,{\text{CuS}}{{{\text{O}}}_{{\text{4}}}}{\kern 1pt} \left( {{\text{н а с ы щ }}{\text{.}}} \right)\,} \right|\left| {\,{\text{KCl}}\left( {{\text{aq}}} \right)\,} \right|\,{\text{AgCl}}\left( {{\text{т в }}{\text{.}}} \right)\,|\,{\text{Ag}}.$Результаты измерений потенциала ХСЭ, заполненного насыщенным раствором хлорида калия, представлены на рис. 1 вместе с литературными данными для электродов, содержащих 3.5 М и насыщенный растворы KCl. При температуре 25°С наши и литературные значения потенциала совпадают. С ростом температуры измеренные значения потенциала начинают превышать литературные данные для ХСЭ с насыщенным раствором KCl, и приближаются к величинам потенциала электрода с 3.5 М раствором KCl. Как уже упоминалось выше, это обусловлено иным режимом нагрева. В наших экспериментах электрохимическую ячейку нагревали от 25°С с шагом 5 К. При определенной температуре ячейку выдерживали в течение 5 мин, а затем измеряли ЭДС. Важным фактором является то, что при повышении температуры равновесие растворения KCl не успевает установиться, и концентрация раствора все более отклоняется от точки насыщения. При том режиме нагрева, который реализовывался в наших экспериментах, температурная зависимость потенциала ХСЭ с насыщенным раствором KCl представляется формулой
(2)
$\begin{gathered} {{E}_{{{\text{AgCl}}/{\text{Ag}},{\text{Cl}} - }}},\;{\text{м В }} = \left( {{\text{198}}.{\text{4}} \pm 0.{\text{6}}} \right) - \hfill \\ - \;\left( {0.{\text{76}} \pm 0.0{\text{4}}} \right)(T - 25^\circ {\text{C}}). \hfill \\ \end{gathered} $С целью проверки правильности предложенного метода определения потенциала ХСЭ с использованием формулы (2) определили стандартные термодинамические характеристики реакции восстановления гексацианоферрата (III) калия
(3)
$\begin{gathered} {\text{Fe}}({\text{CN}})_{6}^{{3 - }}({\text{aq}}) + 1{\text{/}}2{{{\text{H}}}_{{\text{2}}}}({\text{г }}.) \to \\ \to {\text{Fe}}({\text{CN}})_{6}^{{4 - }}({\text{aq}}) + {{{\text{H}}}^{ + }}({\text{aq}}). \\ \end{gathered} $(4)
$\begin{gathered} {\text{Ag}}\,\left| {\,{\text{AgCl}}({\text{т в }}.)\,} \right|\,{\text{KCl}}({\text{aq}})\,{\text{||}}\,{\text{Fe}}({\text{CN}})_{6}^{{3 - }}({\text{aq}}), \\ {\text{Fe}}({\text{CN}})_{6}^{{4 - }}({\text{aq}})\,|\,{\text{Pt}} \\ \end{gathered} $Потенциал ферри-ферроцианидного электрода определяли по формуле
(5)
${{E}_{{{\text{Fe(CN)}}_{6}^{{3 - }}/{\text{Fe(CN)}}_{6}^{{4 - }}}}} = {{E}_{{\text{4}}}} + {{E}_{{{\text{AgCl}}/{\text{Ag}},{\text{Cl}} - }}},$(6)
$\begin{gathered} E_{{{\text{Fe(CN)}}_{6}^{{3 - }}/{\text{Fe(CN)}}_{6}^{{4 - }}}}^{^\circ } = {{E}_{{{\text{Fe(CN)}}_{6}^{{3 - }}/{\text{Fe(CN)}}_{6}^{{4 - }}}}} - \\ - \;\frac{{RT}}{F}{{A}_{{{\text{DH}}}}} \times 7\ln 10\frac{{\sqrt I }}{{1 + 1.5\sqrt I }}, \\ \end{gathered} $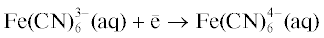 , с учетом равенства концентраций гексацианоферратов (II) и (III) и при использовании
формулы второго приближения теории Дебая–Хюккеля: $\lg {{\gamma }_{i}} = - z_{i}^{2}{{A}_{{{\text{DH}}}}}{{\sqrt I } \mathord{\left/ {\vphantom {{\sqrt I } {(1 + 1.5\sqrt I )}}} \right. \kern-0em} {(1 + 1.5\sqrt I )}}$ для расчета коэффициентов активности ионов.
, с учетом равенства концентраций гексацианоферратов (II) и (III) и при использовании
формулы второго приближения теории Дебая–Хюккеля: $\lg {{\gamma }_{i}} = - z_{i}^{2}{{A}_{{{\text{DH}}}}}{{\sqrt I } \mathord{\left/ {\vphantom {{\sqrt I } {(1 + 1.5\sqrt I )}}} \right. \kern-0em} {(1 + 1.5\sqrt I )}}$ для расчета коэффициентов активности ионов.
В настоящей работе получены следующие значения стандартного потенциала ферри-ферроцианидного электрода при 25°С и выражения его температурной зависимости в интервале 20–50°С при концентрации гексацианоферратов (II) и (III) 0.0025 М:
(7)
$\begin{gathered} E_{{{\text{Fe(CN)}}_{6}^{{3 - }}/{\text{Fe(CN)}}_{6}^{{4 - }},298}}^{^\circ } = 359 \pm 1{\text{ м В }}, \\ E_{{{\text{Fe(CN)}}_{6}^{{3 - }}/{\text{Fe(CN)}}_{6}^{{4 - }}}}^{^\circ },\;{\text{м В }} = ({\text{11}}0{\text{5}} \pm {\text{23}}) - \\ - \;({\text{2}}.{\text{5}}0{\text{4}} \pm 0.0{\text{74}})T({\text{K}}), \\ \end{gathered} $при концентрации 0.005 М:
(8)
$\begin{gathered} E_{{{\text{Fe(CN)}}_{6}^{{3 - }}/{\text{Fe(CN)}}_{6}^{{4 - }},298}}^{^\circ } = {\text{362}} \pm {\text{1}}\;{\text{м В }}, \\ E_{{{\text{Fe(CN)}}_{6}^{{3 - }}/{\text{Fe(CN)}}_{6}^{{4 - }}}}^{^\circ },\;{\text{м В }} = ({\text{1134}} \pm {\text{25}}) - \\ - \;({\text{2}}.{\text{589}} \pm 0.0{\text{79}})T({\text{K}}). \\ \end{gathered} $Интервалы неопределенности обусловлены погрешностями значений ЭДС гальванического элемента (4) E4 и потенциала ХСЭ EAgCl/Ag,Cl–, рассчитанного с помощью выражения (2).
Стандартные энтальпия и энтропия реакции (3) вычисляли из коэффициентов выражений (7)–(8), энергия Гиббса – из значений $E_{{{\text{Fe(CN)}}_{6}^{{3 - }}/{\text{Fe(CN)}}_{6}^{{4 - }},298}}^{^\circ }$ с помощью известных термодинамических соотношений (см., например, [11]). Полученные результаты представлены в табл. 1. Они очень хорошо согласуются с соответствующими литературными данными. Это подтверждает правильность и надежность предложенного метода определения потенциала ХСЭ, поскольку в настоящей работе ключевым фактором при вычислении стандартных термодинамических характеристик реакции (3), было наличие корректных значений потенциала ХСЭ при различных температурах.
Таблица 1.
Стандартные термодинамические характеристики реакции (3)
| –ΔH°, кДж/моль | $--\Delta G_{{298}}^{^\circ }$, кДж/моль | –ΔS°, Дж моль–1 К–1 | $E_{{{\text{Fe(CN)}}_{6}^{{3 - }}/{\text{Fe(CN)}}_{6}^{{4 - }},298}}^{^\circ }$, В | Ссылка |
|---|---|---|---|---|
| 107 ± 2 | 34.6 ± 0.1 | 242 ± 7 | 0.358 ± 0.001 | *с = 0.0025M |
| 109 ± 2 | 34.9 ± 0.1 | 250 ± 8 | 0.362 ± 0.001 | *с = 0.005M |
| 106.3 | 34.3 | 240.6 | 0.358 | [12] |
| 106.3 | 35.7 | 236.8 | 0.370 | [13] |
| 115.4 | 34.6 | 271.1 | 0.358 | [14] |
| 111.7 | 34.2 | 259.8 | 0.355 | [15] |
| 115.5 | 34.9 | 270.3 | 0.364 | [16] |
Список литературы
Galster H. pH-Messung: Grundlagen, Methoden, Anwendungen, Geraete. Weinheim: Wiley-VCH, 1990.
Galster H. / pH Measurement and Control // in Ullmann’s Encyclopedia of Industrial Chemistry, V. 26. Weinheim: Wiley-VCH, 2001. P. 377–406.
Baucke F.G.K. // Chemie Ingenieur Technik. 1975. V. 47. № 13. P. 565–566.
Galster H. // Chem. Lab. Betr. (Chemie für Labor und Betrieb). 1979. V. 30. № 8. P. 330.
Бейтс Р. Определение pH. Теория и практика (пер. с англ.). Л.: Химия, 1972. С. 246.
Alner D.J., Greczek J.J., Smeeth A.G. // J. Chem. Soc. A. 1967. P. 1205.
Bates R.G., Bower V.E. // J. Res. Natl. Bur. Stand. 1954. V. 53. № 5. P. 283.
Grzybowski A.K. // J. Phys. Chem. 1958. V. 62. № 5. P. 550.
Bogacz W., Al-Rashed M.H., Lemanowicz M., Wójcik J. // J. Sol. Chem. 2016. V. 45. № 7. P. 1071.
Stern H.a.G., Sadoway D.R., Tester J.W. // J. Electroanalyt. Chem. 2011. V. 659. № 2. P. 143.
Леванов А.В., Исайкина О.Я., Богданов В.П., Игнатьева Н.Ю. Практикум по физической химии. Определение стандартных термодинамических функций химической реакции методом ЭДС, 2018.
Wagman D.D., Evans W.H., Parker V.B., Schumm R.H., Halow I., Bailey S.M., Churney K.L., Nutall R.L. The NBS Tables of Chemical Thermodynamic Properties. J. Phys. Chem. Ref. Data, 1982, 11, Supplement № 2. Washington D.C.: National Bureau of Standards, 1982.
Иориш В.С., Юнгман В.С. База данных “Термические константы веществ”, рабочая версия-2, http://www.chem.msu.ru/cgi-bin/tkv.pl?show=welcome.html (дата доступа 27.05.2018)
Nordstrom D.K. // Geochim. Cosmochim. Acta. 1977. V. 41. № 12. P. 1835.
Hanania G.I.H., Irvine D.H., Eaton W.A., George P. // J. Phys. Chem. 1967. V. 71. № 7. P. 2022.
Lin J., Breck W.G. // Can. J. Chem. 1965. V. 43. № 4. P. 766.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии