Журнал физической химии, 2019, T. 93, № 6, стр. 908-912
Исследование взаимодействия паров воды с поверхностью γ-Al2O3 методом ИК-спектроскопии
С. Д. Бадмаев a, *, Е. А. Паукштис a, В. Д. Беляев a, В.А. Собянин a
a Российская академия наук, Сибирское отделение, Институт катализа им. Г.К. Борескова
Новосибирск, Россия
* E-mail: sukhe@catalysis.ru
Поступила в редакцию 23.08.2018
После доработки 23.08.2018
Принята к публикации 11.09.2018
Аннотация
Методом ИК-спектроскопии изучено взаимодействие паров H2O и D2O с поверхностью γ-Al2O3. Показано образование поверхностных гидроксильных групп ОН и OD уже при температуре 100–200°С. Установлено, что эти поверхностные гидроксильные группы обладают бренстедовской кислотностью и при взаимодействии с NH3 приводят к образованию ионов NH$_{4}^{ + }$.
Оксид алюминия – один из наиболее востребованных материалов в гетерогенном катализе и широко используется в качестве катализатора или носителя катализаторов различных процессов [1–3]. Известно, что γ-Al2O3 является типичным представителем льюисовской твердой кислоты [4, 5]. Многие исследователи предполагают, что льюисовские кислотные центры (ЛКЦ) γ‑Al2O3 в присутствии паров воды, например, в условиях реакций гидролиза, парового риформинга и т.п. могут переходить в бренстедовские кислотные центры (БКЦ) [2, 3, 6]. Для подтверждения такого перехода в данной работе при помощи метода ИК-спектроскопии in situ изучено взаимодействие паров H2O, D2O и дополнительно NH3 с поверхностью γ-Al2O3.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Взаимодействие паров H2O, D2O и NH3 с поверхностью γ-Al2O3 изучали методом ИК-спектроскопии in situ. Спектры регистрировали на спектрометре Shimadzu IRAffinity-1 с разрешением 4 см–1 и усредняли по 64 сканам. В экспериментах использовали высокотемпературную ячейку Harrick High Temperature Cell, оснащенную окнами из KBr. Спектры снимали с интервалом 3 мин в течение 0.5–1 ч до прекращения изменений. Результирующие спектры приведены после вычитания фоновых спектров.
В исследованиях использовали коммерческий образец γ-Al2O3 производства ОАО “Катализатор”, г. Новосибирск. Он имел удельную поверхность ~200 м2/г, объем пор ~0.7 см3/г, концентрацию ЛКЦ и БКЦ после прокаливания в вакууме при 500°С, соответственно равную 600 и 30 мкмоль/г [4].
Термогравиметрический анализ (ТГА) образца γ-Al2O3 проводили с использованием дериватографа STA 409 PC Luxx, оснащенного масс-спектрометром QMS-200. Порошок γ-Al2O3 (~50 мг) перед проведением эксперимента прокаливали непосредственно в дериватографе при 650°С в течение 1 ч в атмосфере He. Затем образец охлаждали до 50оС и обрабатывали парами воды с использованием смеси 2.5 об. % Н2О + 97.5 об. % He при объемной скорости ее подачи в дериватограф 70 мл/мин. Далее образец нагревали до 800°С (5 К/мин) с остановкой при 100, 150 и 200°С в потоке He и при скорости его подачи 70 см3/мин. В ходе этих экспериментов регистрировали изменение массы образца, а концентрацию десорбируемой воды в газовой фазе измеряли с помощью масс-спектрометра.
Перед проведением экспериментов ИК-спектроскопии in situ порошок γ-Al2O3 прокаливали на воздухе при 650°С в течение 1 ч. Прессовали в диск массой 10 мг и диаметром 13 мм и перемещали в ячейку. Перед проведением всех экспериментов образцы продували в потоке сухого He (100 мл/мин) и непосредственно в ячейке выдерживали при температуре 350°С в течение 1 ч.
Адсорбцию воды на γ-Al2O3 проводили из потока гелия содержащего ~2.5 об. % воды при скорости 100 мл/мин и температуре 50°С, периодически снимая ИК-спектры. Избыток воды удаляли продувкой ячейки сухим гелием (100 мл/мин) в течение 30 мин. Далее ячейку охлаждали в потоке гелия до 50°С и регистрировали ИК-спектр адсорбированной воды. После этого образец последовательно нагревали ступенями до температур 100, 150 и 200°С. При каждой температуре образец выдерживали в течение 30 мин и снимали ИК- спектр. Затем при температуре ячейки 200°С образец продували гелием, содержащим 5 об. % аммиака (70 мл/мин). Избыток аммиака из ячейки удаляли потоком сухого гелия при скорости 100 мл/мин и регистрировали ИК-спектр адсорбированного аммиака в течение 30 мин. Спектр γ‑Al2O3 после адсорбции воды при 200°С использовали в качестве фонового.
Для повышения надежности полученных результатов дополнительно проводили эксперименты по адсорбции D2O. Предварительно все ОН-группы оксида алюминия заменяли на OD-группы. Для этого ячейку с оксидом алюминия при 350°С продували потоком гелия (100 мл/мин), содержащим ~2.5 об. % D2O до полной замены ОН- на OD-группы. Далее эксперимент проводили по той же процедуре, как прописано выше, только вместо H2O использовали D2O. Приведенные спектры по адсорбции H2O и D2O на γ-Al2O3 получены вычитанием спектров, измеренных при 50°С, из спектров, зарегистрированных при повышенных температурах. Этот прием позволил более наглядно показать спектры изолированных групп Al–O–H (Al–O–D) разных типов.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Для проведения количественной оценки адсорбированной воды образец γ-Al2O3 исследовали методом ТГА. На рис. 1 приведены зависимости температуры и массы образца после адсорбции паров H2O при 50°С от времени его нагревания в потоке He до 800оС. Промежуточные температуры 100, 150 и 200°С выбраны в соответствии с проведенными ИК-исследованиями. Следует отметить, что при продувке образца гелием при 50оС масса образца уменьшалась почти на ~1% за счет десорбции слабоадсорбированной воды. На рис. 1 приведены данные после удаления слабоадсорбированной воды с поверхности γ-Al2O3. При нагревании образца от 50 до 100°С его масса уменьшалась еще на ~1%. При дальнейшем увеличении температуры до 150 и 200°С масса образца уменьшалась на 1.6 и 1.9% соответственно. Известно, что при 200оС практически полностью удаляется молекулярная вода с поверхности γ-Al2O3 [3, 7]. Дальнейшее увеличение температуры до 800°С ведет к уменьшению массы образца еще на 2%, что связано с удалением прочносвязанной хемосорбированной воды – AlОН-групп, образование которых будет показано на рис. 2. Как показали расчеты, потеря 2% массы соответствует удалению 3.4 молекулы H2O с 1 нм2 поверхности γ‑Al2O3, что больше чем суммарная концентрация ЛКЦ на поверхности γ-Al2O3, которая составляет 600 мкмоль/г или 1.8 ЛКЦ/нм2. Это, вероятнее всего, связано с хемосорбцией воды не только на ЛКЦ, но и на поверхностных ионах кислорода с образованием водородных связей [8].
Рис 1.
Зависимости температуры и массы образца γ‑Al2O3 после адсорбции паров H2O при 50°С от времени его нагревания в потоке He.
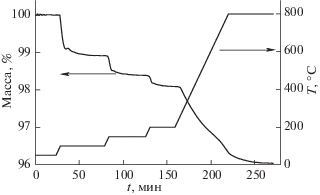
Рис 2.
ИК-спектры после адсорбции паров H2O на γ-Al2O3 при 50°С и последующего нагревания в потоке He до температур 100 (1), 150 (2) и 200°С (3).

В целом, из рис. 1 видно, что при нагревании образца до 800°С наблюдается суммарная потеря его массы на ~4%. Аналогичные данные были получены в работе [9]. Также в этой работе показано, что полное удаление ОН-групп происходит при температуре выше 1000°С, а при 800°С на поверхности γ-Al2O3 все еще остаются прочносвязанные ОН-группы с концентрацией ~3 ОН/нм2.
Таким образом, анализ литературы [10] и проведенный ТГА (рис. 1) позволяет предположить, что возможен переход адсорбированной молекулы воды в ОН-группу на поверхности γ-Al2O3. Для подтверждения этих данных проведены специальные эксперименты с использованием ИК-спектроскопии in-situ.
Адсорбция H2O. На рис. 2 приведены ИК-спектры γ-Al2O3 после адсорбции H2O при 50°С и последующего нагревания образца в потоке He до 200°С с шагом 50 К. Как уже отмечалось в экспериментальной части, спектры получены вычитанием спектров, измеренных при 50°С, из спектров, зарегистрированных при повышенных температурах. Видно, что при повышении температуры ячейки до 200°С наблюдаются изменения при ~1600, ~3200 и ~3700 см–1. Согласно [5], молекулярная вода на поверхности γ-Al2O3 характеризуется полосами поглощения адсорбированной воды при 1635 см–1 (деформационные колебания) и 3100–3150 см–1 (валентные колебания); изолированные ОН-группы на поверхности γ-Al2O3 характеризуются полосами поглощения в ИК-спектре в области 3670–3800 см–1 [1–3, 5, 6].
Как видно из рис. 2, при увеличении температуры наблюдается уменьшение интенсивности полос поглощения, относящихся к молекулярной воде, адсорбированной на ЛКЦ и частично на наиболее кислотных –ОН-группах. При 200°С полностью исчезает молекулярная вода на поверхности γ-Al2O3. Одновременно с этим наблюдается увеличение интенсивности полос поглощений –ОН-групп в области 3680–3750 см–1, которые отвечают терминальным и мостиковым –ОН-группам соответственно, связанные с одним и двумя катионами алюминия в разной координации. Согласно литературным данным [11], полосы поглощения с максимумами при 3727 и 3745 см–1 (рис. 2) относятся к терминальным гидроксильным группам γ-Al2O3, а 3680–3710 см–1 – к мостиковым гидроксильным группам γ-Al2O3.
Из рис. 2 видно, что концентрации мостиковых и терминальных гидроксильных групп увеличиваются с ростом температуры. Эти данные были полностью подтверждены экспериментами с использованием D2O, обеспечивающими повышение отношения сигнал/шум.
Адсорбция D2O. На рис. 3 представлены ИК-спектры адсорбированной D2O на поверхности дейтерированного образца γ-Al2O3. Наблюдаемые полосы поглощения соответствовали деформационным (~1200 см–1) и валентным (~2400 см–1) колебаниям D2O на поверхности γ-Al2O3, а также OD-группам (2710–2780 см–1). Изменения полос поглощений на рис. 3 были идентичными данным рис. 2 с тем лишь различием, что интенсивности полос поглощения отличались в 1.3–1.4 раза ($ \sim {\kern 1pt} \sqrt 2 $). Из рис. 3 видно, что с увеличением температуры наблюдается уменьшение интенсивностей полос поглощений D2O и увеличение интенсивностей полос поглощения OD-групп, в частности, полос с максимумами при 2715, 2747 и 2762 см–1. Согласно [12], эти группы соответствуют ОН-группам γ-Al2O3 – с максимумами при 3680 (мостиковые), 3727 и 3745 (терминальные) см–1 соответственно. Эти данные, а также аналогичные результаты, приведенные на рис. 2, демонстрируют образование ОD-групп из адсорбированной D2O на γ-Al2O3. Необходимо отметить, что мостиковые гидроксильные группы обладают более высокой кислотностью, чем терминальные [12, 13]. Для подтверждения полученных результатов были проведены специальные эксперименты по адсорбции аммиака на уже гидроксилированный γ-Al2O3.
Рис 3.
ИК-спектры после адсорбции паров D2O на γ-Al2O3 при 50°С и последующего нагревания в потоке He до температур 100 (1), 150 (2) и 200°С (3).

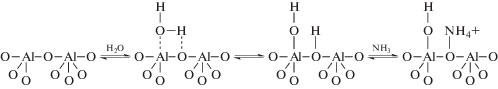
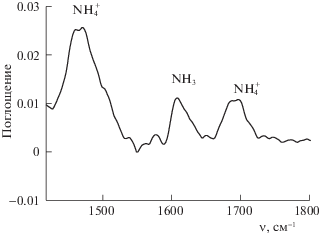
Адсорбция NH3. На рис. 4 показаны ИК-спектры после адсорбции аммиака γ-Al2O3 в продолжение эксперимента, проведенного при 200°С (рис. 2). После адсорбции аммиака на гидроксилированный γ-Al2O3 в ИК-спектрах наблюдаются полосы поглощения в области 1400–1500, 1600–1640 и 1670–1720 см–1. Полосы поглощений в области 1600–1640 см–1 относятся к физически адсорбированному NH3 на поверхности образца или же к адсорбированному на ЛКЦ. Образование ионов аммония (δas(NH$_{4}^{ + }$) ≈ 1470 и δs(NH$_{4}^{ + }$) ≈ ≈ 1690 см–1) [14], свидетельствует о том, что мостиковые гидроксильные группы обладают кислотностью, и их можно идентифицировать как БКЦ. С учетом приведенных выше результатов, а также представлений о структуре γ-Al2O3 [13] предлагается механизм перехода ЛКЦ в БКЦ при адсорбции воды на γ-Al2O3:
Рис 4.
ИК-спектры после взаимодействия NH3 при 200°С с поверхностью γ-Al2O3, полученной в ходе адсорбции паров H2O при 50°С и последующего нагревания в потоке He до 200°С.
Таким образом, методом ИК-спектроскопии in situ показано образование гидроксильных (ОН) групп при 100–200°С на поверхности γ-Al2O3 после адсорбции паров H2O. Установлено, что эти ОН-группы обладают кислотностью, достаточной для протонирования аммиака. Предложен механизм перехода ЛКЦ в БКЦ на поверхности γ‑Al2O3.
Работа выполнена в рамках государственного задания Института катализа СО РАН (проект № АААА-А17-117041710088-0).
Список литературы
Busca G. // Chem. Rev. 2007. V. 107. № 11. P. 5366.
Trueba M., Trasatti S.P. // Eur. J. Inorg. Chem. 2005. V. 17. P. 3393.
Sanchez Escribano V., Garbarino G., Finicchio E., Busca G. // Top. Catal. 2017. V. 60. P. 1554.
Badmaev S.D., Belyaev V.D., Volkova G.G. et al. // React. Kinet. Catal. Lett. 2007. V. 90. P.197.
Паукштис Е.А. Инфракрасная спектроскопия в гетерогенном кислотно-основном катализе. Новосибирск: Наука, 1992. 255 с.
Бондаренко Г.Н., Волнина Э.А., Кипнис М.А. и др. // Журн. физ. химии. 2016. Т. 90. № 2. С. 272
Szanyi J., Kwak J.H., Chimentao R.J., Peden Ch.H.F. // J. Phys. Chem. C. 2007. V. 111. P. 2661.
De Boer J.H., Fortuin J.M.H., Lippens B.C., Mejs W.H. // J. Catal. 1963. V. 2. P. 1.
McHale J.M., Auroux A., Perrotta A.J., Navrotsky A. // Sci. 1997. V. 277. P. 788.
Busca G. // Catalysis Today. 2014. V. 226. P. 2.
Busca G., Lorenzelli V., Sanchez Escribano V., Guidetti R. // J. Catal. 1991. V. 131. P. 167.
Onfroy T., Li W.-C., Schuth F., Knosinger H. // Top. Catal. 2011. V. 54. P. 390.
Senchenya I.N., Pelmeshchikov A.G., Zhidomirov G.M., Kazanskii A.B. // React. Kinet. Catal. Lett. 1986. V. 31. P. 101.
Jobson E., Baiker A., Wokaun A. // J. Chem. Soc. Faraday Trans. 1990. V. 86. P. 1131.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии