Журнал физической химии, 2019, T. 93, № 6, стр. 866-871
Описание структуры пространственных сеток водородных связей в жидкостях методом Вороного–Делоне
Н. К. Балабаев a, И. А. Стрельников b, М. А. Мазо b, Е. Б. Гусарова b, М. Н. Родникова c, *, С. В. Краевский d, e
a Российская академия наук, Институт математических проблем биологии – филиал Института прикладной математики им. М.В. Келдыша
Московская область, Пущино, Россия
b Российская академия наук, Институт химической физики им. Н.Н. Семенова
Москва, Россия
c Российская академия наук, Институт общей и неорганической химии им. Н.С. Курнакова
Москва, Россия
d Федеральное медико-биологическое агенство России, Федеральный научно-клинический центр физико-химической медицины
Москва, Россия
e “Институт теоретической и экспериментальной физики им. А.И. Алиханова Национального исследовательского центра” Курчатовский институт
Москва, Россия
* E-mail: rodnikova@igic.ras.ru
Поступила в редакцию 09.08.2018
После доработки 09.08.2018
Принята к публикации 11.11.2018
Аннотация
Методом молекулярной динамики получены характеристики мгновенных (I), колебательно-усредненных (V) и “замороженных” (F) структур жидких этиленгликоля (ЭГ), моноэтаноламина (МЭА) и этилендиамина (ЭД) в интервале температур 273–453 К. Описание структур выполнено построением многогранников Вороного и симплексов Делоне. Получены распределения объемов многогранников Вороного и радиусов сфер симплексов Делоне в интервале температур жидкой фазы ЭГ, МЭА и ЭД. Проведен сравнительный анализ этих характеристик для трех исследованных жидкостей при разном усреднении по времени и пространству. Показано, что описание структуры жидкости методом Вороного–Делоне позволяет весьма наглядно сравнить характеристики пространственных сеток водородных связей в жидкости.
Молекулы производных этана – этиленгликоля (ЭГ), моноэтаноламина (МЭА) и этилендиамина (ЭД) – различаются своими активными группами: два гидроксила в ЭГ, две аминные группы в ЭД, гидроксильная и аминная группа в МЭА, дающими возможность образовывать пространственную сетку Н-связей в жидких фазах этих соединений [1]. Физические свойства этих веществ имеют много общего. Например, большое переохлаждение жидкой фазы, трудность кристаллизации, легкость стеклообразования, малые сжимаемости и малые тепловые коэффициенты объемного расширения, объясняемые наличием пространственной сетки Н-связей. Отличие их связано с различием активных групп, донорной способности и конформации молекул, конформационных переходов, энергии и времен жизни внутри- и межмолекулярных Н-связей и др. Это и определяет различие пространственных сеток водородных связей в жидких ЭГ, МЭА и ЭД. Физико-химические свойства этих веществ приведены в табл. 1 [2].
Таблица 1.
Физико-химические характеристики ЭД, МЭА и ЭГ [2]
| Характеристики | ЭД | МЭА | ЭГ |
|---|---|---|---|
| М | 60 | 61 | 62 |
| Тпл, °С | 8.5 | 10.3 | –12.9 |
| Ткип, °С | 118 | 170 | 197 |
| ρ(25°С) × 10–3, кг/м3 | 0.890 | 1.012 | 1.113 |
| η(25°С) × 103, Па с | 1.46 | 18.95 | 16.16 |
| μ(25°С), D | 1.89 | 2.27 | 2.29 |
| ε(25°С) | 13 | 31.4 | 40 |
| $\beta _{Т }^{{(25^\circ {\text{С }})}}$ × 1011, Па–1 | 50.8 | 38.7 | 36 |
| χ × 105, К–1 | 107.2 | 80.7 | 64.9 |
| ∆плH, кДж/моль | 22.58 | 20.5 | 9.958 |
| ∆плS, Дж/(моль К) | 79.44 | 56 | 38.21 |
| ∆vapH, кДж/моль | 37.98 | 49.83 | 50 |
| ∆vapH/Ткип | 23.2 | 26.9 | 25.5 |
Как известно, структура жидкости, кроме пространственных координат, имеет еще координату времени. Локальные структуры в жидкости получают методом молекулярной динамики (МД). В зависимости от времени экспозиции они рассматриваются как мгновенные (I) и колебательно-усредненные (V) [3–5]. Рассматриваются еще и “замороженные” (F) cтруктуры, получаемые быстрым охлаждением до 0 К при сохранении объема (плотности) системы [5]. F-структура – аналог “собственной” структуры жидкости, под которой понимается пространственное расположение частиц при устранении термических возбуждений [5–8]. С F-структурами удобно работать. Например, лучше всего именно в них можно определить и рассчитать характеристики водородной связи. Локальные структуры выбранных нами жидкостей, представляющие пространственные сетки Н-связей, были исследованы методом молекулярной динамики [9–12].
Для сравнения этих структур в жидкости и распределения в них пустот в настоящей работе использовали методы построения многогранников Вороного и симплексов Делоне, широко применяемых при описании некристаллических структур [13]. Например, в жидких воде, метаноле, НF [14, 15] и в жидких растворах [16, 17], в леннард-джонсовских системах [5], в гидратных оболочках белков и на поверхностях мембран в водных растворах [18, 19].
ОПИСАНИЕ МОДЕЛИ И МЕТОДИКИ ВЫЧИСЛЕНИЙ
Мгновенное расположение атомов вещества в пространстве получали методом МД. Для каждого из исследованных веществ строили модель из 1000 молекул в прямоугольной расчетной ячейке с периодическими граничными условиями. Моделирование проводили с помощью программного комплекса ПУМА, разработанного в ИМПБ РАН с использованием силового поля AMBER99, дополненного специальной процедурой задания начальной конфигурации системы и программами анализа структурно-динамических характеристик жидких ЭГ, МЭА и ЭД.
Моделирование проводили в условиях NPT-ансамбля в температурном интервале жидкой фазы исследуемых веществ. Потенциалы взаимодействия и методика молекулярно-динамического расчета описаны в работах [10–12]. Время релаксации для каждой из систем составляло не менее 2 нс, после чего следовал расчетный участок, по которому рассчитывали различные характеристики системы. Шаг численного интегрирования уравнений движения был 1 фс. Длина расчетного участка траектории была, как правило, 500 пс. Для анализа I-структур координаты всех атомов записывали с шагом 0.1 пс. Для расчета V-структур рассматривали три времени усреднения: 0.1, 1 и 10 пс. “Замороженные” F-структуры рассчитывали каждые 0.1 пс в соответствии с методикой, которая подробно описана в [5].
Для анализа распределения пустого пространства в жидких ЭГ, МЭА и ЭД при разных температурах принимали упрощенное представление молекул этих жидкостей: СН2-, ОН- и NH2-группы, имеющие приблизительно одинаковый объем и близкую к сферической форму, представляли одинаковыми шарообразными частицами с центрами в центрах масс этих групп и радиусом R = 1.7 Å, который соответствует ван-дер-ваальсовому радиусу рассматриваемых групп. Таким образом, молекулы ЭГ, МЭА и ЭД при анализе структуры рассматриваемых жидкостей рассматривали как четыре одинаковые частицы, связанные валентными связями. Это позволяло использовать для анализа полученных структур стандартный алгоритм разбиения Вороного и построение сопряженных с ним симплексов Делоне [13].
Многогранники Вороного разбивают все пространство на области, в каждой из которых расстояние от любой ее точки до расположенной в ее центре частицы меньше, чем до любой другой. Это позволяет разбить весь объем рассматриваемой жидкости на локальные объемы, относящиеся к каждой частице (рис. 1а). Симплексы Делоне (в трехмерном пространстве тетраэдры), напротив, характеризуют межатомное пространство, поскольку сферы, проведенные через вершины этих тетраэдров, не содержат никаких частиц [13], причем эти сферы могут пересекаться.
Рис. 1.
Схемы, иллюстрирующие разбиение пространства в методах Вороного (а) и Делоне (б). Пояснения в тексте.

В данной работе мы рассматриваем “пустые сферы Делоне”, которые получаются уменьшением их радиуса на радиус частиц (рис. 1б). Для наглядности на рис. 1 показан двумерный случай разбиения Вороного–Делоне. Молекулы представлены тремя частицами, связанными валентными связями (жирные линии). На рис. 1а для многоугольника Вороного для центральной частицы серыми гало показаны соседние частицы; на рис. 1б представлено разбиение на симплексы Делоне. Для относительно большого центрального симплекса показана “пустая сфера Делоне”, которая касается ван-дер-ваальсовых сфер трех частиц (в пространстве – четырех!). Таким образом, любая молекула, которая помещается в эту сферу (например, молекула инертного газа) не будет стерически пересекаться с атомами жидкости. Усредненные по времени и пространству распределения объемов многогранников Вороного и радиусов пустых сфер Делоне служат характеристиками вещества и зависят от его термодинамического состояния [5, 13, 18].
Многогранники Вороного и симплексы Делоне рассчитывали с использованием алгоритмов [13] для случая системы с периодическими граничными условиями с расчетной ячейкой в форме прямоугольного параллелепипеда, состоящей из одинаковых атомов. Сферы Делоне однозначно определяются по четырем вершинам тетраэдров.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
На основании результатов МД-расчетов получены функции распределения объемов многогранников Вороного и радиусов пустых сфер Делоне для ЭГ, МЭА и ЭД в интервале температур их жидкой фазы: от 268 до 443 К для ЭГ, от 273 до 453 К для МЭА и от 273 до 393 К для ЭД. Исследованы характеристики распределений и зависимость их от температуры. Проведен сравнительный анализ этих характеристик для трех исследованных жидкостей.
Результаты найденного распределения объемов многогранников Вороного для V-cтруктур жидких ЭГ, ЭД и МЭА получены в виде гистограмм. Температурные зависимости параметров этих гистограмм: объем в максимуме, ширина пика на полувысоте и высота максимального пика, представлены на рис. 2. Подобные гистограммы получены и для I- и F-структур исследованных веществ. Распределение многогранников Вороного для I-, V- и F-cтруктур исследованных нами жидкостей при 293 К представлены в виде гистограмм на рис. 3. Рассчитанные параметры этих гистограмм для I-, V- и F-cтруктур (положение и значение максимума, ширина распределения на полувысоте) для МЭА, ЭД и ЭГ при двух температурах 293 К и 323 К приведены в табл. 2.
Рис. 2.
Зависимости параметров гистограмм распределения многогранников Вороного по их объемам в V-cтруктуре ЭГ, МЭА и ЭД от температуры: объем в максимуме (а), Å3, ширина пика на полувысоте (б), Å, и высота пика (в), произвольные единицы.
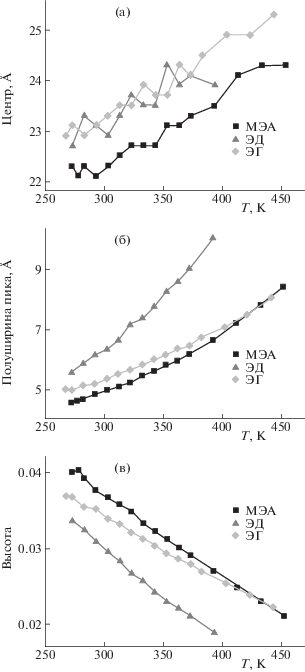
Рис. 3.
Гистограммы распределения многогранников Вороного по их объемам в V-, F-, I-структурах ЭГ (а), МЭА (б) и ЭД (в) при 293 К.

Таблица 2.
Параметры гистограмм распределения многогранников Вороного по их объемам в различных структурах при 293 и 323 К для V-структур
| Объект | Ширина на полувысоте, Å3 | Положение максимума, Å3 | Высота пика | |||
|---|---|---|---|---|---|---|
| 293 К | 323 К | 293 К | 323 К | 293 К | 323 К | |
| I-структуры | ||||||
| МЭА | 5.38 | 7.68 | 21.9 | 24.4 | 0.034 | 0.023 |
| ЭД | 5.91 | 8.6 | 22.5 | 24.5 | 0.031 | 0.021 |
| ЭГ | 6.27 | 6.92 | 23.1 | 22.5 | 0.029 | 0.027 |
| F-структуры | ||||||
| МЭА | 5.91 | 6.8 | 22.5 | 23.9 | 0.031 | 0.025 |
| ЭД | 6.07 | 6.81 | 23.0 | 23.5 | 0.035 | 0.026 |
| ЭГ | 6.06 | 5.13 | 22.5 | 21.5 | 0.030 | 0.036 |
| V-структуры | ||||||
| МЭА | 4.83 | 5.21 | 22.1 | 22.7 | 0.038 | 0.035 |
| ЭД | 6.15 | 7.16 | 23.1 | 23.7 | 0.031 | 0.027 |
| ЭГ | 5.18 | 5.66 | 23.1 | 23.5 | 0.035 | 0.032 |
Обсуждая V-структуры исследованных жидкостей и параметры пиков их гистограмм в зависимости от температуры (рис. 2), можно сделать следующий вывод: наименее выражена сетка Н-связей у ЭД (наименьшая высота максимального пика, наибольшая ширина на полувысоте и наибольшая зависимость всех параметров от температуры). Это подтверждается как экспериментальными [20], так и расчетными данными [12]. Анализируя объемы полиэдров Вороного для I- и F-структур, такой вывод сделать трудно (рис. 3). Это понятно, так как многогранник Вороного – это объем пространства, отнесенный к группе атомов, похожих друг на друга в ЭГ, МЭА и ЭД. Из табл. 2 можно сделать общий вывод – наилучшим образом метод Вороного описывает V‑структуры жидкости. Показано, что наиболее высокий и узкий пик с наименьшей координатой по абсциссе у МЭА, что указывает на лучшую выраженность структуры пространственной сетки Н-связей этого вещества.
Если многогранник Вороного характеризует объем пространства, отнесенный к группе атомов вещества в данный момент времени, то симплексы Делоне связаны с межмолекулярным пространством и пористостью вещества. Были рассчитаны сферы Делоне и построены гистограммы радиусов этих сфер в том же интервале температур, что и объемы многогранников Вороного. Получены гистограммы распределений радиусов пустых сфер Делоне в температурных интервалах жидкого состояния ЭГ, ЭД, МЭА для V-cтруктур. В табл. 3 приведены рассчитанные радиусы максимальных пор в исследованных жидкостях в зависимости от температуры (широкий температурный интервал расчета связан со способностью переохлаждения и перегрева жидкой фазы этих веществ).
Таблица 3.
Температурная зависимость радиусов максимальных пор (Å) для V-структур
| Т, К | ЭГ | ЭД | МЭА |
|---|---|---|---|
| 273 | 2.35 | 2.07 | 2.25 |
| 283 | 2.63 | 2.09 | 2.09 |
| 293 | 2.57 | 2.23 | 2.23 |
| 303 | 2.43 | 2.15 | 2.37 |
| 313 | 2.73 | 2.25 | 2.39 |
| 323 | 2.69 | 2.49 | 2.35 |
| 333 | 2.75 | 2.35 | 2.45 |
| 343 | 2.71 | 2.55 | 2.71 |
| 353 | 2.79 | 2.79 | 2.69 |
| 363 | 2.81 | 2.73 | 2.75 |
| 373 | 3.03 | 2.61 | 2.71 |
Отметим более сильную температурную зависимость максимальных пор у ЭД, что свидетельствует о наиболее подвижной и слабой сетке данной жидкости. Это также согласуется с физико-химическими свойствами [20] и молекулярно-динамическими расчетами ЭД [12, 21]. Интересно сравнить полученные данные с результатами измерения размеров пор, полученных нами ранее методом молекулярной динамики для ЭГ [10] и МЭА [11]. Так, радиус максимальных пор в ЭГ был оценен в 1.67 Å при 268 К и 2.17 Å при 443 К, а радиус максимальных пор в МЭА – в 1.98 Å при 293 К и 2.53 Å при 453 К. Эти величины несколько занижены по сравнению с нашими более полными данными, но температурная зависимость их одна и та же; то же соотношение пор в ЭГ и МЭА.
Таким образом, метод Вороного–Делоне – один из методов описания структуры жидкости через описание пустого пространства в ней в разные промежутки времени – применен для описания структур и сравнения характеристик пространственных сеток водородных связей в жидких ЭГ, ЭД и МЭА. Показано, что этот метод эффективен при сравнении пространственных сеток Н-связей в жидкости, особенно для V-cтруктур. Если многогранник Вороного показывает объем пространства, отнесенный к группе атомов, то симплексы Делоне связаны с межмолекулярным пространством. Установлено, что наиболее слабой и в наибольшей степени зависимой от температуры является сетка ЭД, что согласуется с молекулярно-динамическими расчетами и физико-химическими свойствами этой жидкости.
Основные расчеты проведены в Межведомственном суперкомпьютерном центре РАН и на кластере Института прикладной математики им. М.В. Келдыша РАН. Работа выполнена в рамках государственного задания ИОНХ РАН в сфере фундаментальных научных исследований.
Список литературы
Родникова М.Н. // Журн. физ. химии. 1993. Т. 67. С. 275.
Родникова М.Н., Самигуллин Ф.М., Солонина И.А., Сироткин Д.А. // Журн. структур. химии. 2014. Т. 55. № 2. С. 276.
Фишер И.З. Статистическая теория жидкости. М.: Физ. мат. лит., 1961.
Hirata F., Rossky P. // J. Chem. Phys. 1981. V. 74. № 12. P. 6867.
Наберухин Ю.И., Волошин В.П., Медведев Н.Н. // Расплавы. 1987. Т. 1. С. 71.
Stillenger F.H., Weber T.A. // Phys. Rev. 1982. V. A25. № 2. P. 978.
Malenkov G.G. // Struct. Chem. 2007. V. 18. № 4. P. 429.
Ohmin I. // Conf. Proc. 1993. V. 43. P. 7.
Наберухин Ю.И., Волошин В.П. // Журн. структур. химии. 2006. Т. 47. Прилож. S. 129–143.
Белащенко Д.К., Родникова М.Н., Балабаев Н.К., Солонина И.А. // Журн. физ. химии. 2013. Т. 87. № 7. С. 1171.
Белащенко Д.К., Родникова М.Н., Балабаев Н.К., Солонина И.А. // Там же. 2016. Т. 90. № 1. С. 64.
Балабаев Н.К., Краевский С.В., Родникова М.Н., Солонина И.А. // Там же. 2016. Т. 90. № 10. С. 1505.
Медведев Н.Н. Метод Вороного–Делоне в исследовании структуры некристаллических систем. Новосибирск: Наука, 2000.
Волошин В.П., Медведев Н.Н., Наберухин Ю.И. и др. // Журн. структур. химии. 2005. Т. 46. № 3. С. 451.
Jedlovszky P. // J. Chem. Phys. 2000. V. 113. P. 9113.
Idrissi F., Polok K., Gadomski W. et al. // Phys. Chem. Chem. Phys. 2012. V. 14. P. 5979.
Idrissi A., Damay, Yukichi K., Jedlovszky Pal // J. Chem. Phys. 2008. V. 129. P. 164512.
Voloshin V.P., Kim A.V., Medvedev N.N. et al. // Biophys. Chem. 2014. V. 192. P. 1.
Волошин В.П., Ким А.В., Шелепова Е.А., Медведев Н.Н. // Журн. структур. химии. 2018. Т. 59. № 1. С. 10.
Вальковская Т.М. Дис. … канд. хим. наук. М.: ИОНХ РАН, 2000.
Gubskaya A.V., Kusalik P.G. // J. Phys. Chem. A. 2004. V. 108. P. 7151.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии


