Журнал физической химии, 2019, T. 93, № 6, стр. 890-894
Квантово-химическая модель структуры полисульфида силиката железа
Л. Р. Бараева a, *, А. А. Юсупова a, **, Р. Т. Ахметова a, А. И. Хацринов a, Ж. В. Межевич a
a Казанский национальный исследовательский технологический университет
Казань, Россия
* E-mail: baraeva.linara@yandex.ru
** E-mail: alsu16rus@yandex.ru
Поступила в редакцию 13.09.2018
После доработки 15.11.2018
Принята к публикации 15.01.2019
Аннотация
С использованием квантово-химической программы Priroda 6 и программы-визуализатора Chemcraft смоделирована пространственная структура полисульфида силиката железа и оценена его стабильность. Результатами теоретических исследований доказана высокая прочность связей независимо от длины серной цепочки, что свидетельствует о способности железа удерживать длинные серные цепочки без ослабления связей. Установлено, что хлорид железа служит своеобразным мостиком между силикагелевым кластером и серой с образованием полисульфида силиката железа, который может быть основой для получения материалов строительного назначения. Показано, что при получении подобных материалов сера способна образовывать поверхностный гидрофобный слой, защищая материал от разрушения в водной среде, и формировать плотный беспористый материал.
При переработке нефти наблюдается устойчивое перепроизводство серы, возрастающее с каждым годом. Производство серы становится столь значительным, что эффективная утилизация данного продукта стала важной технико-экономической и экологической проблемой. Одним из наиболее материалоемких потребителей серы может быть строительная отрасль. Такие специфические свойства серы как гидрофобность, бактерицидность и связующие свойства, стойкость в кислых средах создают предпосылки для использования попутной серы в указанной отрасли. В строительных материалах сера выступает связующим компонентом, помимо этого в состав вводятся наполнители, заполнители, модифицирующие добавки. Важно при получении серных материалов переводить серу в связанное состояние, например, в сульфид для предотвращения выделения диоксида серы и снижения токсичности. Напрямую сера с наполнителем (чаще всего силикатным) не взаимодействует. Авторами предполагается, что для обеспечения взаимодействия и перевода серы в сульфид необходимо вводить дополнительный компонент. Таким компонентом может выступать хлорид железа, способный взаимодействовать как с наполнителем, так и с вяжущим компонентом [1]. Исследование подобной системы связано с определенными трудностями предсказания поведения компонентов, эффективности введенной добавки и свойств получаемых материалов. Поэтому авторами наряду с практическими исследованиями применялось квантово-химическое моделирование продукта взаимодействия системы Si(OH)4–FeCl3–Sn. Оценив стабильность и прочность смоделированных соединений, можно прогнозировать и регулировать эксплуатационные характеристики получаемых серных материалов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В данной работе приведены результаты теоретических исследований. Экспериментальные результаты опубликованы нами ранее [1].
Для визуализации пространственного строения исследуемых систем использовали программу ChemCraft. С помощью данной программы моделировали исходную геометрию молекул и получали начальную матрицу в декартовых координатах. Квантово-химические расчеты выполняли с помощью программы Priroda 6 посредством гибридного метода функционала плотности dft functional = PBE в полноэлектронном скалярном релятивистском приближении в базисе гауссовых функций L11 с базисным набором basis4.in, включающим релятивистские поправки four = 1 с заданием метода расчета, базисного набора, заряда и мультиплетности. Расчет завершали при полной оптимизации исследуемой структуры, что соответствует наличию всех положительных частот колебаний в матрице вторых производных [2, 3].
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Первая задача при моделировании продукта взаимодействия тройной системы – выбор структуры силикатного наполнителя. При построении квантово-химических моделей функциональных групп использовали кластерное приближение. При этом возможны два подхода к моделированию. Первый заключается в использовании больших кластеров, описывающих структуру приповерхностной области, которую, по мнению многих авторов [4, 5], можно уподоблять кристаллографическим сечениям β-кристобалита. Такой метод позволяет учесть не только природу групп Si–ОН, но и связи Si–О–Si.
Второй подход – использование конкретной кристаллической структуры – неоднозначен, при этом необходимо рассмотреть значительное число возможных вариантов. Подобная задача представляет предмет самостоятельного, весьма обширного и трудоемкого исследования по моделированию структуры поверхности силиката. Разумной альтернативой этим подходам представляется использование кластеров малых размеров, моделирующих непосредственно только саму силанольную группу. Силикагелевый кластер (ОH)4–Si был выбран нами в качестве модели силиката. Это позволило упростить проведение расчетов и надежно воспроизвести свойства поверхностных структур, имеющих локальный характер.
Учитывая свойства ОН-групп, в качестве реагента, способного активно взаимодействовать с ними, можно использовать легкогидролизующиеся вещества [6], к таким можно отнести и хлорид железа (III). При обработке силиката хлоридом железа образуется полисиликат оксихлорида железа (III). Данное соединение использовали как исходный компонент для прививки серы и получения полисульфида силиката железа (продукт взаимодействия тройной системы Si(OH)4–FeCl3–Sn) .
Для построения модели полисульфида силиката железа в начальном приближении использовали упрощенную модель, в которой хлорид железа закреплялся на один кремнекислородный тетраэдр. Четвертая координация атома железа формируется за счет образования связи Fe–S. При введении в систему серы происходит взаимодействие с железом по донорно-акцепторному механизму за счет вакантных d-орбиталей системы диоксид кремния – хлорид железа и неподеленных электронных пар серного бирадикала с образованием полисульфида силиката железа по схеме:
Представленная схема взаимодействия полисиликата оксихлорида железа с серой является упрощенной (с целью снижения времени расчета). Мы предполагаем, что данные, полученные для упрощенных моделей, могут быть соотнесены и к большим полисиликатным комплексам, в которых хлорид железа закрепляется на трех кремнекислородных тетраэдрах.
Рассмотрим структуры комплексов, формирующихся при предполагаемом механизме взаимодействия. На рис. 1 представлен вариант присоединения серы в виде бирадикала к поверхности модифицированного силикагелевого кластера Si(OH)4. Следует отметить, что атом серы в данных комплексах рассматривается как синглет, сульфидный комплекс в целом является дублетом. Связь Fe–S, образованная одним атомом серы, является наиболее прочной (рис. 1). Далее с увеличением числа атомов серы в цепи с S1 до S4 длина связи Fe–S постепенно увеличивается, а энергия связи снижается (длина связи – с 198.7 до 215.8 пм, энергия – с 293.5 до 153.7 кДж/моль).
Рис. 1.
Структуры полисульфидов силикатов железа; в числителе – длина связи, пм; в знаменателе – энергия связи, кДж/моль.
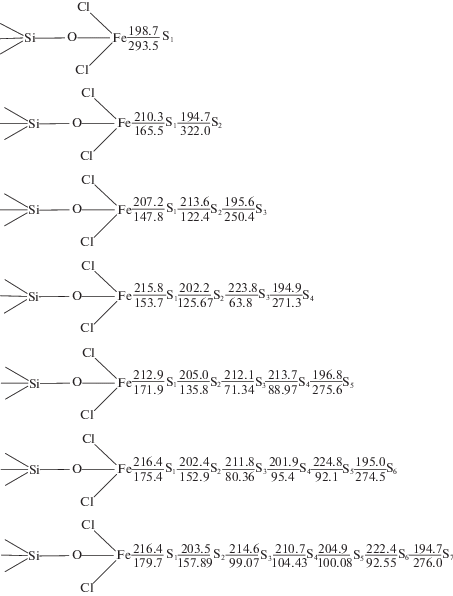
При дальнейшем наращивании серного радикала связь Fe–S стабилизируется (~170 кДж/моль и 214 пм). Ослабление связи наблюдается также внутри серных цепочек. Так, связь S2–S3 в молекуле с четырьмя атомами серы ослабевает по сравнению со связью S1–S2 на 62 кДж/моль; ослабление S2–S3 и S3–S4 при присоединении S5 – на 64.4 и 46.8 кДж/моль по сравнению с S1–S2. В случае присоединения гексасерного радикала связи S2–S3, S3–S4 и S4-S5 ослабевают по сравнению со связью S1–S2 на 72.6, 57.8 и 60.8 кДж/моль соответственно. При взаимодействии семиатомного серного радикала с железом ярко выраженного альтернирования связи S–S внутри серного цикла не наблюдается. Энергия на разрыв средних связей составляет ~100 кДж/моль. Во всех случаях присоединения серного радикала от S2 до S7 к модифицированной поверхности силикагелевого кластера крайние связи являются достаточно прочными и не уступают ближайшим к железу связям.
При закреплении длинных серных радикалов на железе, цепочка “скручивается” и перегруппировывается в структуру короны, характерную для циклооктасеры S8 – термодинамически стабильную молекулярную форму серы. Возможно, этим и объясняется стабильность комплекса, содержащего радикал S7, как наиболее близкого по строению к структуре “корона”.
По величине абсолютной энергии более выгодно присоединение циклических серных циклов. Рассмотрим структуру комплексов, формирующихся при взаимодействии циклической серы S6 и S8 с модифицированной поверхностью силикагелевого кластера. Для сравнения на рис. 2 представлена оптимизированная геометрия цикло-S6 и -S8. В случае присоединения циклических молекул S6 и S8 в виде кресла и короны (рис. 2) происходит ослабление связей внутри цикла. Ближайшие к железу связи S – S удлиняются с 210.4 до 224 пм и с 209.5 до 220.7 пм, наблюдается некоторое альтернирование связей в цикле и искажение двугранных углов.
Все смоделированные продукты образуются при взаимодействии в системе Si(OH)4–FeCl3–Sn. Однако поскольку авторами доказана склонность серы к полимеризации в присутствии хлорида железа при исследовании реологических свойств серы [7], можно ожидать преобладание длинных серных цепочек (S7, S8). Сера в конце серной цепочки чрезвычайно активна и может взаимодействовать с подобным атомом серы, прикрепленным к поверхности модифицированного силикагелевого кластера. Таким образом, происходит сшивка двух силикагелевых кластеров, подобно сшивке в каучуках, с формированием поперечных связей. Учитывая вывод, сделанный при моделировании структуры полисульфида силиката железа о предпочтительном содержании полимерной серы, в данном случае тоже следует ожидать наличия длинных серных цепей. При этом сульфидные комплексы рассматривали с мультиплетностью один (синглеты). Сравнивали длины и энергии связей внутри серных цепочек при различных механизмах сшивки (рис. 3).
Рис. 3.
Модели полисульфидов, образующихся при сшивке серной цепочки по атому кремния, по атому кислорода и по железу: а – шестью; б – семью, в – восьмью атомами серы; в числителе – длина связи, пм; в знаменателе – энергия связи, кДж/моль.
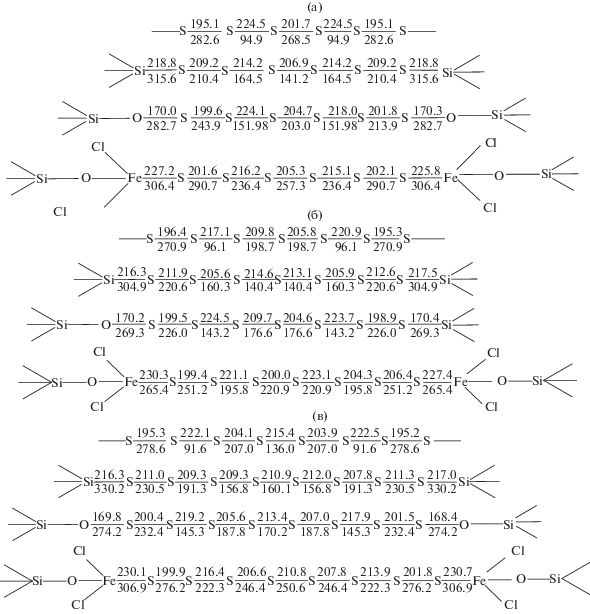
При сшивке двух силикагелевых кластеров отмечается высокая прочность связи как внутри серной цепочки, так и в крайней связи Fe–S, что свидетельствует о способности железа удерживать длинные серные цепочки без ослабления всех связей.
При взаимодействии модифицированного хлоридом железа (III) силикагелевого кластера с серой образуются сульфиды переменного состава, содержащие как два атома серы, так и полимерные серные цепочки.
Для учета влияния не только поверхностных Si–OH-групп, но Si–O–Si-групп объемной фазы проводили расчеты на модели многоатомного кластера полисиликата (на трех силикагелевых кластерах, рис. 4). Как и в случае упрощенной модели (на одном силикагелевом кластере) смоделированные продукты являются термодинамически устойчивыми с прочными связями. При сшивке двух силикагелевых кластеров серой S4 образуется прочный комплекс: центральная связь S2–S3 существенно упрочняется (201.7 кДж/моль), что указывает на хорошую сшивающую способность серы.
Рис. 4.
Продукт взаимодействия циклической молекулы серы с модифицированным полисиликатом и сшивка силикагелевых кластеров серой S4.
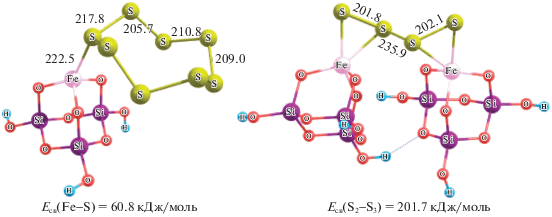
Таким образом, хлорид железа выступает своеобразным мостиком между силикагелевым кластером и серой с образованием полисульфида силиката железа, который может служить основой для получения материалов строительного назначения. При получении подобных материалов сера в составе смоделированного полисульфида силиката железа способна образовывать поверхностный гидрофобный слой, защищая материал от разрушения в водной среде, и формировать плотный беспористый материал [8, 9].
Список литературы
Бараева Л.Р., Ахметова Р.Т., Хацринов А.И., Юсупова А.А. Технология сульфида полисиликата железа на основе серы нефтехимического комплекса и аморфного диоксида кремния. Монография. Казань: Изд-во КНИТУ, 2013. 80 с.
Бараева Л.Р., Ахметова Р.Т., Хацринов А.И., Сабахова Г.И. // Вестник Казанского технологического университета. 2013. № 24. С. 261.
Бараева Л.Р. и др. // Фундаментальные исследования. 2014. № 11 (Часть 10). С. 2125.
Малыгин А. А. // Журн. прикл. химии. 1996. Т. 69. № 10. С. 1585.
Артемьев Ю.М. Физико-химические свойства полисиликатов железа, синтезированных методом химической сборки: Дис. …канд. хим. наук. Л.: Ин-т, 1984. 159 с.
Лисичкин Г.В. Модифицированные кремнеземы в сорбции, катализе и хроматографии. М.: Химия, 1986. 248 с.
Бараева Л.Р. и др. // Фундаментальные исследования. 2015. № 2. С. 4855.
Орловский Ю.И. // Бетон и железобетон. 1993. № 4. С. 27.
Юсупова А.А., Бараева Л.Р., Ахметова Р.Т., Хацринов А.И. // Сборник материалов XIX Международной научно-технической конференции “Актуальные проблемы строительства, строительной индустрии и промышленности”. Тула, 28–29 июня, 2018. С. 181.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии




