Журнал физической химии, 2019, T. 93, № 6, стр. 895-899
Теоретическое исследование электрохимического восстановления серы в литий-серных ячейках: образование октасульфида лития
Э. М. Хамитов a, *, Е. В. Кузьмина a, **, Д. В. Колосницын a, В. С. Колосницын a
a Российская академия наук, Уфимский федеральный исследовательский центр,
Уфимский институт химии
450054 Уфа, Россия
* E-mail: khamitovem@gmail.com
** E-mail: kuzmina@anrb.ru
Поступила в редакцию 28.09.2018
После доработки 15.11.2018
Принята к публикации 15.11.2018
Аннотация
Представлены результаты квантово-химического моделирования первой стадии электрохимического восстановления серы S8 до Li2S8. Оценены тепловые эффекты образования всех возможных интермедиатов электрохимического восстановления серы до октасульфида лития. Установлена последовательность этих элементарных реакций. Структура и свойства образующихся интермедиатов охарактеризованы методом AIM.
Электрохимическая система Li–S – одна из наиболее перспективных систем для создания электрохимических аккумуляторов с рекордными энергетическими характеристиками. Теоретическая удельная энергия электрохимической системы Li–S по разным оценкам составляет 2300–2600 Вт ч/кг [1, 2], поэтому ожидается что литий-серные аккумуляторы могут обладать удельной энергией порядка 600–700 Вт ч/кг. К тому же сера доступна (16-й элемент по распространенности в земной коре), дешева и безопасна для человека и окружающей среды. Поэтому интерес к исследованиям процессов в системе литий–сера неуклонно возрастает.
Механизм электрохимических превращений серы и ее соединений в литий-серных аккумуляторах исследуется как экспериментальными [3–9], так и теоретическими методами [10–13]. Несмотря на большое количество опубликованных работ, механизм электрохимического восстановления серы при разряде литий-серных ячеек детально не изучен: работы носят разрозненный и иногда противоречивый характер. Причина этого – многостадийность процесса электрохимического восстановления серы и многообразие промежуточных продуктов ее восстановления.
На первой стадии электрохимического восстановления октета серы происходит электрохимическое восстановление серы до октасульфида лития:
(1)
${{{\text{S}}}_{{\text{8}}}} + {\text{2L}}{{{\text{i}}}^{ + }} + {\text{2}}{{{\text{e}}}^{ - }} \to {\text{L}}{{{\text{i}}}_{{\text{2}}}}{{{\text{S}}}_{{\text{8}}}}.$На последующих стадиях образовавшийся октасульфид лития через ряд промежуточных соединений электрохимически восстанавливается до сульфида лития:
(2)
${\text{L}}{{{\text{i}}}_{{\text{2}}}}{{{\text{S}}}_{n}} + {\text{2}}(n - {\text{1}}){\text{L}}{{{\text{i}}}^{ + }} + {\text{2}}(n - {\text{1}}){{{\text{e}}}^{ - }} \to {\text{L}}{{{\text{i}}}_{{\text{2}}}}{\text{S}}.{\text{ }}$Цель данной работы – исследование механизма электрохимического восстановления серы. Подробно рассмотрена первая стадия электрохимического восстановления S8 до Li2S8. Для понимания механизма исследуемого процесса проанализированы все возможные промежуточные стадии, включающие в себя перенос электрона(ов) и взаимодействие промежуточных продуктов с катионами Li+.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Квантово-химические расчеты проводили с использованием программного пакета Gaussian 09 [14]. Поиск равновесных геометрических параметров и расчет энергетических характеристик серы S8 и возможных промежуточных продуктов ее восстановления выполняли без учета сольватации. Процедуру оптимизации и расчет колебательной задачи выполняли методом TPSS/aug-cc-pVTZ для корректного описания анионов, а электронную корреляцию учитывали единичным расчетом на уровне теории возмущения объединенных кластеров CCSD (CCSD/aug-cc-pVTZ//TPSS/aug-cc-pVTZ). Все структуры, рассчитанные в данной работе, являются стационарными точками на поверхности потенциальной энергии (ППЭ), что доказано решением колебательной задачи. Частицы с неспаренным электроном рассчитывали, используя неограниченный метод Хартри–Фока/Кона–Шама. Для визуализации результатов моделирования использовали программу VMD [15].
Энтальпию реакции ΔH и сродство к электрону EA определяли как разность абсолютных энтальпий конечных и исходных реагентов по закону Гесса. Абсолютную энтальпию рассчитывали при стандартных условиях (Т = 298 K). Величины изменения энтальпии реакций приведены с учетом термической поправки и энергии нулевых колебаний. Анализ волновой функции на уровне теории QTAIM Бейдера для стационарных точек проводили с помощью программы AIMAll [16]. Для построения исходных структур интермедиатов реакции восстановления серы до октасульфида лития, содержащих катионы лития, проведены количественные оценки электростатического потенциала реагентов по методике, описанной в работе [17].
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
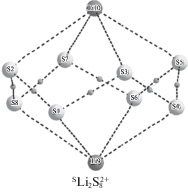
В качестве исходной структуры молекулы серы использовали циклическую молекулу S8 с группой симметрии D4d по номенклатуре Шенфлиса. Для определения области пространства координации катиона лития на молекуле серы рассчитывали трехмерную карту электростатического потенциала (ESP) октета серы S8 (рис. 1).
Рис. 1.
Карта ESP (ккал/моль) молекулы S8 и катиона $^{{\text{S}}}{\text{LiS}}_{8}^{ + }$. Черными и белыми точками отображены экстремумы на поверхности.

Установлено, что наиболее вероятными областями пространства будут точки минимумов со значением ESP = –7.35 ккал/моль. Ввиду симметрии молекулы серы таких экстремумов всего восемь, по четыре с каждой стороны кольца молекулы. При построении исходной структуры комплекса серы с катионом лития последний помещали в соответствующую область пространства – в центр пересечения четырех экстремумов. Аналогичным образом, для построения комплекса, содержащего второй катион лития, построили и проанализировали карту ESP для катиона $^{{\text{S}}}{\text{LiS}}_{8}^{ + }$ (рис. 1).
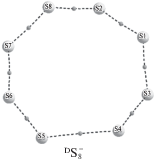
Из данных расчетов (табл. 1) следует деформация структуры S8 при добавлении электронов. Так, при добавлении одного электрона к S8 образуется анион $^{{\text{D}}}{\text{S}}_{8}^{ - }$, в структуре которого связь S4–S5 удлиняется по сравнению с исходной молекулой на 0.781 Å; остальные длины связей S–S увеличиваются менее значительно – максимальное значение ≥0.028 Å. Наличие восьми критических точек связей в структуре $^{{\text{D}}}{\text{S}}_{8}^{ - }$ свидетельствует о том, что на этом этапе не произошло ни одного разрыва связи S–S.
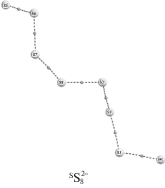
При добавлении второго электрона в дианионе $^{{\text{S}}}{\text{S}}_{8}^{ - }$ происходят разрыв одной связи S–S и трансформация кольца в спираль; в дианионе $^{{\text{T}}}{\text{S}}_{8}^{{ - 2}}$ происходит синхронный разрыв двух связей S–S, конечный продукт – пара частиц ${\text{S}}_{4}^{{ - 1}}$.
Добавление катионов лития к четырем состояниям серы SS8, $^{{\text{D}}}{\text{S}}_{8}^{ - }$, $^{{\text{S}}}{\text{S}}_{8}^{{ - 2}}$ и $^{{\text{T}}}{\text{S}}_{8}^{{ - 2}}$ приводит к следующим изменениям: при добавлении первого катиона Li+ к $^{{\text{S}}}{\text{S}}_{8}^{{ - 2}}$ исходная симметрия кольца серы не изменяется, наблюдается увеличение всех длин связей S–S на 0.012 Å. Атом лития образует четыре эквивалентные связи с серой (Li–S) длиной 2.618 Å. Последующее присоединение второго катиона лития не приводит к деформации структуры и нарушению группы симметрии. Добавление катионов лития к анионам $^{{\text{D}}}{\text{S}}_{8}^{{ - 1}}$ и $^{{\text{S}}}{\text{S}}_{8}^{{ - 2}}$ приводит к разрыву одной из связей S–S и образованию связей Li–S, полисульфидная цепь при этом не разрывается. В отличие от анионов $^{{\text{D}}}{\text{S}}_{8}^{ - }$ и $^{{\text{S}}}{\text{S}}_{8}^{{ - 2}}$ в анионе $^{{\text{T}}}{\text{S}}_{8}^{{ - 2}}$ изменения исходного кольца серы более существенны – при добавлении первого катиона лития наблюдается разрыв двух связей S–S с образованием комплекса, состава (S3 + + Li + S5)2–, а при добавлении двух катионов образуется комплекс (S4 + Li2 + S4)2–.
На основе анализа тепловых эффектов (табл. 2) возможных элементарных стадий электрохимического восстановления серы до октасульфида лития можно предположить следующий наиболее вероятный механизм:
Таблица 2.
Тепловой эффект и сродство к электрону возможных элементарных стадий электрохимического восстановления серы до октасульфида лития (ккал/моль)
| Процесс | EA | Процесс | ΔrH |
|---|---|---|---|
| SS8 + e– → DS$_{8}^{ - }$ | –135.07 | SS8 + Li+ → SLiS$_{8}^{ + }$ | –148.91 |
| DS$_{8}^{ - }$ + e– → SS$_{8}^{{ - 2}}$ | 22.58 | SLiS$_{8}^{ + }$ + Li+ → SLi2S$_{8}^{{2 + }}$ | 205.91 |
| DS$_{8}^{ - }$ + e– → TS$_{8}^{{ - 2}}$ | 202.82 | DS$_{8}^{ - }$ + Li+ → DLiS8 | –566.53 |
| SLiS$_{8}^{ + }$ + e– → DLiS8 | –552.70 | DLiS8 + Li+ → DLi2S$_{8}^{ + }$ | –186.96 |
| DLiS8 + e– → SLiS$_{8}^{ - }$ | –353.31 | SS$_{8}^{{ - 2}}$ + Li+ → SLiS$_{8}^{ - }$ | –942.42 |
| DLiS$_{8}^{ - }$ + e– → TLiS8–2 | –285.99 | SLiS$_{8}^{ - }$ + Li+ → SLi2S8 | –557.74 |
| SLi2S8 + e– → DLi2S$_{8}^{ - }$ | –945.57 | TS$_{8}^{{ - 2}}$ + Li+ → TLiS$_{8}^{ - }$ | –1055.34 |
| DLi2S$_{8}^{ - }$ + e– → SLi2S8–2 | –724.09 | TLiS$_{8}^{ - }$ + Li+ → TLi2S8 | –540.59 |
| DLi2S$_{8}^{ - }$ + e– → TLi2S8–2 | –639.62 |
1) $^{{\text{S}}}{{{\text{S}}}_{{\text{8}}}} + {\text{L}}{{{\text{i}}}^{ + }} \to \,{{\,}^{{\text{S}}}}{\text{LiS}}_{8}^{ + },$
2) $^{{\text{S}}}{\text{LiS}}_{8}^{ + } + {{{\text{e}}}^{ - }} \to \,{{\,}^{{\text{D}}}}{\text{Li}}{{{\text{S}}}_{{\text{8}}}},$
3) $^{{\text{D}}}{\text{Li}}{{{\text{S}}}_{{\text{8}}}} + {{{\text{e}}}^{ - }} \to \,{{\,}^{{\text{S}}}}{\text{LiS}}_{8}^{ - },$
4) $^{{\text{S}}}{\text{LiS}}_{8}^{ - } + {\text{L}}{{{\text{i}}}^{ + }} \to \,{{\,}^{{\text{S}}}}{\text{L}}{{{\text{i}}}_{{\text{2}}}}{{{\text{S}}}_{{\text{8}}}}.$
Таким образом, выполнены квантово-химические расчеты интермедиатов электрохимического восстановления серы до октасульфида лития. Идентифицированы топологические характеристики всех стационарных точек на поверхности потенциальной энергии моделируемых процессов. В рамках выбранной модели на основании термодинамических расчетов установлен наиболее вероятный реакционный путь восстановления октета серы: первым актом является взаимодействие серы S8 с катионом Li+; вторым – принятие электрона частицей $^{{\text{S}}}{\text{LiS}}_{8}^{ + }$; третьим – присоединение электрона частицей DLiS8 и заключительная стадия – присоединение катиона лития к частице $^{{\text{S}}}{\text{LiS}}_{8}^{ + }$ с образованием молекулы Li2S8.
Работа выполнена по теме № АААА-А17-117011910031-7 государственного задания и РНФ (проект № 17-73-20115). Расчеты выполнены на кластерном суперкомпьютере ЦКП “Химия” УфИХ РАН. За счет средств гранта РНФ выполнены квантово-химические расчеты тепловых эффектов элементарных стадий электрохимического восстановления серы до октасульфида лития. В рамках выполнения государственного задания выполнен AIM анализ.
Список литературы
Manthiram A., Fu Y., Chung S.H., Zu Ch., Su Y.S. // Chem. Rev. 2014. V. 114. I. 23. P. 11751.
Шиппер Ф., Аурбах Д. // Электрохимия. 2016. Т. 52. № 12. С. 1229.
Li Z., Yuan L., Yi Z. et al. // Adv. Energy Materials. 2014. V. 4. № 7. P. 1301473.
Diao Y., Xie K., Xiong S. et al. // J. Electrochem. Soc. 2012. V. 159. № 4. P. A421
Cuisinier M., Hart C., Balasubramanian M. et al. // Adv. Energy Materials. 2015. V. 5. I. 16. P. 1401801.
Hagena M., Schiffelsb P., Hammera M. et al. // J. Electrochem. Soc. 2013. V. 160. № 8. P. A1205.
Bondarenko E.A., Mazanik A.V., Streltsov E.A. et al. // Materials Science and Engineering B. 2015. V. 202. P. 61.
Zhu W., Paolella A., Kim C.-S. et al. // Sustainable Energy Fuels. 2017. V. 1. № 4. P. 737.
Waluś S., Barchasz C., Bouchet R. et al. // Adv. Energy Materials. 2015. V. 5. № 16. P. 1500165.
Assary R.S., Curtiss L.A., Moore J.S. // J. Phys. Chem. C. 2014. V. 118. № 22. P. 11545.
Park H., Kumar N., Melander M. et al. // Chemistry of Materials. 2018. V. 30. P. 915.
Wang L., Zhang T., Yang S. et al. // J. Energy Chem. 2013. V. 22. № 1. P. 72
Chen J.-J., Yuan R.-M., Feng J.-M. et al. // Chemistry of Materials. 2015. V. 27. № 6. P. 2048.
Gaussian 09, Revision C, M.J. Frisch, G.W. Trucks, H.B. Schlegel, G.E. Scuseria, M.A. Robb, J.R. Cheeseman, G. Scalmani, V. Barone, G.A. Petersson, H. Nakatsuji, X. Li, M. Caricato, A. Marenich, J. Bloino, B.G. Janesko, R. Gomperts, B. Mennucci, H.P. Hratchian, J.V. Ortiz, A.F. Izmaylov, J.L. Sonnenberg, D. Williams-Young, F. Ding, F. Lipparini, F. Egidi, J. Goings, B. Peng, A. Petrone, T. Henderson, D. Ranasinghe, V.G. Zakrzewski, J. Gao, N. Rega, G. Zheng, W. Liang, M. Hada, M. Ehara, K. Toyota, R. Fukuda, J. Hasegawa, M. Ishida, T. Nakajima, Y. Honda, O. Kitao, H. Nakai, T. Vreven, K. Throssell, J.A. Montgomery, Jr., J.E. Peralta, F. Ogliaro, M. Bearpark, J.J. Heyd, E. Brothers, K.N. Kudin, V.N. Staroverov, T. Keith, R. Kobayashi, J. Normand, K. Raghavachari, A. Rendell, J.C. Burant, S.S. Iyengar, J. Tomasi, M. Cossi, J.M. Millam, M. Klene, C. Adamo, R. Cammi, J.W. Ochterski, R.L. Martin, K. Morokuma, O. Farkas, J.B. Foresman, and D.J. Fox, Gaussian, Inc., Wallingford CT, 2016.
Humphrey W., Dalke A., Schulten K. // J. Mol. Graphics. 1996. V. 14. № 1. P. 33.
AIMAll (Version 17.11.14), Todd A. Keith, TK Gristmill Software, Overland Park KS, USA, 2017 (aim.tkgristmill.com)
Lu T., Manzetti S. // Struct. Chem. 2014. V. 25. № 5. P. 1521.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии