Журнал физической химии, 2019, T. 93, № 6, стр. 818-826
Масс-спектрометрическое исследование процессов испарения перовскита
a Российская академия наук, Институт геохимии и аналитической химии им. В.И. Вернадского
Москва, Россия
* E-mail: sergey.shornikov@gmail.com
Поступила в редакцию 02.09.2018
После доработки 03.10.2018
Принята к публикации 15.10.2018
Аннотация
Высокотемпературным масс-спектрометрическим эффузионным методом Кнудсена изучено испарение перовскита CaTiO3 в области температур 1700–2200 K. В газовой фазе над перовскитом идентифицированы молекулярные компоненты, типичные для простых оксидов, и в незначительном количестве сложный газообразный оксид CaTiO3. Впервые определенные значения парциальных давлений пара молекулярных компонентов, содержащихся в газовой фазе над перовскитом, сопоставлены с таковыми, соответствующими простым оксидам, что показывает преимущественное влияние кальциевой составляющей перовскита на характер его испарения.
Титанат кальция CaTiO3 (перовскит) – сравнительно редкий минерал, являющийся перспективным материалом в качестве матриц для надежного и долговременного хранения актиноидов и их редкоземельных аналогов, присутствующих в радиоактивных отходах [1]. Перовскит представляет особый интерес для петрологии, а также для космохимических исследований как минерал, входящий в состав вещества тугоплавких Ca–Al-включений, часто встречающихся в углистых хондритах и являющихся самым ранним объектом Солнечной системы с необычными изотопными характеристиками [2–5]. Помимо перовскита в системе CaO–TiO2 установлено существование еще двух титанатов кальция – Ca3Ti2O7 [6] и Ca4Ti3O10 [7] или Ca5Ti4O13 [8], плавящихся инконгруэнтно.
Процессы испарения и термодинамические свойства простых оксидов – CaO и TiO2 – детально рассмотрены в справочных изданиях [9–12].
Газовая фаза над оксидом кальция состоит из молекулярных компонентов: (O), (O2), (O3), (O4), (Ca), (Ca2) и (CaO), образование которых может происходить по следующим реакциям:
(здесь и далее – квадратными скобками обозначена конденсированная фаза, круглыми скобками – газовая).В составе газовой фазы над оксидом титана присутствуют подобные молекулярные формы пара: (O), (O2), (O3), (O4), (Ti), (Ti2), (Ti3), (TiO) и (TiO2), образующиеся по похожим реакциям:
Балдуччи и др. [13] масс-спектрометрическим эффузионным методом Кнудсена обнаружили в газовой фазе над титанатом кобальта CoTiO3 в области температур 2210–2393 K молекулы (Ti2O3) и (Ti2O4), которые могут участвовать в следующих равновесиях:
(12)
$2({\text{Ti}}{{{\text{O}}}_{{\text{2}}}}) = ({\text{T}}{{{\text{i}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{4}}}}),$(13)
$({\text{T}}{{{\text{i}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{4}}}}) = ({\text{T}}{{{\text{i}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}}) + ({\text{O}}).$Свойства газовой фазы над перовскитом изучены не так подробно. Краткая сводка условий проведения немногочисленных экспериментов и результатов высокотемпературных исследований испарения перовскита [3–5, 14–21] приведена в табл. 1.
Таблица 1.
Условия проведения экспериментов и основные результаты исследования процессов испарения перовскита [3–5, 14–21]
| Система | Материал контейнера | T, K | Наблюдаемый компонент газовой фазы | Основные результаты исследований | Ссылка, год |
|---|---|---|---|---|---|
| CaTiO3 | – | 4890 | O, Ca, CaO, Ti, TiO, CaTiO3 | [14], 1974 | |
| CaTiO3–TiO2–Ti2O3 | Mo | 1900–2200 | Ca, Ti, TiO, TiO2 | ${{p}_{{{\text{O}},\;2150}}}$, ${{a}_{{{\text{Ti}}{{{\text{O}}}_{{\text{2}}}},2150}}}$, $\Delta G_{{2150}}^{m}$ | [15], 1981 |
| CaTiO3–CaSiO3 | Mo | 1700–2500 | Ca, CaO, TiO, TiO2, SiO, SiO2, MoO2, MoO3 | ${{a}_{{i,2100}}}$, $\Delta G_{{2100}}^{m}$ | [16, 17], 2000 |
| CaO–TiO2–SiO2 | Mo | 1850–2350 | Ca, TiO, TiO2, SiO, SiO2, MoO2, MoO3 | ${{a}_{{{\text{Si}}{{{\text{O}}}_{{\text{2}}}},1850}}}$ | [18], 2000 |
| CaСO3 + TiO2 | W | 2287–2466 | CaO, TiO, TiO2, CaTiO3 | ${{p}_{{{\text{CaO}}}}}$, ${{p}_{{{\text{Ti}}{{{\text{O}}}_{{\text{2}}}}}}}$, ${{p}_{{{\text{CaTi}}{{{\text{O}}}_{{\text{3}}}}}}}$, ${{\Delta }_{{\text{f}}}}{{H}_{{298}}}({\text{CaTi}}{{{\text{O}}}_{{\text{3}}}})$, ${{\Delta }_{{{\text{at}}}}}{{H}_{{298}}}({\text{CaTi}}{{{\text{O}}}_{{\text{3}}}})$ | [21], 2001 |
| CaTiO3–SiO2 | Mo | 1582–2529 | O, Ca, TiO, SiO | ${{a}_{{i,2100}}}$, $\Delta G_{{2100}}^{m}$ | [19], 2003 |
| CaO–TiO2–SiO2 | W | 1800–2200 | CaO, SiO, WO2, WO3 | ${{p}_{{{\text{CaO}},\;1981}}}$, ${{p}_{{{\text{Si}}{{{\text{O}}}_{{\text{2}}}},1981}}}$, ${{a}_{{{\text{CaO}},\;2057}}}$, ${{a}_{{{\text{Si}}{{{\text{O}}}_{{\text{2}}}},1981}}}$ | [20], 2004 |
| CaTiO3 | Ir | 2278 | – | ptot | [3–5], 1995–2014 |
Захаров и Протас [14], изучая эмиссию ионов с поверхности перовскита под воздействием лазерного излучения, идентифицировали в масс-спектрах пара помимо ионов, принадлежащих простым оксидам (O+, Ca+, CaO+, Ti+, TiO+), ион сложной молекулы (CaTiO3). Наличие этого иона авторы объясняют сходством процессов высокотемпературного испарения титанатов щелочно-земельных оксидов, что подтверждается составом наблюдаемых конденсатов (BaTiO3, SrTiO3 и CaTiO3), образующихся в подобных условиях [22, 23]. Соотношение интенсивностей ионных токов (Ii) в масс-спектрах пара над перовскитом, полученных при длительности лазерного импульса 800–1000 мкс с длиной волны 6943 Å и энергией 3–5 Дж, было следующим: ${{I}_{{\text{O}}}}$ : ${{I}_{{{\text{Ca}}}}}$ : ${{I}_{{{\text{CaO}}}}}$ : ${{I}_{{{\text{Ti}}}}}$ : ${{I}_{{{\text{TiO}}}}}$ : ${{I}_{{{\text{CaTi}}{{{\text{O}}}_{{\text{2}}}}}}}$ = = 0.41 : 100 : 0.17 : 4.32 : 0.54 : 0.05. Следует отметить, что иона TiO$_{2}^{ + }$ не наблюдалось в масс-спектре пара как над перовскитом CaTiO3, так и над рутилом TiO2. Это объясняется особенностью масс-спектрометрического эксперимента с применением лазера, в котором в масс-спектрах пара доминируют легкоионизирующиеся молекулярные формы и дискриминируются трудноионизирующиеся молекулы. Отмеченная селективность регистрируемых ионов в масс-спектрах пара в значительной степени ограничивает точность и применимость этого метода [24]. Вместе с тем, оценка температуры нагрева перовскита под действием лазерного излучения по данным [9] на основании возможного равновесия в газовой фазе:
составляет 4890 ± 70 K, что довольно приблизительно, однако не противоречит условиям проведения подобного рода масс-спектрометрических экспериментов с применением лазерного удара, находящихся в интервале 4000–6000 K.Банон и др. [15] методом дифференциальной масс-спектрометрии исследовали испарение 24 составов системы CaTiO3–Ti2O3–TiO2 из молибденовых эффузионных контейнеров (по Кнудсену) в интервале температур 1900–2200 K. Масс-спектры записывались при низком ионизирующем напряжении, равном 13 эВ, для того, чтобы избежать возможной фрагментации молекулярного иона TiO$_{2}^{ + }$ на осколочные ионы Ti+ и TiO+, которые также были молекулярными. Преобладающим компонентом газовой фазы над изученными составами был атомарный кальций. Сложный газообразный оксид (CaTiO3) обнаружен не был. Значения парциальных давлений пара (Ca), (TiO), (TiO2) и (O) над перовскитом при температуре 2150 K были рассчитаны с использованием термохимических данных [9] и приведены на рис. 1 в зависимости от обратной температуры (для удобства понимания температурная шкала отмасштабирована соответствующим образом).
Рис. 1.
Логарифмические зависимости парциальных давлений компонентов пара Ca (а), TiO (б), TiO2 (в) и O (г) над перовскитом (1–3) и оксидами кальция (4, 5, 5*) и титана (6–8, 8*) от обратной температуры, определенные масс-спектрометрическим эффузионным методом Кнудсена: 1 – в настоящей работе; 2 – Банон и др. [15]; 4 – Самойлова и Казенас [27]; 5 – Шорников [35]; 6 – Гровз и др. [36]; 7 – Берковиц и др. [29]; 8 – Казенас и Цветков [11]; и в вакуумной печи методом Ленгмюра: 3 – Жанг и др. [5]; а также рассчитанные: 5* и 8* – в настоящей работе на основании термохимических данных [9]. Вертикальными пунктирными линиями 9 и 10 обозначены точки плавления оксида титана и перовскита соответственно.
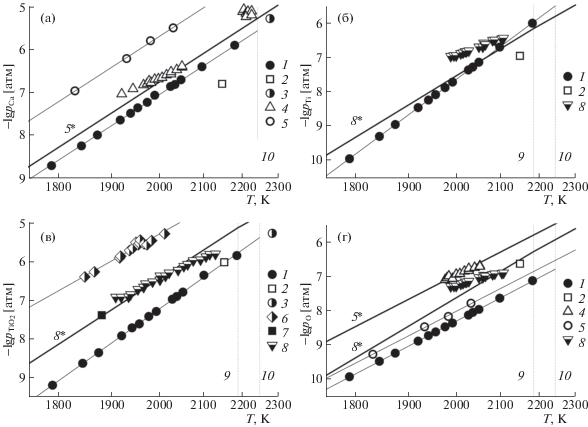
Не удалось обнаружить газообразный перовскит и в масс-спектрометрических исследованиях высокотемпературного испарения различных составов системы CaO–TiO2–SiO2 из молибденовых и вольфрамовых эффузионных контейнеров (по Кнудсену) в области температур 1700–2500 K [16–20], что, возможно, было связано либо с недостаточной для определения иона CaTiO$_{3}^{ + }$ чувствительностью использованной аппаратуры [16, 20], либо не было целью исследований [17–19].
Лопатин и Семенов [21] изучали испарение смеси карбоната кальция и диоксида титана из вольфрамовых контейнеров масс-спектрометрическим эффузионным методом Кнудсена в интервале температур 2100–2500 K. В масс-спектрах пара были обнаружены следующие ионы: Ca+, CaO+, Ti+, TiO+, TiO$_{2}^{ + }$ и CaTiO$_{3}^{ + }$. Найденные энергии появления ионов в масс-спектрах пара над рассматриваемой смесью позволили авторам установить молекулярную природу происхождения ионов Ca+, CaO+, TiO+, TiO$_{2}^{ + }$ и CaTiO$_{3}^{ + }$. Ион TiO+ содержал также фрагментарную составляющую от иона TiO$_{2}^{ + }$, а ион Ti+, по мнению авторов, был полностью фрагментарным. Энергия появления молекулярного иона CaTiO$_{3}^{ + }$ была определена равной 9 ± 1 эВ, в качестве стандарта использовалась энергия появления в масс-спектре пара иона золота. Величины парциальных давлений молекулярных форм пара (${{p}_{i}}$) были рассчитаны из сравнения с принятыми значениями парциального давления пара золота, взятых в качестве стандартных (${{p}_{s}}$), по соотношению [25]:
(15)
${{p}_{i}} = \frac{{{{I}_{i}}{{T}_{i}}}}{{{{I}_{s}}{{T}_{s}}}}{{p}_{s}}\frac{{{{\sigma }_{s}}{{\gamma }_{s}}{{\eta }_{s}}}}{{{{\sigma }_{i}}{{\gamma }_{i}}{{\eta }_{i}}}},$Рис. 2.
Логарифмические зависимости константы равновесия реакции (CaTiO3) = (CaO) + (TiO2) от обратной температуры, определенные масс-спектрометрическим эффузионным методом Кнудсена: 1 – в настоящей работе; 2 – Лопатин и Семенов [21]. Вертикальной пунктирной линией 3 обозначена точка плавления перовскита.

Дэвис и др. [3–5] изучали изотопное фракционирование кальция и титана при испарении расплава перовскита, подвешенного на иридиевой проволоке в вакуумной печи, при температуре 2278 K (по Ленгмюру). Изменение состава остаточного расплава перовскита в процессе испарения свидетельствовало о преимущественном испарении из расплава кальциевой составляющей расплава. Из полученных данных можно было оценить общее давление пара над перовскитом, которое также представлено на рис. 1.
Таким образом, имеющаяся информация о процессах испарения перовскита довольно скудна и ограничивается установленным составом газовой фазы и разрозненными определениями величин парциального давления молекулярных форм и общего давления пара над перовскитом при различных температурах.
Цель настоящей работы – изучение высокотемпературных процессов испарения перовскита.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Испарение перовскита из молибденового эффузионного контейнера (по Кнудсену) было изучено масс-спектрометрическим методом в температурном интервале 1700–2200 K. Используемый серийный масс-спектрометр МИ–1201 был оснащен модифицированным ионным источником для проведения высокотемпературных исследований (до температуры 3000 K). Эффузионный контейнер нагревался переменным электрическим током, протекающим через его корпус, температура нагрева определялась оптическим пирометром ЭОП-66, с погрешностью, не превышающей 10 K при 2400 K. Общее давление остаточных газов в масс-спектрометре в области эффузионного контейнера не превышало 10–10 атм во всем температурном интервале исследований. Высокая чувствительность аппаратуры была достигнута близостью положения эффузионного контейнера к области ионизации источника при соосности молекулярного и ионного пучков. Конструкция разработанного ионного источника и методические особенности проведения масс-спектрометрического эксперимента детально описаны ранее [26].
Синтез перовскита был выполнен по керамической технологии с последующим рентгенофазовым и химическим анализом образцов. Для приготовления требуемого состава в качестве исходных материалов были использованы CaCO3 (марка “ос. ч.”) и TiO2 (марка “ос. ч.”), которые смешивались в шаровой яшмовой мельнице в ацетоне в течение 24 ч. После просушки полученная смесь кальцинировалась в силитовой печи на воздухе в течение 24 ч при температуре до 1300 K. После вторичного перетирания производился высокотемпературный обжиг образца в течение 24 ч при 1530 K.
В масс-спектрах пара над перовскитом при энергии ионизирующих электронов, равной 20 эВ, преобладали ионы TiO$_{2}^{ + }$, Ca+, TiO+ и O+, а также были обнаружены другие ионы, характерные для масс-спектров над индивидуальными оксидами [11]. В незначительном количестве наблюдался ион сложного газообразного оксида (CaTiO3), который приблизительно на четверть фрагментировал на ионы CaTi+, CaTiO+ и CaTiO$_{2}^{ + }$ (${{I}_{{{\text{CaTi}}}}}$ : ${{I}_{{{\text{CaTiO}}}}}$ : ${{I}_{{{\text{CaTi}}{{{\text{O}}}_{{\text{2}}}}}}}$ : ${{I}_{{{\text{CaTi}}{{{\text{O}}}_{{\text{3}}}}}}}$ = 6 : 10 : 13 : 100). Соотношение интенсивностей ионных токов в масс-спектрах пара над перовскитом при температуре 2182 K было следующим: ${{I}_{{{\text{Ca}}}}}$ : ${{I}_{{{\text{CaO}}}}}$ : ${{I}_{{{\text{Ti}}}}}$ : ${{I}_{{{\text{TiO}}}}}$ : ${{I}_{{{\text{Ti}}{{{\text{O}}}_{{\text{2}}}}}}}$ : ${{I}_{{{\text{CaTi}}{{{\text{O}}}_{{\text{3}}}}}}}$ : ${{I}_{{\text{O}}}}$ : ${{I}_{{{{{\text{O}}}_{{\text{2}}}}}}}$ = 100 : 0.06 : 0.07 : 54 : 100 : 0.12 : 0.73 : 0.02 и соответствовало таковому, наблюдаемому в том же интервале температур Самойловой и Казенасом [27] при испарении CaO из алундового контейнера и Семеновым [28] при испарении TiO2 из вольфрамового контейнера. Сопоставляя приведенный масс-спектр пара над перовскитом с полученным Захаровым и Протас [14], легко заметить различия, обусловленные характером ионизации молекулярных форм газовой фазы над перовскитом под действием электронного удара и эмиссии ионов с поверхности перовскита под действием лазерного излучения.
Наличие в масс-спектрах пара над перовскитом ионов MoO$_{i}^{ + }$ (i = 0–3) было обусловлено собственным испарением молибденового контейнера при высокой температуре:
а также взаимодействием перовскита с материалом контейнера (${{I}_{{{\text{Ti}}{{{\text{O}}}_{{\text{2}}}}}}}$ : ${{I}_{{{\text{Mo}}}}}$ : ${{I}_{{{\text{MoO}}}}}$ : ${{I}_{{{\text{Mo}}{{{\text{O}}}_{{\text{2}}}}}}}$ : ${{I}_{{{\text{Mo}}{{{\text{O}}}_{{\text{3}}}}}}}$ = = 100 : 0.8 : 2.6 : 7.3 : 0.6), что проявлялось в образовании газообразных оксидов молибдена, находящихся в следующих равновесиях: Заметим, что Берковиц и др. [29], исследуя при температуре 1881 K испарение оксида титана из молибденового вкладыша, вставленного в танталовый тигель, обнаружили превышение величин ${{p}_{{{\text{Mo}}{{{\text{O}}}_{{\text{2}}}}}}}$ в 10–102 раз по сравнению со значением ${{p}_{{{\text{Ti}}{{{\text{O}}}_{{\text{2}}}}}}}$. Величина ${{p}_{{{\text{Mo}}{{{\text{O}}}_{{\text{2}}}}}}}$ затем постепенно понижалась и сравнивалась с величиной ${{p}_{{{\text{Ti}}{{{\text{O}}}_{{\text{2}}}}}}}$, что значительно отличается от результатов настоящей работы. Причиной такого наблюдения, по-видимому, являлось низкое качество используемого в работе [29] материала вкладыша из молибдена (или его сплава), возможно, изготовленного по порошковой технологии из MoO3, восстановленного до металлического молибдена при температурах около 1300 K, что и могло привести к такому превышению значений ${{p}_{{{\text{Mo}}{{{\text{O}}}_{{\text{2}}}}}}}$ и к их последующему понижению по мере испарения MoO3 с поверхностных слоев материала вкладыша.Энергии появления ионов в масс-спектрах пара над перовскитом были определены методом Уоррена [30] и соответствовали принятым значениям энергий ионизации атомов и молекул [31], типичных для простых оксидов. Энергия появления иона CaTiO$_{3}^{ + }$ в масс-спектрах пара над перовскитом была равна 8.5 ± 0.6 эВ (в качестве стандарта использовалась энергия появления в масс-спектре пара иона серебра) и соответствовала полученной Лопатиным и Семеновым [21]. Монотонный ход кривой эффективности ионизации молекулы (CaTiO3) не выявлял изломов, характерных для процессов значительной фрагментации, что соответствовало наблюдаемому масс-спектру иона CaTiO$_{3}^{ + }$, рассмотренного выше.
Установленный молекулярный состав газовой фазы над перовскитом свидетельствовал о преимущественном испарении перовскита по реакциям (1), (2), (4), (7), (8) и (9), типичных для испарения индивидуальных оксидов [9–12]. Присутствие в незначительном количестве в газовой фазе над перовскитом молекулярной формы (CaTiO3) показывало возможность протекания следующей гетерогенной реакции:
Величины парциальных давлений компонентов газовой фазы над перовскитом были определены по уравнению Герца–Кнудсена, записанному в следующем виде [32]:
(22)
${{p}_{i}} = {{K}_{\alpha }}\frac{{{{q}_{i}}}}{{{{s}_{{or}}}{{C}_{{or}}}t}}\sqrt {\frac{{2\pi RT}}{{{{M}_{i}}}}} ,$(23)
${{K}_{\alpha }} = \frac{1}{{{{C}_{{or}}}}} + {{s}_{{or}}}\frac{{1 - {{C}_{c}}{{\alpha }_{i}}}}{{{{S}_{v}}{{\alpha }_{i}}{{C}_{c}}}},$Рассчитанные по соотношениям (22) и (23) парциальные давления компонентов газовой фазы над перовскитом с погрешностью, не превышающей 8%, приведены в табл. 2. Парциальные давления атомарного кислорода (табл. 3), определенные по этим соотношениям, удовлетворительно соответствовали рассчитанным из термохимических данных [9] о константах равновесия Kr(T) возможных реакций (2), (4), (8), (9) и (20), протекающих в газовой фазе над перовскитом по следующим соотношениям:
(26)
${{p}_{{\text{O}}}} = \frac{{{{p}_{{{\text{Ti}}{{{\text{O}}}_{2}}}}}}}{{{{p}_{{{\text{TiO}}}}}}}{{K}_{8}}(T),$(28)
${{p}_{{\text{O}}}} = \frac{{{{p}_{{{\text{Mo}}{{{\text{O}}}_{{\text{3}}}}}}}}}{{{{p}_{{{\text{Mo}}{{{\text{O}}}_{{\text{2}}}}}}}}}{{K}_{{20}}}(T).$Таблица 2.
Парциальные давления компонентов газовой фазы над перовскитом (атм)
| T, K | ${{p}_{{{\text{Ca}}}}}$ | ${{p}_{{{\text{CaO}}}}}$ | ${{p}_{{{\text{Ti}}}}}$ | ${{p}_{{{\text{TiO}}}}}$ | ${{p}_{{{\text{Ti}}{{{\text{O}}}_{{\text{2}}}}}}}$ | ${{p}_{{{{{\text{O}}}_{2}}}}}$ | ${{p}_{{{\text{CaTi}}{{{\text{O}}}_{{\text{3}}}}}}}$ |
|---|---|---|---|---|---|---|---|
| 1791 | 2.08 × 10–9 | – | – | 1.16 × 10–10 | 6.19 × 10–10 | – | – |
| 1845 | 5.96 × 10–9 | – | – | 5.09 × 10–10 | 2.28 × 10–9 | – | – |
| 1875 | 1.07 × 10–8 | – | – | 1.12 × 10–9 | 4.31 × 10–9 | 6.28 × 10–12 | – |
| 1920 | 2.37 × 10–8 | 3.93 × 10–12 | – | 3.43 × 10–9 | 1.17 × 10–8 | 1.23 × 10–11 | – |
| 1941 | 3.39 × 10–8 | 7.06 × 10–12 | – | 5.65 × 10–9 | 1.89 × 10–8 | 1.85 × 10–11 | – |
| 1956 | 4.54 × 10–8 | 9.71 × 10–12 | 4.56 × 10–12 | 8.09 × 10–9 | 2.40 × 10–8 | 2.45 × 10–11 | 1.12 × 10–12 |
| 1976 | 6.11 × 10–8 | 1.41 × 10–11 | 7.96 × 10–12 | 1.29 × 10–8 | 3.73 × 10–8 | 3.56 × 10–11 | 2.28 × 10–12 |
| 1992 | 8.89 × 10–8 | 1.83 × 10–11 | 1.29 × 10–11 | 1.85 × 10–8 | 5.01 × 10–8 | 4.78 × 10–11 | 3.77 × 10–12 |
| 2027 | 1.42 × 10–7 | 3.37 × 10–11 | 3.30 × 10–11 | 4.14 × 10–8 | 1.04 × 10–7 | 8.93 × 10–11 | 9.66 × 10–12 |
| 2037 | 1.58 × 10–7 | 4.84 × 10–11 | 4.03 × 10–11 | 5.02 × 10–8 | 1.23 × 10–7 | 1.06 × 10–10 | 1.36 × 10–11 |
| 2051 | 2.04 × 10–7 | 6.24 × 10–11 | 5.78 × 10–11 | 6.90 × 10–8 | 1.60 × 10–7 | 1.35 × 10–10 | 2.30 × 10–11 |
| 2100 | 4.06 × 10–7 | 1.58 × 10–10 | 2.03 × 10–10 | 1.88 × 10–7 | 4.06 × 10–7 | 3.08 × 10–10 | 9.98 × 10–11 |
| 2182 | 1.28 × 10–6 | 6.55 × 10–10 | 1.33 × 10–9 | 9.16 × 10–7 | 1.41 × 10–6 | 1.12 × 10–9 | 7.57 × 10–10 |
Таблица 3.
Парциальные давления пара атомарного кислорода над перовскитом, атм (расчет по соотношениям (22)–(28)
| T, K | (22), (23) | (24) | (25) | (26) | (27) | (28) |
|---|---|---|---|---|---|---|
| 1791 | 1.26 × 10–10 | – | – | 1.25 × 10–10 | – | 1.31 × 10–10 |
| 1845 | 3.52 × 10–10 | – | – | 3.61 × 10–10 | – | 3.69 × 10–10 |
| 1875 | 6.10 × 10–10 | – | 6.02 × 10–10 | 5.96 × 10–10 | – | 6.01 × 10–10 |
| 1920 | 1.36 × 10–9 | 1.29 × 10–9 | 1.24 × 10–9 | 1.36 × 10–9 | – | 1.43 × 10–9 |
| 1941 | 1.97 × 10–9 | 2.12 × 10–9 | 1.80 × 10–9 | 2.04 × 10–9 | – | 1.88 × 10–9 |
| 1956 | 2.52 × 10–9 | 2.61 × 10–9 | 2.34 × 10–9 | 2.43 × 10–9 | 2.53 × 10–9 | 2.49 × 10–9 |
| 1976 | 3.52 × 10–9 | 3.58 × 10–9 | 3.31 × 10–9 | 3.52 × 10–9 | 3.53 × 10–9 | 3.45 × 10–9 |
| 1992 | 4.57 × 10–9 | 3.87 × 10–9 | 4.33 × 10–9 | 4.46 × 10–9 | 4.37 × 10–9 | 4.56 × 10–9 |
| 2027 | 7.76 × 10–9 | 6.71 × 10–9 | 7.73 × 10–9 | 7.96 × 10–9 | 7.75 × 10–9 | 7.94 × 10–9 |
| 2037 | 9.31 × 10–9 | 9.67 × 10–9 | 9.08 × 10–9 | 9.30 × 10–9 | 9.43 × 10–9 | 9.10 × 10–9 |
| 2051 | 1.13 × 10–8 | 1.12 × 10–8 | 1.14 × 10–8 | 1.13 × 10–8 | 1.19 × 10–8 | 1.18 × 10–8 |
| 2100 | 2.39 × 10–8 | 2.45 × 10–8 | 2.43 × 10–8 | 2.50 × 10–8 | 2.34 × 10–8 | 2.31 × 10–8 |
| 2182 | 7.73 × 10–8 | 7.40 × 10–8 | 8.00 × 10–8 | 6.88 × 10–8 | 7.56 × 10–8 | 7.78 × 10–8 |
Необходимо заметить, что установленное соответствие значений ${{p}_{{\text{O}}}}$, рассчитанных по независимым реакциям в газовой фазе над перовскитом, подтверждает предположение о молекулярном происхождении идентифицированных ионов в масс-спектре пара над перовскитом.
Определенные таким образом парциальные давления компонентов газовой фазы над перовскитом, как это следует из рис. 1, могут быть представлены в виде линейных логарифмических зависимостей от обратной температуры в следующем виде:
Рассчитанные методом наименьших квадратов константы ai и bi для зависимостей (29) приведены в табл. 4. Заметим, что соотношение (29) является с точностью до константы следствием известного выражения для константы реакции [9]:
(30)
$R\ln {{K}_{{\text{r}}}}(T) = - \frac{{{{\Delta }_{{\text{r}}}}{{G}_{T}}}}{T} = - \frac{{{{\Delta }_{{\text{r}}}}{{H}_{T}}}}{T} + {{\Delta }_{{\text{r}}}}{{S}_{T}},$Таблица 4.
Коэффициенты логарифмических зависимостей парциальных давлений компонентов газовой фазы над перовскитом от обратной температуры, рассчитанные методом наименьших квадратов в настоящей работе (атм)
| Компо-нент | T, K | $\lg {{p}_{i}} = {{a}_{i}}{\text{/}}T + {{b}_{i}}$ | |
|---|---|---|---|
| –ai | bi | ||
| (O) | 1791–2182 | 27 825 ± 103 | 5.628 ± 0.053 |
| (O2) | 1875–2182 | 30 072 ± 305 | 4.792 ± 0.155 |
| (Ca) | 1791–2182 | 27 921 ± 182 | 6.919 ± 0.092 |
| (CaO) | 1920–2182 | 35 055 ± 406 | 6.880 ± 0.201 |
| (Ti) | 1956–2182 | 46 531 ± 224 | 12.456 ± 0.111 |
| (TiO) | 1791–2182 | 39 002 ± 109 | 11.847 ± 0.052 |
| (TiO2) | 1791–2182 | 33 851 ± 182 | 9.701 ± 0.093 |
| (CaTiO3) | 1956–2182 | 53659 ± 527 | 15.498 ± 0.262 |
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Определенные в настоящей работе значения парциальных давлений пара преобладающих компонентов газовой фазы над перовскитом (Ca, TiO, TiO2 и О) сопоставлены на рис. 1 с полученными в работах [5, 15], а также с результатами, относящимися к испарению простых оксидов (CaO и TiO2), найденными в подобных восстановительных условиях, вызванных взаимодействием кислорода с материалом молибденового [29, 35], вольфрамового [11] и танталового [36] эффузионного контейнера или же в химически нейтральных условиях (при отсутствии этого взаимодействия) для алундового контейнера [27].
В случае работы [15] значения парциальных давлений молекулярных форм пара над перовскитом при температуре 2150 K мы рассчитали на основании приведенных авторами величин активностей TiO, TiO2 и значения энергии Гиббса смешения перовскита ($\Delta G_{{2150}}^{m}$), а также термохимических данных [9] о равновесиях (1), (2), (7) и (8). Поэтому полученные значения ${{p}_{i}}$ характеризуют испарение перовскита не в восстановительных условиях (из молибденового контейнера), а напротив – в химически нейтральных условиях (при отсутствии взаимодействия перовскита с материалом контейнера).
На рис. 1 изображены также соответствующие парциальные давления пара рассматриваемых компонентов газовой фазы над оксидами кальция и титана, рассчитанные в настоящей работе на основании термохимических данных [9]. Сопоставление экспериментальных данных, полученных в [11, 27, 29, 35, 36] и в настоящей работе, с результатами расчетов показывает степень восстановительных свойств материала, используемого в качестве эффузионного контейнера: тантал [36], молибден [29, 35], вольфрам [11] и алунд [27]. Как уже отмечалось нами ранее [37], наибольшие отклонения испытывают молекулярные формы с “дефицитом” по кислороду – атомарный кальций (рис. 1а) и монооксид титана (рис. 1б), а также сам атомарный кислород (рис. 1г). В случае газообразного диоксида титана (рис. 1в) различий в величинах ${{p}_{{{\text{Ti}}{{{\text{O}}}_{{\text{2}}}}}}}$, определенных при испарении из молибденового [29] и вольфрамового [11] контейнеров не наблюдается.
Результаты Жанг и др. [5] по определению величины общего давления пара над расплавом перовскита при температуре 2278 K согласуются с экстраполированными к этой температуре значениями парциальных давлений преобладающих компонентов газовой фазы – атомарного кальция и диоксида титана (рис. 1а, 1в), найденными в настоящей работе. Интересно отметить, что незначительные изменения наклона линейных логарифмических зависимостей ${{p}_{{{\text{Ti}}{{{\text{O}}}_{{\text{2}}}}}}}$ от обратной температуры в точках плавления оксида титана (2185 ± 10 K) и перовскита (2244 ± 10 K), представленных на рис. 1в на основании термохимических расчетов по данным [9] и соответственно результатам настоящей работы и работы [5], свидетельствуют о незначительности отличия в значениях энтальпий плавления рутила TiO2 и перовскита CaTiO3.
Близкие величины наклона логарифмических зависимостей ${{p}_{{{\text{Ca}}}}}$ и ${{p}_{{\text{O}}}}$ от обратной температуры для оксида кальция и перовскита (рис. 1a и 1г; линии 1, 5 и 5*, соответственно) свидетельствуют о преимущественном влиянии на характер испарения кальциевой составляющей перовскита. Этим обстоятельством может быть объяснено различие в наклонах логарифмических зависимостей ${{p}_{{{\text{TiO}}}}}$ от обратной температуры в случае перовскита CaTiO3 и рутила TiO2 (рис. 1б; линии 1 и 8* соответственно) согласно равновесиям (2) и (8).
Как следует из рис. 2, наклон полученной в настоящей работе логарифмической зависимости константы равновесия реакции в газовой фазе (16) совпадает с определенным Лопатиным и Семеновым [21]. Некоторое расхождение абсолютных величин K16(T), находящихся в пределах погрешностей расчета, вероятно, обусловлено систематическими отклонениями, возникающими в расчетах парциальных давлений по соотношению (15), которым пользовались авторы работы [21]. Возможной причиной этих отклонений может быть выбор стандартного вещества – золота, низкотемпературного по отношению к области температур исследований, а также неопределенность в эффективности регистрации соответствующего иона CaTiO$_{3}^{ + }$ детектирующим электронным умножителем. Сопутствующее процессу испарения изотопное фракционирование перовскита [3–5] может оказать, хотя и незначительное, влияние на величину изотопного распределения, используемого в соотношении (15).
Рассчитанные по соотношению (30) энтальпии и энтропии реакций с участием газообразного сложного оксида (CaTiO3) приведены в табл. 5 и находятся в соответствии с определенными Лопатиным и Семеновым [21] и со сделанными нами ранее оценками [37].
Таблица 5.
Энтальпии (${{\Delta }_{{\text{r}}}}{{H}_{T}}$, кДж/моль ) и энтропии (${{\Delta }_{{\text{r}}}}{{S}_{T}}$, Дж/(K моль)) реакций с участием молекулы CaTiO3
| Реакция | T, K | ${{\Delta }_{{\text{r}}}}{{H}_{{298}}}$ | ${{\Delta }_{{\text{r}}}}{{H}_{T}}$ | ${{\Delta }_{{\text{r}}}}{{S}_{T}}$ | Ссылка |
|---|---|---|---|---|---|
| (CaTiO3) = (CaO) + (TiO2) | 2287–2466 | 545 ± 8 | 284 ± 44 | 28 ± 19 | [21] |
| » | 2000 | – | 298 ± 30 | – | [37] |
| » | 1956–2182 | – | 287 ± 12 | 18 ± 6 | Данная работа |
| [Ca] + [Ti] + 3/2(O2) = (CaTiO3) | 2287–2466 | –826 ± 26 | – | – | [21] |
| » | 1956–2182 | – | –760 ± 10 | –242 ± 5 | Данная работа |
| (CaTiO3) = (Ca) + (Ti) + 3(O) | 2287–2466 | 2225 ± 26 | – | – | [21] |
| » | 2000 | – | 1983 ± 81 | – | [37] |
| » | 1956–2182 | – | 1993 ± 15 | 396 ± 7 | Данная работа |
| [CaTiO3] = (CaTiO3) | 2000 | – | 1030 ± 22 | – | [37] |
| » | 1956–2182 | – | 1027 ± 10 | 297 ± 5 | Данная работа |
Найденные в настоящей работе термодинамические данные о константе равновесия (16) в газовой фазе и определенное Захаровым и Протас [14] соотношение интенсивностей ионных токов в масс-спектрах пара над перовскитом под воздействием лазерного излучения позволяют также оценить температуру поверхности из равновесия:
(31)
$\begin{gathered} 2({\text{С aO}}) + 2({\text{TiO}}) = ({\text{CaTi}}{{{\text{O}}}_{{\text{3}}}}) + \\ + \;({\text{Ti}}) + ({\text{Ca}}) + ({\text{O}}), \\ \end{gathered} $Таким образом, высокотемпературным масс-спектрометрическим эффузионным методом Кнудсена изучено испарение перовскита из молибденового контейнера в области температур 1700–2200 K. В газовой фазе над перовскитом идентифицированы молекулярные компоненты, типичные для простых оксидов, и в незначительном количестве сложный газообразный оксид (CaTiO3). Впервые определены значения парциальных давлений пара молекулярных компонентов, содержащихся в газовой фазе над перовскитом. Проведенное сопоставление этих величин с имеющейся экспериментальной информацией и с величинами, соответствующими простым оксидам, показывает преимущественное влияние кальциевой составляющей перовскита на характер его испарения.
Автор искренне благодарен О.И. Яковлеву (Институт геохимии и аналитической химии им. В.И. Вернадского РАН) за постоянное внимание и полезное обсуждение при написании настоящей публикации и М.А. Назарову (Институт геохимии и аналитической химии им. В.И. Вернадского РАН) за поддержку, оказанную автору при выполнении настоящей работы.
Работа выполнена при финансовой поддержке Программы № 7 Президиума РАН “Экспериментальные и теоретические исследования объектов Солнечной системы и планетных систем звезд. Переходные процессы в астрофизике” и РФФИ (проект № 19-05-00801A).
Список литературы
Stefanovsky S.V., Yudintsev S.V. // Russ. Chem. Rev. 2016. V. 85. № 9. P. 96.
Wark D., Boynton W.V. // Met. Planet. Sci. 2001. V. 36. № 8. P. 1135.
Davis A.M., Hashimoto A., Clayton R.N., Mayeda T.K. // XXVI Lunar. Planet. Sci. Conf. 1995. P. 3.
Zhang J., Huang S., Davis A.M. et al. // XLIII Lunar Planet. Sci. Conf. 2012. Abstract #2132.
Zhang J., Huang S., Davis A.M. et al. // Geochim. Cosmochim. Acta. 2014. V. 140. P. 365–380.
Ершов Л.Д. // Тр. Гипроцемента. 1940. № 1. С. 5.
Roth R.S. // J. Res. NBS. 1958. V. 61. № 5. P. 437.
Kirschen M., DeCapitani C. // J. Phase Equil. 1999. V. 20. № 6. P. 593.
Глушко В.П., Гурвич Л.В., Бергман Г.А. и др. Термодинамические свойства индивидуальных веществ. Справочник / Под ред. В.П. Глушко. М.: Наука, 1978–1982.
Куликов И.С. Термодинамика оксидов: Спр. изд. М.: Металлургия, 1986. 344 с.
Казенас Е.К., Цветков Ю.В. Испарение оксидов. М.: Наука, 1997. 543 с.
Chase M.W. // J. Phys. Chem. Ref. Data. 1998. Monograph № 9. 1951 p.
Balducci G., Gigli G., Guido M. // J. Chem. Phys. 1985. V. 83. № 4. P. 1913.
Захаров В.П., Протас И.М. // Изв. АН СССР. Сер. физ. 1974. Т. 38. № 2. С. 23.
Banon S., Chatillon C., Allibert M. // Can. Met. Q. 1981. V. 20. № 1. P. 79.
Archakov I.Yu., Shornikov S.I., Tchemekova T.Yu., Shultz M.M. // Proc. 9th World conf. on titanium / Ed. I.V. Gorynin and S.S. Ushkov. Saint-Petersburg: CRISM “Prometey”, 2000. V. 3. P. 1464.
Shornikov S.I., Archakov I.Yu., Shultz M.M. // Proc. 9th World conf. on titanium / Ed. by I.V. Gorynin and S.S. Ushkov. Saint-Petersburg: CRISM “Prometey”, 2000. V. 3. P. 1469.
Ostrovski O., Tranell G., Stolyarova V.L. et al. // High Temp. Mater. Processes. 2000. V. 19. № 5. P. 345.
Shornikov S.I., Archakov I.Yu. // Proc. II Intern. Symp. on High Temperature Mass Spectrometry / Ed. by L. Kudin, M. Butman, A. Smirnov. Ivanovo: ISUCST, 2003. P. 112.
Stolyarova V.L., Zhegalin D.O., Stolyar S.V. // Russ. Glass Physics & Chemistry. 2004. V. 30. № 2. P. 142.
Lopatin S.I., Semenov G.A. // Russ. J. General Chem. 2001. V. 71. № 10. P. 1522.
Schwarz H., Tourltellotte H.A. // J. Vacuum Sci. Technol. 1969. V. 6. № 3. P. 373.
Hao J., Si W., Xia X.X. et al. // Appl. Phys. Lett. 2000. V. 76. № 21. P. 3100.
Knox B.E. in: Trace Analysis by Mass Spectrometry / Ed. by A. J. Ahearn. N.Y., L.: Acad. Press, 1972. P. 423–444.
Семенов Г.А., Николаев Е.Н., Францева К.Е. Применение масс-спектрометрии в неорганической химии . Л.: Химия, 1976. 152 с.
Shornikov S.I., Archakov I.Yu., Chemekova T.Yu. // Russ. J. Phys. Chem. 2000. V. 74. № 5. P. 677.
Самойлова И.О., Казенас Е.К. // Металлы. 1995. № 1. С. 33.
Семенов Г.А. // Неорган. материалы. 1969. Т. 5. № 1. С. 67.
Berkowitz J., Chupka W.A., Inghram M.G. // J. Phys. Chem. 1957. V. 61. № 11. P. 1569.
Warren J.W. // Nature. 1950. V. 165. № 4203. P. 810.
Гурвич Л.В., Карачевцев Г.В., Кондратьев В.Н. и др. Энергии разрыва химических связей. Потенциалы ионизации и сродство к электрону. M.: Наука, 1974. 351 с.
Shornikov S.I. // Geochem. Int. 2002. V. 40. Suppl. 1. P. S46–S60.
Комлев Г.А. // Журн. физ. химии. 1964. Т. 38. № 11. С. 2747.
Shornikov S.I. // Geochem. Int. 2015. V. 53. № 12. P. 1080.
Шорников С.И. Процессы испарения и термодинамические свойства системы CaO–Al2O3–SiO2 и материалов на ее основе: Автореф. дис. … канд. хим. наук. СПб.: ИХС РАН, 1993. 21 с.
Groves W.O., Hoch M., Johnston H.L. // J. Phys. Chem. 1955. V. 59. № 2. P. 127.
Shornikov S.I., Yakovlev O.I. // Geochem. Int. 2015. V. 53. № 8. P. 690.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии


