Журнал физической химии, 2019, T. 93, № 6, стр. 827-834
Изучение гидроталькитоподобных соединений, изоморфно замещенных железом и кобальтом, методом обратного температурно-программированного восстановления
И. Г. Рыльцова a, *, Ф. Ресснер b, О. Е. Лебедева a, О. В. Нестройная a
a Белгородский государственный национальный исследовательский университет
Белгород, Россия
b Carl von Ossietzky University
Oldenburg, Germany
* E-mail: ryltsova@bsu.edu.ru
Поступила в редакцию 03.09.2018
После доработки 11.09.2018
Принята к публикации 11.09.2018
Аннотация
Методом обратного температурно-программированного восстановления (оТПВ) изучена способность к восстановлению в токе водорода мультикомпонентных слоистых двойных гидроксидов (СДГ) со структурой гидроталькита, содержащих Mg2+, Co2+, Al3+, Fe3+ с различным соотношением указанных катионов металлов, и продуктов их термической деструкции. Показано, что на профилях температурно-программированного восстановления образцов СДГ присутствуют сигналы, отвечающие не только восстановлению катионов железа и кобальта, входящих в структуру бруситоподобных слоев, но и восстановлению кобальта и железа из смешанных оксидных или шпинелеподобных фаз, появление которых обусловлено термической деструкцией СДГ, происходящей одновременно с восстановлением в процессе оТПВ-измерений. Кроме того, на профилях оТПВ выявлены также сигналы, отвечающие предположительно восстановлению остаточных нитрат-анионов.
Слоистые двойные гидроксиды (СДГ) отвечают общей формуле ${\text{M}}_{{1 - x}}^{{2 + }}{\text{M}}_{x}^{{3 + }}{{({\text{OH}})}_{2}}{{({{{\text{A}}}^{{n - }}})}_{{x/n}}} \cdot m{{{\text{H}}}_{{\text{2}}}}{\text{O}}$. Структура СДГ является производной структуры брусита. При этом часть двухзарядных катионов изоморфно замещается трехзарядными, что приводит к возникновению избыточного положительного заряда на бруситоподобных слоях, который компенсируется межслоевыми анионами Аn–. В межслоевом пространстве присутствуют также молекулы воды, которые участвуют в стабилизации слоистой структуры. Наиболее изученным представителем данного класса соединений является гидроталькит ${\text{Mg}}_{6}^{{2 + }}{\text{Al}}_{2}^{{3 + }}{{({\text{OH}})}_{{16}}}{\text{CO}}_{3}^{{2 - }} \cdot 4{{{\text{H}}}_{{\text{2}}}}{\text{O}}$ [1, 2]. Остальные соединения этого класса рассматриваются преимущественно как продукты частичного или полного замещения магния и/или алюминия в структуре гидроталькита и часто называются гидроталькитоподобными [3–5]. Структура СДГ представлена на рис. 1.
Интерес к слоистым гидроксидам обусловлен возможностью использования их в различных областях. Гидроталькит – единственный природный анионообменник, а его синтетические аналоги также проявляют ярко выраженные ионообменные и сорбционные свойства. Гидроталькитоподобные соединения могут использоваться в качестве катализаторов и прекурсоров катализаторов, носителей лекарственных препаратов и т.д. [6–8]. Для катализа наибольшее значение имеют СДГ, содержащие катионы переходных металлов в составе бруситоподобных слоев или межслоевых анионов. В большинстве случаев катализаторы, полученные на основе СДГ, подвергаются термической предобработке в восстановительной атмосфере с целью формирования мелкодисперсных частиц металлов, инкорпорированных в оксидную матрицу [9–12]. В связи с этим особую важность приобретает изучение способности СДГ к восстановлению и определение оптимальных условий их предварительной обработки.
Известны примеры, когда лучшими характеристиками по сравнению с монометаллическими катализаторами обладают образцы, содержащие биметаллические пары, например, никеля и железа или кобальта и железа [13]. Образцы, представляющие собой биметаллические пары в оксидной матрице, также можно получить из СДГ-прекурсоров. Настоящая работа посвящена изучению способности к восстановлению слоистых двойных гидроксидов, содержащих в составе бруситоподобных слоев, наряду с магнием и алюминием, двухзарядные ионы кобальта и трехзарядные ионы железа.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Слоистые двойные гидроксиды MgCo/AlFe синтезировали методом соосаждения компонентов из растворов при переменном значении рН и комнатной температуре путем добавления раствора осадителя (мольное отношение NaOH : Na2CO3 = 8 : 1) к раствору, содержащему Mg(NO3)2, Co(NO3)2, Al(NO3)3, Fe(NO3)3. В табл. 1 приведено содержание катионов металлов в синтезированных образцах – результат полуэмпирического расчета на основании совокупности данных о содержании катионов металлов, полученных методом энергодисперсионного анализа, и данных термогравиметрического анализа [14].
Таблица 1.
Содержание катионов кобальта и железа в СДГ
| Образец | αСо | αFe | М2+/М3+ | Со2+, мас. % | Fe3+, мас. % |
|---|---|---|---|---|---|
| MgCo/AlFe-1 | 0.16 | 0.14 | 2.37 | 8.0 | 2.7 |
| MgCo/AlFe-2 | 0.31 | 0.26 | 2.6 | 14.8 | 4.6 |
| MgCo/AlFe-3 | 0.56 | 0.54 | 1.90 | 22.4 | 10.8 |
Полученный осадок подвергали старению. Известно, что при наличии в растворе двух или более типов анионов происходит внедрение в структуру СДГ преимущественно одного из них [3]. Тем не менее, была включена стадия обмена на карбонат-анионы с целью более полного удаления нитрат-анионов. После обмена образцы отмывали дистиллированной водой и сушили.
Идентификацию структуры и фазового состава полученных образцов слоистых двойных гидроксидов проводили методом рентгенофазового анализа на дифрактометре Rigaku (CuKα-излучение) с шагом сканирования по 2θ = 0.02°. Содержание катионов металлов в синтезированных образцах определяли с использованием энергодисперсионного анализатора сканирующего электронного микроскопа QUANTA 3D при рабочем напряжении 20 кВ.
Способность к восстановлению СДГ и продуктов их термической деструкции изучали методом обратного температурно-программированного восстановления (оТПВ) [15, 16]. Детектирование расхода водорода в данном методе осуществляют с использованием пламенно-ионизационного детектора (ПИД), что повышает чувствительность метода по сравнению с классическим вариантом ТПВ, в котором используется детектор по теплопроводности. Газы, выходящие из реактора, смешиваются с диоксидом углерода и пропускаются через дополнительный реактор, заполненный катализатором для гидрирования диоксида углерода до метана водородом, не израсходованным в процессе восстановления исследуемых образцов. Схематично процесс можно представить следующим образом:
(1)
${\text{М }}{{{\text{е }}}^{{х + }}} + {{{\text{Н }}}_{{2({\text{и з б }})}}} \to {\text{М }}{{{\text{е }}}^{0}} + х {{{\text{Н }}}^{ + }} + {{{\text{Н }}}_{{2({\text{о с т }})}}},$(2)
${\text{С }}{{{\text{О }}}_{2}} + 4{{{\text{Н }}}_{{2({\text{о с т }})}}}\;\mathop \to \limits^{{\text{kat}}} \;{\text{C}}{{{\text{H}}}_{4}} + 2{{{\text{H}}}_{2}}{\text{O}}.{\;\;\;}$Образовавшийся метан детектируется ПИД, и его количество пропорционально содержанию водорода в смеси с учетом стехиометрии реакции (2). До и после реакции система была откалибрована водородом.
Для выполнения измерений навеску образца 25 мг помещали в U-образный кварцевый реактор. Через заполненный образцом реактор пропускали смесь газов, содержащую 5 об. % H2 в N2, со скоростью 50 мл/мин. В процессе оТПВ реактор нагревали в интервале температур от 30 до 800°C либо 900°C с линейной скоростью нагрева 10 К/мин. Скорость потока диоксида углерода, используемого для превращения неизрасходованного в ходе восстановления образцов водорода в метан, составляла 2 мл/мин.
Для изучения способности к восстановлению продуктов термической деструкции СДГ предварительную обработку последних осуществляли непосредственно в реакторе в атмосфере азота. Образец нагревали со скоростью 10 К/мин до 100, 300 и 600°С соответственно, затем выдерживали при заданной температуре в течение 1 ч, охлаждали до комнатной температуры и далее выполняли оТПВ.
Для сравнения использовали следующие образцы: синтетический гидроталькит в нитратной форме Mg/Al–${\text{NO}}_{3}^{ - }$, полученный по методике, аналогичной описанной выше, однако с использованием раствора Na(OH) в качестве осадителя; образцы, приготовленные методом пропитки коммерческого гидроталькита Puralox MG 70 (Sasol) в карбонатной форме водными растворами Fe(NO3)3 и Co(NO3)2, содержащими необходимое количество указанных солей, с последующим удалением воды (Fe/Puralox и Со/Puralox).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
На рис. 2 представлены порошковые дифрактограммы синтезированных образцов слоистых гидроксидов. На всех дифрактограммах наблюдаются только рефлексы, характерные для гидроталькитоподобных соединений [3, 4]: набор из пяти рефлексов, которые соответствуют базальным отражениям (003), (006), (009/012), (015), (018) в порядке возрастания угла дифракции 2θ. Интенсивность пиков убывает с увеличением угла дифракции. При больших углах (более 56°) имеется дублет из шестого и седьмого рефлекса, соответствующий базальным отражениям (110) и (113). Однако с увеличением содержания кобальта и железа в образцах можно заметить снижение интенсивности сигнала, что может свидетельствовать о деформации кристаллической решетки и/или разупорядоченности бруситоподобных слоев при введении в их структуру более крупных катионов (Mg2+ – 0.071 ± 0.003 нм, Co2+ – 0.074 ± ± 0.002 нм, Al3+ – 0.051 ± 0.003 нм, Fe3+ – 0.062 ± ± 0.003 нм [17]).
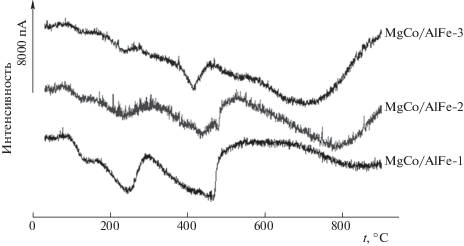
На рис. 3 представлены профили оТПВ мультикомпонентных слоистых двойных гидроксидов. Можно отметить, что все сигналы поглощения водорода широки и недостаточно разделены, базовая линия не возвращается в исходное положение в изученном температурном интервале, что затрудняет количественный расчет степени восстановления катионов металлов. Содержание катионов металлов, способных к восстановлению в токе водорода, в синтезированных образцах невелико (табл. 1) и, следовательно, изучение данных образцов осуществлено на пределе чувствительности метода оТПВ. В связи с образованием смешанных оксидов одновременно с восстановлением катионов металлов протекают диффузионные процессы в твердой фазе, препятствующие получению острых и хорошо разделенных сигналов на профилях температурно-программированного восстановления. В случае железа и кобальта возможно образование различных фаз с разными температурами восстановления.
На всех профилях оТПВ можно условно выделить три области поглощения водорода. Первая низкотемпературная область располагается в интервале температур от ~80 до 300°С, вторая – от 300 до 550°С, третья – находится выше 550°С. Происхождение низкотемпературных сигналов в оТПВ-профилях СДГ не очевидно. Можно предположить, что поглощение водорода в оТПВ-профилях исходных СДГ (рис. 3) в температурном интервале от 80 до 300°С обусловлено восстановлением межслоевых анионов, которые находятся в структуре СДГ. Преобладающими анионами в изучаемых образцах являются карбонаты. Мнения о возможности восстановления карбонат-анионов весьма противоречивы. Так, в работе [18] есть упоминание о том, что при восстановлении исходного NiAl–СДГ в области низких температур при 270 и 310°С наблюдаются два пика низкой интенсивности, которые авторами отнесены к восстановлению интеркалированных анионов ${\text{С О }}_{3}^{{2 - }}$ и ионов Ni2+, не входящих в структуру слоев соответственно. Однако, как следует из данных [19], для образцов NiAl–СДГ и NiMgAl–СДГ восстановления карбонат-анионов не наблюдается.
В данной работе температурно-программированное восстановление СДГ осуществляли с последующим масс-спектрометрическим детектированием газообразных продуктов восстановления. В масс-спектрах наблюдались только сигналы CO2, NO и H2O. Полученные авторами данные позволили отнести сигнал поглощения водорода в ТПВ-профиле в температурном интервале от 227 до 327°С к восстановлению ${\text{NO}}_{3}^{ - }$ до NO. Аналогичные результаты представлены в работе [20] для Co–Al и Co–Mg–Al–СДГ, восстанавливаемых без предварительной обработки. После прокаливания Co–Al–СДГ при 350°С в масс-спектре, зарегистрированном в процессе восстановления, наблюдались лишь следовые количества NO, что обусловлено практически полной деструкцией ${\text{NO}}_{3}^{ - }$ в процессе прокаливания при данной температуре. В свою очередь для образца Mg–Co–Al СДГ в масс-спектре сигнал NO наблюдался даже после прокаливания при 350°С и полностью исчезал только после прокаливания при 500°С, что обусловлено, как полагают авторы, более высокой термической стабильностью ${\text{NO}}_{3}^{ - }$ и ${\text{CO}}_{3}^{{2 - }}$ при увеличении содержания ионов магния.
Для подтверждения того, что в указанном интервале температур могут восстанавливаться нитраты, методом обратного температурно-программированного восстановления были исследованы образцы сравнения, содержащие ${\text{NO}}_{3}^{ - }$ и обладающие структурой и катионным составом, сходными с синтезированными MgCo/AlFe–СДГ. В качестве образцов сравнения использовали синтетический гидроталькит Mg/Al в нитратной форме (Mg/Al–${\text{NO}}_{3}^{ - }$) и образцы, полученные пропиткой коммерческого синтетического гидроталькита Mg/Al в карбонатной форме растворами нитратов кобальта и железа (7.6% Co/Puralox MG70 и 2.7% Fe/Puralox MG 70). Содержание кобальта и железа в полученных образцах было близко к содержанию соответствующих катионов в синтезированном MgCo/AlFe–1 СДГ. оТПВ-профили образцов сравнения без предварительной обработки представлены на рис. 4.
Рис. 4.
Профили оТПВ для образцов сравнения: 1–7.6% Со/Puralox MG 70, 2 – 2.7% Fe/Puralox MG 70, 3 – Mg/Al–${\text{NO}}_{3}^{ - }$.

Во всех оТПВ-профилях наблюдается интенсивный широкий несимметричный сигнал. В случае Mg/Al–${\text{NO}}_{3}^{ - }$ наличие столь интенсивного сигнала однозначно свидетельствует о том, что поглощение водорода в интервале температур от 330 до 730°С с максимумом поглощения около 475°С обусловлено восстановлением ${\text{NO}}_{3}^{ - }$. По расходу водорода можно предположить, что продуктом восстановления может быть не только NO, как описывалось в работах [19, 20], но и N2. Расчетное количество поглощенного водорода для образцов 7.6% Co/Puralox MG70 и 2.7% Fe/Puralox MG70 также значительно превышает необходимое для восстановления кобальта и железа соответственно. Судя по всему, для данных образцов поглощение водорода обусловлено двумя процессами: восстановлением соответствующих металлов и ${\text{NO}}_{3}^{ - }$. Следует отметить, что температура максимальной скорости расхода водорода существенным образом зависит от катионного состава образцов. Наличие железа смещает положение максимума расхода водорода относительно образца Mg/Al–${\text{NO}}_{3}^{ - }$ на 40°С в область низких температур. В свою очередь, присутствие кобальта приводит к более существенному снижению температуры восстановления ${\text{NO}}_{3}^{ - }$. Для данного образца наблюдается смещение максимума расхода водорода относительно образца Mg/Al–${\text{NO}}_{3}^{ - }$ на 180°С в низкотемпературную область.
Сопоставляя литературные данные, результаты оТПВ исходных MgCo/AlFe–СДГ и образцов сравнения, можно предположить, что поглощение водорода в низкотемпературной области обусловлено восстановлением остаточных нитрат-анионов. Даже следовые количества нитратов приводят к появлению интенсивных пиков, так как это – мультиэлектронный процесс. Процесс восстановления нитратов может идти с образованием различных продуктов, например, NO, N2 .
Наличие незначительного количества ${\text{NO}}_{3}^{ - }$ в структуре MgCo/AlFe–СДГ возможно, так как для синтеза образцов СДГ использовали нитраты соответствующих металлов, и часть нитратов могла остаться даже после ионного обмена на карбонаты [19].
Природа поглощения водорода в средне- и высокотемпературной областях (рис. 3) более очевидна: оно вызвано процессами восстановления железа и кобальта. Сигналы в интервале температур от 300 до 550°С представляют собой суперпозицию нескольких сигналов; наиболее вероятно, что восстанавливаются ионы Со2+ и Fe3+, находящиеся в различном окружении (алюминия или магния). Восстановление ионов Со2+ до Со0 происходит в одну стадию. В свою очередь ионы железа способны к ступенчатому восстановлению сначала до двухзарядных катионов, а затем – до Fe0, что тоже может вносить вклад в сложный вид сигнала.
Восстановление объемной фазы α-Fe2O3 происходит следующим образом:
В случае СДГ картина восстановления катионов железа осложняется их взаимодействием с катионами магния и алюминия, а также возможностью образования различных фаз твердых растворов, таких как MgFe2O4, Mg(Al,Fe)2O4, (Mg,Fe)Al2O4, Fe3O4 и т.д., в процессе оТПВ-анализа. Поскольку оТПВ представляет собой кинетический метод, диффузия водорода через фазу оксидов может приводить к уширению сигнала.
Как следует из данных рис. 3, восстановлению в среднетемпературном интервале подвергаются не все катионы кобальта и железа: на профилях оТПВ хорошо видны широкие высокотемпературные области поглощения водорода. Это, вероятно, также обусловлено тем, что в процессе термической обработки СДГ формируются смешанные оксидные или шпинелеподобные фазы. Как известно, восстановление кобальта и железа из подобных фаз затруднено [22, 23]. Так, согласно [22], СоО дает единственный узкий сигнал при ~337°С, тогда как CoAl2O4 восстанавливается при значительно более высоких температурах, максимум восстановления наблюдается при 887°С. Увеличение температуры восстановления кобальта из шпинели объясняется тем, что ионы алюминия поляризуют связь Co–O, что приводит к увеличению энергии решетки. Также известно, что восстановление кобальта из твердого раствора Mg(Co,Al)O начинается при температуре выше 700°С с максимумом около 870–887°С, что свидетельствует о сильном взаимодействии СоО и Mg(Al)O [23]. Аналогичная картина наблюдается в случае восстановления катионов железа. Согласно данным [24], Fe2O3 восстанавливается до Fe3O4 при ~297°С, восстановление Fe3O4 до Fe0 наблюдается при ~497°С. В свою очередь в работе [25] сообщается, что присутствие катионов магния замедляет процесс восстановления железа, и предлагается следующая двухстадийная схема восстановления железа из продуктов термической деструкции Mg70Fe30 СДГ:
В случае продуктов термической деструкции Mg–Al–Fe–СДГ авторы отмечают наличие на профилях ТПВ широких и перекрывающихся пиков, смещенных в область более высоких температур, и предполагают, что вторая стадия восстановления начинается до завершения первой. При этом первую стадию авторы рассматривают как частичное восстановление Fe3+ до Fe2+:
Вторая стадия рассматривается авторами аналогично представленной выше. Однако в случае серии Mg–Al–Fe–СДГ, как сообщается в данной работе, температура восстановления железа по первой и второй стадиям существенно зависит от содержания катионов магния, алюминия и железа, и колеблется для первой стадии в пределах от 409 до 473°С, для второй стадии – от 737 до 789°С.
Для проверки приведенных предположений о процессе восстановления СДГ методом оТПВ были изучены продукты обработки СДГ при различных температурах (рис. 5). Как следует из данных, представленных на рис. 3, термическая обработка при 100°С приводит к исчезновению самого низкотемпературного сигнала, расположенного ниже 170°С. После термической обработки при 300°С полностью исчезает наиболее интенсивный сигнал в низкотемпературной области с максимумом при 250°С. Таким образом, полученные данные согласуются с предположением о восстановлении в данной области остаточных нитрат-анионов, которые удаляются в результате коллапса слоистой структуры в процессе термической обработки образцов СДГ. Однако нельзя исключать, что при более высокой температуре предобработки исчезновение сигнала в низкотемпературной области также может быть обусловлено превращением, приводящим к исчезновению легко восстанавливаемых форм металлов.
Рис. 5.
Профили оТПВ для образца MgCo/AlFe–1: исходного (1) и после термической обработки при 100 (2), 300 (3) и 600°С (4).

Данные, полученные при термопрограммированном восстановлении СДГ, подвергшихся термообработке при достаточно высоких температурах, также согласуются с предположением о формировании шпинельных фаз. Термическая обработка СДГ при 600°С приводит к уменьшению интенсивности сигнала поглощения водорода в процессе оТПВ в интервале температур от 330 до 550°С и увеличению интенсивности сигнала в высокотемпературной области (выше 550°С). Также происходит смещение максимумов поглощения водорода. Полученные нами результаты для смешанных четырехметаллических слоистых гидроксидов и продуктов их термодеструкции хорошо согласуются с данными работы [26], в которой изучены двухметаллические кобальтсодержащие СДГ. Оксиды, полученные авторами [26] путем термической обработки СоAl–СДГ, помимо низкотемпературных сигналов поглощения водорода, обусловленных двухстадийным восстановлением фазы Co3O4 (Co3O4 → СоО и СоО → Со), также демонстрируют высокотемпературный сигнал с максимумом при ~660–680°С и плечом при 520–600°С, отнесенный к восстановлению CoAl2O4. Авторами предложена следующая схема восстановления CoAl2O4:
Таким образом, сигналы в высокотемпературной области могут быть с уверенностью отнесены к восстановлению ионов Со2+ и Fe2+, входящих в состав шпинелеподобной фазы, которая образуется в процессе одновременного восстановления и термической деструкции СДГ. Результаты исследования показывают, что биметаллические пары в оксидной матрице могут быть получены путем восстановления слоистых двойных гидроксидов без их предварительной обработки.
Авторы выражают благодарность сотрудникам Центра коллективного пользования “Технологии и материалы” НИУ “БелГУ” за помощь в проведении рентгенофазового и элементного анализов, сотрудникам кафедры Технической химии 2 (Carl von Ossietzky University, Oldenburg, Germany) S. Stefan и J.-H. Bölte за помощь в освоении методики обратного температурно-программированного восстановления.
Работа выполнена в рамках совместной программы Германской службы академических обменов и Министерства образования и науки РФ “Михаил Ломоносов” (гос. задание № 11.711.2016/ДААД).
Список литературы
Miyata S. // Clays Clay Miner. 1980. V. 28. № 1. P. 50.
Reichle W.T. // Solid State Ionics. 1986. V. 22. P. 135.
Cavani F., Trifiro F., Vaccari A. // Catal. Today. 1991. V. 11. № 2. P. 173.
Evans D.G., Slade R.C.T. // Struct. Bond. 2006. V. 119. P. 1.
Forano C., Hibino T., Leroux F., Taviot-Gueho C. // Dev. Clay. Sci. 2006. V. 1. P.1021.
Li F., Duan X. // Structure and Bonding. 2006. V. 119. P. 193.
Fan G., Li F., Evans D.G., Duan X. // Chem. Soc. Rev. 2014. V. 43. P. 7040.
Sels B.F., De Vos D.E., Jacobs P.A. // Cat. Rev. 2001. V. 43. № 4. P. 443.
Zazoua H., Saadi A., Bachari K. et al. // Res. Chem. Intermed. 2014. V. 40. № 3. P. 931.
Das N.N., Srivastava S.C. // Bull. Mater. Sci. 2002. V. 25. № 4. P. 283.
Gabrovska M., Edreva-Kardjieva R., Crisan D. // Reac. Kinet. Mech. Cat. 2012. V. 105. P. 79.
Dussault L., Dupin J.C., Guimon C. // J. Catal. 2007. V. 251. P. 223.
Aw M.S., Dražić G., Djinović P., Pintara A. // Catal. Sci. Technol. 2016. V. 6. P. 3797.
Нестройная О.В., Рыльцова И.Г., Лебедева О.Е. и др. // Журн. общ. химии. 2017. Т. 87. № 2. С. 181.
Roessner F., Schoenen S. Method and Device for Detecting Hydrogen: Patent WO2011134934 A1. German // 2011.
Thomé A.G., Peters S., Roessner F. // Catal. Commun. 2017. V. 97. P. 10.
Bugaenko L.T., Ryabykh S.M., Bugaenko A.L. // Mosc. Univ. Chem. Bull. 2008. V. 63. P. 303.
Fan Q., Li X., Yang Z. // Chem. Mater. 2016. V. 28. P. 6296.
Lebedeva O., Tichit D., Coq B. // Appl. Catal. A. 1999. V. 183. P. 61.
Ribet S., Tichit D., Coq B. et al. // J. Solid State Chem. 1999. V. 142. P. 382.
Gao X., Shen J., Hsia Y., Chen Y. // J. Chem. Soc. Faraday Trans. 1993. V. 89. № 7. P. 1079.
Arnoldy P., Moulijn J.A. // J. Catal. 1985. V. 93. P. 38.
Li D., Lu M., Xu S. et al. // Int. J. Hydrogen Energy. 2017. V. 42. № 8. P. 5063.
Lin H.-Y., Chen Y.-W., Li C. // Thermochim. Acta. 2003. V. 400. P. 61.
Vulic T.J., Reitzmann A.F.K., Lázár K. // Chem. Eng. J. 2012. V. 207–208. P. 913.
Genty E., Brunet J., Poupin C. et al. // Catalysts. 2015. V. 5. P. 851.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии