Журнал физической химии, 2019, T. 93, № 6, стр. 938-941
Вольтамперометрическое определение аскорбиновой кислоты в лекарственных формах на алмазном электроде, допированном бором
М. Д. Веденяпина a, *, М. М. Казакова a, **, А. М. Скундин b, ***
a Российская академия наук, Институт органической химии им. Н.Д. Зелинского
Москва, Россия
b Российская академия наук, Институт физической химии и электрохимии им. А.Н. Фрумкина
Москва, Россия
* E-mail: mvedenyapina@yandex.ru
** E-mail: frau.marinakazakova@yandex.ru
*** E-mail: askundin@mail.ru
Поступила в редакцию 24.08.2018
После доработки 11.09.2018
Принята к публикации 15.09.2018
Аннотация
Проведено исследование электрохимического поведения аскорбиновой кислоты (АК) методами циклической вольтамперометрии (ЦВА) и квадратно-волновой вольтамперометрии (КВВА) на алмазном электроде, допированном бором (АЭДБ). Показана возможность использования сигнала вольтамперометрического отклика для количественного определения концентрации АК в водном растворе. Получена аналитическая прямая для КВВА на АЭДБ и показано, что определяемый предел для АК составляет 1.87 мкМ. Показана применимость метода КВВА для определения содержания АК в фармацевтических препаратах.
Водорастворимый витамин С или L-аскорбиновая кислота (АК) играет важную роль в организме человека. АК легко окисляется химически и электрохимически в L-дегидроаскорбиновую кислоту. Это свойство широко используется при разработке электрохимических методов определения содержания АК в различных фармацевтических препаратах и продуктах питания [1–3]. Для увеличения чувствительности и избирательности электрохимических сенсоров их поверхности часто подвергают различному модифицированию [4–13]. Для определения АК применяют также титрование, жидкостную хроматографию, УФ-спектроскопию. Цель настоящей работы – оценка возможности использования в электроаналитических целях алмазного электрода, допированного бором (АЭДБ), с применением методов циклической вольтамперометрии (ЦВА) и квадратно-волновой вольтамперометрии (КВВА).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В качестве эталона использовали АК производства фирмы “Sigma”. Растворы для электрохимических измерений готовили на бидистиллированной воде. Электрохимические измерения проводили в буферном растворе Бриттона–Робинсона (BR), в состав которого входили фосфорная, борная и ледяная уксусная кислоты, а значение рН регулировали с помощью NaOH, при помощи компьютеризированного потенциостата IPC–Pro ЗАО “КРОНАС” (IPC–Pro computer-assisted potentoistat manufactured by KRONAS) в стандартной трехэлектродной ячейке с хлор-серебряным электродом сравнения (Ag/AgCl 3 М KCl) и вспомогательным электродом из Pt пластины площадью 0.1 см2. В качестве рабочего электрода использовали АЭДБ с подложкой из ниобия, производства германской фирмы Condias с рабочей площадью 0.1 см2.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
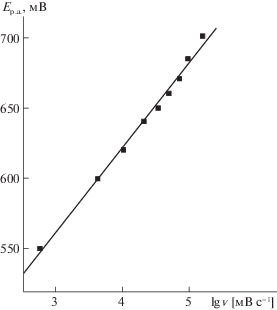
ЦВА для АК на АЭДБ в фоновом растворе (0.1 н. Na2SO4) при концентрации АК 2.27 мМ (0.4 г/л) приведены на рис. 1. Видно, что АК дает четкие отклики. Зависимости величин токов пиков (Ip,a) и потенциалов пиков (Ep,a) от скорости развертки потенциала (ν) приведены на рис. 2 и 3 соответственно. Из рис. 2 видно, что для АК на АЭДБ зависимость величин Ip,a от ν0.5 линейна. Это означает, что анодное окисление АК лимитируется стадией массопереноса субстрата к поверхности анода [14], в согласии с литературными данными, свидетельствующими о диффузионном контроле реакции [6–9].
Из рис. 3 видно, что зависимость величин Ер.а от величины ν может быть описана уравнением [14]:
(1)
$\begin{gathered} {{E}_{{{\text{p,а }}}}} = {{E}^{0}} + RT{\text{/}}(2\alpha {{n}_{\alpha }}F) \times \\ \times \;\{ \ln [(RT{{k}_{{\text{s}}}}){\text{/}}(\alpha {{n}_{\alpha }}F)]--\ln \nu \} , \\ \end{gathered} $Для необратимых анодных процессов величина Ip.а может быть вычислена по уравнению Рэндлса–Шевчика [16]:
(2)
${{I}_{{\text{p}}}} = 0.496{{\alpha }^{{0.5}}}n_{\alpha }^{{0.5}}n_{1}^{{0.5}}F{{c}_{0}}{{\left( {FD{\text{/}}RT} \right)}^{{0.5}}}{{\nu }^{{0.5}}},$Значение D, рассчитанное из экспериментальных данных, приведенных на рис. 1, оказалось равным 5.6 × 10–7 см2 с–1, что близко к значению D, полученному в [15].
Для разработки электроаналитического метода определения АК самым важным оказывается уровень шума на ЦВА, представляющего нефарадеевские токи. В описанном выше случае уровень шума оказывается достаточно высоким, что снижает точность расчета токов отклика, являющихся мерой концентрации АК в растворе.
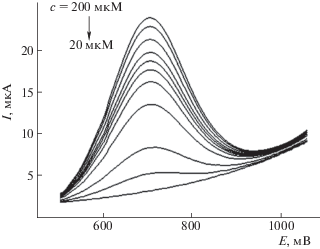
Значительное улучшение ситуации было достигнуто при использовании метода КВВА. Было найдено, что нефарадеевские токи в этом случае дают незначительный вклад в общий электрохимический отклик, на кривых КВВА имеются хорошо выраженные пики окисления АК при Е = = 703 мВ.
Для определения условий регистрации КВВА для электроаналитических целей при концентрации АК 200 мкМ были оптимизированы аналитические параметры КВВА – частота импульсов f, амплитуда импульсов а и приращение потенциала ΔE. С этой целью определена зависимость Ip,а от частоты f. Было найдено, что с увеличением f токи отклика возрастают и максимум тока смещается в анодную область. В интервале f = 20–60 Гц величина Ip,а линейно зависит от f 0.5. При больших значениях f эта зависимость отклоняется от линейной. Зависимости Ip от а и ΔE сохраняли свою линейность до значений а = 40 мВ и ΔE = = 3 мВ соответственно. В связи с этим для электроаналитических определений были выбраны следующие параметры КВВА: а = 40 мВ, f = 60 Гц и ΔE = 3 мВ.
При выбранных параметрах для АЭДБ были получены КВВА для растворов АК с различной концентрацией (рис. 4). По данным рис. 4 была построена аналитическая прямая в интервале концентраций АК 20–200 мкМ (рис. 5). Уравнение регрессии:
(3)
$\begin{gathered} I,\;{\text{м к А }} = 0.10355с \;({\text{м к М }}) + 0.091, \\ R = 0.99996. \\ \end{gathered} $Воспроизводимость приведенных данных определялась пятикратным повторением КВВА для концентрации АК 200 мкМ и отвечала относительному стандартному отклонению 1.7%. Из отношения трехкратного стандартного отклонения КВВА для фона к наклону аналитической прямой найденный предел обнаружения АК составил 1.87 мкМ. Таким образом, показана возможность применения метода КВВА с использованием АЭДБ для определения содержания АК в водных растворах.
Данный метод был использован для определения аскорбиновой кислоты в лекарственных препаратах. В этом эксперименте концентрации АК рассчитывали с использованием стандартного метода добавок. Установлено, что концентрация АК, определенная с помощью этого метода, хорошо согласуется с данными градуировочного графика. Экспериментально полученные и рассчитанные концентрации АК в составе таблеток представлены в табл. 1.
Таблица 1.
Сравнение рассчитанной (ср) и экспериментально полученной (сэ) концентраций (моль/л) АК в таблетках (Δ – ошибка)
| Название препарата | ср × 105 | сэ × 105 | Δ, % |
|---|---|---|---|
| Витамин С (производства фирмы “Хемофарм концерн А.Д.”, Сербия и Черногория) | 7.0 | 6.9 | –1.4 |
| Витамин С (производства фирмы “Фарма-Косметик-Логистик”, Германия) | 5.5 | 5.4 | 1.5 |
Таким образом, АК дает сильные электрические сигналы в условиях линейного или импульсного сканирования потенциала АЭДБ. Установлено, что наименьший нефарадаеевский ток регистрируется на АЭДБ в условиях импульсной поляризации. Оптимизация условий регистрации КВВА приводит к определяемому минимуму для АК 40 мкМ (0.007 г/л) и относительному стандартному отклонению 1.7% для 12,4 мМ (0.2 г/л). Показано, что сочетание этих методик позволяет надежно определять содержание АК в фармацевтических препаратах в широком диапазоне концентрации рабочего раствора.
Список литературы
Thangamuthu R., Senthil Kumar S.M., Chandrasekara Pillai K. // Sensors and Actuators B. 2007. V. 120. P. 745.
Erdurak-Kilic C.S., Uslu B., Dogan B. et al. // J. Anal. Chem. 2006. V. 61. № 11. P. 1113.
Zare H.R., Nasirizadeh N. // Sensors and Actuators B. 2010. V. 143. P. 666.
Shen-Ming Chen, Wen-Yan Chzo // J. Electroanal. Chem. 2006. V. 587. P. 226.
Vijaykumar S. Ijeri, Algarra Manuel, Martins Ana // Electroanalysis. 2004. V. 16. № 24.
Soundappan Thiagarajan, Tsung-Hsuan Tsai, Shen-Ming Chen // Biosensors and Bioelectronics. 2009. V. 24. P. 2712.
Alireza Nezamzadeh, Mohammad K. Amini, Hossein Faghihian // Int. J. Electrochem. Sci. 2007. V. 2. P. 583.
Protiva Rani Roy, Madhu Sudan Saha, Takeyoshi Okajima, Takeo Ohsaka // Electrochimica Acta. 2006. V. 51. P. 4447.
Takeshi Kondo, Yu Niwano, Akira Tamura et al. // Electrochimica Acta. 2009. V. 54, P. 2312.
Soo-Gil Park, Jong-Eun Park, Eun-In Cho, Jin-Hee Hwang, Takeo Ohsaka // Res. Chem. Intermed. 2006. V. 32. № 5–6. P. 595.
Tryk D.A., Tachibana H., Inoue H., Fujishima A. // Diamond & Related Materials. 2007. V. 16. P. 881.
Saeed Shahrokhian, Mona Khafajia // Electrochim. Acta. 2010. V. 55. P. 9090–9096.
Saeed Shahrokhian, Mona Khafajia // Ibid. 2005. V. 51. P. 347.
Галюс З. Теоретические основы электрохимического анализа. М.: Мир, 1974. 552 с.
Mahdie Motahary, Sayed Mehdi Ghoreishi Mohsen Behpour, Mahshid Golestaneh // J. Appl. Electrochem. 2010. V. 40. P. 841.
Хенце Г. Полярография и вольтамперометрия. М.: БИНОМ. Лаборатория знаний, 2008. 284 с.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии