Журнал физической химии, 2019, T. 93, № 7, стр. 1023-1026
Влияние температуры на термодинамические характеристики кислотно-основных реакций в водных растворах D,L-валил-D,L-лейцина
А. И. Лыткин a, *, В. В. Черников a, О. Н. Крутова a, Д. К. Смирнова a
a Ивановский государственный химико-технологический университет
Иваново, Россия
* E-mail: kdvkonkpd@yandex.ru
Поступила в редакцию 17.10.2018
После доработки 17.10.2018
Принята к публикации 05.11.2018
Аннотация
Калориметрическим методом измерены тепловые эффекты взаимодействия раствора DL-валил-DL-лейцина с растворами HNO3 и КОН в различных интервалах рН при температурах 288.15 К и 308.15 К и значении ионной силы 0.5; 1.0 и 1.5 (фоновый электролит КNO3, LiNO3). Определены тепловые эффекты ступенчатой диссоциации дипептида. Рассчитаны стандартные термодинамические характеристики (ΔrH°, ΔrG°, ΔrS°, $\Delta С _{p}^{^\circ }$) реакций кислотно-основного взаимодействия в водных растворах DL-валил-DL-лейцина. Рассмотрена связь термодинамических характеристик диссоциации дипептида со структурой данного соединения.
Данные по термодинамическим характеристикам растворов дипептидов необходимы в различных областях, где находят применение эти соединения: фармакологии, медицине, пищевой и косметической промышленности, для разработки, обоснования и оптимизации технологических процессов с участием этих соединений и их комплексов с металлами. Эта информация может быть использована для изучения термодинамических свойств более сложных белковых систем и для нужд биотехнологии.
Диссоциацию DL-валил-DL-лейцина в водном растворе можно представить схемой:
(1)
${{{\text{Н }}}_{2}}{{{\text{L}}}^{ + }} \leftrightarrow {\text{Н }}{{{\text{L}}}^{ \pm }} + {{{\text{Н }}}^{ + }},$В литературе имеются данные по константам ионизации DL-валил-DL-лейцина [1–3]. Пересчет констант диссоциации на нулевую ионную силу был выполнен по уравнению Дэвис [4] (для I < 0/5):
(3)
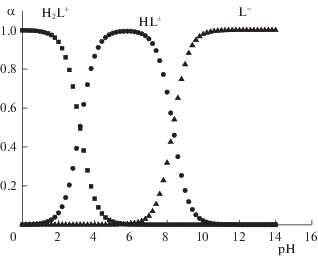
${{\text{p}}{{K}^{o}} = {\text{p}}{{K}^{c}} + A\Delta {{Z}^{2}}\left( {\frac{{\sqrt I }}{{{\text{1}} + \sqrt I }} - {\text{0}}{\text{.2}}I} \right)},$На рис. 1 представлена диаграмма равновесий в водном растворе DL-валил-DL-лейцина, построенная на основании расчетов равновесного состава растворов пептида при различных значениях рН с использованием программы RRSU [5].
Данные по теплотам реакций кислотно-основного взаимодействия с участием DL-валил-DL-лейцина весьма немногочисленны. В работе [6], прямым калориметрическим методом определили теплоты ступенчатой диссоциации DL-валил-DL-лейцина при температуре 298.15 К, (нулевая ионная сила), автор получил следующие величины: ${{\Delta }_{{{\text{dis}}}}}{{H}_{{{\text{H}}{{{\text{L}}}^{ \pm }}}}}$ = 45.82 ± 0.28 кДж/моль и ${{\Delta }_{{{\text{dis}}}}}{{H}_{{{{{\text{H}}}_{{\text{2}}}}{{{\text{L}}}^{ + }}}}}$ = = –2.31 ± 0.15 кДж/моль. Влияние температуры на термодинамические характеристики процессов ступенчатой диссоциации DL-валил-DL-лейцина не исследовалось. В работе [7], калориметрическим методом определили теплоты ступенчатой диссоциации пептида также при температуре 298.15 К, и получены величины: ${{\Delta }_{{{\text{dis}}}}}{{H}_{{{\text{H}}{{{\text{L}}}^{ \pm }}}}}$ = 45.90 кДж/моль и ${{\Delta }_{{{\text{dis}}}}}{{H}_{{{{{\text{H}}}_{{\text{2}}}}{{{\text{L}}}^{ + }}}}}$ = –1.6 кДж/моль, точность измерений авторами не указана.
Целью настоящей работы является исследование влияния температуры и концентрации фонового электролита на тепловые эффекты ступенчатой диссоциации дипептида на основании экспериментального определения энтальпии ионизации DL-валил-DL-лейцина в водном растворе при 288.15 К и 308.15 К и значениях ионной силы 0.5; 1.0 и 1.5 на фоне нитрата калия; расчет стандартных термодинамических характеристик процессов ступенчатой диссоциации дипептида.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использован препарат DL-валил-DL-лейцина (С11Н22N2О3) марки “хроматографически гомогенный” фирмы “Reanal” (Венгрия) без дополнительной очистки. Растворы дипептида готовили растворением навесок препарата в свежеприготовленном бидистилляте непосредственно перед проведением опыта. Нитрат калия (“ч”) был дважды перекристаллизован из бидистиллированной воды. Растворы KOH и НNO3 готовили из реактивов квалификации “х.ч.” Концентрацию рабочих растворов устанавливали обычными титриметрическими методами [8].
Калориметрические измерения проводили в ампульном калориметре с изотермической оболочкой, термисторным датчиком температуры КМТ-14 и автоматической записью изменения температуры во времени [9]. Работа калориметрической установки была проверена по общепринятому калориметрическому стандарту – теплоте растворения кристаллического хлорида калия в воде. Препарат KCl очищали двукратной перекристаллизацией реактива марки “x.ч.” из бидистиллята. Перед взятием навесок хлорид калия высушивали в сушильном шкафу при 393.15 К до постоянной массы. Согласование экспериментально полученных теплот растворения КСl (кр.) в воде ΔsolН(∞Н2О) = –17.25 ± 0.06 кДж/моль с наиболее надежными литературными данными [10] свидетельствует об отсутствии заметной систематической погрешности в работе калориметрической установки. Навески растворов взвешивали на весах марки ВЛР-200 с точностью 2 × 10–4 г.
При определении теплового эффекта присоединения протона к карбоксильной группе DL-валил-DL-лейцина в качестве калориметрической жидкости использовался 0.02 М раствор пептида (рНисх 3.7), а в ампулу соответственно помещали точную навеску раствора НNO3 (с концентрацией 0.9004 моль/кг раствора). После смешения растворов величина рН была близка к 2.1. Экспериментальные данные по теплотам смешения и разведения приведены в табл. 1.
Таблица 1.
Тепловые эффекты (Дж/моль) взаимодействия 0.02 М раствора DL-валил-DL-лейцина с раствором HNО3 (рНисх 3.7, рНкон 2.1)
| I (КNO3) | –ΔmixH | –ΔdilH | $ - {{\Delta }_{{{\text{dis}}}}}{{H}_{{{{{\text{H}}}_{{\text{2}}}}{{{\text{L}}}^{ + }}}}}$ |
|---|---|---|---|
| 288.15 К | |||
| 0.5 1.0 1.5 |
541 ± 150 898 ± 200 1473 ± 180 |
1320 ± 180 1565 ± 180 1981 ± 150 |
1025 ± 230 890 ± 270 669 ± 230 |
| 308.15 К | |||
| 0.5 1.0 1.5 |
–475 ± 150 172 ± 200 –877 ± 180 |
1599 ± 180 1790 ± 180 2003 ± 150 |
2730 ± 230 2130 ± 230 1482 ± 220 |
Для определения теплового эффекта диссоциации HL± использовали следующую методику: определяли теплоты взаимодействия раствора НNО3 (1.1638 моль/кг раствора) с 0.02 М раствором пептида в интервале рН 9.2–7.5 и соответствующие теплоты разведения. Данные по теплотам смешения растворов и разведения минеральной кислоты в растворе фонового электролита представлены в табл. 2. Опыты проводили при 288.15 К, 308.15 К и значениях ионной силы 0.5, 0.1 и 1.5 (КNО3).
Таблица 2.
Тепловые эффекты (кДж/моль ) взаимодействия раствора HNО3 (1.1638 моль/кг р-ра) с 0.02 М раствором DL-валил-DL-лейцина (рНисх 9.2, рНкон7.5)
| I (КNO3) | –ΔmixH | ΔdilH | ${{\Delta }_{{{\text{dis}}}}}{{H}_{{{\text{H}}{{{\text{L}}}^{ \pm }}}}}$ |
|---|---|---|---|
| 288.15 К | |||
| 0.5 1.0 1.5 |
44.60 ± 0.25 44.18 ± 0.24 43.61 ± 0.25 |
2.38 ± 0.28 3.19 ± 0.28 3.99 ± 0.25 |
46.98 ± 0.38 47.37 ± 0.37 47.59 ± 0.35 |
| 308.15 К | |||
| 0.5 1.0 1.5 |
43.58 ± 0.27 43.73 ± 0.29 43.01 ± 0.27 |
2.76 ± 0.28 2.91 ± 0.28 3.85 ± 0.25 |
46.34 ± 0.33 46.64 ± 0.36 46.86 ± 0.35 |
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Долевое распределение частиц H2L+, HL± и L– при различных значениях рН среды (рис. 1) указывает на возможность независимого определения теплот диссоциации катиона и цвиттер-иона DL-валил-DL-лейцина. Равновесный состав растворов до и после калориметрического опыта рассчитывали с использованием универсальной программы RRSU [5]. Выбор концентрационных условий проведения калориметрических опытов проводился на основании диаграммы равновесий в водном растворе DL-валил-DL-лейцина (рис. 1).
Теплоту диссоциации HL± определяли по данным о теплотах взаимодействия раствора HNO3 с раствором DL-валил-DL-лейцина в интервале рН 9.2–7.5. Поскольку полнота протекания реакции протонирования в условиях калориметрического опыта составляла более 99.9% то, вклад теплового эффекта образования воды из ионов Н+ и ОН– ничтожно мал, изменение энтальпии рассчитывали по соотношению:
(4)
${{\Delta }_{{{\text{dis}}}}}{{H}_{{{\text{H}}{{{\text{L}}}^{ \pm }}}}} = - ({{\Delta }_{{{\text{mix}}}}}H - {{\Delta }_{{{\text{dil}}}}}H),$Тепловой эффект диссоциации частицы H2L+$({{\Delta }_{{{\text{dis}}}}}{{H}_{{{{{\text{H}}}_{{\text{2}}}}{{{\text{L}}}^{ + }}}}})$ рассчитывали по уравнению:
(5)
${{\Delta }_{{{\text{dis}}}}}{{H}_{{{{{\text{H}}}_{{\text{2}}}}{{{\text{L}}}^{ + }}}}} = - ({{\Delta }_{{{\text{mix}}}}}H - {{\Delta }_{{{\text{dil}}}}}H){\text{/}}{{\alpha }_{{\text{1}}}},$Расчет составов растворов до и после калориметрического опыта проводили с использованием универсальной программы RRSU [5]. Результаты расчетов представлены в табл. 1.
Тепловые эффекты диссоциации DL-валил-DL-лейцина в стандартном растворе найдены экстраполяцией теплот ступенчатой диссоциации при фиксированных значениях ионной силы на нулевую ионную силу по уравнению, предложенному в [11]:
(6)
${{\Delta }_{{\text{r}}}}{{H}_{i}} - \Delta {{z}^{{\text{2}}}}\Psi (I) = {{\Delta }_{{\text{r}}}}H_{i}^{0} + bI,$Точки в координатах (ΔН – Δz2Ψ(I) от I), удовлетворительно укладывались на прямую. При обработке по МНК получили энтальпии диссоциации DL-валил-DL-лейцина при нулевой ионной силе.
Стандартные термодинамические характеристики процессов ступенчатой диссоциации DL-валил-DL-лейцина, полученные нами впервые, представлены в табл. 3.
Таблица 3.
Стандартные термодинамические характеристики (кДж/моль) кислотно-основного взаимодействия DL-валил-DL-лейцина в водном растворе
| Т, К | рK° | ΔG°, кДж/моль | ΔН°, кДж/моль | –ΔS°, Дж/(моль K) | $ - \Delta C_{p}^{^\circ }$, Дж/(моль K) |
|---|---|---|---|---|---|
| H2L+ = HL± + H+ | |||||
| 288.15 298.15* 308.15 |
3.24 ± 0.05 3.19 ± 0.01 3.15 ± 0.05 |
17.87 ± 0.11 18.21 ± 0.06 18.58 ± 0.11 |
–1.21 ± 0.25 –2.31 ± 0.15 –3.36 ± 0.30 |
66.2 ± 1.0 68.8 ± 0.5 71.2 ± 1.0 |
0.1 ± 15 |
| HL± = L– + H+ | |||||
| 288.15 298.15* 308.15 |
8.41 ± 0.03 8.33 ± 0.01 8.25 ± 0.03 |
46.39 ± 0.12 47.55 ± 0.06 48.67 ± 0.17 |
46.11 ± 0.25 45.82 ± 0.28 45.38 ± 0.30 |
0.9 ± 1.4 5.8 ± 0.9 10.6 ± 1.3 |
36 ± 15 |
Температурная зависимость тепловых эффектов диссоциации частиц Н2L+ и НL+ оказалась линейной. Изменения теплоемкости (ΔСр) в процессах диссоциации дипептида отрицательны и уменьшаются по абсолютной величине с ростом концентрации фонового электролита.
Тепловой эффект диссоциации НL+, как и для других подобных структур [12, 13], в изучаемом интервале температур изменяется незначительно, в то время как рост температуры от 288.15 К до 308.15 К приводит к существенному уменьшению ΔdisH(H2L+).
Температуру Θ, при которой тепловой эффект диссоциации карбоксильной группы меняет знак, можно оценить по уравнению:
(7)
$\Theta = {\text{298}}.{\text{15}} - {{\Delta }_{{\text{r}}}}{{H}_{{{\text{298}}.{\text{15}}}}}{\text{/}}{{\Delta }_{{\text{r}}}}{{C}_{р }}.$Применимость уравнения (7) для определения значений Θ была показана ранее [14] при изучении кислотно-основного взаимодействия в растворах иминодиуксусной, этилендиаминтетрауксусной кислот.
Из графиков можно видеть, что прямая пересекает ось абсцисс при температуре 277 К, т.е. при Θ 277 К тепловой эффект процесса (1) равен нулю. Это значение температуры совпадает с величиной Θ, рассчитанной по уравнению (7). Поскольку эндотермичность процесса (1) с ростом ионной силы возрастает, следует ожидать смещение Θ в область более высоких температур при увеличении концентрации фонового электролита.
Эта закономерность отмечается и при изучении дикарбоновых кислот и при исследовании оксикислот. Температурный коэффициент энтальпии диссоциации ΔСр также заметно меняется с ростом ионной силы. Это, по-видимому, связано с тем, что при больших концентрациях электролита сказывается недостаток молекул воды в растворе, что уменьшает вклад “замораживания” в гидратных оболочках ионов и приводит к уменьшению абсолютной величины ΔСр.
Увеличение температуры приводит к усилению хаотического, теплового движения молекул воды, способствующего разрушению ее структуры, поэтому ориентация молекул вокруг ионов облегчается и при постоянной ионной силе возрастание температуры приводит к более отрицательным значениям ΔdisS; это подтверждают данные табл. 3.
Изменение энтропии в процессе диссоциации дипептида по первой ступени значительно по абсолютной величине, а возрастание заряда анионной частицы резко сказывается на величине ΔdisS. С повышением температуры эффект структурирования воды анионными частицами проявляется сильнее, что вызывает уменьшение энтропии ионизации. Повышение заряда частицы приводит к более резкому изменению ΔdisS с ростом температуры.
Список литературы
Petrov N., Nabokov V. // Zn. Fiz. Khim. 1977. V. 50. P. 2208.
Petrov N., Nabokov V. // Zn. Fiz. Khim. 1976. V. 50. P. 2208.
Salakhutdinov U., Borisova A., Granovskii A.B. // Proc. Acad. Sci. (USSR) 1967. № 177. P. 1039.
Davies C. // J. Chem. Soc. 1938. V. 3. P. 2093.
Васильев В.П., Бородин В.А., Козловский Е.В. “Применение ЭВМ в химико-аналитических расчетах”. М.: Высшая школа. 1993. 112 с.
Гридчин С.Н. // Журн. общ. химии. 2015. Т. 85. Вып. 4. С. 563.
Rodante F., Fantauzzi F. // Thermochim. Acta. 1989. V. 154. P. 279.
Коростелев П.П. Приготовление растворов для химико-аналитических работ. М.: Изд-во АН СССР. 1962. С. 398.
Васильев В.П., Кочергина Л.А., Крутова О.Н. // Изв. вузов. химия и хим. технология. 2003. Т. 46. Вып. 6. С. 69.
Parcker W.B. Thermal Properties of Aqueous Uni-Univalent Electrolytes.Washington: NSRDS-NBS, 1965. B. 2. P. 342.
Васильев В.П. Термодинамические свойства растворов электролитов. М.: Высш. школа. 1982. 320 с.
Васильев В.П., Кочергина Л.А., Крутов Д.В., Крутова О.Н. // Журн. физ. химии. 2008. Т. 81. № 2. С. 234.
Кочергина Л.А., Волков А.В., Крутова О.Н., Хохлова О.Ю. // Журн. физ. химии. 2011. V. 85. № 5. С. 970.
Васильев В.П. Кочергина Л.А., Орлова Т.Д. // Журн. общ. химии. 1985. Т. 55. Вып. 1. С. 189.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии