Журнал физической химии, 2019, T. 93, № 7, стр. 1015-1022
Растворимость, термический анализ и ассоциация бис-аддуктов легкого фуллерена С60 и аминокислот: лизина, треонина и оксипролина в водных растворах
К. Н. Семенов a, А. В. Куриленко a, Н. А. Чарыков b, В. А. Кескинов b, *, А. Л. Воробьев c, Ж. К. Шаймарданов c, Н. А. Куленова c, Ж. С. Оналбаева c, Д. Г. Летенко d
a Санкт-Петербургский государственный технологический институт (технический университет)
190013 Санкт-Петербург, Россия
b Санкт-Петербургский государственный университет
199034 Санкт-Петербург, Россия
c Восточно-Казахстанский государственный технический университет им. Д. Серикбаева
070000 Усть-Каменногорск, Казахстан
d Санкт-Петербургский государственный архитектурно-строительный университет
190005 Санкт-Петербург, Россия
* E-mail: keskinov@mail.ru
Поступила в редакцию 28.09.2018
После доработки 08.11.2018
Принята к публикации 08.11.2018
Аннотация
Методом изотермического насыщения в ампулах изучена растворимость бис-аддуктов легкого фуллерена С60 и незаменимых аминокислот: лизина, треонина и оксипролина в воде в интервале температур 20–80°С. Методом комплексного термического анализа проведено исследование кристаллогидратов С60(C6H13N2O2)2 · 5Н2О, С60(C4H8NO3)2 · 6Н2О, С60(C5H9NO2)2 · 2Н2О в интервале температур 40–1100°С. Методом динамического светорассеяния изучены концентрационные зависимости размеров ассоциатов в бинарных водных растворах указанных бис-аддуктов.
Настоящая работа представляет собой продолжение цикла работ авторов [1–18], посвященных синтезу, идентификации и изучению физико-химических свойств водорастворимых производных легких фуллеренов, а также изучению объемных и рефракционных свойств водных растворов этих бис-аддуктов [19, 20].
РАСТВОРИМОСТЬ И ПЛОТНОСТЬ НАСЫЩЕННЫХ РАСТВОРОВ В БИНАРНЫХ СИСТЕМАХ С60(C6H13N2O2)2–Н2О, С60(C4H8NO3)2–Н2О, С60(C5H9NO3)2–Н2О В ИНТЕРВАЛЕ ТЕМПЕРАТУР 20–80°С
В работе методом изотермического насыщения в ампулах изучена растворимость бис-аддуктов легкого фуллерена С60 и незаменимых аминокислот: лизина, треонина и оксипролина – С60(C6H13N2O2)2, С60(C4H8NO3)2, С60(C5H9NO2)2 в воде в интервале температур 20–80°С. Насыщение проводилась в водном шейкер-термостате, точность термостатирования составила ΔТ = = ±0.1 K, частота встряхивания ν ∼ 2 Гц, время насыщения t ∼ 8 ч, после цикла насыщения пробы отстаивались в течение 30 мин. Концентрации бис-аддуктов определялись спектро-фото-метрически (по электронным спектрам в ближней ультрафиолетовой области при длине волны 330 нм) [19]. Точность определения составила ΔСбис-аддукт = = ±2.5–3.5 отн. %. Политермические данные по растворимости бис-аддуктов представлены в табл. 1 и на рис. 1.
Таблица 1.
Растворимость (S, г/л) и плотность насыщенных растворов (ρ, г/см3) в бинарных системах С60(C6H13N2O2)2–Н2О, С60(C4H8NO3)2–Н2О, С60(C5H9NO3)2–Н2О в интервале температур 20–80°С
| Т, °С | S, г/л | ||
|---|---|---|---|
| С60(C6H13N2O2)2–Н2О | С60(C4H8NO3)2–Н2О | С60(C5H9NO3)2–Н2О | |
| 20 | 23.24 | 42.80 | 181.3 |
| 30 | 35.69 | 56.05 | 268.2 |
| 40 | 44.58 | 81.16 | 393.4 |
| 50 | 45.75 | 109.4 | 448.5 |
| 60 | 45.82 | 126.4 | 597.2 |
| 70 | 23.24 | 127.9 | 693.5 |
| 80 | 48.42 | 124.9 | 777.1 |
| ρ, г/см3 | |||
| С60(C6H13N2O2)2–Н2О | С60(C4H8NO3)2–Н2О | С60(C5H9NO3)2–Н2О | |
| 20 | 0.9983 | 1.0385 | 1.0675 |
| 30 | 0.9985 | 1.0400 | 1.0875 |
| 40 | 1.0020 | 1.0415 | 1.1020 |
| 50 | 1.0175 | 1.0460 | 1.1123 |
| 60 | 1.0195 | 1.0510 | 1.1425 |
| 70 | 1.0230 | 1.0490 | 1.1481 |
| 80 | 1.0355 | 1.0447 | 1.1495 |
Примечание. В системе С60(C6H13N2O2)2–Н2О при 44°С в твердой фазе происходит диссоциация кристаллогидрата по схеме: С60(C6H13N2O2)2 · 5H2O → С60(C6H13N2O2)2 + 5H2O. В системе С60(C4H8NO3)2–Н2О при 55°С в твердой фазе происходит диссоциация кристаллогидрата по схеме: С60(C4H8NO3)2 · 6Н2О → С60(C4H8NO3)2 + 6H2O. В системе С60(C5H9NO2)2–Н2О при 50°С в твердой фазе происходит диссоциация кристаллогидрата по схеме: С60(C5H9NO2)2 · 2H2O → С60(C5H9NO2)2 + 2H2O.
Рис. 1.
Растворимость в бинарных системах С60(C6H13N2O2)2–Н2О (а), С60(C4H8NO3)2–Н2О (б), С60(C5H9NO3)2–Н2О (в) в интервале температур 20–80°С.

Методом пикнометрии в тех же условиях изучена температурная зависимость плотности насыщенных водных растворов С60(C6H13N2O2)2, С60(C4H8NO3)2, С60(C5H9NO3)2. Использованы кварцевые пикнометры с рабочим объемом ≈10 см3, стандартизированные по чистому растворителю (Н2О – дист.), точность термостатирования составила ΔТ = ±0.1 К, точность определения ∆ρ = ±0.0002–0.0005 г/см3. Политермические данные по плотности насыщенных растворов бис-аддуктов представлены в табл. 1 и на рис. 2.
Рис. 2.
Плотность насыщенных растворов в бинарных системах С60(C6H13N2O2)2–Н2О (а), С60(C4H8NO3)2–Н2О (б), С60(C5H9NO3)2–Н2О (в) в интервале температур 20–80°С.
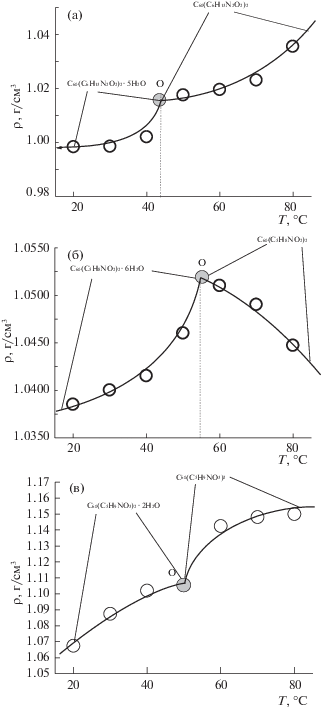
Из табл. 1, в частности, следует, что политермы растворимости во всех системах состоят из двух ветвей, отвечающих кристаллизации кристаллогидратов бис-аддуктов: С60(C6H13N2O2)2 · · 5Н2О, С60(C4H8NO3)2 · 6Н2О, С60(C5H9NO3)2 · · 2Н2О (низкотемпературные ветви) и безводных бис-аддуктов: С60(C6H13N2O2)2, С60(C4H8NO3)2, С60(C5H9NO3)2, (высокотемпературные ветви). При этом ветви кристаллогидратов (продолженные в метастабильную область) лежат выше ветвей кристаллизации безводных бис-аддуктов для систем С60(C6H13N2O2)2–Н2О, С60(C4H8NO3)2–Н2О, а для третьей системы С60(C5H9NO3)2–Н2О ветвь кристаллогидрата С60(C5H9NO2)2 · 2Н2О и безводного С60(C5H9NO3)2 располагаются практически на одной прямой (см. рис. 1в). Политермы растворимости содержат по одной нонвариантной точке проходного типа (по терминологии работ [21, 22]) – точкам О на рис. 1, отвечающим насыщению сразу двумя твердыми фазами – кристаллогидратом и безводным бис-аддуктом. Все точки О отвечают близким температурам дегидратации $T{{({\text{О }})}_{{{{{\text{С }}}_{{{\text{60}}}}}{{{{\text{(}}{{{\text{C}}}_{{\text{6}}}}{{{\text{H}}}_{{{\text{13}}}}}{{{\text{N}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{2}}}}{\text{)}}}}_{{\text{2}}}}}}}$ = 44°С, $T{{({\text{О }})}_{{{{{\text{С }}}_{{{\text{60}}}}}{{{{\text{(}}{{{\text{C}}}_{{\text{4}}}}{{{\text{H}}}_{{\text{8}}}}{\text{N}}{{{\text{O}}}_{{\text{3}}}}{\text{)}}}}_{{\text{2}}}}}}}$ = = 55°С, $T{{(О )}_{{{{{\text{С }}}_{{{\text{60}}}}}{{{{\text{(}}{{{\text{C}}}_{{\text{5}}}}{{{\text{H}}}_{{\text{9}}}}{\text{N}}{{{\text{O}}}_{{\text{3}}}}{\text{)}}}}_{{\text{2}}}}}}}$ = 50°С. Если сингулярность на политермах С60(C6H13N2O2)2–Н2О, С60(C4H8NO3)2–Н2О выражена отчетливо, то для системы С60(C5H9NO3)2–Н2О она проявляется весьма слабо, и определена нами по политермической зависимости плотности насыщенных растворов от температуры ρ(Т) – рис. 2в, где сингулярность проявляется вполне отчетливо, см. ниже.
Как видно из рисунков, растворимость всех бис-аддуктов весьма значительна и составляет от десятков до сотен г/л. При этом растворимости бис-аддуктов при всех температурах подчиняются следующему соотношению: ${{S}_{{{{{\text{С }}}_{{{\text{60}}}}}{{{{\text{(}}{{{\text{C}}}_{{\text{6}}}}{{{\text{H}}}_{{{\text{13}}}}}{{{\text{N}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{2}}}}{\text{)}}}}_{{\text{2}}}}}}}$ < < ${{S}_{{{{{\text{С }}}_{{{\text{60}}}}}{{{{\text{(}}{{{\text{C}}}_{{\text{4}}}}{{{\text{H}}}_{{\text{8}}}}{\text{N}}{{{\text{O}}}_{{\text{3}}}}{\text{)}}}}_{{\text{2}}}}}}}$ < ${{S}_{{{{{\text{С }}}_{{{\text{60}}}}}{{{{\text{(}}{{{\text{C}}}_{{\text{5}}}}{{{\text{H}}}_{{\text{9}}}}{\text{N}}{{{\text{O}}}_{{\text{3}}}}{\text{)}}}}_{{\text{2}}}}}}}$. Растворимость всех бис-аддуктов на ветвях кристаллизации кристаллогидратов С60(C6H13N2O2)2 · 5Н2О, С60(C4H8NO3)2 · 6Н2О, С60(C5H9NO3)2 · 2Н2О существенно возрастает с ростом температуры dSбис-аддукт/dT > 0 (рис. 1). Напротив, на ветвях кристаллизации безводных бис-аддуктов растворимость ведет себя по-разному: проходит через экстремум (рис. 1а), монотонно убывает (рис. 1б) и монотонно возрастает (рис. 1в). При этом, например, ${{S}_{{{{{\text{С }}}_{{{\text{60}}}}}{{{{\text{(}}{{{\text{C}}}_{{\text{5}}}}{{{\text{H}}}_{{\text{9}}}}{\text{N}}{{{\text{O}}}_{{\text{2}}}}{\text{)}}}}_{{\text{2}}}}}}}$ (Т = 80°С) такова, что массовая доля С60(C5H9NO2)2 существенно превосходит массовую долю растворителя – Н2О.
Такая же сингулярность при смене равновесной твердой фазы проявляется на политермческих зависимостях плотности насыщенных растворов ρ(Т) в системах: С60(C6H13N2O2)2–Н2О, С60(C4H8NO3)2–Н2О, С60(C5H9NO3)2–Н2О именно при тех же температурах Т(О) – см. рис. 2. Если на ветвях кристаллизации кристаллогидратов С60(C6H13N2O2)2 · 5Н2О, С60(C4H8NO3)2 · 6Н2О, С60(C5H9NO3)2 · 2Н2О плотность насыщенных растворов монотонно возрастает dρ/dT > 0, то на ветвях кристаллизации безводных бис-аддуктов: С60(C6H13N2O2)2, С60(C4H8NO3)2, С60(C5H9NO3)2 функция ρ(Т) снова ведет себя по-разному: возрастает для С60(C6H13N2O2)2, С60(C5H9NO3)2 и убывает для С60(C4H8NO3)2. Такое температурное поведение плотности насыщенных растворов вызвано наложением двух тенденций при увеличении температуры: 1) уменьшением плотности как растворителя, так и растворов заданных концентраций и 2) симбатным изменением плотности растворов и концентрации бис-аддуктов при заданной температуре (см., например [20]). Для ветви кристаллизации С60(C4H8NO3)2 обе тенденции действуют однонаправленно в сторону уменьшения плотности и действительно в этом случае dρ/dT < 0 (см. рис. 2б).
КОМПЛЕКСНЫЙ ТЕРМИЧЕСКИЙ АНАЛИЗ КРИСТАЛЛОГИДРАТОВ С60(C6H13N2O2)2 · 5Н2О, С60(C4H8NO3)2 · 6Н2О, С60(C5H9NO3)2 · 2Н2О
Для проведения комплексного термического анализа в работе использован термогравиметр NETZSCH STA 449F3 (скорость нагрева $\text{v}$ = = 10 K/мин, открытый объем, атмосфера – воздух, интервал температур 40–1100°С, массы навесок 2.5–5.0 мг). Полученные данные представлены в табл. 2 и на рис. 3.
Таблица 2.
Комплексный термический анализ кристаллогидратов С60(C6H13N2O2)2 · 5Н2О, С60(C4H8NO3)2 · · 6Н2О, С60(C5H9NO3)2 · 2Н2О в интервале температур 20–1000°С (нагрев в открытом объеме на воздухе 3 K/мин)
| N эф-фекта | Tst – Textr – Tfin , °C | (∆meff/m0)exp × × 100% | (∆meff/m0)th × × 100% | Термо-окислительный процесс |
|---|---|---|---|---|
| С60(C6H14N2O2)2 · 5H2O | ||||
| 1 | 30–70–160 | 8.2 | 8.2 | С60(C6H14N2O2)2 · 5H2O → С60(C6H14N2O2)2 + 5H2O |
| 2 | 170–210–305 | 11.6 | 11.1 | С60(C6H14N2O2)2 + O2 → С60(NH(CH2)4CH3)2 + 2CO2 + + N2 + 2H2O |
| 3 | 320–400–520 | 11.2 | 10.6 | С60(NH(CH2)4CH3)2 + 14 O2 → С60(NHCH=O)2 + + 8CO2 + 10H2O |
| 4 | 560–590–630 | 2.4 | 2.5 | С60(NHCH=O)2 → С60NH2(NHCH=O) + СО |
| 5 | 630–690–760 | 2.9 | 2.5 | С60NH2(NHCH=O) → С60(NH2)2 + СО |
| 6 | 780–800–820 | 2.8 | 2.8 | С60(NH2)2 + O2 → C60 + 2Н2О+N2 |
| 7 | 820–930–1050… | более 14 | более 14 | Частичное окисление кора C60 |
| С60(C4H8NO3)2 · 6Н2О | ||||
| 1 | 30–70–170 | 10.7 | 10.2 | С60[–NH–CH(CH(OH)CH3)–COOH]2 · 6H2O → → С60[–NH–CH(CH(OH)CH3)–COOH]2 + 6H2O |
| 2 | 200–20–400 | 12.2 | 11.7 | С60[–NH–CH(CH(OH)CH3)–COOH]2 → → С60[–NH–CH=CH–CH3]2 + 2CO2 + 2H2O |
| 3 | 400–580–720 | 4.6 + 6.7 = 11.1 | 10.5 | С60[–NH–CH=CH–CH3] + 9O2 → С60 + 6CO2 + 6H2O + 2N2 |
| 4 | 750–850–1000… | Более 19 | Более 19 | Частичное окисление кора C60 |
| С60(C5H9NO3)2 · 2Н2О | ||||
| 1 | 30–155–200 | 3.5 | 3.7 | С60(C5H9NO2)2 · 2H2O → С60(C5H9NO2)2 + 2H2O |
| 2 | 220–350–460 | 8.4 | 8.8 | С60(C5H9NO2)2 → С60(NC4H9)2 + 2CO2 |
| 3 | 500–620–830 | 5.7 + 8.5 = 14.2 | 14.4 | С60(NC4H9)2 + 12.5O2 → С60 + N2 8CO2 + 9H2O |
| 4 | 850–900–980… | Более 60 | Более | Окисление кора C60 |
Рис. 3.
Термогравиметрический анализ незаменимых аминокислот (кривые TG): C6H14N2O2 – лизина (средняя кривая при 300°С), C4H9NO3 – треонина (нижняя кривая), C5H10NO2 – оксипролина (верхняя кривая) (а), кристаллогидратов С60(C6H13N2O2)2 · 5Н2О (нижняя кривая при 600°С), С60(C4H8NO3)2 · 6Н2О (средняя кривая), С60(C5H9NO3)2 · 2Н2О (верхняя кривая) (б), и пример кривой DTG для С60(C6H13N2O2)2 · 5Н2О (в).
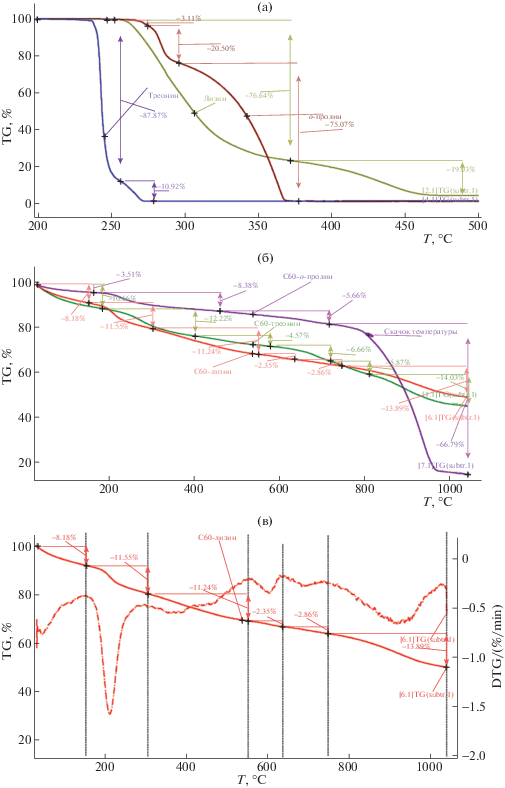
На рис. 3а представлены термограммы (TG-кривые или зависимости (m/mo) × 100%, m и mo – текущая и начальная массы образцов) для аминокислот: лизина, треонина, оксипролина – C6H14N2O2, C4H9NO3, C5H10NO3. Как видно из рисунка, все изученные аминокислоты в условиях опыта термически достаточно нестойки: наиболее нестойкий – треонин начинает разлагаться при температуре ≈240°С и полностью разлагается (m/mo) × 100% → 0 при ≈270°С, оксипролин начинает разлагаться при температуре ≈270°С и полностью разлагается при ≈370°С, лизин начинает разлагаться при температуре ≈260оС и полностью разлагается при ≈500°С, причем при 350°С (m/mo) × × 100% ≈ 20.
На рис. 3б представлены TG-кривые бис-аддуктов: кристаллогидратов С60(C6H13N2O2)2 · 5Н2О, С60(C4H8NO3)2 · 6Н2О, С60(C5H9NO3)2 · 2Н2О. Из рисунка и табл. 2 видно, что кристаллогидраты вначале теряют кристаллизационную воду, затем при температурах ≈170–220°С начинается окислительная термо-деструкция аминокислотных остатков фуллеренового кора (без заметного окисления последнего), сопровождающееся последовательными процессами: внутренней дегидратации (–Н2О), деазотирования (–N2), декарбоксилирования (–СО2 и –СО) – см. табл. 2. Эти стадийные процессы завершаются при температурах ≈720–830°С, т.е. фуллереновый кор С60 существенно стабилизирует аминокислотные остатки. Наконец, при температурах ≈750–850°С начинается окислительная деструкция фуллеренового кора. На рис. 3в в качестве примера представлена DTG-термограмма d[(m/mo) × 100%]/dT для С60(C6H13N2O2)2 · 5Н2О.
АССОЦИАЦИЯ В БИНАРНЫХ ВОДНЫХ РАСТВОРАХ С60(C6H13N2O2)2–Н2О, С60(C4H8NO3)2–Н2О, С60(C5H9NO3)2–Н2О ПРИ 25°С
Нами были изучены концентрационные зависимости размеров ассоциатов в бинарных системах С60(C6H13N2O2)2–Н2О, С60(C4H8NO3)2–Н2О, С60(C5H9NO3)2–Н2О при 25°С Malvern Zeta Nanosizer. Данные представлены в табл. 3 и на рис. 4. Изученный интервал концентраций С = 0.01–10 г/л, при больших концентрациях растворы становились непрозрачными и не могли быть использованы при данном методе исследования.
Таблица 3.
Размеры ассоциатов наноластеров в бинарных системах С60(C6H13N2O2)2–Н2О, С60(C4H8NO3)2–Н2О, С60(C5H9NO3)2–Н2О при температуре 25°С
| Система С60(C6H13N2O2)2–Н2О | ||||||
|---|---|---|---|---|---|---|
| ${{C}_{{{{{\text{С }}}_{{{\text{60}}}}}{{{{\text{(}}{{{\text{C}}}_{{\text{6}}}}{{{\text{H}}}_{{{\text{13}}}}}{{{\text{N}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{2}}}}{\text{)}}}}_{{\text{2}}}}}}}$, г/л | δ0, нм | δI, нм | δII, нм | NI, ед. | N2, ед. | NI/II, ед. |
| 0 | 2 | – | – | 1 | – | – |
| 0.01 | – | 10 | 100 | 60 | 3 × 104 | 500 |
| 0.1 | – | 20 | 200 | 500 | 2 × 105 | 500 |
| 1.0 | – | 20 | 300 | 500 | 8 × 105 | 1700 |
| 3.0 | – | 20 | 300 | 500 | 8 × 105 | 1700 |
| Система С60(C4H8NO3)2–Н2О | |||||||
|---|---|---|---|---|---|---|---|
| ${{C}_{{{{{\text{С }}}_{{{\text{60}}}}}{{{{\text{(}}{{{\text{C}}}_{{\text{4}}}}{{{\text{H}}}_{{\text{8}}}}{\text{N}}{{{\text{O}}}_{{\text{3}}}}{\text{)}}}}_{{\text{2}}}}}}}$, г/л | δ0, нм | δI, нм | δII, нм | δIII, нм | NII, ед. | NIII, ед. | NII/III, ед. |
| 0 | 2 | – | 200 | – | – | – | – |
| 0.01 | – | – | 200 | – | 3 × 105 | – | – |
| 0.1 | – | – | 200 | – | 3 × 105 | – | – |
| 1.0 | – | – | 200 | 5000 | 3 × 105 | 2 × 109 | 8 × 103 |
| 5.0 | – | – | 200 | 5000 | 3 × 105 | 2 × 109 | 8 × 103 |
| 10.0 | – | – | 200 | 5000 | 3 × 105 | 2 × 109 | 8 × 103 |
| Система С60(C5H9NO3)2–Н2О | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| ${{C}_{{{{{\text{С }}}_{{{\text{60}}}}}{{{{\text{(}}{{{\text{C}}}_{{\text{5}}}}{{{\text{H}}}_{{\text{9}}}}{\text{N}}{{{\text{O}}}_{{\text{2}}}}{\text{)}}}}_{{\text{2}}}}}}}$, г/л | δ0, нм | δI, нм | δII, нм | δIII, нм | NI, ед. | NII, ед. | NIII, ед. | NI/II, ед. | NI/III, ед. | NII/III, ед. |
| 0 | 2 | – | – | – | 1 | – | – | – | – | – |
| 0.01 | – | 40 | 200 | – | 8 × 103 | 3 × 105 | – | 300 | – | – |
| 0.1 | – | 40 | 200 | – | 8 × 103 | 3 × 105 | – | 300 | – | – |
| 1.0 | – | – | 200 | 5000 | – | 3 × 105 | 2 × 109 | – | 5 × 105 | 8 × 103 |
| 2.5 | – | – | 200 | 5000 | – | 3 × 105 | 2 × 109 | – | 5 × 105 | 8 × 103 |
| 5.0 | – | – | 200 | 5000 | – | 3 × 105 | 2 × 109 | – | 5 × 105 | 8 × 103 |
Рис. 4.
Примеры распределений по размерам ассоциатов в бинарных системах С60(C6H13N2O2)2–Н2О (а), С60(C4H8NO3)2–Н2О (б), С60(C5H9NO3)2–Н2О (в) при температуре 25°С, все рисунки представлены для равных концентраций бис-аддукта С = 1 г/л.

Как видно из табл. 3, мономерных форм С60(C6H13N2O2)2, С60(C4H8NO3)2, С60(C5H9NO3)2, точнее их гидратов (с “диаметром квазисферы” δ0 ∼ 2 ± 0.2 нм) не обнаружено даже в самых разбавленных растворах при концентрациях бис-аддуктов С = 0.01 г/л. Во всех случаях установлено последовательно образование из мономеров ассоциатов I-го порядка (δI ∼ 20 ± 10 нм), из них образуются ассоциаты II-го порядка (δII ∼ 200 ± 100 нм), из них, в свою очередь, ассоциаты III-го порядка (δIII ∼ 5000 ± 1000 нм). Последние ассоциаты, отвечающие микро-гетерогенным системам, в системе С60(C6H13N2O2)2–Н2О не обнаруживаются. Подобный тип “иерархической” последовательной ассоциации наблюдался нами и ранее для других водорастворимых производных С60 (см., например, [1, 3, 4, 18]). Следует отметить, что в системах С60(C4H8NO3)2–Н2О, С60(C5H9NO3)2–Н2О размеры ассоциатов δI и δII относительно более устойчивы, чем в системе С60(C6H13N2O2)2–Н2О – см. табл. 2. На рис. 4 представлены примеры распределений по размерам ассоциатов в бинарных системах С60(C6H13N2O2)2–Н2О (рис. 4.1 ), С60(C4H8NO3)2–Н2О (рис. 4.2 ), С60(C5H9NO3)2–Н2О (рис. 4в) при температуре 25°С для равных концентраций бис-аддукта С = 1 г/л. Из рис. 4 хорошо видно, что, если в системе С60(C6H13N2O2)2–Н2О присутствуют ассоциаты I-го и II-го порядков, то в системах: С60(C4H8NO3)2–Н2О, С60(C5H9NO3)2–Н2О II-го и III-го при полном отсутствии мономерных форм. В табл. 3 представлены также оценочные значения Ni/i+1 (среднее число кластеров i-го порядка в кластере i+1-порядка), рассчитанные по соотношению:
где Kу ≈ 0.52 – коэффициент упаковки “малых сфер” в “большую сферу”. В табл. 3 представлены оценочные значения Ni (среднее число мономеров в кластере i порядка), рассчитанные по соотношению:Таким образом, в работе методом изотермического насыщения в ампулах изучена растворимость бис-аддуктов легкого фуллерена С60 и незаменимых аминокислот: лизина, треонина и оксипролина – С60(C6H13N2O2)2, С60(C4H8NO3)2, С60(C5H9NO3)2 в воде в интервале температур 20–80°С. Концентрации бис-аддуктов определялись спектро-фото-метрически (по электронным спектрам в ближней ультрафиолетовой области при длине волны 330 нм). Методом пикнометрии в тех же условиях изучена температурная зависимость плотности насыщенных водных растворов. Показано, что политермы растворимости во всех системах состоят из двух ветвей, отвечающих кристаллизации кристаллогидратов бис-аддуктов: С60(C6H13N2O2)2 · 5Н2О, С60(C4H8NO3)2 · 6Н2О, С60(C5H9NO3)2 · 2Н2О (низкотемпературные ветви) и безводных бис-аддуктов (высокотемпературные ветви). Методом комплексного термического анализа проведено исследование кристаллогидратов С60(C6H13N2O2)2 · 5Н2О, С60(C4H8NO3)2 · 6Н2О, С60(C5H9NO3)2 · 2Н2О в интервале температур 40–1100°С (в открытых объемах в атмосфере воздуха). Во всех случаях наблюдалось последовательное выделение гидратной (слабо связанной) воды, а также процессы окислительной дегидратации химически (сильно связанной) воды, декарбоксилирования, деазотирования и, наконец, оксиления самого фуллеренового кора бис-аддуктов. Как оказалось, фуллереновый кор глобально стабилизирует аминокислотные остатки. Методом динамического светорассеяния изучены концентрационные зависимости размеров ассоциатов в бинарных системах С60(C6H13N2O2)2–Н2О, С60(C4H8NO3)2–Н2О, С60(C5H9NO3)2–Н2О при 25°С. Мономерных форм С60(C6H13N2O2)2, С60(C4H8NO3)2, С60(C5H9NO3)2, точнее их гидратов не обнаружено. Во всех случаях установлено последовательно образование из мономеров ассоциатов I-го порядка, из них образуются ассоциаты II-го порядка, из них, в свою очередь, ассоциаты III-го порядка.
Pабота выполнена при поддержке Российского фонда фундаментальных исследований (Проекты № 18-08-00143 А, 19-015-00469 А, 19-016-00003 А).
Список литературы
Semenov K.N., Charykov N.A., Postnov V.N. et al. // Russian Chemical Reviews. 2016. V. 85. № 1. P. 38.
Panova G.G., Ktitorova I.N., Skobeleva O.V. et al. // Intern. J. Plant Growth and Development. 2015. V. 77. № 4. 10 p. ASC Publ.
Semenov K.N., Charykov N.A., Murin I.V., Pukharenko Yu.V. // J. Molecular Liquids. 2015. V. 202. P. 50.
Semenov K.N., Charykov N.A., Murin I.V., Pukharenko Yu.V. // J. Molecular Liquids. 2015. V. 202. P. 1.
Тюрин Д.П., Семенов К.Н., Чарыков Н.А. и др. // Журн. физ. химии. 2015. Т. 89. № 5. С. 764.
Pestov I.A., Keskinov V.A., Semenov K.N. et al. // Rus. J. Phys. Chem. 2015. V. 89. № 6. P. 990.
Manyakina O.S., Semenov K.N., Charykov N.A. et al. // J. Molecular Liquids. 2015. V. 211. P. 487.
Semenov K.N., Kanterman I.G., Charykov N.A. et al. // Rus. J. Phys. Chem. 2014. V. 88. № 6. P. 1073.
Семенов К.Н., Кантерман И.Г., Чарыков Н.А. и др. // Радиохимия. 2014. Т. 56. № 5. С. 421.
Semenov K.N., Charykov N.A., Keskinov V.A. // J. Chem. Eng. Data. 2011. V. 56. P. 230.
Семенов К.Н., Кескинов В.А., Летенко Д.Г. и др. // Журн. физ. химии. 2011. Т. 85. № 6. С. 1108.
Letenko D.G., Nikitin V.A., Semenov K.N., Ivanov S.A. // Rus. J. Phys. Chem. 2012. V. 86. № 12. P. 1806.
Semenov K.N., Charykov N.A. // Rus. J. Phys. Chem. 2012. V. 86. № 10. P. 1636.
Lushin A.I., Charykov N.A., Semenov K.N. et al. // Industrial and Engineering Chemical Research. 2013. V. 52. P. 14583.
Semenov K.N., Keskinov V.A., Charykov N.A. et al. // Industrial and Engineering Chemical Research. 2013. V. 52. P. 16095.
Semenov K.N., Charykov N.A. // Chapter in Handbook on Fullerene: Synthesis, Properties and Applications. Phase Equilibria in Fullerene – Containing Systems / Ed. R.F. Verner, C. Benvegny. Nova Sciences Publishers, Inc., 2011. P. 1–91.
Semenov K.N., Charykov N.A. Chapter in Handbook on Grapes. Solubility of Light Fullerenes and Fullerenol in Biocompatible with Human Beings Solvents / Ed. R.P. Murphy et al. Nova Sciences Publishers, Inc., 2011 P. 1–48.
Shestopalova A.A., Semenov K.N., Charykov N.A. et al. // J. Molecular Liquids. 2015. V. 211. P. 301.
Семенов К.Н., Иванова Н.М., Чарыков Н.А. и др. // Изв. СПбГТИ(ТУ). 2018. В печати.
Семенов К.Н., Иванова Н.М., Чарыков Н.А. и др. // Журн. физ. химии. 2017. Т. 91. № 2. С. 318.
Чарыков Н.А., Румянцев А.В., Чарыкова М.В. // Там же. 1998. Т. 72. № 10. С. 1746.
Чарыкова М.В., Чарыков Н.А. Термодинамическое моделирование процессов эвапоритовой седиментации. СПб.: Наука, 2003. 262 с.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии


