Журнал физической химии, 2019, T. 93, № 7, стр. 1118-1120
Реакционная способность промежуточных продуктов импульсного фотолиза йодфенола
В. И. Порхун a, А. В. Аршинов a, *, Г. Ю. Васильева a, В. Е. Аввакумов a
a Волгоградский государственный технический университет
Волгоград, Россия
* E-mail: alex1076@inbox.ru
Поступила в редакцию 03.10.2018
После доработки 03.10.2018
Принята к публикации 15.11.2018
Аннотация
Изучен прямой фотолиз п-йодфенола в бензоле и воде. При этом зарегистрированы спектры поглощения комплекса атомарного йода с бензолом и п-гидроксифенилйодгидроксициклогексадиенильного радикала ${{{\text{R}}}^{ \bullet }}$. Зарегистрирован спектр поглощения и получено абсолютное значение константы скорости реакции гибели по закону второго порядка п-йодфеноксильного радикала в опытах по сенсибилизированному фотоокислению п-йодфенола.
ПРЯМОЙ ФОТОЛИЗ п-ЙОДФЕНОЛА
Фенильные радикалы являются простейшими представителями класса ароматических радикалов и так же как и фенольные и семихиноновые радикалы присутствуют в качестве промежуточных продуктов во многих химических, биологических и фотохимических системах, которым в последнее время посвящено много работ [1–8].
Исследование реакционной способности фенильных и феноксильных радикалов также является важной задачей физической кинетики радикальных реакций.
п-Йодфенол может служить удобным источником феноксильных и фенильных радикалов: при фотолизе п-йодфенола принципиально возможно образование п-йодфеноксильного и гидрофеноксильного радикала. Методом импульсного фотолиза исследовались спектры поглощения и кинетики гибели промежуточных продуктов фотолиза п-йодфенола при 20°С.
Импульсное фотовозбуждение (λ > 280 нм) обескислороженного раствора пара-йодфенола в бензоле (10–2 М) привело к возникновению промежуточных продуктов, спектр поглощения которых представлен на рис. 1. Полоса поглощения при 495 нм, согласно экспериментам по импульсному фотолизу растворов йода в бензоле и данным, полученным в настоящей работе (рис. 1), обусловлена образованием комплекса атомарного йода с бензолом. Таким образом, первичный акт фотолиза представляет собой гомолитический разрыв связи углерод–йод:
(1)
${\text{HO}}{{{\text{C}}}_{{\text{6}}}}{{{\text{H}}}_{{\text{4}}}}{\text{I}} + hv \to {\text{HO}}{{{\text{C}}}_{6}}{\text{H}}_{4}^{ \bullet } + {{{\text{I}}}^{ \bullet }}.$Рис. 1.
Спектры поглощения промежуточных продуктов к моменту времени 5 × 105 с, полученных[ при импульсном фотолизе п-йодфенола в бензоле (1–3) и в воде (4) при различных концентрациях: 1, 4 – 10–2, 2 – 2 × 10–4, 3 – 2 × 10–5 М.

Оторвавшийся атом йода участвует в комплексообразовании с растворителем:
(2)
${{{\text{I}}}^{ \bullet }} + {{{\text{C}}}_{6}}{{{\text{H}}}_{6}} \leftrightarrow {{{\text{C}}}_{6}}{{{\text{H}}}_{6}}{{{\text{I}}}^{ \bullet }}.$Полоса при 350 нм в спектре поглощения промежуточных продуктов (рис. 1) обусловлена образованием п-гидроксифенилйодгидроксицикло-гексадиенильного радикала при взаимодействии сольватированного гидроксифенильного радикала с исходным фенолом:
(3)
${\text{OH}}{{{\text{C}}}_{6}}{\text{H}}_{4}^{ \bullet } + {\text{I}}{{{\text{C}}}_{6}}{{{\text{H}}}_{4}}{\text{OH}} \to {{{\text{R}}}^{ \bullet }}.$В пользу протекания реакции (3) свидетельствует отсутствие поглощения при 350 нм в спектре промежуточных продуктов при импульсном фотолизе растворов, содержащих п-йодфенол в низкой концентрации 10–5 М (рис. 1). Другим доказательством образования радикала ${\text{R}}$ по реакции (3) служат эксперименты по фотолизу водных растворов п-йодфенола. На рис. 1 приведен спектр поглощения (λmax = 370 нм) радикала ${{{\text{R}}}^{ \bullet }}$, образовавшегося по реакции (3) при импульсном фотовозбуждении (λ > 200 нм) водного раствора п-йодфенола (10–2 М). Протекание процессов такого типа в водных растворах показано методами импульсного радиолиза, ЭПР и анализом продуктов. Смещение максимума поглощения и некоторое изменение формы полосы поглощения радикала ${{{\text{R}}}^{ \bullet }}$ обусловлены различиями сольватирующих свойств воды и бензола.
Кинетика гибели комплексов йода с бензолом и радикалов ${{{\text{R}}}^{ \bullet }}$ (измеренная при 495 и 350 нм соответственно) подчиняется закону второго порядка:
(4)
$2{{{\text{C}}}_{6}}{{{\text{H}}}_{6}}{{{\text{I}}}^{ \bullet }} \to {{{\text{I}}}_{2}} + {{{\text{C}}}_{6}}{{{\text{H}}}_{6}},$При низких концентрациях п-йодфенола (∼10–5 М) реакция рекомбинации гидроксифенильных радикалов
способна составить конкуренцию реакции (3), и в спектре поглощения промежуточных продуктов наблюдается лишь поглощение при 495 нм. В конденсированной фазе гидроксифенильный радикал поглощает в более далекой УФ-области (λ < 300 нм). В соответствии с реакцией (4), при фотолизе йодфенола одним из конечных продуктов является молекулярный йод. Количество выделившегося йода определялось спектрофотометрически с использованием калибровочного графика. Это позволило определять концентрацию атомов йода в первый момент после вспышки и равную ей концентрацию ${{{\text{R}}}^{ \bullet }}$ и, следовательно, значение коэффициента экстинкции ${{{\text{R}}}^{ \bullet }}$ (${{\varepsilon }_{{350}}} = $ $ = \;1.2 \times {{10}^{2}}$ М–1 см–1). Значение константы скорости реакции (5) составило: ${{k}_{5}} = 1.5 \times {{10}^{7}}$ М–1 с–1.Значение константы равновесия процесса (2) было получено, согласно уравнению:
(7)
${{K}_{2}} = \frac{{[{{{\text{C}}}_{6}}{{{\text{H}}}_{4}}{{{\text{I}}}^{ \bullet }}]}}{{[{{{\text{C}}}_{6}}{{{\text{H}}}_{4}}][{{{\text{I}}}^{ \bullet }}]}} = 3 \times {{10}^{{ - 3}}}\;{{{\text{М }}}^{{ - {\text{1}}}}}.$Полученное значение константы равновесия значительно меньше константы равновесия образования комплекса атомарного йода с мезитиленом [1], что связано, по-видимому, с меньшей основностью бензольного кольца.
СЕНСИБИЛИЗИРОВАННОЕ ФОТООКИСЛЕНИЕ п-ЙОДФЕНОЛА
Сенсибилизированное 2,6-дисульфоантрахиноном фотоокисление фенилов – один из способов получения феноксильных радикалов. Фотовозбуждение через фильтр УФС-6 (λ = 320–360 нм) водного обескислороженного раствора в присутствии п-йодфенола (5 × 10–3 М) 2,6-дисульфоантрахинона (5 × 10–5 М) приводило к образованию п-йодфеноксильных и антрасемихиноновых радикалов (рис. 2).
(9)
${\text{A}}_{T}^{*} + {\text{HO}}{{{\text{C}}}_{6}}{{{\text{H}}}_{4}}{\text{I}} \to {{{\text{A}}}^{{\underset{\raise0.3em\hbox{$\smash{\scriptscriptstyle-}$}}{ \bullet } }}} + {{{\text{H}}}^{ + }} + {\text{I}}{{{\text{C}}}_{6}}{{{\text{H}}}_{4}}{{{\text{O}}}^{ \bullet }}.$Рис. 2.
Спектры поглощения промежуточных продуктов к моменту 5 × 105 с, полученных при импульсном фотолизе водных растворов рН 9 п-йодфенола [5 × 10–3 М] и 2,6-дисульфоантрахинона [5 × 10–5 М]; 1 – обескислороженный раствор, 2 – воздушно-насыщенный раствор.
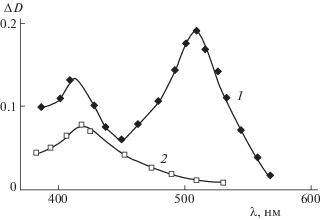
Введение кислорода в раствор приводило к тому, что реакция
(10)
${{{\text{A}}}^{{\underset{\raise0.3em\hbox{$\smash{\scriptscriptstyle-}$}}{ \bullet } }}} + {{{\text{O}}}_{2}} \to {{{\text{A}}}_{0}} + {\text{O}}_{2}^{{\underset{\raise0.3em\hbox{$\smash{\scriptscriptstyle-}$}}{ \bullet } }}$Был вычислен коэффициент экстинкции п-йодфеноксильного радикала в максимуме поглощения при 420 нм ($\varepsilon = 2.8 \times {{10}^{3}}$ л М–1см–1). Реакция гибели п-йодфеноксильных радикалов в воздушно-насыщенных растворах подчиняется закону второго порядка:
(11)
$2{\text{I}}{{{\text{C}}}_{6}}{{{\text{H}}}_{4}}{{{\text{O}}}^{ \bullet }} \to {\text{п р о д у к т ы }}.$Таким образом при изучении прямого фотолиза п-йодфенола в бензоле и воде зарегистрированы спектры поглощения комплекса атомарного йода с бензолом и п-гидроксифенилйодгидроксициклогексадиенильного радикала ${{{\text{R}}}^{ \bullet }}$. Установлено, что реакция гибели комплексов атомарного йода с бензолом и радикалов ${\text{R}}_{x}^{ \bullet }$ (5) подчинялась закону второго порядка; в бензоле при 20°С значение ${{k}_{5}} = 1.5 \times {{10}^{7}}$ М–1 с–1. Квантовый выход реакции фотолиза п-йодфенола (1) при стационарном облучении светом 310 нм составляет 0.12.
Зарегистрирован спектр поглощения и получено абсолютное значение константы скорости реакции гибели по закону второго порядка п-йодфеноксильного радикала в опытах по сенсибилизированному фотоокислению п-йодфенола. Экспериментальный факт отсутствия перегруппировки феноксильного радикала в гидроксифенильный согласуется с высокой энергией активации этого процесса (больше 100 ккал/моль), рассчитанной методами РМ-3 и Хартри–Фока–Рутана.
Список литературы
Кузьмин В.А. // Докл. АН СССР. 1976. Т. 227. № 6. С. 1394.
Худяков И.В. // Там же. 1975. Т. 225. № 4. С. 882.
Steward J.J.P. // J. Comput. Chem. 1989. V. 10. № 2. P. 209.
Порхун В.И., Рахимов А.И. // Журн. общ. химии. 2010. Т. 80. № 1. С. 154.
Порхун В.И., Аристова Ю.В., Порхун Э.В. // Журн. физ. химии. 2017. Т. 91. № 3. С. 455.
Порхун В.И., Аристова Ю.В., Аршинов А.В. и др. // Журн. общ. химии. 2017. Т. 87 (149). № 4. С. 570.
Васильева Г.Ю., Юдина А.С., Перминов В.Н., Порхун В.И. // Там же. 2015. Т. 85. № 1. С. 39.
Порхун В.И., Сивко А.Н., Порхун Э.В., Рахимов А.И. // Хим. физика. 2015. Т. 34. № 5. С. 30.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии


