Журнал физической химии, 2019, T. 93, № 8, стр. 1123-1129
Особенности поведения окружения при диффузии ионов в жидкости
А. В. Ланкин a, b, Г. Э. Норман c, a, М. А. Орехов a, b, c, *
a Российская академия наук, Объединенный институт высоких температур
Москва, Россия
b Московский физико-технический институт (Государственный университет)
Москва, Россия
c Национальный исследовательский университет Высшая школа экономики
Москва, Россия
* E-mail: mo2411@mail.ru
Поступила в редакцию 13.06.2018
После доработки 06.12.2018
Принята к публикации 10.12.2018
Аннотация
Получено разложение коэффициента диффузии иона в жидкости при низкой концентрации ионов на сумму “коллективной” и “структурной” диффузии (коллективная диффузия – диффузия иона вместе с сольватной оболочкой как единого целого, структурная диффузия – диффузия иона, связанная с обменами атомов в сольватной оболочке, которые приводят к изменению ее конфигурации). Показано, что область применимости такого разложения соответствует ионам, сильно взаимодействующим с сольватной оболочкой в силу их малого размера. Результаты верифицированы сравнением с молекулярно-динамическими расчетами диффузии ионов в воде и жидком ксеноне. Показано хорошее согласие с имеющимися экспериментальными данными.
Диффузия положительных и отрицательных ионов в жидкости важна при описании процессов в растворах электролитов и при ионизации жидких диэлектриков. Транспортные свойства ионов существенны для разработки аккумуляторов [1–5]. Растворы электролитов также присутствуют в биологических системах [6]. С другой стороны, ионизация жидкости может происходить в результате пробоя диэлектрика. Диффузия ионов оказывает существенное влияние на восстановление электрической прочности при пробое трансформаторов [7–9].
Существует несколько основных подходов к описанию транспорта иона в жидкости. Распространенный метод для описания диффузии иона в жидкости – использование формулы Эйнштена–Стокса с некоторой модификацией. В частности, используются эмпирические модификации [10] или модификации на основе идеи коллективной диффузии, как, например, в модели HSK (Hilt, Schmidt, Khrapak) [11–13]. Основной недостаток этой модели в невозможности описать зависимость подвижности от сорта иона. Это не позволяет описать возникновение максимума диффузии на зависимости от радиуса иона. Классические модели [14, 15] основывались на идее возникновения диэлектрического трения, связанного с релаксацией молекул жидкости в поле иона при его движении. Совместное влияние гидродинамического и диэлектрического трения позволяет обьяснить возникновение максимума на зависимости коэффициента диффузии иона от его радиуса.
В недавней работе было показано, что зависимость коэффициента диффузии от радиуса иона имеет множественные максимумы [16]. Данный эффект обьясняется изменением числа ближайших соседей иона, происходящим с ростом его размера. Этот эффект связан с локальной молекулярной структурой оболочки иона и не может быть получен в континуальном приближении. Для его описания можно использовать модели разделения движения на коллективную и структурную компоненты. Под коллективной компонентой понимается диффузия иона вместе с сольватной оболочкой. Структурной диффузии отвечает диффузия иона сопровождающаяся изменением оболочки. Такой подход получил широкое распространение в современных работах [16–18], где он вводится как феноменологическое разложение. В данной статье будет проведен его вывод с получением ограничений на область применимости и тестирование ограничений путем сопоставления с молекулярной динамикой и имеющимися экспериментальными данными. Численные методы, такие как молекулярная динамика [16–18], и метод Монте-Карло [19, 20], активно используются для анализа свойств ионов и их сольватных оболочек в жидкости.
В первом разделе приводятся детали молекулярно динамических расчетов, использовавшихся для проверки теоретических построений. Во втором разделе проводится формальный вывод разложения коэффициента диффузии на структурную и коллективную компоненты. В третьем разделе обсуждается область применимости данного разложения. В четвертом разделе проводится верификация построенной теории путем сравнения с молекулярной динамикой и экспериментом.
МЕТОД РАСЧЕТА
Модель потенциала межатомного взаимодействия, использованная для моделирования иона в жидком ксеноне, следующая. Рассмотрим ион, погруженный в жидкость. Потенциал взаимодействия иона с атомами жидкости [21].
(1)
$U(r)\, = \,({{E}_{0}}{\text{/}}2)[{{({{r}_{0}}{\text{/}}r)}^{{12}}}\, - \,3{{({{r}_{0}}{\text{/}}r)}^{4}}]\, = \,\beta {\text{/}}{{r}^{{12}}}\, - \,\alpha {\text{/}}{{r}^{4}},$Параметры σ = 3.94 Ǻ, ε = 0.02 эВ, соответствующие ксенону взяты из работы [23]. Потенциал взаимодействия считался равным нулю на расстоянии больше rcut = 12 Å от частицы. Моделирование проводилось при температуре T = 163 K и плотности ρ = 3 г/см3. Число частиц жидкости – 5324.
Использовалась следующая модель иона в воде [24]. Вода описывалась потенциалом SPC/E. Взаимодействие иона с молекулами воды описывалось потенциалом Букингема, наложенным на кулоновское взаимодействие
Моделирование проводилось при температуре 300 K и плотности 1.01 г/см3. Число молекул воды – 1000. Кулоновское взаимодействие рассчитывалась с использованием метода PPPM (Particle–Particle–Particle–Mesh) [25]. Избыточный положительный заряд компенсировался равномерно распределенным по расчетной ячейке отрицательным зарядом.
Для вычисления коэффициента диффузии использовался метод классической молекулярной динамики. Уравнения движения системы частиц численно интегрировались с использованием программного пакета LAMMPS [26]. Для определения коэффициента диффузии иона вычислялось усредненное значение квадрата его смещения за время t. Далее коэффициент диффузии вычислялся по формуле Эйнштейна из наклона зависимости этой величины от времени
РАЗЛОЖЕНИЕ КОЭФФИЦИЕНТА ДИФФУЗИИ
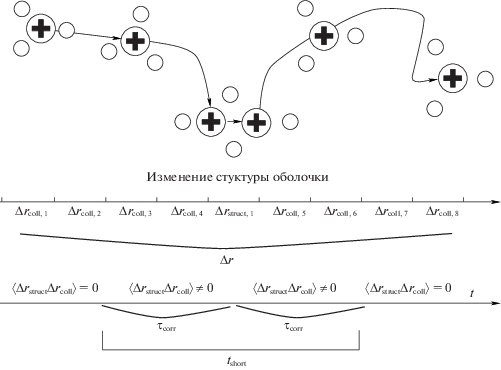
Проведем вывод разложения коэффициента диффузии на коэффициент, соответствующий коллективному движению иона вместе с сольватной оболочкой, и коэффициент, соответствующий движению с перестройкой структуры оболочки. Демонстрация этих режимов диффузии приведена на рис. 1. Данное разложение будет построено с использованием разделения временных масштабов разных типов диффузии.
Рис. 1.
Качественная демонстрация различных режимов диффузии. Сверху – пример коллективной диффузия иона вместе с сольватной оболочкой. Снизу – пример диффузии иона с изменением структуры сольватной оболочки. Показаны конфигурации иона с сольватной оболочкой в три последовательных момента времени t1, t2, t3. В процессе структурной диффузии меняется число ближайших соседей иона.

Из полного смещения иона (Δrion) можно выделить коллективное движение иона, при котором структура его сольватной оболочки и составляющие ее молекулы остаются неизменны (см. рис. 1). Оболочка и ион движутся вместе как единое целое. Смещение при таком движении обозначим за Δrcoll. Тогда любое другое смещение иона будет происходить с изменением структуры сольватной оболочки. При этом конфигурация оболочки и составляющие ее атомы меняются. Обозначим такое смещение за Δrstruct (рис. 1). В процессе диффузии иона могут наблюдаться оба режима. Полное перемещение Δrion состоит из перемещений с изменением оболочки и с неизменной оболочкой
На рис. 2 схематично показан пример сложения отдельных участков различных режимов диффузии. Смещения в формуле (3) получаются суммированием всех перемещений Δrcoll,i и Δrstruct,i рис. 2 вдоль траектории.
Рис. 2.
Качественная демонстрация траектории иона. Присутствуют два участка коллективной диффузии и один участок смены конфигурации оболочки приводящий к структурной диффузии. Схематично показано смещение иона, разбитое на отдельные участки. Смена структуры влияет на коллективную диффузию только на времени τcorr до и после нее.
Возведем соотношение (3) в квадрат и усредним
(4)
$\left\langle {\Delta r_{{ion}}^{2}} \right\rangle = \left\langle {\Delta r_{{coll}}^{2}} \right\rangle + \left\langle {\Delta r_{{struct}}^{2}} \right\rangle + 2\left\langle {\Delta {{r}_{{coll}}}\Delta r_{{struct}}^{{}}} \right\rangle .$Перейдем от среднеквадратичных смещений в формуле (4) к коэффициентам диффузии, используя формулу Эйнштейна (2)
(5)
${{D}_{{ion}}} = {{D}_{{coll}}} + {{D}_{{struct}}} + 2\left\langle {\Delta {{r}_{{coll}}}\Delta r_{{struct}}^{{}}} \right\rangle {\text{/}}6t.$Для получения разложения коэффициента диффузии необходимо избавиться от третьего слагаемого формулы (5), отвечающего корреляции движений. Можно оценить последнее слагаемое $2\left\langle {\Delta {{r}_{{coll}}}\Delta r_{{struct}}^{{}}} \right\rangle {\text{/}}(6t)$, исходя из времен корреляции в системе τcorr и среднего времени между перестройками кластера τstruct. Это будет сделано в два шага.
Первый шаг: отбрасывание корреляций на больших временах. Учтем, что корреляции движения частицы затухают за конечное время τcorr . Это выражается в том, что на времени более τcorr до и после смены конфигурации оболочки движение частицы не коррелированно с данной перестройкой (рис. 2). Таким образом, корреляции смещений Δrstruct и Δrcoll возможны только на промежутке времени τcorr до и после перестройки структуры оболочки. В это время возможно как коллективное движение иона с оболочкой, так и дополнительные перестройки оболочки. В частности, на рис. 2 представлена одна такая перестройка, однако, в общем случае, на траектории может быть n изменений оболочки. Полное время, на котором возможна корреляция разных режимов диффузии не превосходит 2τcorrn, где n – среднее число перестроек структуры оболочки на данной траектории. Оно вычисляется по формуле n = t/τstruct. Здесь t – полное время диффузии иона, τstruct среднее время между перестройками оболочки. Таким образом, полное время на котором возможна корреляция разных режимов диффузии tshort = 2τcorrt/τstruct. Это позволяет оценить третье слагаемое формулы (5) корреляцией на промежутке времени tshort (см. рис. 2) .
(6)
$\begin{gathered} \left\langle {\Delta {{r}_{{coll}}}(t)\Delta {{r}_{{struct}}}(t)} \right\rangle \leqslant \left\langle {\Delta {{r}_{{coll}}}({{t}_{{short}}})\Delta {{r}_{{struct}}}(t_{{short}}^{'})} \right\rangle \\ {{t}_{{short}}} = 2{{\tau }_{{corr}}}t{\text{/}}{{\tau }_{{struct}}}. \\ \end{gathered} $Второй шаг: оценка корреляций через коэффициенты диффузии. Оценим полученные корреляции с использованием неравенства Коши–Буняковского для случайных величин. Оно ограничивает значение корреляции величин из формулы (6) средним геометрическим их дисперсий
(7)
$\left| {\left\langle {\Delta {{r}_{{coll}}}\Delta {{r}_{{struct}}}} \right\rangle } \right| < {{\left( {\left\langle {\Delta r_{{coll}}^{2}} \right\rangle \left\langle {\Delta r_{{struct}}^{2}} \right\rangle } \right)}^{{1/2}}}.$Перейдем от среднеквадратичных смещений в оценке (7) к коэффициентам диффузии, используя формулу Эйнштейна (2)
(8)
$\begin{gathered} {{\left( {\left\langle {\Delta r_{{coll}}^{2}} \right\rangle \left\langle {\Delta r_{{struct}}^{2}} \right\rangle } \right)}^{{1/2}}}\, = \,6{{({{D}_{{coll}}}{{t}_{{short}}}{{D}_{{struct}}}{{t}_{{short}}})}^{{1/2}}}\, = \\ = \,12{{({{D}_{{coll}}}{{D}_{{struct}}})}^{{1/2}}}t{{\tau }_{{corr}}}{\text{/}}{{\tau }_{{struct}}}. \\ \end{gathered} $Среднее геометрическое коэффициентов диффузии ${{({{D}_{{coll}}}{{D}_{{struct}}})}^{{1/2}}}$ меньше среднего арифметического этих коэффициентов. Используя это можно переписать соотношение (8) в виде
(9)
$\begin{gathered} 12\sqrt {{{D}_{{coll}}}{{D}_{{struct}}}} t{{\tau }_{{corr}}}{\text{/}}{{\tau }_{{struct}}} < \\ < \;6({{D}_{{coll}}} + {{D}_{{struct}}})t{{\tau }_{{corr}}}{\text{/}}{{\tau }_{{struct}}}. \\ \end{gathered} $Данное выражение – итоговая оценка корреляции разных режимов диффузии иона. Таким образом, поправка к сумме квадратов смещений в формуле (2) уменьшается с уменьшением времени корреляции в системе и уменьшением частоты перестроек оболочки.
Подставим полученную оценку (9) в формулу (5)
(10)
$\begin{gathered} {{D}_{{ion}}} = ({{D}_{{coll}}} + {{D}_{{struct}}})({\text{1}} + \gamma {{\tau }_{{corr}}}{\text{/}}{{\tau }_{{struct}}}), \\ \left| \gamma \right| < 3. \\ \end{gathered} $При τcorr/τstruct $ \ll $ 1 получаем итоговое разложение коэффициента диффузии иона
ОБЛАСТЬ ПРИМЕНИМОСТИ РАЗЛОЖЕНИЯ
Для разложения движения на коллективную и структурную диффузию в соответствии с формулой (10) достаточно выполнения соотношения τcorr$ \ll $ τstruct. В данном разделе это условие переформулируется с использованием более доступных свойств системы.
Оценка времени τstruct. Времена между сменами конфигурации сольватной оболочки можно оценить исходя из теории переходного состояния
где Uexch – величина энергетического барьера смены структуры оболочки, ${{\text{v}}_{0}}$ – частота колебаний атомов оболочки, Nnb – количество атомов оболочки.Перестройка сольватной оболочки сопровождается уходом или присоединением атома к ней. При этом происходит смещение иона (рис. 1). Энергетический барьер обмена Uexch достаточно сложно оценить количественно для произвольной системы. Для проверки выполнения условия τcorr/τstruct$ \ll $ 1 нужно оценить снизу минимальное значение τstruc и соответственно минимальную величину энергии Uexch. Величина Uexch может быть приближенно оценена снизу, как энергия, необходимая для удаления одного атома из сольватной оболочки. Это связано с тем, что энергетический барьер всегда превышает разницу энергий начального и конечного состояния при переходе в состояние с большей энергией. Такие переходы всегда будут наблюдаться, так как при изменении конфигурации оболочки происходит как увеличение, так и уменьшение числа соседей (рис. 1) и лимитирующим будет переход с большим барьером
(13)
$\begin{gathered} {{U}_{{exch}}} > {{U}_{{n + 1}}} - {{U}_{n}}\sim (n + 1){{U}_{{ion - neutral}}} - \\ - \;n{{U}_{{ion - neutral}}} = {{U}_{{ion - neutral}}}. \\ \end{gathered} $Таким образом, энергетической барьер обмена пропорционален энергии взаимодействия иона с молекулами сольватной оболочки. Число ближайших соседей растет с площадью поверхности иона ${{N}_{{nb}}}\sim R_{{ion}}^{2}$. Данные оценки являются очень грубыми, но позволяют качественно оценить необходимые величины. Итоговая оценка на время между перестройками оболочки получается подстановкой (13) в (12)
(14)
${{\tau }_{{{\text{struct}}}}} = 1{\text{/}}{{\text{v}}_{{struct}}} = \exp [{{U}_{{ion - neutral}}}{\text{/}}kT]{\text{/}}{{\text{v}}_{0}}R_{{ion}}^{2}.$Оценка времени τcorr. Перейдем к анализу второго характерного времени системы – времени корреляции. Корреляции движения иона имеют достаточно сложный вид [13]. Однако, для разделения диффузии на различные компоненты достаточно затухания корреляций коллективного движения иона с оболочкой. Его можно качественно оценить исходя из модели экспоненциального затухания корреляций. Это следует, например, из уравнения Ланжевена. Время убывания корреляций в e раз равно
Данная оценка хорошо работает для достаточно тяжелых, по сравнению с молекулами жидкости, наночастиц [27]. Приближенно можно считать такой наночастицей сольватную оболочку, движущуюся как единое целое. Оценим коэффициент диффузии иона вместе с сольватной оболочкой по формуле Стокса–Эйнштейна и подставим результат в (15)
(16)
${{\tau }_{{corr = }}} = {{m}_{{shell}}}{{D}_{{shell}}}{\text{/}}kT = {{m}_{{shell}}}{\text{/}}C\eta {{R}_{{shell}}}.$Оценим плотность сольватной оболочки, как постоянную
(17)
${{\tau }_{{corr = }}} = {{\rho }_{{shell}}}{\text{ }}({\text{4/3}})\pi R_{{shell}}^{2}{{D}_{{shell}}}{\text{/}}kT = {{m}_{{shell}}}{\text{/}}C\eta .$Итоговая область применимости. Параметр, отвечающий за применимость разложения коэффициента диффузии (11), получается подстановкой оценок (14) и (17) в соотношение τcorr$ \ll $ τstruct
(18)
$\begin{gathered} {{\tau }_{{corr}}}{\text{/}}{{\tau }_{{struct}}} = {{\rho }_{{shell}}}({\text{4/3}})\pi R_{{shell}}^{2} \times \\ \times \;{{\text{v}}_{0}}R_{{ion}}^{2}{\text{/}}\exp [{{U}_{{ion - neutral}}}{\text{/}}kT]C\eta \ll {\text{1}}. \\ \end{gathered} $Для оценки размера сольватной оболочки используем модель HSK [11–13]. В данной модели радиус сольватной оболочки не зависит от радиуса иона. Данная модель применима при достаточно малом размере иона. Как будет показано далее, это требование выполняется в итоговой области применимости разложения диффузии. Опуская в (18) все параметры, не зависящие от радиуса иона, получаем
Аппроксимируем глубину потенциальной ямы иона упрощенной моделью ${{U}_{{ion}}}_{{ - neutral}} = \alpha {\text{/}}R_{{ion}}^{4}$ в соответствии с потенциалом (1)
Частота осцилляций оболочки достаточно слабо зависит от размера иона. Если считать ${{\upsilon }_{0}}$ постоянной, параметр из (20) возрастает с ростом радиуса. Если считать, что осцилляции атомов оболочки происходят в потенциале (1) с частотой ${{\text{v}}_{0}}\sim {\text{1/}}R_{{ion}}^{3}$, то итоговая оценка параметра из (4) будет возрастать с ростом Rion при ${{R}_{{ion}}} < \sqrt[4]{{\alpha {\text{/(}}kT)}}$. Параметр становится слишком большим для применения формулы (11) еще до достижения данного размера иона. Важно отметить, что полученное ограничение на применимость разложения диффузии согласуются с областью применимости модели HSK [11–13], которая использовалась при выводе данных ограничений.
Итоговая теоретическая оценка условий применимости разложения следующая. Размер иона должен быть достаточно мал для обеспечения большой глубины потенциальной ямы взаимодействия иона с атомами жидкости. С ростом размера иона возможно нарушение разложения (2).
СРАВНЕНИЕ МОДЕЛИ С МОЛЕКУЛЯРНОЙ ДИНАМИКОЙ И ЭКСПЕРИМЕНТОМ
Проведем верификацию модели сравнением с расчетами коэффициентов диффузии методом молекулярной динамики и экспериментальными данными.
Методика сравнения. Алгоритм прямого вычисления коэффициента диффузии описан в разделе метод расчета. Для сравнения теории и прямых расчетов необходимо также вычислить отдельные слагаемые формулы (11). Слагаемое, отвечающее коллективной диффузии, получается из молекулярно динамических расчетов диффузии по формуле (2) для размеров ионов, при которых наблюдается только коллективная диффузия. Данные оценки совпадают [16] с коэффициентом коллективной диффузии в модели HSK [11–13] дающей предсказание для произвольного размера иона. Структурную диффузию можно оценить по переходам между различными конфигурациями сольватной оболочки в молекулярно динамическом расчете
где hi,j – среднее смещение при перестройке оболочки из конфигурации i в конфигурацию j, τstruct,i,j – среднее время между такими перестройками. Эти параметры могут быть напрямую получены из молекулярной динамики. Здесь снова учтено, что вклад корреляций отдельных компонент суммы уменьшается с уменьшением τcorr/τstruct.Сравнения с молекулярной динамикой. Результаты расчетов приведены на рис. 3 и рис. 4 для иона в воде и в жидком ксеноне соответственно. При малых значениях радиуса иона теоретические значения коэффициентов диффузии близки к данным прямых расчетов из молекулярной динамики. С ростом размера иона наблюдается нарушение теоретической модели. Это согласуется с теоретически полученным ограничением на ее область применимости.
Рис. 3.
Результаты расчетов коэффициентов диффузии для иона в воде. Сплошная линия – отношение коэффициента диффузии, вычисленного по теоретической модели, к коэффициенту диффузии из молекулярной динамики. Пунктирная линия – аналогичное отношение для коэффициента диффузии с учетом только обменов со средними временами больше времени корреляции. Квадратами показаны экспериментальные значения коэффициентов диффузии Mg2+, Ca2+, Sr2+, Ba2+, Ra2+ [28].
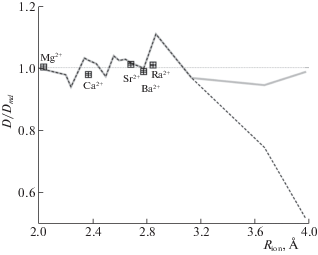
Рис. 4.
Результаты расчетов коэффициентов диффузии для иона в жидком ксеноне. Сплошная линия – отношение коэффициента диффузии, вычисленного по теоретической модели, к коэффициенту диффузии из молекулярной динамики. Пунктирная линия – аналогичное отношение для коэффициента диффузии с учетом только обменов со средними временами больше времени корреляции. Квадратом показано экспериментальное значение коэффициента диффузии ${\text{O}}_{2}^{ - }$ [11].

Взаимосвязь между нарушением формулы (11) и изменением характерных времен системы проверялась расчетом структурной диффузии без учета частых перестроек оболочки. Частыми считались перестройки со средним периодом меньше времени корреляции в системе. Отклонение таких расчетов от молекулярной динамики происходит в той же области радиусов, при которой наблюдается нарушение теоретической модели (рис. 4). Таким образом, нарушение модели связано с невыполнением условия разделения характерных времен структурных перестроек и времени корреляции.
Кроме того, в окрестности Rion = 2 Å в жидком ксеноне наблюдается отклонение расчета без частых перестроек от молекулярной динамики на 30%. Это связано с изменением числа ближайших соседей иона при данном радиусе, которое приводит к увеличению частоты перестроек структуры оболочки. Уменьшение времен между перестройками оболочки противоречит теоретически полученной применимости модели при малом радиусе иона. Это связано с использованием достаточно грубых приближений при ее выводе. При этом предсказания модели с учетом всех типов перестроек согласуется с молекулярной динамикой.
В воде отклонение расчета без частых перестроек наблюдается при больших радиусах иона. При этих радиусах предсказания модели совпадают с данными молекулярной динамики. Это связано с тем, что условие разделения характерных времен не является необходимым для применения разложения коэффициента диффузии, но является достаточным.
Сравнения с экспериментом. Результаты расчетов согласуются с экспериментальными данными по диффузии ионов (рис. 3 и рис. 4). Теоретическая модель также согласуется с экспериментом. Согласие наблюдается как в воде, так и в жидком ксеноне. Радиусы ионов Mg2+, Ca2+, Sr2+, Ba2+, Ra2+ в воде взяты из [24, 29–32]. Радиус иона ${\text{O}}_{2}^{ - }$ в жидком ксеноне определялся исходя из модели [33] и прямого расчета парной корреляционной функции иона в молекулярной динамике.
Таким образом, теоретически обосновано разложение коэффициента диффузии иона на коллективную и структурную диффузию. Коллективная диффузия представляет собой диффузию иона вместе с сольватной оболочкой как единого целого. Структурная диффузия представляет собой диффузию иона, связанную с обменами атомов в сольватной оболочке. Теоретически и с применением молекулярной динамики определены ограничения на такое разложение. Показано, что разложение возможно при условии малости времени корреляции движения иона по сравнению со средним временем между динамическим изменением структуры оболочки. Качественно определен параметр (20), малое значение которого отвечает области применимости модели. Показано, что области применимости соответствуют ионы, сильно взаимодействующие с жидкостью. В частности, это относится к ионам малого размера, которые сильно сближаются с молекулами жидкости, что приводит к росту кулоновского взаимодействия. Увеличение иона больше некоторого, зависящего от конкретной системы, радиуса может приводить к нарушению разложения. Результаты теоретических и молекулярно динамических расчетов согласуются с экспериментальными данными.
Расчеты выполнены на вычислительном кластере МВС-10п и суперкомпьютерном центре ОИВТ РАН. Работа поддержана грантом РНФ 18-19-00734.
Список литературы
Pavlov S.V., Kislenko S.A. // Phys. Chem. Chem. Phys. 2016. V. 18. P. 30830.
Smirnov V.S., Kislenko S.A. // Chem. Phys. Chem. 2017. V. 19. P. 75.
Рахманова О.Р., Галашев А.Е. // Журн. физ. химии. 2017. Т. 91. № 5. С. 887.
Шестаков А.Ф., Юдина А.В., Тулибаева Г.З. и др. // Там же. 2017. Т. 91. № 8. С. 1313.
Chen F., Kerr R., Forsyth M. // J. Chem. Phys. 2018. V. 148. P. 193813.
Yellen G. // Nat. Rev. Neurosci. 2002. V. 419. P. 35.
Апфельбаум М.С. // Электронная обработка материалов 2009. № 2. С. 29.
Apfelbaum M.S., Doludenko A.N. // J. Phys.: Conf. Ser. 2016. V. 774. P. 012184.
Lankin A.V., Orekhov M.A. // J. Phys.: Conf. Ser. 2018. V. 946. P. 012123.
Borovkov V.I. // J. Phys. Chem. A 2006. V. 110. P. 13366.
Hilt O., Schmidt F., Khrapak A. // IEEE Trans. Dielectr. Electr. Insul. 1994. V. 1. P. 648.
Khrapak A., Schmidt W. // Int. J. Mass. Spectrom. 2008. V. 277. P. 236.
Ланкин А.В., Норман Г.Э., Орехов М.А. // Журн. физ. химии. 2016. Т. 90. № 5. С. 710.
Hubbard J.B., Onsager L. // J. Chem. Phys. 1977. V. 67. P. 4850.
Zwanzig R. // J. Chem. Phys. 1963. V. 38. P. 1603.
Orekhov M. // Phys. Chem. Chem. Phys. 2017. V. 19. P. 32398.
Møller K.B., Rey R., Masia M., Hynes J.T. // J. Chem. Phys. 2005. V . 122. P. 114508.
Borodin O., Smith G.D., Henderson W. // J. Phys. Chem. B. 2006. V. 110. P. 16879.
Шевкунов С.В. // Журн. физ. химии. 2017. Т. 91. № 10. С. 1753.
Шевкунов С.В. // Там же. 2017. Т. 91. № 2. С. 339.
Nelson D., Benhenni M., Eichwald O., Yousfi M. // J. Phys. D: Appl. Phys. 2001. V. 34. P. 3247.
Ivanishko I.S., Borovkov V.I. // J. Phys. Chem. B. 2010. V. 114. P. 9812.
Horton G.K., Leech J.W. // Proc. Phys. Soc. 1963. V. 82. P. 816.
Putnis A., Putnis C.V. // Phys. Chem. Chem. Phys. 2014. V. 16. P. 7772.
Hockney R.W., Eastwood J.V. Computer Simulation Using Particles. NY: IOP Publishing, 1989. 540 c.
Plimpton S. // J. Comput. Phys. 1995. V. 117. P. 1.
Рудяк В.Я., Харламов Г.В., Белкин А.А. // Письма в ЖТФ. 2000. Т. 26. № 13. С. 29.
Yuan-Hui L., Gregory S. // Geochim. Cosmochim. Acta. 1974. V. 38. P. 703.
Pejov L., Spångberg D., Hermansson K. // J. Chem. Phys. 2010. V. 133. P. 174513.
Chaudhari M., Soniat M., Rempe S. // J. Phys. Chem. B. 2015. V. 119. P. 8746.
Ramos S., Neilson G., Barnes A. // J. Chem. Phys. 2003. V. 118. P. 5542.
Matsuda A., Mori H. // J. Solution. Chem. 2014. V. 43. P. 1669.
Khrapak A., Tegeder P., Illenberger E. et al. // Chem. Phys. Lett. 1999. V. 310. P. 557.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии


