Журнал физической химии, 2019, T. 93, № 8, стр. 1130-1137
Высокотемпературное масс-спектрометрическое исследование термодинамических свойств перовскита CaTiO3
a Российская академия наук, Институт геохимии и аналитической химии им. В.И. Вернадского
Москва, Россия
* E-mail: sergey.shornikov@gmail.com
Поступила в редакцию 05.10.2018
После доработки 28.01.2019
Принята к публикации 01.02.2019
Аннотация
На основании данных, полученных масс-спектрометрическим эффузионным методом Кнудсена, определены значения активностей оксидов в перовските CaTiO3 в интервале температур 1791–2398 K. Определены величины энергии Гиббса, а также энтальпии и энтропии образования перовскита из индивидуальных оксидов, равные –39.88 ± 0.54 кДж/моль и 3.15 ± 0.28 Дж/(моль K) соответственно, и энтальпия плавления перовскита при температуре 2241 ± 10 K, равная 47.61 ± 1.84 кДж/моль.
Титанат кальция CaTiO3–перовскит – был обнаружен Густавом Розе [1] в Уральских горах в 1839 г. и назван им в честь русского государственного деятеля графа Льва Перовского. Атомы титана в перовските расположены в узлах слабо искаженной кубической решетки. В центрах псевдокубов располагаются атомы кальция. Атомы кислорода образуют вокруг атомов титана октаэдры, которые немного развернуты и наклонены относительно идеальных положений. Структурой перовскита обладают высокотемпературные сверхпроводники, ионные проводники, а также многие магнитные и сегнетоэлектрические материалы.
Настоящая работа является продолжением исследований термодинамических свойств перовскита [2], представляющего особый интерес при производстве новых видов высокоогнеупорных конструкционных керамических материалов из чистых оксидов, обусловленного высокой температурой плавления и целым рядом специфических физико-химических свойств [3], которые могут найти применение в солнечной энергетике [4].
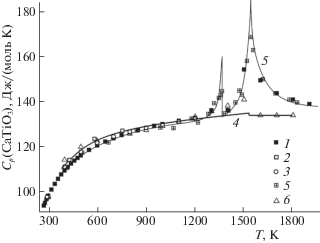
Термохимические данные о перовските [5–9] базируются на калориметрических измерениях значения энтропии образования перовскита ΔS298(CaTiO3), полученного Шомейтом [10], и высокотемпературной теплоемкости перовскита Cp(CaTiO3) в интервалах температур 15–398 K [11], 293–773 K [12], 376–1184 K [13], 383–1794 K [14] и 413–1825 K [15], расхождения между которыми не превышают 5 Дж/(моль K) в области температур до 1200 K, однако при более высоких температурах довольно противоречивы (рис. 1).
Нейлор и Кук [14] определили энтальпию фазового перехода перовскита, равную 2.30 ± 0.07 кДж/моль при температуре 1530 ± 1 K. Наблюдаемые Гайо и др. [15] перекрывающиеся фазовые переходы в перовските (рис. 1) объяснялись авторами последствиями структурных изменений – орторомбической (Pbnm) в орторомбическую (Cmcm) при температуре 1384 ± 10 K и наложением переходов – орторомбической в тетрагональную (I4/mcm) и тетрагональной в кубическую фазу ($Pm\bar {3}m$) при температуре 1520 ± 10 K с тепловыми эффектами, равными 1.0 ± 0.5 и 5.5 ± ± 0.5 кДж/моль соответственно. Значительная аномалия теплоемкости перовскита Cp(CaTiO3) выше 1520 K могла быть обусловлена сильной разупорядоченностью кубической фазы вплоть до температуры плавления перовскита. Однако Яшима и Али [16] на основании дифракционных данных о структуре перовскита, полученных в интервале температур 296–1720 K, уточняют, что фазы Cmcm не существует, и утверждают, что сначала происходит переход (Pbnm) → (I4/mcm) при температуре 1512 ± 13 K, а затем переход (I4/mcm) → → ($Pm\bar {3}m$) при температуре 1635 ± 2 K.
Панфилов и Федосьев [17] методом калориметрической бомбы при сжигании стехиометрических смесей рутила TiO2 и карбоната кальция CaCO3 определили энтальпию реакции
(1)
$[{\text{CaC}}{{{\text{O}}}_{{\text{3}}}}] + [{\text{Ti}}{{{\text{O}}}_{{\text{2}}}}] = [{\text{CaTi}}{{{\text{O}}}_{{\text{3}}}}] + ({\text{C}}{{{\text{O}}}_{{\text{2}}}})$(2)
$[{\text{CaO}}] + [{\text{Ti}}{{{\text{O}}}_{{\text{2}}}}] = [{\text{CaTi}}{{{\text{O}}}_{{\text{3}}}}]$Таблица 1.
Энтропия (ΔST, Дж/(моль K)) и энтальпия (ΔHT, кДж/моль) образования перовскита из простых оксидов (при расчете на 1 моль соединения)
| Метод исследования | Т, K | ΔHT | ΔST | Ссылка |
|---|---|---|---|---|
| HF/HCl калориметрия растворения | 298 | 1.05 ± 0.21 | [10] | |
| HF/HCl калориметрия растворения | 298 | –40.48 ± 0.42 | 1.86 ± 0.71 | [5, 18] |
| Калориметрия в бомбе | 298 | –41.84 ± 1.88 | [17] | |
| Адиабатическая калориметрия | 298 | –40.48 ± 1.65 | 2.40 ± 0.35 | [11] |
| Адиабатическая калориметрия | 298 | –47.11 ± 1.41 | 2.72 ± 0.23 | [13] |
| Na6Mo4O15 калориметрия растворения | 298 | –42.98 ± 1.96 | [27] | |
| ЭДС | 888–972 | –37.05 ± 3.28 | 4.62 ± 3.54 | [34] |
| ЭДС | 900–1250 | –40.07 ± 0.05 | 3.15 ± 0.05 | [36] |
| Pb2B2O5 калориметрия растворения | 973 | –38.73 ± 1.34 | [22] | |
| Na6Mo4O15 калориметрия растворения | 975 | –42.25 ± 1.05 | [24, 25] | |
| Na6Mo4O15 калориметрия растворения | 975 | –41.88 ± 1.36 | [26] | |
| Na6Mo4O15 калориметрия растворения | 976 | –42.86 ± 1.71 | [23] | |
| Pb2B2O5 калориметрия растворения | 1046 | –42.38 ± 1.82 | [22] | |
| (Li,Na)BO2 калориметрия растворения | 1068 ± 2 | –40.45 ± 1.15 | [19] | |
| Pb2B2O5 калориметрия растворения | 1073 | –40.43 ± 1.87 | 4.37 ± 1.23 | [20] |
| Pb2B2O5 калориметрия растворения | 1074 | –43.78 ± 1.73 | [21] | |
| Pb2B2O5 калориметрия растворения | 1078 | –42.83 ± 3.12 | [30] | |
| ЭДС | 1180–1290 | –26.88 ± 8.05 | 11.07 ± 6.44 | [33] |
| Рамановская спектроскопия | 1300 | 2.82 ± 1.29 | [32] | |
| Термохимические расчеты | 1600–1800 | –37.19 ± 0.14 | 5.85 ± 0.09 | [7] |
| Термохимические расчеты | 1600–2100 | –38.23 ± 0.04 | 5.00 ± 0.02 | [8] |
| Термохимические расчеты | 1600–2100 | –37.47 ± 0.03 | 5.60 ± 0.02 | [9] |
| ДТА | 1740 ± 20 | –37.55 ± 3.76 | [37] | |
| Масс-спектрометрический эффузионный Кнудсена | 1791–2241 | –39.98 ± 0.54 | 3.15 ± 0.28 | * |
| Масс-спектрометрический эффузионный Кнудсена | 2241–2398 | 7.73 ± 1.76 | 24.39 ± 0.76 | * |
Навротская и др. [11, 19–28] провели целый ряд исследований, выполненных различными калориметрическими методами (адиабатической калориметрией [11] и калориметрией растворения в солях (Li,Na)BO2 [19], Pb2B2O5 [20–22] и Na6Mo4O15 [23–28] в интервале температур 973–1074 K) и определили величину ΔHT(CaTiO3), находящуюся в пределах от –44 до –39 кДж/моль с погрешностью измерений до 2 кДж/моль (табл. 1). Такие расхождения могут быть вызваны свойствами используемых растворителей: оксидный растворитель Pb2B2O5 обладает низкой растворимостью перовскита и образующих его оксидов, расплав Na6Mo4O15 довольно летуч и становится непригодным при температурах выше 1000 K, а растворитель (Li,Na)BO2 гигроскопичен, что вызывает ряд трудностей при его синтезе [29]. Значение ΔH1078(CaTiO3), определенное Който и др. [30] подобным методом – калориметрии растворения в соли Pb2B2O5, менее точно, но близко к результатам Навротской и др. [19–28].
Данные Сато и др. [13], полученные методом адиабатической калориметрии, в области температур выше 1000 K имеют несистематические отклонения до 7 кДж/моль в определении энтальпий (HT–H298) и приблизительно такое же систематическое отклонение во всем интервале исследований в определении величины энтальпии образования перовскита ΔHT(CaTiO3) из оксидов (при расчете на 1 моль соединения), обусловленное применением в расчетах грубого полуэмпирического приближения, предложенного в работе [31]. Вместе с тем, величины энтропии образования перовскита ΔS298(CaTiO3), определенные Сато и др. [13], находятся в удовлетворительном соответствии c полученными Келли и Мах [5] и в работах [11, 20], а также рассчитанными Жиллет и др. [32] на основании информации, полученной ими методом рамановской спектроскопии (табл. 1).
Голубенко и Резухина [33] методом ЭДС в интервале температур 1180–1290 K изучали гетерогенную реакцию
(3)
$[{\text{CaO}}] + 1{\text{/}}2[{\text{T}}{{{\text{i}}}_{{\text{2}}}}{\text{O}}] + 3{\text{/}}4({{{\text{O}}}_{{\text{2}}}}) = [{\text{CaTi}}{{{\text{O}}}_{{\text{3}}}}].$Электрод сравнения представлял собой смесь FeO и Fe (или NbO и Nb). В качестве твердого электролита использовали приготовленную смесь кристаллов La2O3–ThO2. Энергию Гиббса перовскита ΔGT(CaTiO3) рассчитывали на основании компиляции довольно приблизительных литературных данных и собственных оценок термодинамических свойств соединения [Ti2O], что и обусловливает значительную погрешность определения этой величины (рис. 2). Позднее Резухина и др. [34] провели более точные измерения по определению значений ΔGT(CaTiO3) в области температур 888–972 K с гальванической ячейкой, использующей в качестве твердого электролита CaF2 (рис. 2), хотя и в этом случае несистематические погрешности в определении величин ΔHT(CaTiO3) и ΔST(CaTiO3) оказались также значительными (табл. 1).
Рис. 2.
Энергия Гиббса образования перовскита из простых оксидов (при расчете на 1 моль соединения), определенная: 1 и 2 – калориметрическими методами [13, 20] соответственно; 3–6 – методом ЭДС [33–36] соответственно; 7–9 – масс-спектрометрическим эффузионным методом Кнудсена [46, 47] и в настоящей работе соответственно; и 10 и 11 – рассчитанная по термохимическим данным [9, 11] соответственно.
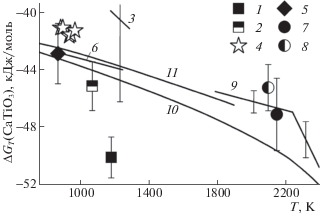
Методом ЭДС с использованием такого же твердого электролита Тейлор и Шмальцрид [35] при температуре 873 K и Жакоб и Абрахам [36] в области температур 900–1250 K также определяли величины энергии Гиббса перовскита. Полученные значения ΔGT(CaTiO3) были близки к результатам Резухиной и др. [34].
Климм и др. [37] методом дифференциального термического анализа (ДТА) определили энтальпию реакции (2) при температуре 1740 ± 20 K и оценили энтальпию плавления перовскита, равную 56.65 ± 11.33 кДж/моль при температуре 2220 ± 20 K (табл. 2), что довольно близко к ранее сделанным термохимическим оценкам [9, 43].
Таблица 2.
Температуры, энтальпии и энтропии плавления соединений в системе CaO–TiO2 (расчет на 1 моль соединения)
| Соединение | Tmelt, K | ΔHmelt, кДж/моль | ΔSmelt, Дж/(моль К) | Ссылка |
|---|---|---|---|---|
| CaO | 2843 | 52.00 | 18.29 | [43] |
| » | 2845 | 79.50 | 27.94 | [9] |
| » | 2898 | 50.21 | 17.33 | [3] |
| » | 2900 ± 150 | 52.00 ± 5.00 | 17.93 ± 1.72 | [41] |
| » | 2980 | 51.21 | 17.19 | [38] |
| » | 3200 | 79.50 | 24.84 | [8, 42] |
| CaTiO3 | 2188 | [7] | ||
| » | 2188 | 41.84 | 19.12 | [40] |
| » | 2220 ± 20 | 56.65 ± 11.33 | 25.52 ± 5.10 | [37] |
| » | 2233 ± 30 | [6, 8] | ||
| » | 2233 | 53.32 | 23.88 | [9] |
| » | 2241 ± 10 | 47.61 ± 1.84 | 21.24 ± 0.81 | Данная работа |
| » | 2243 ± 10 | [39] | ||
| » | 2243 | 63.65 | 28.38 | [43] |
| TiO2 | 2098 | 47.70 | 22.73 | [38] |
| » | 2103 | [7] | ||
| » | 2103 | 66.90 | 31.81 | [43] |
| » | 2130 ± 20 | 66.94 ± 16.70 | 31.43 ± 7.84 | [8, 42] |
| » | 2130 | 46.02 | 21.61 | [9] |
| » | 2143 | 64.85 | 30.26 | [3] |
| » | 2185 ± 10 | 68.00 ± 8.00 | 31.12 ± 3.66 | [41] |
Суито и др. [44, 45] при температуре 1873 K исследовали равновесие:
в шлаках CaO–TiOx (или CaO–TiOx–A12O3) с жидким никелем по отношению к кислороду и азоту в зависимости от содержания Ti (или A1) в металле с использованием тиглей из CaO или Al2O3. В этом случае активность оксида титана также оценивали косвенным образом в зависимости от содержания в шлаке Al, Ti и О, используя данные об энергии Гиббса образования оксидов (рис. 3б). Более точно Банон и др. [46] и Шорников и Арчаков [47] определили значения активностей CaO и TiO2 (рис. 3) и энергию Гиббса перовскита ΔGT(CaTiO3) масс-спектрометрическим эффузионным методом Кнудсена при относительно близких температурах (~2150 K). В пределах погрешностей, не превышающих 2.5 кДж/моль, полученные значения коррелировали между собой, однако величины ΔGT(CaTiO3) относились к температуре на ~1000 K выше, чем в уже рассмотренных ранее результатах (рис. 2).Таким образом, имеющаяся экспериментальная термодинамическая информация о термодинамических свойствах перовскита в области температур до 1200 K представляется обширной, однако довольно неточной: различия в значениях теплоемкостей перовскита составляют до 5 Дж/(моль K), в энтальпиях и энтропиях образования перовскита – до 5 кДж/моль и до 2 Дж/(моль K) соответственно (табл. 1). В области высоких температур (выше 1800 K) термодинамическая информация скудна и ограничивается результатами разрозненных экспериментов. Имеющиеся экспериментальные и теоретические термодинамические оценки, характеризующие плавление перовскита, приблизительны: значение температуры плавления перовскита находится в интервале от 2188 до 2243 K (по различным термохимическим данным), точность определения величины энтальпии плавления перовскита превышает 20%. Заметим, что данные, характеризующие плавление простых оксидов [3, 7–9, 38, 41–43], также довольно грубы (табл. 2).
Цель настоящей работы – изучение термодинамических свойств перовскита масс-спектрометрическим эффузионным методом Кнудсена в области высоких температур (выше 1800 K). Экспериментальные особенности аппаратуры детально описаны в ранее [48].
РЕЗУЛЬТАТЫ ЭКСПЕРИМЕНТА
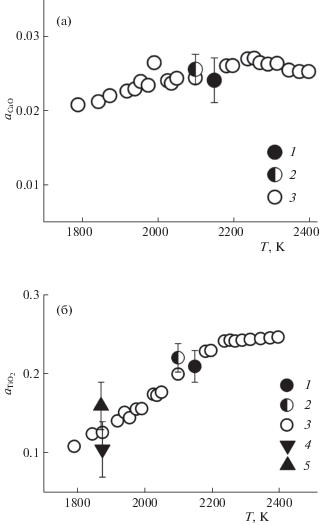
Исходные данные для расчета активностей оксидов в перовските – парциальные давления компонентов газовой фазы над перовскитом (рис. 4), определенные масс-спектрометрическим эффузионным методом Кнудсена в интервале температур 1791–2182 K [2]. Значения активностей оксидов в перовските, приведенные на рис. 3, были рассчитаны на основании соотношения Льюиса [49]:
(5)
${{a}_{{{\text{CaO}}}}} = \frac{{{{p}_{{{\text{CaO}}}}}}}{{p_{{{\text{CaO}}}}^{ \circ }}} = \frac{{{{p}_{{{\text{Ca}}}}}{{p}_{{\text{O}}}}}}{{p_{{{\text{Ca}}}}^{ \circ }p_{{\text{O}}}^{ \circ }}},$(6)
${{a}_{{{\text{Ti}}{{{\text{O}}}_{{\text{2}}}}}}} = \frac{{{{p}_{{{\text{Ti}}{{{\text{O}}}_{{\text{2}}}}}}}}}{{p_{{{\text{Ti}}{{{\text{O}}}_{{\text{2}}}}}}^{ \circ }}} = \left( {\frac{{{{p}_{{{\text{TiO}}}}}}}{{p_{{{\text{TiO}}}}^{ \circ }}}} \right)\left( {\frac{{{{p}_{{\text{O}}}}}}{{p_{{\text{O}}}^{ \circ }}}} \right),$Рис. 4.
Парциальные давления компонентов газовой фазы над перовскитом [2]: 1 – Ca, 2 – CaO, 3 – Ti, 4 – TiO, 5 – TiO2, 6 – O, 7 – O2, 8 – CaTiO3.

Величины активностей оксидов в перовските в кристаллическом состоянии в области более высоких температур (2182–2241 K) были найдены с использованием данных [47], полученных при исследовании испарения расплавов системы CaTiO3–SiO2, составы которых за счет преимущественного испарения диоксида кремния из расплава достигали линии ликвидуса области “CaTiO3 + жидкость” [39] (рис. 5). Значения ${{a}_{{{\text{CaO}}}}}$ и ${{a}_{{{\text{Si}}{{{\text{O}}}_{{\text{2}}}}}}}$ рассчитывались в этом случае по методу Белтона–Фруехана [50] по следующему соотношению:
(7)
$\ln {{a}_{i}} = - \int {{{x}_{j}}d\ln \frac{{{{a}_{j}}}}{{{{a}_{i}}}}} - \int {{{x}_{k}}d\ln \frac{{{{a}_{k}}}}{{{{a}_{i}}}}} ,$(8)
$\ln {{a}_{{{\text{Si}}{{{\text{O}}}_{{\text{2}}}}}}} = - \int {{{x}_{{{\text{CaO}}}}}d} \ln \frac{{{{I}_{{{\text{Ca}}}}}}}{{{{I}_{{{\text{SiO}}}}}}} - \int {{{x}_{{{\text{Ti}}{{{\text{O}}}_{2}}}}}} d\ln \frac{{{{I}_{{{\text{TiO}}}}}}}{{{{I}_{{{\text{SiO}}}}}}},$(9)
$\ln {{a}_{{{\text{Cao}}}}} = - \int {{{x}_{{{\text{Si}}{{{\text{O}}}_{2}}}}}d} \ln \frac{{{{I}_{{{\text{SiO}}}}}}}{{{{I}_{{{\text{Ca}}}}}}} - \int {{{x}_{{{\text{Ti}}{{{\text{O}}}_{2}}}}}} d\ln \frac{{{{I}_{{{\text{TiO}}}}}}}{{{{I}_{{{\text{Ca}}}}}}},$(10)
$\ln {{a}_{{{\text{Ti}}{{{\text{O}}}_{{\text{2}}}}}}} = - \int {\frac{{{{x}_{{{\text{CaO}}}}}}}{{{{x}_{{{\text{Ti}}{{{\text{O}}}_{{\text{2}}}}}}}}}d\ln {{a}_{{{\text{CaO}}}}}} - \int {\frac{{{{x}_{{{\text{Si}}{{{\text{O}}}_{{\text{2}}}}}}}}}{{{{x}_{{{\text{Ti}}{{{\text{O}}}_{{\text{2}}}}}}}}}} d\ln {{a}_{{{\text{Si}}{{{\text{O}}}_{{\text{2}}}}}}}.$Рис. 5.
Диаграмма состояния CaTiO3–SiO2 [39]. Обозначения: 1 – CaTiO3 + жидкость, 2 – CaTiO3 + CaTiSiO5, 3 и 4 – CaTiSiO5 + жидкость, 5 – CaTiSiO5 + SiO2 (тридимит), 6 – SiO2 (тридимит) + жидкость, 7 – SiO2 (кристобалит) + жидкость, 8 – SiO2 (кристобалит) + две жидкости, 9 – две жидкости, 10 – SiO2 (кристобалит) + жидкость, 11 – жидкость.

Величина энергии Гиббса перовскита ΔGT(CaTiO3) была найдена по известному соотношению [51]:
(11)
$\Delta {{G}_{T}}({\text{CaTi}}{{{\text{O}}}_{{\text{3}}}}) = RT\sum\limits_i {{{x}_{i}}\ln {{a}_{i}}} ,$Величины активностей оксидов, рассчитанные по соотношениям (9) и (10), также приведены на рис. 3. Эти данные позволяли рассчитать энергии Гиббса перовскита в жидком состоянии и по соотношению (11) найти энтальпии и энтропии образования перовскита в жидком состоянии, равные ΔHT(CaTiO3) = 7.73 ± 1.76 кДж/моль и ΔST(CaTiO3) = 24.39 ± 0.76 Дж/(моль K) соответственно. Из разностей величин энтальпий (или энтропий), относящихся к жидкой (liq) и к кристаллической (sol) фазам были рассчитаны энтальпия, энтропия и температура плавления перовскита (табл. 2) по следующим соотношениям [51]:
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Как следует из рис. 3, определенные в настоящей работе по соотношениям (5), (6) и (9), (10) значения активностей оксидов в перовските согласуются между собой в рассматриваемой температурной области. Наблюдается незначительная тенденция повышения активностей оксидов кальция (рис. 3а) и титана (рис. 3б) в кристаллической фазе перовскита с ростом температуры. В области жидкой фазы эта тенденция менее замета. Величины активностей оксидов в перовските (рис. 3), полученные в настоящей работе, удовлетворительно коррелируют с определенными масс-спектрометрическим эффузионным методом Кнудсена [46, 47]. Активности оксида титана (рис. 3б), рассчитанные на основании исследований равновесий в шлаках в работах [44–45], довольно приблизительны, хотя и не противоречат результатам настоящей работы.
Значения энергий Гиббса перовскита, определенные в интервале температур 800–1200 K методами ЭДС [33–36] и калориметрии растворения [20], удовлетворительно коррелируют с полученными в настоящей работе. На рис. 2 можно заметить хорошее совпадение наших данных с результатами термохимических расчетов, выполненных Вудфилд и др. [11]. Расхождение с термохимическими данными, рассчитанными Бейл и др. [9], максимально в области точки плавления перовскита, но не превышает 3 кДж/моль.
Как следует из табл. 1, определенные в настоящей работе величины ΔHT(CaTiO3) и ΔST(CaTiO3) коррелируют с результатами работ, выполненных методом калориметрии растворения [19, 20, 22, 23, 30] и методом ЭДС [34, 36], выполненными при более низких температурах, а также в близкой температурной области методом рамановской спектроскопии [32] и методом ДТА [37].
Рассчитанные по соотношениям (13)–(15) величины, характеризующие плавление перовскита (табл. 2), удовлетворительно совпадают с экспериментальными данными, полученными Климм и др. [37], к которым наиболее близки термохимические оценки, сделанные Бейл и др. [9] и Нерад и Данек [43]. Оценка энтальпии плавления перовскита, сделанная по известному эмпирическому правилу Вальдена [52]:
(16)
$\begin{gathered} \Delta {{H}_{{melt}}} = {\text{8}}.{\text{8}}\;[{\text{Д ж /(г - а т }}\;{\text{K}})]{{T}_{{melt}}} = \\ = {\text{49}}.{\text{39}}\;{\text{к Д ж /м о л ь }} \\ \end{gathered} $Таким образом, на основании данных, полученных масс-спектрометрическим эффузионным методом Кнудсена, определены значения активностей оксидов в перовските CaTiO3 в области температур 1791–2398 K, относящиеся как к кристаллическому, так и к жидкому состоянию перовскита. Найденные величины энергии Гиббса, а также энтальпии и энтропии образования перовскита из простых оксидов (–39.88 ± 0.54 кДж/моль и 3.15 ± ± 0.28 Дж/(моль K) соответственно) и энтальпия плавления перовскита при температуре 2241 ± ± 10 K (47.61 ± 1.84 кДж/моль, при расчете на 1 моль соединения) удовлетворительно соответствуют имеющейся термодинамической информации.
Список литературы
Rose G. // J. Prakt. Chem. 1840. V. 19. № 1. P. 459.
Shornikov S.I. // Russ. J. Phys. Chem. A. 2019. V. 93. № 6. P. 866.
Бережной А.С. Многокомпонентные системы окислов . Киев: Наукова думка, 1970. 544 с.
Coontz R. // Sci. 2013 V. 342. № 6165. P. 1438.
Kelley K.K., Mah A.D. // U. S. Bur. Min. Repts. 1959. № 5490. 48 p.
Reznitskii L.A., Guzei A.S. // Russ. Chem. Rev. 1978. V. 47. № 2. P. 99.
Robie R.A., Hemingway B.S. // U. S. Geol. Surv. Bull. 1995. № 2131. 461 p.
Barin I. Thermochemical Data of Pure Substances. Weinheim: VCH, 1995. 2003 p.
Bale C.W., Belisle E., Chartrand P., Decterov S.A., Eriksson G., Gheribi A.E., Hack K., Jung I.-H., Kang Y.-B., Melancon C., Pelton A.D., Petersen S., Robelin C., Sangster J., Spencer P., Van Ende M.-A. FactSage thermochemical software and databases, 2010–2016 // CALPHAD. 2016. V. 54. P. 35.
Shomate C. H. // J. Amer. Chem. Soc. 1946. V. 68. № 6. P. 964.
Woodfield B.F., Shapiro J.L., Stevens R. et al. // J. Chem. Thermodyn. 1999. V. 31. № 12. P. 1573.
Buykx W.J. // J. Nucl. Mater. 1982. V. 107. № 1. P. 78.
Sato T., Yamazaki S., Yamashita T. et al. // J. Nucl. Mater. 2001. V. 294. P. 135.
Naylor B.F., Cook O.A. // J. Amer. Chem. Soc. 1946. V. 68. № 6. P. 1003.
Guyot F., Richet P., Courtial P., Gillet P. // Phys. Chem. Miner. 1993. V. 20. № 3. P. 141.
Yashima M., Ali R. // Solid State Ionics. 2009. V. 180. № 2–3. P. 120.
Панфилов Б.И., Федосьев Н.Н. // Журн. неорг. химии. 1964. Т. 9. № 12. С. 2685–2692.
Kelley K.K., Todd S.S., King E.G. // U. S. Bur. Min. Repts. 1954. № 5059. 37 p.
Takayama-Muromachi E., Navrotsky A. // J. Solid State Chem. 1988. V. 72. № 2. P. 244.
Prasanna T.R.S., Navrotsky A. // J. Mater. Res. 1994. V. 9. № 12. P. 3121.
Linton J., Navrotsky A., Fei Y. // Phys. Chem. Miner. 1998. V. 25. № 8. P. 591.
Putnam R.L., Navrotsky A., Woodfield B.F. et al. // J. Chem. Thermodyn. 1999. V. 31. № 2. P. 229.
Helean K.B., Navrotsky A., Vance E.R. et al. //J. Nucl. Mater. 2002. V. 303. № 2–3. P. 226.
Navrotsky A. // ECS Trans. 2012. V. 45. № 1. P. 11.
Navi N.U., Shneck R.Z., Shvareva T.Y. et al. // J. Amer. Ceram. Soc. 2012. V. 95. № 5. P. 1717.
Sahu S.K., Maram P.S., Navrotsky A. // J. Amer. Ceram. Soc. 2013. V. 96. № 11. P. 3670.
Feng D., Shivaramaiah R., Navrotsky A. // Amer. Miner. 2016. V. 101. № 9. P. 2051.
Gong W., Wu L., Navrotsky A. // J. Amer. Ceram. Soc. 2018. V. 101. № 3. P. 1361.
Topor N.D., Suponitskii Yu.L. // Russ. Chem. Rev. 1984. V. 53. № 9. P. 827.
Koito S., Akaogi M., Kubota O., Suzuki T. // Phys. Earth Planet. Inter. 2000. V. 120. № 1–2. P. 1.
Aronson S. // J. Nucl. Mater. 1982. V. 107. № 2–3. P. 34.
Gillet P., Guyot F., Price G.D. et al. // Phys. Chem. Miner. 1993. V. 20. № 3. P. 159.
Голубенко А.Н., Резухина Т.Н. // Журн. физ. химии. 1964. Т. 38. № 12. С. 2920.
Резухина Т.Н., Левицкий В.А., Френкель М.Я. // Изв. АН СССР. Неорг. материалы. 1966. Т. 2. № 2. С. 325.
Taylor R.W., Schmalzried H. // J. Phys. Chem. 1964. V. 68. № 9. P. 2444.
Jacob K.T., Abraham K.P. // J. Chem. Thermodyn. 2009. V. 41. № 6. P. 816.
Klimm D., Schmidt M., Wolff N. et al. // J. Cryst. Growth. 2018. V. 486. P. 117.
Kelley K.K. // U. S. Min. Bull. 1936. № 393. 166 p.
DeVries R.C., Roy R., Osborn E.F. // J. Amer. Ceram. Soc. 1955. V. 38. № 5. P. 158.
Bottinga Y., Richet P. // Earth Planet. Sci. Lett. 1978. V. 40. P. 382.
Глушко В.П., Гурвич Л.В., Бергман Г.А., Вейц И.В., Медведев В.А., Хачкурузов Г.А., Юнгман В.С. Термодинамические свойства индивидуальных веществ. Справочник (под ред. В. П. Глушко). М.: Наука. 1978–1982.
Chase M.W. // J. Phys. Chem. Ref. Data. 1998. Monograph № 9. 1951 p.
Nerad I., Danek V. // Chem. Pap. 2002. V. 56. № 2. P. 77.
Cho S.-W., Suito H. // Met. Mater. Trans. A. 1994. V. 25. № 2. P. 5.
Kishi M., Suito H. // Steel Res. 1994. V. 65. № 7. P. 261.
Banon S., Chatillon C., Allibert M. // Can. Met. Q. 1981. V. 20. № 1. P. 79.
Shornikov S.I., Archakov I.Yu. // Proc. II Intern. Symp. on High Temperature Mass Spectrometry. Ed. L. Kudin, M. Butman, A. Smirnov. Ivanovo: ISUCST, 2003. P. 112.
Shornikov S.I., Archakov I.Yu., Chemekova T.Yu. // Russ. J. Phys. Chem. 2000. V. 74. № 5. P. 677.
Lewis G.N., Randall M. Thermodynamics and the Free Energy of Chemical Substances. N. Y. and London: McGrow-Hill book comp., 1923. 676 p.
Belton G.R., Fruehan R.J. // Met. Trans. B. 1971. V. 2. № 1. P. 291.
Prigogine I., Defay R. Chemical Thermodynamics. London: Longman, 1954. 543 p.
Куликов И.С. Термическая диссоциация соединений. М.: Металлургия, 1969. 2-е изд. 576 с.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии