Журнал физической химии, 2019, T. 93, № 8, стр. 1159-1163
Низкотемпературный синтез карбонитрида циркония при восстановлении ZrO2 магнием в присутствии Na2CO3 в атмосфере азота
Р. А. Шишкин a, *, В. С. Кудрякова a
a Уральский федеральный университет имени первого Президента России Б.Н. Ельцина, Физико-технологический институт
Екатеринбург, Россия
* E-mail: roman.shishkin@urfu.ru
Поступила в редакцию 09.11.2018
После доработки 09.11.2018
Принята к публикации 20.11.2018
Аннотация
Исследованы физико-химические превращения в процессе низкотемпературного синтеза карбонитрида циркония при восстановлении оксида циркония магнием в присутствии карбоната натрия в атмосфере азота. С помощью дифференциальной сканирующей калориметрии исследованы как реакции, ведущие к образованию Zr2CN, так и побочные процессы, протекающие в шихте. На основании полученных результатов сделан вывод о возможности образования карбонитрида циркония в температурном диапазоне 600–675°С. Показано, что применение графита не приводит к образованию карбида или карбонитрида циркония в исследуемом интервале температур, а использование мочевины практически не влияет на конечный продукт.
Карбиды, нитриды и карбонитриды переходных металлов III–V групп представляют большой интерес благодаря их выдающимся физико-химическим свойствам [1], в частности, высокой температуре плавления, твердости, химической стойкости, прочности, износостойкости, термостойкости [2, 3]. Такие характеристики Zr2CN позволяют его применять в качестве износостойких покрытий, барьерных слоев.
На текущий момент разработан ряд методов синтеза карбонитридов переходных металлов, в том числе карбонитрида циркония: пиролиз органических прекурсоров [4–6], сольвотермический синтез [7, 8], химическое осаждение из газовой фазы [9], карботермическое восстановление в среде азотсодержащего газа [10, 11] или сжигание [11, 12]. В последние годы особый интерес прикован к методам совместного восстановления неорганических соединений, содержащих переходный металл, и карбоната щелочного или щелочно-земельного металла металлическим магнием [13–15]. Однако при этом не рассматривалась возможность проведения синтеза в азотсодержащей атмосфере, использование которой представляется перспективным как с точки зрения источника азота, так и дополнительного восстановителя.
Реакция образования карбонитрида циркония может быть записана в следующем виде:
(1)
$\begin{gathered} 2{\text{Zr}}{{{\text{O}}}_{2}} + {\text{N}}{{{\text{a}}}_{2}}{\text{C}}{{{\text{O}}}_{3}} + 6{\text{Mg}} + 0.5{\text{N}}_{2}^{{({\text{г }})}} = \\ = {\text{Z}}{{{\text{r}}}_{2}}{\text{CN}} + 6{\text{MgO}} + {\text{N}}{{{\text{a}}}_{2}}{\text{O}}. \\ \end{gathered} $Однако, остаются неясными химические превращения при совместном восстановлении оксида циркония и карбоната щелочного металла металлическим магнием в азотсодержащей атмосфере. Исследование процессов, происходящих в шихте, позволит не только подобрать оптимальные температуры синтеза, но и отказаться от использования стального автоклава и длительного времени синтеза 8–12 ч, стандартно применяемых в таких технологиях.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В качестве исходных реагентов использовали оксид циркония (“oc.ч.” 9-2), карбонат натрия (“х.ч.”), порошок металлического магния (МПФ-1, хранящийся в керосине), графит порошкообразный (ГИИ-А) и мочевину (“ч.д.а.”). Состав четырех образцов представлен в табл. 1. Исследуемые образцы помещали в алундовый тигель, в котором проводили синхронный термогравиметрический анализ с дифференциально-сканирующей калориметрией на приборе Sentsys EVO 1600 при нагревании до 1200°С в атмосфере азота особой чистоты (99.999%). Полученный продукт промывали 0.1 М соляной кислотой и изопропиловым спиртом на фильтре белая лента, после чего сушили в течение 4 ч при 90°С.
Таблица 1.
Состав образцов, мол. %
| № | ZrO2 | Mg | Na2CO3 | С | Мочевина |
|---|---|---|---|---|---|
| 1 | 33 | 67 | – | – | – |
| 2 | 29 | 57 | – | 14 | – |
| 3 | 22 | 67 | 11 | – | – |
| 4 | 20 | 60 | 10 | – | 10 |
Рентгенофазовый анализ выполняли на дифрактометре Xpert PRO MRD с вертикальным гониометром и никелевым фильтром на вторичном пучке на излучении CuKα с фокусировкой по Бреггу–Брентано. Для расшифровки полученных данных использовали картотеку PDF-2 и специализированное программное обеспечение полнопрофильного анализа Rietvelda.
Расчеты проводили с помощью программы HSC Chemistry v.6.1, имеющей полную базу современных взаимосогласованных термодинамических данных и позволяющей рассчитывать термодинамические параметры с учетом образования твердых, жидких и газообразных продуктов.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
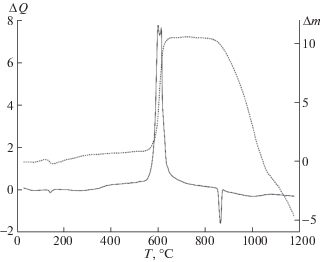
Образец 1. Термограмма образца 1, представленная на рис. 1, показала наличие нескольких экзотермических процессов, протекающих при восстановлении оксида циркония металлическим магнием в потоке азота. До 500°С наблюдается увеличение массы шихты на 1.79%, что может быть связано с поглощением газообразного азота металлическим магнием. При 584.07°С (‒1.63 Дж/г) происходит реакция образования нитрида магния:
(2)
$\begin{gathered} 3{\text{Mg}} + {{{\text{N}}}_{2}} = {\text{M}}{{{\text{g}}}_{{\text{3}}}}{{{\text{N}}}_{2}}, \\ \Delta G({\text{584}}^\circ {\text{С }}) = - {\text{288}}.{\text{19}}\;{\text{к Д ж /м о л ь }}. \\ \end{gathered} $Дальнейшее увеличение температуры приводит к восстановлению оксида циркония металлическим магнием при температуре 600.93°С с выделением тепла (–115.08 Дж/г):
(3)
$\begin{gathered} {\text{Zr}}{{{\text{O}}}_{2}} + 2{\text{Mg}} = {\text{Zr}} + 2{\text{MgO,}} \\ \Delta G({\text{6}}00^\circ {\text{С }}) = - {\text{82}}.{\text{15}}\;{\text{к Д ж /м о л ь }}. \\ \end{gathered} $Начало образования нитрида циркония зафиксировано при температуре 627.33°С с экзотермическим эффектом –1953.03 Дж/г. Совокупное увеличение массы, вызванное азотированием циркония и магния в температурном диапазоне от 500 до 700°С, составило 10.08%. Последний экзотермический процесс при 651.02°С (–4.02 Дж/г) можно объяснить реакцией между нитридом магния и непрореагировавшим металлическим цирконием:
(4)
$\begin{gathered} 2{\text{Zr}} + {\text{M}}{{{\text{g}}}_{{\text{3}}}}{{{\text{N}}}_{{\text{2}}}} = 2{\text{ZrN}} + 3{\text{Mg,}} \\ \Delta G({\text{65}}0^\circ {\text{С }}) = - {\text{28}}0.{\text{49}}\;{\text{к Д ж /м о л ь }}. \\ \end{gathered} $Образец 2. Во втором образце, представляющим собой механическую смесь порошков оксида циркония, металлического магния и графита, также наблюдается увеличение массы шихты при температурах до 500°С на 1.35% (рис. 2). Характер основного экзотермического пика остается аналогичным зарегистрированному с образца 1 – происходит азотирование магния (реакция (2)), восстановление оксида циркония (реакция (3)) и последующее его азотирование.
Однако перечисленные процессы наблюдаются в более высокотемпературной области по сравнению с образцом 1 вследствие наличия в шихте графита. Так, пик, отвечающий восстановлению оксида циркония, зафиксирован при температуре 647.15°С, а образование нитрида циркония происходит при 661.96°С. Также значительно уменьшилась величина экзотермических пиков этих реакций – восстановление циркония из оксида сопровождается выделением 70.93 Дж/г, что на 38% ниже, чем в первом образце. А азотирование циркония сопровождается экзотермическим эффектом – 845.20 Дж/г, что на 56% меньше, чем в отсутствие графита.
Следует отметить, что увеличение массы шихты в температурном диапазоне от 500 до 700°С составило 9.98%, как и в случае с образцом 1. Пик на 669.97°С с выделением 53.37 Дж/г тепла связан с реакцией (4). Однако, в отличие от первого образца, наблюдается резкое снижение массы образца на 6.78% при температурах выше 700°С без явных химических превращений, что может быть связано с медленным тлением графита ввиду наличия на его поверхности адсорбированного кислорода. Это подтверждается ярко выраженным падением теплового потока при 1000°С, которое совпадает с окончанием падения массы шихты. На дифрактограмме образца 2 присутствуют пики нитрида циркония и графита, не вступившего в реакцию при температурах синтеза, и полностью отсутствуют пики ZrC и Zr2CN.
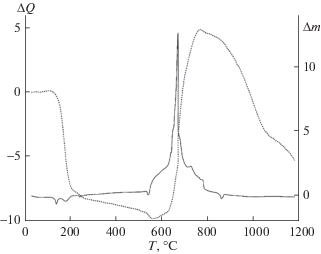
Образец 3. Термограмма образца 3, представляющего собой механическую смесь оксида циркония, карбоната натрия и металлического магния в атмосфере азота представлена на рис. 3.
Первый процесс эндотермического характера (9.09 Дж/г) связан с разрушением кристаллогидрата карбоната натрия при 143.64°С и падением массы шихты на 0.33%. До 500°С происходит поглощение азота металлическим магнием и, как следствие, увеличение массы шихты на 1.05%.
Характер основного экзотермического процесса значительно отличается от наблюдаемого для предыдущих образцов (однако при этом не происходит смещения пиков, как в образце 2): наблюдаются два сильных экзотермических процесса при 601.32 и 615.36°С с выделением тепла в количестве 1718.59 и 67.19 Дж/г соответственно. Первый процесс связан с восстановлением оксида циркония и карбоната натрия металлическим магнием (реакции (3), (5)). При протекании реакции восстановления Na2CO3 (5) происходит образование активной формы углерода [16–18], которая способствует образованию карбида циркония при низких температурах:
(5)
$\begin{gathered} {\text{N}}{{{\text{a}}}_{{\text{2}}}}{\text{C}}{{{\text{O}}}_{{\text{3}}}} + 2{\text{Mg}} = 2{\text{MgO}} + {\text{N}}{{{\text{a}}}_{{\text{2}}}}{\text{O}} + {\text{C}}*, \\ \Delta G({\text{6}}00^\circ {\text{С }}) = - {\text{426}}.{\text{31}}\;{\text{к Д ж /м о л ь }}{\text{.}} \\ \end{gathered} $Второй процесс, в результате которого масса шихты увеличивается на 9.69%, связан с формированием карбонитрида и нитрида циркония:
(6)
$\begin{gathered} 3{\text{Zr}} + {\text{CN}}_{{\text{2}}}^{{{\text{(г )}}}} = {\text{Z}}{{{\text{r}}}_{{\text{2}}}}{\text{CN}} + {\text{ZrN,}} \\ \Delta G({\text{615}}^\circ {\text{С }}) = - {\text{192}}.{\text{82}}\;{\text{к Д ж /м о л ь }}. \\ \end{gathered} $Разложение непрореагировавшего карбоната натрия с убылью массы на 11.72% происходит при 865.97°С.
Дифрактограмма полученного образца представлена на рис. 4. Очевидно, присутствие двух основных фаз – карбонитрида циркония (2/1/1) и нитрида циркония; ZrN сформировался из-за недостатка активного углерода, вследствие недостаточной степени завершенности реакции (5).
Образец 4. Добавка мочевины в исходную шихту вызывает ряд новых процессов при формировании карбонитрида циркония. Как и в образце 2 при 140.05°С происходит разрушение кристаллогидрата карбоната натрия с эндотермическим эффектом 25.97 Дж/г. Разложение карбамида происходит при 182.49°С и с потерей массы шихты на 7.69%:
(7)
$\begin{gathered} {\text{CO(N}}{{{\text{H}}}_{{\text{2}}}}{{{\text{)}}}_{2}} \to {\text{HNCO}} + {\text{N}}{{{\text{H}}}_{{\text{3}}}}, \\ \Delta G({\text{14}}0^\circ {\text{С }}) = - {\text{17}}0.{\text{58}}\;{\text{к Д ж /м о л ь }}. \\ \end{gathered} $Далее происходит разложение образовавшихся соединений при 242.26°С (2.19 Дж/г) с потерей еще 0.68% массы при 260°С и 1.06% массы при 560°С. Окончательное разложение субпродуктов пиролиза мочевины происходит при 543.19°С с поглощением 33.15 Дж/г и уменьшением массы на 0.48%, что согласуется с известными данными [19].
Термограмма образца 4 значительно отличается от полученных для других образцов (рис. 5).
Азотирование магния наблюдается при 641.28°С, восстановление оксида циркония и карбоната натрия при 648.78°С. Образование карбонитрида и нитрида циркония происходит при 672.42°С с экзотермическим эффектом 347.98 Дж/г (по реакции (6)). Происходит увеличение массы навески 14.08% с ростом температуры от 600 до 750°С, что подтверждает образование нитрида и карбонитрида циркония. Добавление мочевины и ее пиролиз повлияли на проведение магнийтермии оксида циркония схожим образом, как и графит в образце 2: химические реакции смещены в более высокотемпературную зону на 50–70°С.
Последний пик, относящийся к пиролизу мочевины [19], наблюдается при 683.07°С (–14.04 Дж/г) и соответствует разложению моноамида циануровой кислоты. Образующиеся в результате разложения продуктов пиролиза мочевины пары NH3 и CO вступают в реакцию с непрореагировавшим цирконием с образованием нитрида (729.06°C, –16.19 Дж/г) и карбида циркония (766.29°С, –1.26 Дж/г) соответственно:
(8)
$\begin{gathered} {\text{Zr}} + {\text{NH}}_{3}^{{({\text{г }})}} = {\text{ZrN}} + 1.5{\text{H}}_{2}^{{({\text{г }})}}, \\ \Delta G(766^\circ {\text{С }}) = --332.35\;{\text{к Д ж /м о л ь }}, \\ \end{gathered} $(9)
$\begin{gathered} {\text{Zr}} + 2{\text{C}}{{{\text{O}}}^{{({\text{г }})}}} = {\;ZrC} + {\text{CO}}_{2}^{{({\text{г }})}}, \\ \Delta G(729^\circ {\text{С }}) = --174.99\;{\text{к Д ж /м о л ь }}. \\ \end{gathered} $При 863.06°С происходит плавление с разложением непрореагировавшего карбоната натрия с падением массы на 9.37%.
Таким образом, при изучении физико-химических процессов, протекающих при совместном восстановлении оксида циркония и карбоната натрия в азотсодержащей атмосфере, установлено, что в потоке азота происходит образование карбонитрида циркония в температурном интервале 600–675°С. С помощью рентгенофазового анализа подтверждено, что использование графита не приводит к образованию ни карбида, ни карбонитрида циркония в процессе низкотемпературного синтеза, однако присутствие графита приводит к смещению процессов образования карбонитрида циркония в более высокотемпературную область.
Исследования проводились в рамках выполнения работ по ФЦП “Исследования и разработки по приоритетным направлениям развития научно-технологического комплекса России на 2014–2020 годы”, соглашение № 14.578.21.0200 (уникальный идентификатор ПНИЭР RFMEFI57816X0200).
Список литературы
Jalaly M., Gotor F.J., Sayagues M.J. // J. Solid State Chem. 2018. V. 267. P. 106.
Toth L.E. Transition Metal Carbides and Nitrides. London.: Academic Press, Inc., 1971. 279 c.
Oyama S.T. The Chemistry of Transition Carbides and Nitrides. Cornwall.: Hartnolls LTD, 1996. 537 c.
Potts S.E., Carmalt C.J., Blackman C.S. et al. // Organometalics. 2009. V. 28. P. 1838.
Carmalt C.J., Newport A.C., O’Neil S.A. et al. // Inorg. Chem. 2005. V. 44. P. 615.
Zhang T., Zheng S.F., Wen G. // Materials Letters. 2014. V. 132. P. 277.
Huang F.L., Cao C.B., Xiang X. et al. // Diamond and Related Materials. 2004. V. 13. P. 1757.
Chen D., Huang Y., Hu X. et al. // Materials. 2018. V. 11. P. 387.
Puyoo G., Teyssandier F., Pailler R. et al. // Carbon. 2017. V. 122. P. 19.
Faziev Sh. A., Paizullakhanov M.S., Nurmatov Sh.R. // Heliotechnical Materials Science. 2010. V. 46. P. 53.
Sun J., Liang B., Huang Y. et al. // Catalysis Today. 2016. V. 274. P. 123.
Jalay M., Gotor F.J., Sayagues M.J. // J. Alloys and Compounds. 2018. V. 763. P. 18.
Wang L., Su Y., Zhu Y.Q. // Intern. J. Refractory Metals and Hard Materials. 2013. V. 38. P. 134.
Rasaki S.A., Zhang B., Anbalgam K. et al. // Progress in Solid State Chem. 2018. V. 50. P. 1.
Wang L., Xi W., Mei T. et al. // J. Ceramic Soc. Japan. 2017. V. 125. № 10. P. 789.
Ma J., Du Y. // J. Alloys and Compounds. 2008. V. 448. P. 215.
Ma J., Wu M., Du Y. et al. // Materials Science and Engineering B. 2008. V. 153. P. 96.
Ma J., Wu M., Du Y. et al. // Materials Letters. 2009. V. 63. P. 905.
Schaber P.M., Colson J., Higgins S. et al. // Thermochimica Acta. 2004. V. 424. P. 131.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии