Журнал физической химии, 2019, T. 93, № 9, стр. 1415-1419
Закономерности всаливания в системах неорганическая кислота–оксиэтилированное ПАВ–вода
А. М. Елохов a, b, *, О. С. Кудряшова b, А. Е. Леснов c, d
a Пермский государственный национальный исследовательский университет
614990 Пермь, Россия
b Естественнонаучный институт Пермского государственного национального исследовательского университета
614990 Пермь, Россия
c Пермский государственный аграрно-технологический университет им. Д.Н. Прянишникова
614990 Пермь, Россия
d Российская академия наук, Уральское отделение, Институт технической химии
614013 Пермь, Россия
* E-mail: elhalex@yandex.ru
Поступила в редакцию 07.09.2018
После доработки 05.03.2019
Принята к публикации 12.03.2019
Аннотация
Установлены закономерности трансформации фазовых областей систем неорганическая кислота–оксиэтилированное ПАВ–вода. Показано, что всаливающее действие неорганических кислот уменьшается с ростом абсолютного значения энергии гидратации аниона. Изучена растворимость в системе борная кислота–смесь оксиэтилированных нонилфенолов–вода в интервале температур 25–75°С.
Поверхностно-активные вещества (ПАВ) и водорастворимые полимеры активно используются в методах экстракционного концентрирования веществ различной природы [1–3]. Известно, что неорганические кислоты, необходимые для реализации анионообменного механизма экстракции в системах на основе оксиэтилированных ПАВ [4–6] и полиэтиленгликолей [7] оказывают всаливающее действие, приводящее к гомогенизации расслаивающихся смесей в результате протонирования оксиэтиленового фрагмента. В работах [8–10] показано, что введение серной и хлороводородной кислоты приводит к росту температуры помутнения вследствие образования оксониевых соединений между ионом гидроксония и атомами кислорода оксиэтиленовых фрагментов ПАВ. В работе [11] показано, что анионы кислот оказывают высаливающее действие в отношении триблоксополимеров оксида этилена и пропилена, однако определяющим является действие иона гидроксония. Настоящая работа посвящена изучению влияния природы неорганической кислоты на закономерности всаливания оксиэтилированных нонилфенолов и трансформации фазовых областей в системах неорганическая кислота–оксиэтилированное ПАВ–вода с изменением температуры.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использована смесь оксиэтилированных нонилфенолов (C9H19C6H4(OCH2CH2)nOH, n = 12 для неонола АФ-9-12 и n = 6 для неонола АФ-9-6, ТУ 2483-077-05766801-98) с массовой долей неонола АФ-9-12 равной 50% (далее Н-9-11) и неорганические кислоты (борная, хлороводородная, серная, фосфорная и хлорная) квалификации “ч.д.а.”
Растворимость в системе H3BO3–смесь неонолов–вода изучена визуально-политермическим методом и изотермическим методом сечений в интервале 25–90°С. Границы области расслаивания определены визуально-политермическим методом. Запаянные ампулы объемом 25–30 мл, содержащие смеси исходных компонентов известного состава общей массой 5.00 г, помещали в термостат и нагревали со скоростью 1 К/5 мин при периодическом встряхивании. Температуру помутнения устанавливали, отмечая появление устойчивой опалесценции. По результатам исследований строили зависимости температуры помутнения от содержания одного компонента или смеси двух компонентов в определенном соотношении. Изотермические разрезы температурной призмы трехкомпонентной системы строили методом графической интерполяции.
Изотермы растворимости при температурах ниже 75°С получены методом сечений. В качестве физического свойства измеряли показатель преломления жидкой фазы на рефрактометре ИРФ-454Б. На основании полученных данных строили зависимости показателя преломления от концентрации одного из компонентов и по изломам на графике определяли составы, отвечающие фазовым переходам при заданной температуре.
Всаливающую способность неорганических кислот в отношении смеси неонолов оценивали визуально-политермическим методом по изоконцентрационным сечениям, содержащим 5.0 мас. % Н-9-11.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В интервале температур 25–58°С на фазовой диаграмме системы H3BO3–H-9-11–вода (рис. 1а, б) присутствуют две области – ненасыщенных растворов (L) и кристаллизации борной кислоты (L + S). Положение линии кристаллизации H3BO3 определено по четырем сечениям, исходящим из вершины, отвечающей борной кислоте, в точки с массовым соотношением Н-9-11 : вода равным 2.5 : 97.5, 5.0 : 95.0, 15.0 : 85.0, 25.0 : 75.0 соответственно. Установлено, что с ростом температуры область ненасыщенных растворов увеличивается.
Рис. 1.
Растворимость в системе борная кислота – Н-9-11 – вода при различных температурах : а –25 (1), 40°С (2); б – 58°С; в –60 (1), 65 (2), 70°С (3), г – 72°С, д – 75°C (точками обозначены экспериментальные данные).
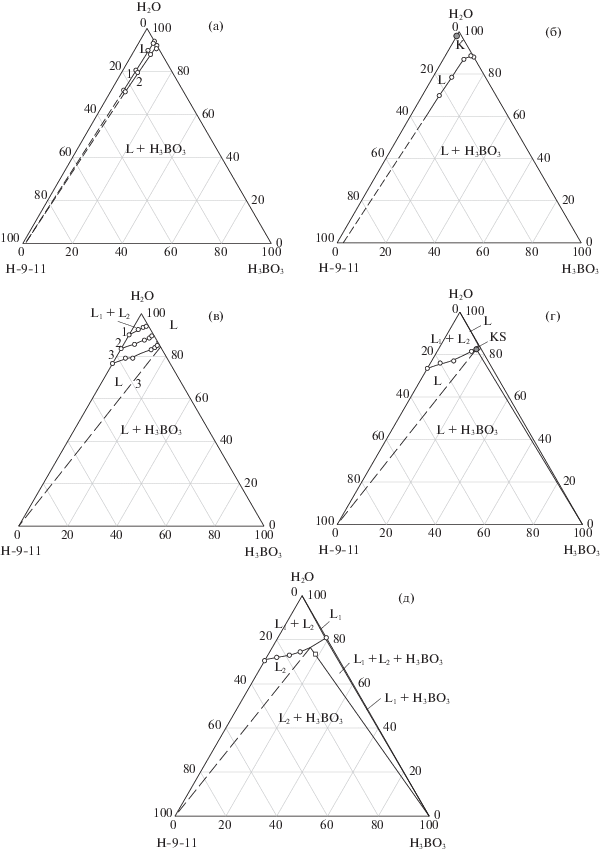
Температура 58°С отвечает нижней критической температуре растворения (НКТР) в двойной подсистеме Н-9-11–вода (рис. 2а) и минимальной температуре, при которой существует расслаивание в тройной системе (рис. 1б). Дальнейшее увеличение температуры приводит к развитию критической точки К (рис. 1б) в область расслаивания, примыкающей к двойной подсистеме Н-9-11–вода (рис. 1в).
Рис. 2.
Политерма двойной подсистемы Н-9-11–вода (а) и сечения (Н-9-11 : вода = 5.0 : 95.0)–H3BO3 (б).
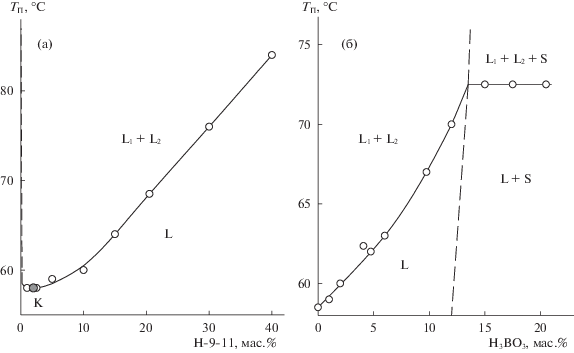
Границы области расслаивания определяли визуально-политермическим методом по шести сечениям треугольника состава. Сечения 1–4 аналогичны описанным выше, смеси сечений 5–6 отличались постоянным массовым соотношением H3BO3 : вода равным 5.0 : 95.0 и 10.0 : 90.0 и переменным содержанием Н-9-11. На политермах сечений 1–4 температура помутнения возрастает от температуры расслоения раствора Н-9-11 без высаливателя (фазовый переход L ↔ L1 + L2) до температуры образования области монотектического равновесия (рис. 2б). Положение линий, отвечающих фазовым равновесиям L ↔ L + S и L1 + L2 ↔ L1 + L2 + S, не устанавливалось в связи с высокой вязкостью растворов и трудностью фиксирования температуры фазовых переходов.
Политермы сечений 5–6 аналогичны политерме двойной подсистемы Н-9-11–вода (рис. 2а). Установлено, что рост температуры приводит к расширению границ области расслаивания, причем бинодальная кривая смещена к двойной подсистеме H3BO3–вода (рис. 1в).
При температуре 72°С область расслаивания касается критической точкой (KS) линии кристаллизации борной кислоты, в результате чего образуется предельная нода монотектического равновесия (KS–H3BO3), которая при дальнейшем увеличении температуры развивается в область монотектического равновесия (рис. 1г, д). Фазовая диаграмма при этом характеризуется шестью областями: ненасыщенных растворов (L1 и L2), расслаивания (L1 + L2), монотектического равновесия (L1 + L2 + H3BO3) и кристаллизации борной кислоты (L1 + H3BO3 и L2 + H3BO3).
Температуру и положение критической ноды монотектического равновесия определяли путем построения прямой, проходящей через вершину H3BO3 и точку политермы сечения с постоянным соотношением H3BO3 : вода равным 20.0 : 80.0 и переменным содержанием Н-9-11, отвечающей минимальной температуре фазового перехода L + + S ↔ L1 + L2 + S и равенству объемов жидких фаз. Концентрационным координатам KS отвечает точка пересечения критической ноды монотектического равновесия и линии растворимости борной кислоты при той же температуре.
Схема топологической трансформации системы H3BO3–H-9-11–вода с изменением температуры (рис. 1) соответствует обобщенной схеме топологической трансформации фазовых диаграмм систем неорганическая соль–бинарный растворитель [12] для случая, когда двойная жидкостная подсистема характеризуется НКТР, а соль обладает только всаливающим действием. Ранее подобная схема подтверждена только для системы содержащей двойную жидкостную систему с замкнутой областью расслаивания на примере системы KClO4–тетрагидрофуран–вода [13].
В предыдущей работе изучена растворимость в системах H3BO3–оксиэтилированный ПАВ–вода при 25 и 75°С [14]. В случае моноалкиполиэтиленгликолей (синтанол АЛМ-10 и синтанол ДС-10) и бис(алкилполиоксиэтилен)-фосфата калия (оксифос Б) топология фазовых диаграмм идентична системе с Н-9-11. Так как борная кислота оказывает на оксиэтилированные ПАВ всаливающее действие, то образование расслаивания в указанных системах можно ожидать при температуре выше НКТР двойной системы ПАВ–вода, т.е. 79°С для оксифоса Б и более 100°С для синтанолов. Однако топология фазовой диаграммы с полиэтиленгликолевыми эфирами алкилмоноэтаноламидов (синтамиды) свидетельствует о высаливающем действии борной кислоты, то есть всаливающее–высаливающее действие борной кислоты зависит от природы ПАВ.
Представляло интерес оценить влияние различных неорганических кислот на температуру расслоения водных растворов Н-9-11. Для оценки всаливающего действия неорганических кислот строили политермы изоконцентрационных сечений, смеси которых содержат 5 мас. % Н-9-11 и различную концентрацию кислот. При построении политерм принимали, что степень диссоциации всех изученных кислот близка к единице, а борная кислота диссоциирует только по первой ступени, исходя из величины ее константы кислотности (pKa,1 = 9.24).
Ранее показано, что катионы оказывают всаливающее действие, величина которого пропорциональна энергии гидратации [15]. Катион гидроксония является сильным всаливателем (ΔGhyd = = ‒1050 кДж/моль [16]). Взаимодействие катионов водорода и атомов кислорода оксиэтиленовых фрагментов приводит к появлению поверхностного положительного заряда и снижению способности ПАВ к высаливанию, поэтому в отличие от неорганических солей, в присутствии кислот доминирующим оказывается всаливающий эффект катиона. Анион при этом проявляет высаливающее действие, противоположное действию катиона. Качественно оценить всаливающую способность кислоты можно по зависимости температуры расслоения от концентрации иона гидроксония в растворе. При фиксированной температуре, всаливающая способность кислоты определяется концентрацией ионов гидроксония, достаточной для гомогенизации расслаивающейся смеси. Очевидно, чем эта концентрация выше, тем ниже всаливающая способность кислоты и выше высаливающая способность аниона кислоты.
Исходя из рис. 3 высаливающая способность анионов увеличивается в ряду ${\text{ClO}}_{4}^{ - }$ < ${\text{C}}{{{\text{l}}}^{ - }}$ < ${{{\text{H}}}_{{\text{2}}}}{\text{BO}}_{3}^{ - }$ < < ${\text{SO}}_{4}^{{2 - }}$ < ${\text{PO}}_{4}^{{3 - }}$, что отвечает росту абсолютной энергии гидратации соответствующих ионов (табл. 1), всаливающая же способность кислот в указанном ряду уменьшается.
Таблица 1.
Всаливающая способность кислот в отношении оксиэтилированных ПАВ и водорастворимых полимеров
| Кислота | HClO4 | HCl | H2SO4 | H3PO4 | H3BO3 | HCO2H | CH3CO2H | |
|---|---|---|---|---|---|---|---|---|
| ΔGhyd(An–) [14] | –242 | –340 | –1080 | –2765 | –460* | –395 | –365 | |
| k | H-9-11 | 0.136 | 0.077 | 0.036 | 0.018 | 0.037 | – | – |
| EPE | – | 0.105 | – | – | – | 0.077 | 0.090 | |
Количественно оценить всаливающую способность можно по коэффициенту k в модифицированном уравнении Сеченова [17]:
где Т0 и Т – температура расслоения раствора Н-9-11 без кислоты и в присутствии кислоты в концентрации С.Очевидно, чем больше значение коэффициента k, тем выше всаливающая способность кислоты и меньше абсолютное значение энергии гидратации соответствующего аниона. Результаты, полученные при обработке данных из работы [10] для нонилфенолов со средней степенью оксиэтилирования 9.7 и триблоксополимеров оксида этилена и пропилена (EPE) [11] и подтверждают справедливость сделанных выводов (табл. 1).
Следует отметить, что переход от борной кислоты, к кислотам с неограниченной растворимостью в воде, приводит к изменению схемы топологической трансформации фазовых диаграмм систем неорганическая кислота–оксиэтилированное ПАВ–вода, связанному с невозможностью образования твердых фаз в системе. Область расслаивания, формирующаяся из критической точки в двойной подсистеме ПАВ–вода, распространяется в трехфазную систему, и граница области двухфазного равновесия расширяется с ростом температуры.
Полученные результаты свидетельствуют, что неорганические кислоты обладают выраженным всаливающим действием в отношении оксиэтилированных ПАВ, обусловленных действием иона гидроксония. Наиболее сильными всаливателями являются неорганические кислоты, содержащие анион, имеющий низкую абсолютную величину энергии гидратации.
Работа выполнена при финансовой поддержке Министерства образования и науки Российской Федерации (задания 4.5947.2017/6.7 и 5.6881.2017/8.9).
Список литературы
The Application of Green Solvents in Separation Processes / Pena-Pereira F., Tobiszewski M. (ed.), Elsevier, 2017. 540 p.
The role of colloidal systems in environmental protection / Fanun M. (ed.), Elsevier, 2014. 693 p.
Pytlakowska K., Kozik V., Dabioch M. // Talanta. 2013. V. 110. P. 202.
Кудряшова О.С., Денисова С.А., Леснов А.Е., Попова М.А. // Журн. физ. химии. 2008. Т. 82. № 4. С. 786.
Денисова С.А., Останина Н.Н., Леснов А.Е., Кудряшова О.С. // Химия в интересах устойчивого развития. 2013. Т. 21. № 5. С. 475.
Леснов А.Е., Головкина А.В., Кудряшова О.С., Денисова С.А. // Журн. физ. химии. 2016. Т. 90. № 8. С. 1200.
Hamta A., Dehghani M.R. // J. of Molecular Liquids. 2017. V. 231. P. 20.
Schott H. // J. of Colloid and Interface Science. 1973. V. 43. № 1. P. 150.
Schott H., Royce A.E., Han S.K. // Ibid. 1984. V. 98. № 1. P. 196.
Shinoda K., Takeda H. // Ibid. 1970. V. 32. № 4. P. 642.
Shaheen A., Kaur N., Mahajan R.K. // Colloid and Polymer Science. 2008. V. 286. № 3. P. 319.
Черкасов Д.Г. Топология фазовых диаграмм трех- и четырехкомпонентных конденсированных систем с всаливанием–высаливанием: диссертация … д-ра хим. наук. Саратов, 2013. 413 с.
Смотров М.П., Черкасов Д.Г., Ильин К.К. // Журн. физ. химии. 2014. Т. 88. № 5. С. 791.
Елохов А.М., Кудряшова О.С., Леснов А.Е. // Журн. неорган. химии. 2015. Т. 60. № 5. С. 698.
Елохов А.М., Кудряшова О.С., Леснов А.Е. // Там же. 2017. Т. 62. № 9. С. 1274.
Marcus Y. // J. Chem. Soc. Faraday Trans. 1991. V. 87. Is. 18. P. 2995–2999.
Архипов В.П., Идиятуллин З.Ш. // Вестн. Казанского технологич. ун-та. 2016. Т. 19. № 5. С. 8.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии



