Журнал физической химии, 2019, T. 93, № 9, стр. 1410-1414
Кинетика растворения таллия в водных растворах соляной кислоты
Г. Т. Сарбаева a, *, Э. Ж. Тулешова a, **, Г. Н. Жылысбаева a, М. Т. Сарбаева a
a Университет Ахмеда Ясави
161200 г. Туркестан, Казахстан
* E-mail: gulnar.sarbayeva@ayu.edu.kz
** E-mail: elmira.tuleshova@ayu.edu.kz
Поступила в редакцию 18.05.2018
После доработки 26.11.2018
Принята к публикации 15.01.2019
Аннотация
Методом потенциометрии исследована кинетика электрохимического окисления–восстановления таллия в водных растворах соляной кислоты. Для характеристики механизма электроокисления таллия рассчитаны следующие кинетические параметры: коэффициент диффузии (D), гетерогенная константа скорости электродного процесса (ks) и эффективная энергия активации процесса (Еэф). Исследовано влияние режимов электролиза: плотности тока, концентрации и температуры электролита на размерные характеристики полученного хлорида таллия (І). Выявлены оптимальные параметры электролиза для получения дисперсных порошков хлорида таллия (І).
Один из основных приоритетов инновационной индустриализации – развитие металлургии и производство готовых металлических продуктов и их соединений. В этой связи актуально применение новых способов получения металлов и их соединений или извлечение их из растворов. Один из перспективных способов, применяющихся в настоящее время, – поляризация переменным током промышленной частоты, которая вызывает интерес исследователей как с точки зрения оксидообразования, так и разрушения пассивирующей пленки. Особенность процессов, протекающих под действием промышленного переменного тока, заключается в том, что при смене направления тока удается снять оксидную пленку и создать условия для беспрепятственного дальнейшего растворения металла [1–6].
Интересными представляются электрохимические процессы с участием металлов, в особенности таллия, в связи с возрастающей потребностью в нем различных отраслей медицины, техники и промышленности. Системные исследования, позволяющие установить закономерности электроокисления таллия с последующим синтезом его соединений, могут приводить как к интенсификации его производства, так и решать проблемы ресурсосбережения.
Нами ранее исследовано электрохимическое поведение различных металлов при поляризации переменным током промышленной частоты [7–11]. Анализ литературных данных показал, что вопросу изучения электрохимического поведения таллия посвящено незначительное количество работ. В этой связи исследование процессов ионизации таллия под действием промышленного переменного тока представляется актуальным и своевременным.
Цель данной работы – исследование закономерностей электрохимического поведения таллия при поляризации синусоидальным переменным током и получение хлорида таллия (І).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Электрохимическое поведение таллия с целью выяснения механизма протекания реакций окисления изучали методом потенциометрии на потенциостате “Autolab” и регистрировали с помощью программы ІРС 2000. Измерения проводили в трехэлектродной ячейке относительно хлорсеребряного электрода (E0 = +0.203 В). Вспомогательным электродом служила платина. Вольтамперограммы в основном получали при скоростях развертки потенциала 50–250 мВ/с. Для выяснения механизма процессов, протекающих при поляризации переменным током, электроды подвергали циклической поляризации, т.е. кривые записывали сначала в направлении катод–анод, затем – анод–катод. Таким образом, в определенной степени имитировали смену направления тока, происходящую при прохождении переменного тока.
Для исследования электрохимического поведения таллия в растворе соляной кислоты основные опыты проводили в электролизере объемом 100 мл без разделения электродных пространств. Использовали рабочие электроды в виде пластинок из таллия с площадью поверхности ∼4.3 см2. Электроды перед экспериментами тщательно зачищали, обезжиривали и промывали дистиллированной водой. Для приготовления растворов использовали соляную кислоту марки “ч. д. а.” и бидистиллированную воду.
Источником синусоидального переменного тока служил источник питания В-24 (в упрощенной форме, представляющий собой понижающий трансформатор с плавной регулировкой напряжения), имеющий клеммы переменного тока. Ток в цепи измеряли многопредельным амперметром марки АВО–5МI. За изменениями формы синусоидального переменного тока в ходе электролиза наблюдали с помощью электронного осциллографа С1-77. Осциллографом контролировали также соотношение величин амплитуд анодного и катодного полупериодов переменного тока. Для проведения исследований влияния частоты переменного тока на скорость растворения таллия в электрохимическую цепь подключали звуковой генератор ГЗМ, позволяющий проводить электролиз в пределах частот от 20 до 20 000 Гц. Для проведения исследований при постоянной температуре использовали специальную электролитическую ячейку марки ЯСЭ-2, вмонтированную в термостат марки IТЖ-0-03.
Размер и форму частиц полученного хлорида таллия (І) определяли с помощью электронной микроскопии. В работе использовали растровый электронный микроскоп JSM 6490 LА при увеличении в 10000 раз. С целью изучения распределения по размерам частиц хлорида таллия (І) использовали лазерный анализатор марки LS 13320 с жидкостным, водным модулем. Диапазон измерения размера частиц колеблется от 0.020 до 200 мкм. Для измерения частиц дифракционным методом использовали лазерный свет с длиной волны 750 нм, сформированный в ультразвуковом излучателе, входящем в комплект с прибором LS 13 320. Рентгеноструктурный анализ выполняли на дифрактометре ДРОН-3.0. Скорость вращения счетчика 2 град/мин.
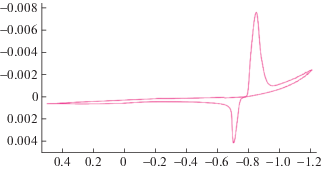
Предварительно были установлены закономерности растворения таллиевого электрода в растворе соляной кислоты методом снятия катодных, анодных и циклических потенциодинамических поляризационных кривых. Изучено влияние концентрации соляной кислоты, скорости развертки потенциала на процесс восстановления таллиевого электрода. На рис. 1 показана циклическая катодно-анодная поляризационная кривая таллиевого электрода в растворе соляной кислоты. При смещении потенциала таллия в отрицательную сторону, регистрируется максимум восстановления хлоридной пленки, образующийся на поверхности электрода, а при потенциале “минус” 1.4 В происходит реакция восстановления ионов водорода. А если потенциал этого электрода сместить в положительную сторону, то при потенциалах “минус” 0.6–0.7 В регистрируется максимум анодного окисления таллия. До потенциала “плюс” 1.0 В в полярограмме не регистрируются максимумы дальнейшего окисления ионов таллия, а также окисления хлорид-ионов.
Рис. 1.
Катодно-анодная потенциодинамическая циклическая поляризационная кривая в растворе соляной кислоты; C = 2.5 М, скорость развертки – 250 мВ/с, t = 25°С.
На реакцию электрорастворения таллия оказывает влияние концентрация раствора. Показано, что при изменении концентрации соляной кислоты в пределах 0.5–4.0 М величина потенциала на таллиевом электроде составляет “минус” 0.6–0.7 В. При смещении потенциала таллия в положительную сторону на полярограмме регистрируется ток окисления металла и при увеличении концентрации соляной кислоты соответственно увеличивается величина тока окисления металла. Установлено, что, начиная от “минус” 0.2 В скорость растворения таллия не увеличивается, с этого момента на поверхности металла образуется пленка хлорида таллия, и его растворение происходит в транспассивном режиме. При изменении скорости развертки потенциала в интервале 25–250 мВ/с в водном растворе соляной кислоты были сняты анодные кривые окисления таллия (рис. 2). Высота тока окисления повышается с увеличением скорости развертки потенциала.
Рис. 2.
Катодные потенциодинамические поляризационные кривые таллия при различной скорости развертки потенциала V: 1 – 25, 2 – 50, 3 – 100, 4 – 150, 5 – 200, 6 – 250 мВ/с; t = 25°C; СНСl = 2.5 М; на вставке – зависимость катодного максимума тока от скорости развертки потенциала.

Для характеристики процесса электроокисления таллия по методике Галюса [12] рассчитаны следующие кинетические параметры: коэффициент диффузии (D = 8.4 × 10–5 см2/с) и гетерогенная константа скорости электродного процесса (ks = 2.6 × 10–1 с–1). Установлено, что в растворе соляной кислоты таллий анодно не растворяется, а при поляризации промышленным переменным током с частотой 50 Гц растворяется с высоким выходом по току, образуя хлорид таллия. Нами установлено, что при оптимальных условиях в анодном полупериоде на поверхности таллиевого электрода образуются одновалентные ионы, а в катодном полупериоде выделяется водород.
Изучено влияние на образование ионов таллия (І) плотности тока на таллиевом электроде в интервале 6000–16 000 А/м2 (табл. 1). Установлено, что при низких плотностях тока таллий не растворяется. При поляризации переменным током в растворе соляной кислоты скорость растворения таллия с образованием TlCl повышается. Например, при 6000 А/м2 cкорость растворения таллия составляет 83.11 г/(см2 ч), при плотности тока 16 000 А/м2 – 198.2 г/(см2 ч). С повышением плотности переменного тока в анодном полупериоде переменного тока уменьшается скорость образования оксидной пленки, и в результате образуется хлорид таллия (І). Наряду с этим при высоких плотностях (выше 16 000 А/м2) электрод перегревается, и затрудняется процесс электролиза. В этой связи плотности тока 14 000–16 000 А/м2 можно считать оптимальными. Следует отметить, что скорость растворения таллия при анодной поляризации (т.е. при поляризации переменным током) не превышает 0.01 г/(см2 ч), а при поляризации промышленным переменным током скорость растворения таллия повышается более чем в 104 раз. Скорость растворения металла определяли по формуле:
Таблица 1.
Влияние плотности переменного тока (і) на скорость растворения таллия (${{{v}}_{{{\text{раств}}}}}$) с образованием ионов таллия (І) при СHCl = 10 М, τ = 0.5 ч, t = 20°С
| і × 10–3, А/м2 | 6 | 8 | 10 | 14 | 16 |
|---|---|---|---|---|---|
| ${{{v}}_{{{\text{раств}}}}}$, г/(см2 ч) | 83.11 | 95.6 | 125.84 | 154.5 | 198.2 |
Влияние концентрации соляной кислоты на образования ионов таллия (І) изучено в интервале 2.0–10.0 М. Высокие концентрации соляной кислоты оказывают заметное влияние на образование хлорида таллия (І). При начальной концентрации 2.0 М скорость растворения таллия составляет 58.86 г/(см2 ч), а при 10.0 М – 198.2 г/(см2 ч) (табл. 2).
Таблица 2.
Влияние концентрации соляной кислоты на скорость растворения таллия с образованием ионов таллия (І) при і = 16 000 А/м2, τ = 0.5 ч, t = 20°С
| СHCl, М | 2.0 | 4.0 | 6.0 | 8.0 | 10.0 |
|---|---|---|---|---|---|
| ${{{v}}_{{{\text{раств}}}}}$, г/(см2 ч) | 58.86 | 94.1 | 147.36 | 168.5 | 198.2 |
Повышение скорости растворения таллиевого электрода при высоких концентрациях, по-видимому, связано с увеличением активности хлорид- и водород-ионов. В этот момент хлорид-ионы интенсивно разрушают кристаллическую решетку металла. Образованные в анодном полупериоде переменного тока ионы Tl+, Cl– легко взаимодействуя, образуют соединение. Во-вторых, увеличение концентрации не позволяет образоваться оксидной пленки на поверхности электрода, металл с отрицательным потенциалом, легко взаимодействуя с водородом, растворяется с образованием собственных ионов. По результатам эксперимента определен порядок реакции окисления таллия, он составляет 1.01:
Влияние температуры электролита на скорость растворения таллия при поляризации таллиевых электродов нестационарным током в кислой среде рассматривалась в интервале 20–80°С при плотности тока 6000 А/м2 (табл. 3). При плотности переменного тока 6000 А/м2 с повышением температуры раствора от 20 до 80°С наблюдается увеличение скорости растворения таллиевых электродов от 34.63 до 583 г/(см2.ч). По-видимому, с увеличением температуры электролита повышается активность молекулы кислоты, следовательно, повышается скорость взаимодействия и подвижность ионов в растворе. По зависимости выхода по току от температуры электролита рассчитана энергия активации процесса (Еэф), она составляет 6.214 кДж/моль. Установлено, что электрохимическое растворение таллия протекает в диффузионном режиме.
Таблица 3.
Влияние температуры раствора (t) на скорость растворения таллия с образованием ионов таллия (І) при і = 6000 А/м2, τ = 0.5 ч, СHСl = 10 М
| t, °C | 20 | 40 | 60 | 80 |
|---|---|---|---|---|
| ${{{v}}_{{{\text{раств}}}}}$, г/(см2 ч) | 34.63 | 40.2 | 49.5 | 58.3 |
Один из основных электрохимических параметров – частота переменного тока. Поэтому нами исследовано влияние частоты переменного тока на скорость растворения таллия с образованием ионов таллия (І) в растворе соляной кислоты (табл. 4). Исследование проводили в интервале 50–500 Гц. Повышение частоты переменного тока приводит к понижению скорости растворения таллия от 34.63 до 1.22 г/(см2 ч). Такое изменение связано с уменьшением величины средней амплитуды тока с ростом частоты переменного тока, что ведет к ослаблению поляризации электродов. При высокой частоте также не обеспечивается необходимая длительность анодного полупериода для протекания реакции растворения.
Таблица 4.
Влияние частоты переменного тока (ν) на скорость растворения таллия с образованием ионов таллия при СHСl = 10 М, і = 6000 А/м2, τ = 0.5 ч
| ν, Гц | 50 | 100 | 200 | 300 | 400 | 500 |
|---|---|---|---|---|---|---|
| ${{{v}}_{{{\text{раств}}}}}$, г/(см2 ч) | 34.63 | 7.3 | 5.0 | 3.8 | 2.45 | 1.22 |
Полученный электрохимическим путем хлорид таллия (I) исследовали методом рентгенофазового анализа на установке марки ДРОН-3 и ИСП-30 в интервале углов 10–500°. Наличие на рентгенограмме хлорида таллия (I) дифракционных линий с межплоскостными расстояниями, равными 6.5, 3.6, 3.45, 3.34, 3.17, 2.86, 2.78 и 2.3 Å соответствует значениям в американской картотеке ASTM. Указанные дифракционные максимумы характерны для кристаллической решетки хлорида таллия (I). Рентгенограмма полученного электрохимическим путем хлорида таллия (I) приведена на рис. 3.
Размер и форму частиц полученного соединения определяли по микрофотографиям, полученным с помощью растрового электронного микроскопа JSM 6490 LА. Для каждого препарата хлорида таллия, полученного после электролиза, делали несколько микрофотографий, что обеспечивало возможность определения дисперсного состава порошка. Микрофотографии хлорида таллия (І) приведены на рис. 4.
Таким образом, методом снятия циклических потенциодинамических поляризационных кривых установлено, что в растворе соляной кислоты на таллиевом электроде протекают достаточно сложные электрохимические реакции. Показаны особенности кинетики окисления таллия в кислой среде. В обычных условиях на поверхности таллия образуется защитная пленка, которая затрудняет его растворение, а при поляризации переменным током в кислой среде таллий растворяется с образованием соответствующих соединений. Методом электрохимического синтеза получены мелкодисперсные порошки хлорида таллия (І). Эти и другие данные, полученные нами в предыдущих исследованиях, служат теоретическими основами электродных процессов металлов, а также предпосылкой создания новых способов синтеза ряда соединений, находящих широкое применение в различных отраслях промышленности.
Список литературы
Эванс Ю.Р. Коррозия, пассивность и защита металлов. М.-Л.: Металлургиздат, 1941. 885 с.
Шульгин Л.П. // Журн. физ. химии. 1979. № 3. С. 2048.
Озеров А.М. Нестационарный электролиз / Под ред. А.М. Озерова. Волгоград: Нижне-Волж. изд-во, 1972. 610 с.
Михайловский Ю.Н. // Коррозия металлов и сплавов / Под ред. Ю.Н. Михайловского, Н.М. Струкалова, Н.Д. Томашева. М.: Металлургия, 1969. С. 267–279.
Сейлханова Г.А., Усипбекова Е.Ж., Березовский А., Курбатов А.П. // Изв НАН РК. 2014. № 1(403). С. 104.
Петрий О.А., Цирлина Г.А., Кузминова З.В. // Электрохимия. 1995. Т. 31. № 9. С. 999.
Tuleshova E.Zh., Bayeshov A. // Russ. J. Appl. Chem. 2015. V. 88. № 7. P. 1142.
Сарбаева Г.Т., Баешов А.Б., Абдуалиева У.А., Тулешова Э.Ж. // Вестн. НАН РК. 2017. № 2. С. 73.
Tuleshova E.Zh., Bayeshov A., Tukibayeva A. // Orient. J. Chem. 2013. V. 29. № 1. P. 33.
Tuleshova E.Zh., Bayeshov A. et al. // Ibid. 2015. V. 31. № 4. P. 1867.
Sarbaeva G.T., Bayeshov A.B., Sunnatova B.M., Sarbaeva K.T. // The Bulletin of the National Academy of Sciences of the Republic of Kazakhstan. 2018. № 2. C. 35.
Галюс З. Теоретические основы электрохимического анализа. М.: Мир, 1974. 552 с.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии




