Журнал физической химии, 2019, T. 93, № 9, стр. 1289-1296
Метод расчета термодинамических свойств диоксида углерода в области давлений до 200 МПа
А. Б. Каплун a, *, А. Б. Мешалкин a
a Российская академия наук, Сибирское отделение, Институт теплофизики им. С.С. Кутателадзе
Новосибирск, Россия
* E-mail: kaplun@itp.nsc.ru
Поступила в редакцию 31.10.2018
После доработки 11.02.2019
Принята к публикации 14.02.2019
Аннотация
С помощью развитых ранее авторами методов и подходов получено новое фундаментальное малопараметрическое уравнение состояния диоксида углерода (в виде приведенной функции Гельмгольца) для описания термодинамических свойств нормальных веществ. Оно позволяет с достаточно высокой точностью, близкой к точности эксперимента (за исключением критической области) описывать термические и калорические свойства газа, жидкости и сверхкритического флюида при давлениях до 200 МПа. Рассчитаны калорические свойства и скорость звука диоксида углерода без привлечения каких либо калорических данных, за исключением энтальпии идеального газа. Рассчитанные значения изохорной теплоемкости, скорости звука и других термодинамических свойств хорошо согласуются с экспериментальными (надежными табличными) данными.
Ранее [1–8] в рамках развитого нами феноменологического подхода были получены физически обоснованные полуэмпирические единые (термические и калорические) уравнения состояния жидкости, газа и флюида для описания термодинамических свойств “нормальных” веществ (инертные газы, азот, кислород, диоксид углерода и др.). В частности, с помощью предложенного нами ступенчатого потенциала межмолекулярного взаимодействия были получены малопараметрические уравнения для высокоточного расчета второго вириального коэффициента B(T) широкого круга веществ во всем изученном температурном интервале. Так, получены уравнения для расчета B(T) для гелия и воды (см., напр., [1]), которые описывают B(T) в пределах погрешности исходных (табличных и экспериментальных) данных.
Кроме того, с помощью анализа дифференциальных уравнений термодинамики была установлена предпочтительная структура уравнения состояния жидкости и газа для фактора сжимаемости Z = PV/(RT) [2] (здесь T – температура, P – давление, V – удельный объем, R – газовая постоянная вещества) и строго показано, что фактор сжимаемости должен содержать в качестве одного из слагаемых функцию только плотности. Уравнения состояния (для фактора сжимаемости Z) записываются в виде суммы, каждый член которой представляет собой произведение функции температуры на функцию плотности. Установлено, что в качестве температурных функций могут быть использованы температурные функции, полученные нами для описания второго вириального коэффициента, а плотностные функции могут быть найдены из анализа экспериментальных или табличных данных.
В разработанных малопараметрических уравнениях [2–8] впервые удается строго выполнить классические критические условия практически без заметной потери точности описания исходных P–V–T-данных, при этом число эмпирических подгоночных коэффициентов обычно не превышает 9–11. Эти уравнения позволяют с удовлетворительной точностью рассчитывать термические и калорические характеристики “нормальных” веществ (за исключением окрестности критической точки) в интервале давлений, не более чем в 5–10 раз (т.е. до 30–50 МПа) превышающих критическое давление.
В настоящей работе с целью расширения диапазона расчета термодинамических свойств по давлениям и, соответственно, по плотностям, разработано новое малопараметрическое уравнение состояния, которое позволяет рассчитывать термические и калорические свойства нормальных веществ в области давлений до ≈30 PC, в том числе для диоксида углерода в области давлений до 200 МПа.
О структуре фундаментального уравнения состояния
В настоящее время принято описывать термодинамические свойства вещества с помощью так называемых “фундаментальных” уравнений состояния, которые представляют собой приведенную функцию Гельмгольца α с независимыми переменными температурой T и плотностью ρ (удельным объемом V)
(1)
$\alpha = {{\alpha }^{0}} + {{\alpha }^{r}} = {F \mathord{\left/ {\vphantom {F {RT}}} \right. \kern-0em} {RT}} = \varphi (T,\rho ),$Уравнение состояния, записанное в такой форме, имеет определенные преимущества по сравнению с УС для фактора сжимаемости Z(T, ρ) = P/ρRT, поскольку для расчета физических характеристик однокомпонентного вещества по (1) в основном используется процедура дифференцирования, в то время как при расчетах этих свойств с помощью фактора сжимаемости Z(T, ρ) часто приходится использовать процедуру интегрирования, что можно выполнить (в квадратурах) далеко не всегда.
Фактор сжимаемости $Z$ связан с приведенной избыточной функцией Гельмгольца αr известным соотношением [9–11]
(2)
$Z(\rho ,T) = \frac{P}{{\rho RT}} = 1 + \omega {{\left( {\frac{{\partial {{\alpha }^{r}}\left( {\omega ,\tau } \right)}}{{\partial \omega }}} \right)}_{\tau }}.$Как уже упоминалось выше, ранее нами было строго показано [2, 7], что уравнение для фактора сжимаемости Z должно содержать в качестве одного из слагаемых функцию только плотности
Уравнение (3) построено так, что при ρ → 0 фактор сжимаемости Z(T, ρ)ρ→0 → 1 (идеальный газ), а при температуре, стремящейся к бесконечности T → +∞ (то есть, когда энергией межмолекулярного взаимодействия можно пренебречь) фактор сжимаемости Z(T, ρ)T → ∝ = 1 + f2(ρ).
Из (2), (3) следует, что “правильная” приведенная функция Гельмгольца, так же, как и фактор сжимаемости, должна содержать в качестве одного из слагаемых функцию только плотности, т.е.
этот результат получен, по-видимому, впервые. В некоторых случаях функция ψ(ρ) может быть найдена из выражения для функции только плотности f(ρ) в уравнении (2) для Z путем интегрирования. Следует заметить, что функция только плотности, которая фигурирует в уравнении состояния для фактора сжимаемости в [7], при интегрировании (2) дает очень сложное выражение для ψ(ρ) в (4), в связи с чем в настоящей работе предложено новое аппроксимационное уравнение для этой функции.Фундаментальное малопараметрическое уравнение состояния CO2
Напомним, что диапазон применимости единого малопараметрического уравнения состояния (для фактора сжимаемости) в работах [7, 8] ограничен областью давлений до (5–10)PC. В связи с этим нами было разработано новое единое фундаментальное уравнение состояния для расчета термодинамических свойств нормальных веществ, которое не имеет указанного выше ограничения по давлению (и, соответственно, по плотности жидкости и газа), и может быть использовано для расчета термодинамических свойств жидкости и газа в расширенном интервале температур и давлений.
В настоящей работе приводятся результаты расчета термодинамических свойств диоксида углерода с помощью нового малопараметрического уравнения состояния при давлениях до 200 МПа (≈27 PC). Это уравнение имеет вид (здесь а1 … а11 – эмпирические коэффициенты)
(5)
$\begin{gathered} + \;{{a}_{4}}({{e}^{{ - 3\tau }}} - 1)\omega + {{a}_{5}}({{e}^{{6\tau }}} - 6\tau ){{\omega }^{2}}{{e}^{{ - \frac{{5{{Z}_{c}}\omega }}{{1 - {{Z}_{{\text{c}}}}\omega }}}}} + \\ + \;{{a}_{6}}({{e}^{{3\tau }}} - 1 - 3\tau )\omega {{e}^{{ - \frac{{2\omega }}{{1 - {{Z}_{{\text{c}}}}\omega }}}}} + \\ \end{gathered} $Из (2) и (5) следует, что фактор сжимаемости Z имеет вид
(6)
$\begin{gathered} + \;{{a}_{3}}({{e}^{{ - \tau }}} - 1)\omega + {{a}_{4}}({{e}^{{ - 3\tau }}} - 1) \times \\ \times \;\omega + {{a}_{5}}({{e}^{{6\tau }}} - 6\tau ){{\omega }^{2}}\left( {2 - \frac{{5{{Z}_{c}}\omega }}{{{{{\left( {1 - {{Z}_{{\text{c}}}}\omega } \right)}}^{2}}}}} \right){{e}^{{ - \frac{{5{{Z}_{c}}\omega }}{{1 - {{Z}_{{\text{c}}}}\omega }}}}} + \\ + \;{{a}_{6}}({{e}^{{3\tau }}} - 1 - 3\tau )\omega \left( {1 - \frac{{2\omega }}{{{{{\left( {1 - {{Z}_{{\text{c}}}}\omega } \right)}}^{2}}}}} \right){{e}^{{ - \frac{{2\omega }}{{1 - {{Z}_{{\text{c}}}}\omega }}}}} - \\ \end{gathered} $Все входящие в уравнение (6) переменные – температура, давление и плотность – могут быть измерены или взяты из справочных таблиц. Единственной характеристикой в уравнениях (2), (5), (6), которая может быть выражена явно, является давление $P = \rho RTZ\left( {\omega ,\tau } \right)$. В связи с этим подгоночные коэффициенты, входящие в (5), (6), были найдены путем минимизации рассчитанных по (6) относительных отклонений давления $\Delta P{\text{/}}P = $ $ = \;({{P}^{{{\text{calc}}}}} - {{P}^{{{\text{tab}}}}}){\text{/}}{{P}^{{{\text{tab}}}}}$ от исходных (табличных или экспериментальных) значений методом наименьших квадратов. Затем, с использованием полученных таким образом коэффициентов, входящих в (5), (6), могут быть с помощью дифференциальных уравнений термодинамики рассчитаны давление, плотность, энтальпия и другие термодинамические характеристики вещества.
Для достижения более точных результатов расчета термодинамических характеристик по (5), (6) мы привлекли следующие соображения. Поскольку относительная погрешность измерения плотности является единственной (не считая температуры) более или менее консервативной характеристикой в широком диапазоне параметров состояния, то для уточнения расчета входящих в УС (6) коэффициентов мы привлекли следующее соотношение:
(7)
$\frac{{\Delta \rho }}{\rho } = \frac{{ - \Delta P}}{{{{{({{\partial P} \mathord{\left/ {\vphantom {{\partial P} {\partial V}}} \right. \kern-0em} {\partial V}})}}_{T}}V}} = \frac{{ - {{\Delta P} \mathord{\left/ {\vphantom {{\Delta P} P}} \right. \kern-0em} P}}}{{{{{({{\partial P} \mathord{\left/ {\vphantom {{\partial P} {\partial V}}} \right. \kern-0em} {\partial V}})}}_{T}}({V \mathord{\left/ {\vphantom {V P}} \right. \kern-0em} P})}}.$Затем каждому рассчитанному выше по (6) значению давления в каждой точке из числа исходных данных присваивались весовые множители, обратно пропорциональные знаменателю в уравнении (7), и производился повторный расчет входящих в (6) коэффициентов путем минимизации отклонений расчетных значений давления
После того как найдены уточненные коэффициенты в уравнениях (6), (7) плотность вещества при заданных температуре и давлении рассчитывается из (6) численным методом.
Уравнения (5), (6) содержат 11 эмпирических коэффициентов. В настоящей работе на уравнение (6) нами, как и в работах [9, 10] было наложено условие, чтобы расчетное значение давления в критической точке равнялось экспериментальному Pcalc(ρC, TC) = Pсexp, при этом число независимых подгоночных коэффициентов в (5), (6) уменьшилось до 10. Если дополнительно потребовать, чтобы в критической точке выполнялось условие равенства нулю первой и второй производных от давления по объему при постоянной температуре, то число независимых подгоночных коэффициентов в (5), (6) понижается до 8.
Сопоставление с экспериментом и табличными данными по термическим свойствам
Проверка нового фундаментального уравнения состояния (5), (6) проводилась по эталонным табличным данным термодинамических свойств диоксида углерода [10]. Отметим, что для расчета коэффициентов этого многопараметрического УС в [10] привлечены разнородные экспериментальные данные в 1118 точках; это уравнение содержит 164 эмпирических подгоночных параметра.
Расчет подгоночных коэффициентов в уравнении (6) проводился по методике, описанной выше. Для расчета приведенной функции Гельмгольца в идеально-газовом состоянии α0, как и в работах [9, 11] использовались литературные данные [10].
Коэффициенты уравнений для расчета термодинамических свойств диоксида углерода, рассчитанные по уравнению (6) в области температур до 1100 К и давлений до 200 МПа, приведены в таблице 1. Там же приведены критические параметры CO2 и значение удельного объема CO2 при абсолютном нуле температуры V0, а также среднеквадратичное σ и средневзвешенное AAD отклонения рассчитанных значений плотности от табличных данных [10].
Таблица 1.
Коэффициенты a1–a11 для расчетов по (5), (6); среднеквадратичное σ и средневзвешенное ААD отклонения расчетных значений плотности от табличных [10]; критические параметры и удельный объем CO2 при T = 0 К
| Параметры | Значение |
|---|---|
| a1 | 3.35136 × 10–2 |
| а2 | −2.678598 |
| а3 | −1.861825 |
| а4 | −1.441346 × 10–2 |
| а5 | −8.834525 × 10–4 |
| а6 | 5.591074 × 10–2 |
| а7 | −1.860809 |
| а8 | 2.565999 × 10–2 |
| а9 | 1.428460 × 10–3 |
| а10 | −7.768676 × 10–5 |
| а11 | −9.084147 × 10–4 |
| σ, % | 0.34 |
| AAD, % | 0.098 |
| ZC | 0.274586 |
| 16 – TC, К | 304.1282 |
| PC, МПа | 7.3773 |
| ρC , кг/м3 | 467.6 |
| V0 = 1/ρ0, м3/кг | 584.8 |
На рис. 1 и в таблице 1 приведены результаты сопоставления рассчитанных по уравнениям (5), (6) значений плотности CO2 при давлениях до 200 МПа с табличными данными [10] при заданных температуре и давлении. Как видно из рис. 1 и таблицы 1, расхождения между рассчитанными по (6) и табличными данными [10] по плотности в основном не превышают (0.2–0.3)%). Как показал анализ, отклонение рассчитанных по новому уравнению (6) значений плотности от [10] в области больших плотностей и давлений заметно меньше, чем отклонение рассчитанных значений плотности по “инженерному” уравнению [11] от табличных данных [10]. Так, средневзвешенное отклонение рассчитанных по уравнению (6) значений плотности диоксида углерода при давлениях до 200 МПа от табличных данных [10] составляет AAD = 0.098%. Для сравнения: средневзвешенное отклонение рассчитанных по малопараметрическому “инженерному” уравнению [11] значений плотности при давлениях до 30 МПа от табличных данных [10] составляет AAD = 0.11%.
Рис. 1.
Отклонение рассчитанных по (6), (7) значений плотности $\delta \rho ,\;\% = 100\left( {{{\rho }_{{{\text{calc}}}}} - {{\rho }_{{{\text{tab}}}}}} \right){\text{/}}{{\rho }_{{{\text{tab}}}}}$ от табличных данных [10] для СО2.
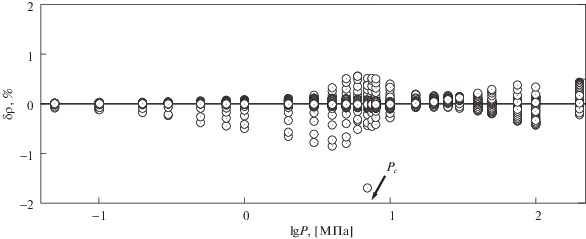
Таким образом, рассчитанные по (6) значения плотности в перекрывающихся по давлению интервалах согласуются с табличными данными [10] не хуже, чем рассчитанные по [11]. Результаты, приведенные на рис. 1 и в таблице 1, свидетельствуют о том, что уравнения (5), (6) не только соответствуют требованиям, предъявляемым к уравнениям состояния для инженерных расчетов (см. [11]): (Δρ/ρ) ≤ 0.2% при давлениях ≤30 МПа; 0.5% при Р > 30 МПа), но и существенно превосходят [11] по диапазону применимости по давлениям.
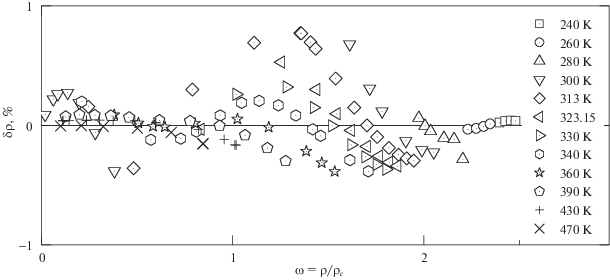
Следует отметить, что расхождения между рассчитанными по (5), (6) и табличными значениями плотности СО2 [10] в диапазоне давлений до 200 МПа в основном не превышают расхождений между табличными данными и экспериментальными значениями по плотности разных авторов; обзор экспериментальных результатов измерения плотности СО2 приведен в [10]. В качестве примера на рис. 2 приведены отклонения рассчитанных по (6) значений плотности СО2 от экспериментальных данных [12]. Подчеркнем, что экспериментальные данные по плотности СО2 в [12] были опубликованы через несколько лет после выхода работы [10]; для расчета коэффициентов в (6) экспериментальные данные [12] не привлекались. Как видно из рис. 2, расхождения между рассчитанными по (6) и экспериментальными данными [12] в основном не превышают 0.3–0.4%, за исключением данных в околокритической области.
Рис. 2.
Отклонение $\delta \rho ,\;\% = 100\frac{{{{\rho }_{{\exp }}} - {{\rho }_{{{\text{calc}}}}}}}{{{{\rho }_{{{\text{calc}}}}}}}$ экспериментальных данных [12] от рассчитанных по (6) значений плотности СО2 в расширенной околокритической области (на изотермах).
Расчет калорических свойств и скорости звука
Известно, что с помощью дифференциальных уравнений термодинамики по фундаментальному уравнению состояния (5) могут быть рассчитаны такие калорические свойства веществ, как энтальпия, энтропия, изохорная и изобарная теплоемкости, скорость звука и другие. Однако далеко не каждое уравнение состояния, удовлетворительно описывающее зависимость плотности от температуры и давления в широком диапазоне параметров состояния, позволяет рассчитывать калорические свойства веществ с приемлемой точностью. Поэтому, как уже упоминалось, обычно для расчета эмпирических коэффициентов, входящих в искомое единое уравнение состояние жидкости и газа, в качестве исходных используют данные по совокупности термических и калорических характеристик того или иного вещества.
Как показали наши расчеты, с помощью уравнений (5), (6), коэффициенты которых рассчитаны только по P–ρ–T-данным, можно вычислить с приемлемой точностью ряд калорических характеристик однокомпонентного вещества, если известны калорические свойства вещества в идеально-газовом состоянии ${{\alpha }^{0}}$ [10]. Проведенные нами расчеты калорических свойств диоксида углерода показали, что рассчитанные с помощью уравнений (5), (6) значения калорических свойств и скорости звука согласуются с табличными данными в основном в пределах оцененной погрешности табличных и экспериментальных данных [10], [12], за исключением околокритической области.
Как известно, наиболее чувствительными характеристиками к “качеству” термического уравнения состояния (6) и, следовательно, к качеству фундаментального уравнения (5), которые являются исходными для получения уравнений для расчета других термодинамических характеристик, являются скорость звука w и изохорная теплоемкость CV; соответствующие уравнения для расчета этих характеристик с использованием фундаментального уравнения (5) приведены ниже:
(8)
$\begin{gathered} \frac{{{{w}^{2}}}}{{RT}} = 1 + 2\omega {{\left( {\frac{{\partial {{\alpha }^{r}}}}{{\partial \omega }}} \right)}_{\tau }} + {{\omega }^{2}}{{\left( {\frac{{{{\partial }^{2}}{{\alpha }^{r}}}}{{\partial {{\omega }^{2}}}}} \right)}_{\tau }} - \\ - \;\frac{{{{{\left[ {1 + \omega {{{\left( {\frac{{\partial {{\alpha }^{r}}}}{{\partial \omega }}} \right)}}_{\tau }} - \omega \tau \left( {\frac{{{{\partial }^{2}}{{\alpha }^{r}}}}{{\partial \omega \partial \tau }}} \right)} \right]}}^{2}}}}{{{{\tau }^{2}}\left[ {{{{\left( {\frac{{{{\partial }^{{}}}{{\alpha }^{0}}}}{{\partial {{\tau }^{2}}}}} \right)}}_{\omega }} + {{{\left( {\frac{{{{\partial }^{2}}{{\alpha }^{r}}}}{{\partial {{\tau }^{2}}}}} \right)}}_{\omega }}} \right]}}; \\ \end{gathered} $(9)
$\frac{{{{C}_{V}}}}{R} = - {{\tau }^{2}}\left[ {{{{\left( {\frac{{\partial {{\alpha }^{0}}}}{{\partial {{\tau }^{2}}}}} \right)}}_{\omega }} + {{{\left( {\frac{{{{\partial }^{2}}{{\alpha }^{r}}}}{{\partial {{\tau }^{2}}}}} \right)}}_{\omega }}} \right].$При расчете равновесной скорости звука в диоксиде углерода по формулам (5), (8) в качестве исходных не использовалось никаких экспериментальных данных по скорости звука и калорическим свойствам веществ, за исключением калорических свойств в идеально-газовом состоянии.
На рис. 3 приведены результаты сопоставления рассчитанных по уравнениям (5), (8) значений скорости звука в CO2 с табличными данными [10], а на рис. 4 результаты расчета скорости звука по (5), (7) сопоставлены с экспериментальными данными, полученными в работах [13–15], (см. также анализ экспериментальных данных по скорости звука в [10, 16]. Из рисунков видно, что рассчитанные по (5), (7) значения скорости звука удовлетворительно согласуются с экспериментальными и табличными данными в широком интервале температур и давлений в газе, жидкости и флюиде. Расхождения между этими данными в газовой области (см. рис. 4) не превышают 0.3–0.5% и существенно возрастают в критической области, особенно при приближении к линии насыщения со стороны жидкой фазы. Однако в этой области существенно возрастают и экспериментальные погрешности измерения скорости звука (см. [10, 13–16]).
Рис. 3.
Сопоставление рассчитанных по уравнениям (5), (8) значений скорости звука W в СО2 (линии) с табличными данными [10] (точки) на изотермах в зависимости от давления.

Рис. 4.
Отклонение экспериментальных значений скорости звука от рассчитанных по (5), (8) $\delta W,\,\% = 100\frac{{{{W}_{{\exp }}} - {{W}_{{{\text{calc}}}}}}}{{{{W}_{{{\text{calc}}}}}}}$ в СО2 на изотермах 25, 50, 75, 100, 125 и 150°С; 1 – данные [13], 2 – данные [14], 3 – данные [15]. Различная степень затемнения символов соответствует разным изотермам.

На рис. 5 сопоставлены результаты расчета по (5), (9) изохорной теплоемкости диоксида углерода с экспериментальными данными [17–19]. При расчете изохорной теплоемкости экспериментальные данные по CV в уравнении (9) не привлекались. Так же, как и скорость звука, изохорная теплоемкость является сравнительно малоизученной характеристикой вещества, что видно из сопоставления экспериментальных данных разных авторов (см. рис. 5), которые достигают (7–9)%. Как видно из рис. 5, отклонения рассчитанных по (5), (9) значений изохорной теплоемкости от экспериментальных данных [17–19] оказались меньше, чем расхождения между этими экспериментальными данными.
Рис. 5.
Отклонение экспериментальных данных по изохорной теплоемкости СО2 от рассчитанных по (5), (9) значений $\delta {{C}_{V}},\% = 100\frac{{{{C}_{{V,}}}_{{\exp }} - {{C}_{{V,}}}_{{{\text{calc}}}}}}{{{{C}_{{V,}}}_{{{\text{calc}}}}}}$ на изохорах: 1 – данные [17], ρ = 679, 705, 751 и 831 кг/м3; 2 – данные [18], ρ=763; 883 и 903 кг/м3; 3 – данные [19], ρ = 88, 181, 615, 880, 1050 и 1140 кг/м3. Различная степень затемнения символов соответствует разным изохорам.

Аналогичные результаты были достигнуты и при расчете с помощью разработанных уравнений других термодинамических свойств диоксида углерода – энтальпии, энтропии, кривой инверсии и др. Детальный анализ полученных результатов выходит за рамки настоящей работы.
Таким образом, в рамках развитого ранее феноменологического подхода (см., например, [1–8] разработано новое единое фундаментальное малопараметрическое уравнение состояния (5) для описания термодинамических характеристик “нормальных” веществ при давлениях до 150–200 МПа. В настоящей работе проведены результаты расчета некоторых термодинамических характеристик диоксида углерода. Эмпирические коэффициенты в уравнениях (5), (6) рассчитаны путем обработки табличных P–ρ–T-данных [10]. Уравнение состояния (6) описывает термические свойства газа, жидкости и флюида в основном в пределах погрешности экспериментальных данных при давлениях до 200 МПа. С помощью дифференциальных уравнений термодинамики из термических уравнений состояния с использованием (5), (6) получены регулярные уравнения для расчетов калорических характеристик и скорости звука диоксида углерода при давлениях. Расхождения между рассчитанными и табличными [10] калорическими данными (в частности, по скорости звука и изохорной теплоемкости) в основном не превышают экспериментальных погрешностей.
Работа выполнена по госзаданию (проект № III.18.2.2.) и при финансовой поддержке Российского фонда фундаментальных исследований (код проекта № 15-08-01072а).
Список литературы
Kaplun A.B., Meshalkin A.B. // Russ. J. Eng. Therm. 2000. V. 10. № 1. P. 65.
Каплун А.Б., Мешалкин А.Б. // ДАН. 2001. Т. 376. № 5. С. 624.
Каплун А.Б., Мешалкин А.Б. // ТВТ. 2010. Т. 48. № 5. С. 692.
Kaplun A.B., Meshalkin A.B. // J. Chem. & Eng. Data. 2010. V. 55. P. 4285.
Kaplun A.B., Meshalkin A.B. // Ibid. 2011. V. 56. P. 1463.
Безверхий П.П., Мартынец В.Г., Матизен Э.В. и др. // Теплофизика и аэромеханика. 2012. Т. 19. № 6. С. 781.
Каплун А.Б., Мешалкин А.Б. // Журн. физ. химии. 2013. Т. 87. № 8. С. 1294.
Безверхий П.П., Мартынец В.Г., Каплун А.Б., Мешалкин А.Б. // ТВТ. 2017. Т. 55. № 5. С. 706.
Kim Y. // J. Mechanical Science and Technology. 2007. V. 21. P. 799.
Span R., Wagner W. // J. Phys. Chem. Ref. Data. 1996. V. 25. № 6. P. 1509.
Span R., Wagner W. // Intern. J. Therm. 2003. V. 24. № 1. P. 1.
Klimeck J., Kleinrahm R., Wagner W. // J. Chem. Therm. 2001. V. 33. P. 251.
Новиков И.И., Трелин Ю.С. // Теплоэнергетика. 1962. Т. 9. № 2. С. 78.
Груздев В.А., Слабняк В.И. // Исследование теплофизических свойств веществ. Сб. научн. трудов. Новосибирск: Наука, 1970. С. 150.
Питаевская Л.Л., Биллевич А.В. // Журн. физ. химии. 1973. Т. 47. № 1. С. 227.
Алтунин В.В. Теплофизические свойства двуокиси углерода. М.: Изд. стандартов. 1975. 546 с.
Амирханов Х.И., Полихрониди Н.Г., Батырова Р.Г. // Теплоэнергетика. 1970. Т. 17. № 3. С. 70.
Амирханов Х.И., Полихрониди Н.Г., Алибеков Б.Г., Батырова Р.Г. // Теплоэнергетика. 1971. Т. 18. № 12. С. 59.
Magee J.W., Ely J.F. // Intern. J. Therm. 1986. V. 7. № 6. P. 1163.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии


